Почвоведение, 2021, № 10, стр. 1207-1230
Биологическая активность почв в условиях покровного оледенения в северной части архипелага Новая Земля
Д. А. Никитин a, d, *, Л. В. Лысак b, Д. В. Бадмадашиев b, С. С. Холод c, Н. С. Мергелов d, А. В. Долгих d, С. В. Горячкин d
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
c Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Профессора Попова, 2, Россия
d Институт географии РАН
119017 Москва, Старомонетный пер., 29, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 08.02.2021
После доработки 16.03.2021
Принята к публикации 27.03.2021
Аннотация
Охарактеризован растительный покров, химические и физические свойства пелоземов сильноскелетных остаточно-карбонатных (Skeletic Leptosols (Loamic)), карбопетроземов (Calcaric Leptosols (Protic)), петроземов (Skeletic Leptosols (Protic)) и криоземов (Oxyaquic Cryosols (Loamic)) северной части архипелага Новая Земля. Определены запасы и структура микробной биомассы, интенсивность эмиссии СО2 (базальное и субстрат-индуцированное дыхание), СН4 (метаногенез) и N2O (денитрификация) в образцах почв указанных территорий. Биомасса микроорганизмов (прокариот и грибов суммарно) варьировала от 22.50 до 390.18 мкг/г (мкгС/г) почвы. Доля микобиоты в микробной биомассе составляла от 80 до 98%. Большая часть микробной биомассы (до 50%) сконцентрирована в поверхностных горизонтах. Численность прокариот колеблется от 1.5 × 107 до 9.66 × 108 кл./г почвы, а биомасса грибов – от 22 до 372 мкг/г почвы. Длина актиномицетного мицелия мала от 0.6 до 23.5 м/г почвы, а грибных гиф на порядок больше (до 166 м/г почвы). Все параметры биологической активности изученных почв резко уменьшаются вниз по профилю, что положительно коррелирует с содержанием органического вещества, углерода и азота. В целом значения изученных показателей биологической активности почв севера Новой Земли меньше, чем в почвах расположенной на 3°–5° севернее Земли Франца-Иосифа. Этот феномен связан с влиянием самого крупного в России ледника на почвенно-растительный покров прилегающей территории.
ВВЕДЕНИЕ
Комплексное изучение биологических свойств почв полярных регионов является одним из наиболее актуальных направлений современной микробиологии [47]. Относительно хорошо исследовано таксономическое разнообразие прокариот и микромицетов арктических территорий [60, 62, 77]. Однако практически неизвестны количественные параметры почвенного микробиома Высокой Арктики (численность микроорганизмов, запасы и структура микробной биомассы, уровень базального дыхания, метаногенеза, денитрификации и др.) несмотря на то, что они имеют важное значение для характеристики функционирования экосистем [9, 69, 73]. Биомасса микроорганизмов – важный показатель интенсивности круговорота макроэлементов в почве [73]. Микроорганизмы – наиболее активная и динамичная часть почвенного органического вещества [28], а численные показатели биомассы позволяют оценить степень его трансформации и уровень продуктивности экосистем [79]. Поскольку о. Северный находится в зоне чрезвычайно сурового климата и, как следствие, обладает минимальным количеством компонентов биогеоценозов, данный район архипелага является наиболее перспективным для выявления новых фундаментальных закономерностей в экологии почвенных микроорганизмов [44, 52].
Помимо биологического и экологического значения, знание о микробиоме почв полярных областей и его функционировании имеет важное почвенно-географическое значение, так как при слабой выраженности признаков почвообразовательных процессов в высоких широтах помогает понять процессы почвообразования и роль абиогенных и биогенных факторов в распределении почв и особенностей их функционирования. Имеется опыт использования данных о биологической активности почв для понимания зональности почвенного покрова в Высокой Арктике [21].
Несмотря на относительно небольшую удаленность от цивилизации, природа архипелага Новая Земля (НЗ) во многом остается не исследованной из-за крайне ограниченного доступа на его территорию в связи с наличием здесь полигона для испытаний ядерного оружия. Наиболее полное историческое освещение почвенных исследований на НЗ выполнено ранее [4], но северная часть архипелага оставалась неохваченной. Новый этап исследования физико-географических характеристик архипелага НЗ, в частности его почвенного покрова, стал возможен в последние годы благодаря развитию национального парка “Русская Арктика” и проекта “Арктический плавучий университет” [21, 24]. Это дало возможность ознакомиться с почвенным покровом в районе мыса Желания – около самой северной оконечности о. Северный НЗ [5]. Некоторые краткие исследования почв этого региона проведены геологами и геохимиками [15, 19].
Эти исследования показали, что процессы почвообразования здесь развиты слабо. Большая часть территории занята выходами скал и каменистыми россыпями с эндолитными солоидами (почвоподобными образованиями) [6], отмечено накопление мелкозема на поверхности снежников и ледников [19], что позволяет предположить наличие супрагляциальных солоидов и криоконитов [85]. Среди почв отмечены петроземы и литоземы серогумусные грубогумусированные.
Особенности растительности НЗ отражены в ряде работ, которые проанализированы А.Н. Кулиевым [16], имеются наблюдения по растительности Карского побережья о. Северный НЗ [29]. Все ботаники относят описанные здесь растительные группировки к полярной пустыне и отмечают крайнюю разреженность покрова, за исключением наиболее благоприятных местообитаний.
Информация о микробиоме почв НЗ крайне отрывочна. Впервые его стал изучать А.Ф. Казанский, который считал, что важнейшая роль в биогеохимических циклах высоких широт принадлежит именно микроорганизмам [16]. Имеются скудные сведения о культивируемых бактериях и простейших внутренних водоемов, поверхности растений и грунтов в разрозненных точках архипелага [40, 63], что не дает возможности оценить реальную численность и функциональную роль микроорганизмов [18, 49]. Информация о некультивируемых формах, которые составляют до 98% от всех известных микроорганизмов, практически отсутствует [18, 43].
Большая часть работ, посвященных оценке запасов биомассы почвенного микробиома Арктики, проведена классическими методами микробиологии (посевом на разнообразные питательные среды) [37, 42], что не позволяет адекватно определить микробную биомассу. Имеются отдельные работы по определению активности эмиссии СО2 методом фумигации–экстракции; измерением эмиссии СО2, при подавлении активности бактерий [34, 68] и др. Единичные статьи посвящены оценке микробной биомассы в почве методом люминесцентной микроскопии на полуострове Таймыр, Аляске, Канаде и архипелаге Земля Франца-Иосифа [21, 23, 37, 75], но не для территории НЗ.
Основными группами почвенного микробиома являются прокариоты (бактерии и археи) и грибы [8], поэтому важно оценить вклад в биомассу обоих этих компонентов. Прокариоты в отличие от остальных микроорганизмов участвуют во всех этапах круговорота биогенных элементов в природе и являются основным фактором, как формирования органического вещества почвы, так и устойчивости биогеоценозов в целом [8, 56, 78]. Несмотря на то, что численность их клеток достигает нескольких миллиардов на грамм почвы [26], биомасса прокариот обычно невелика и составляет не более 2–5% от общей микробной биомассы. Микобиота – неотъемлемый и важный компонент почв, осуществляющий экологическую функцию редуцентов органического вещества [8, 56]. Благодаря широкому спектру гидролаз, наиболее активных в аэробных условиях, для наземных экосистем вклад грибов в круговорот углерода гораздо больше, чем прокариот [79]. Биомасса грибов может достигать 98% от общей микробной биомассы в почве [8, 23, 26]. Информация об обилии нелихенизированной микобиоты субстратов НЗ ограничивается лишь данными о количестве пропагул культивируемых микроскопических грибов, доля которых в природных сообществах мала [18, 40, 43, 55]. Для оценки вклада микобиоты в интенсивность биогеохимических циклов любой экосистемы необходимо определить соотношение мицелия и спор в почве [14]. Мицелий является вегетативным телом многоклеточных грибов, иногда составляющим до 100% массы организма. Однако в полярных экосистемах доля мицелия может быть очень мала из-за сурового климата [14, 51]. Сведения о длине грибного мицелия и содержании спор в почвах НЗ отсутствуют.
Цель работы – количественная оценка параметров биологической активности почв (интенсивности эмиссии СО2, СН4 и N2O, определение численности клеток и биомассы микроорганизмов) на северной части НЗ.
ОБЪЕКТЫ И МЕТОДЫ
Все объекты исследования расположены на о. Северный архипелага НЗ. Здесь располагается самый большой покровный ледник России, площадь которого оценивается по-разному из-за его динамичности, составляя около 20 тыс. км2. От него в сторону Баренцева (на запад) и Карского (на восток) морей спускаются выводные ледники, превращая перигляциальную зону, тянущуюся узкой полосой вдоль берегов, в цепь оазисов [29], подобно тем, которые имеются в Антарктиде (рис. 1). Ледник оказывает охлаждающее и местами иссушающее воздействие на климат из-за стоковых ветров [3, 4], а также на почвообразующие породы, привнеся в современную перигляциальную зону моренный материал, содержащий высокую долю крупнозема.
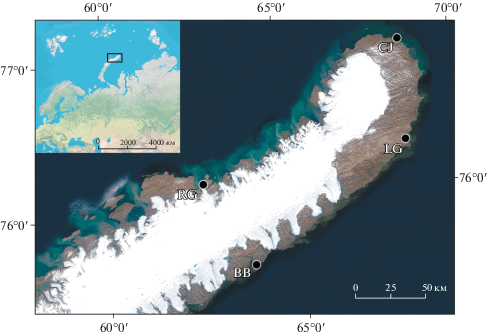
Рис. 1.
Объекты исследования. Расположение точек исследования на о. Северный архипелага Новая Земля. RG – Русская Гавань, CJ – мыс Желания, LG – Ледяная Гавань, BB – залив Бухта Благополучия. На рисунке видны: покровный ледник Северного острова и “лопасти” выводных ледников, спускающихся к Баренцеву (на западе) и Карскому (на востоке) морям.
Поскольку горы НЗ, являющиеся продолжением Уральского хребта, сложены осадочными и метаморфическими породами, то в качестве почвообразующих пород преобладают дериваты карбонатных глинистых сланцев и алевролитов, а также известняков – сильнощебнистые, преимущественно, карбонатные суглинки и глины [27].
Климат на севере НЗ – морской арктический, среднегодовые температуры в районе Русской Гавани и мыса Желания – –8 и –10°С соответственно, а средние температуры июля +4.2 и +1.8°С [20]. На Карской стороне метеостанций не было, но из-за большей ледовитости моря летние температуры здесь ниже на 2–3°С, чем на побережье Баренцева моря на той же широте [7]. Характерны относительно обильные осадки (340 в Русской Гавани и 320 мм/год на мысе Желания), большая влажность воздуха, туманы и сильные ветры до 45–55 м/с [7]. Исследования почвенного и растительного покрова в полевых условиях, а также отбор образцов проводили во второй половине июля 2018 г. в ходе экспедиции по проекту “Арктический плавучий университет”. Местоположение точек полевых работ представлено на рис. 1, а фото почвенных разрезов и названия почв – на рис. 2. Названия почв приведены по Классификации и диагностике почв России с учетом интерпретации почв Арктики для классификации [2], а также по международной классификации WRB [54]. Несмотря на то, что район исследований расположен в зоне распространения сплошных многолетнемерзлых пород, высокая щебнистость не позволяла обнаружить их в большинстве профилей, в связи с чем почвы не были отнесены к мерзлотным (Cryosols), за исключением гидроморфных неглеевых, которые были классифицированы как криоземы [2].
Рис. 2.
Исследованные почвы: А – мыс Желания, разрез CJ-22-23, 76.95064° N, 68.52282° E, криозем остаточно-карбонатный сильноскелетный (Skeletic Oxyaquic Cryosol (Loamic; Calcaric)); Б – мыс Желания, разрез CJ-24-25, 76.95493° N, 68.46068° E, петрозем криотурбированный остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Protic, Turbic)); В – Ледяная Гавань, разрез LG-11, 76.29833° N, 68.153056° E, карбопетрозем очень сильноскелетный (Calcaric Hyperskeletic Leptosol (Loamic)); Г – Ледяная Гавань, разрез LG-12-14, 76.29750° N, 68.153889° E, пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Humic, Turbic)); Д – Ледяная Гавань, разрез LG-15-17; 76.295556° N, 68.148611° E, пелозем гумусовый перегнойный остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Humic Turbic)); Е – Русская Гавань, разрез RG-1-3, 76.1911° N, 62.67194° E, криозем глееватый скелетный (Skeletic Oxyaquic Cryosols (Loamic, Humic)); Ж – Русская Гавань, разрез RG-4, 76.1925° N, 62.72722° E, петрозем (Skeletic Leptosol (Loamic, Protic)); З – Русская Гавань, разрез RG-5-6, 76.19194° N, 62.73944° E, карбопетрозем гумусовый мерзлотный сильноскелетный (Calcaric Hyperskeletic Leptosol (Loamic, Humic)); И – Русская Гавань, разрез RG-7, 76.18833° N, 62.76055° E, пелозем остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Humic)); К – Бухта Благополучия, разрез BB-8, 75.62361° N; 63.814167° E, пелозем гумусовый остаточно-карбонатный среднескелетный (Calcaric Skeletic Leptosol (Loamic, Humic)); Л – Бухта Благополучия, разрез BB-9-10, 75.62805° N, 63.79611° E, криозем грубогумусовый остаточно-карбонатный (Oxyaquic Cryosol (Loamic, Calcaric, Humic)).

В ходе полевых работ образцы отобрали методом усреднения пяти единичных проб. Образцы для микробиологических исследований отобрали с возможными мерами по предотвращению контаминаций и хранили в стерильных емкостях при температуре –18°С сначала в морозильной камере на научно-исследовательском судне “Профессор Молчанов”, а затем в лаборатории. Физические и химические параметры почвы определяли в воздушно-сухих образцах.
Растительный покров характеризовали общепринятыми геоботаническими методами [12].
Содержание углерода и азота определяли методом сухого сжигания на CNSH-анализаторе Elementar Vario Isotope Select (Германия) в ЦКП “Лаборатория радиоуглеродного датирования и электронной микроскопии” Института географии РАН (г. Москва). Полученные данные по неорганическому углероду пересчитаны на содержание CaCO3. Запасы органического углерода рассчитывали для каждого горизонта отдельно с учетом его мощности, плотности и содержания крупной фракции >2 мм. При подсчете суммарных запасов органического углерода результаты складывали по горизонтам. Для стандартизации результатов, а также учитывая среднюю мощность почвенного профиля на севере НЗ, запасы органического углерода пересчитывали на глубину 30 см, где это было возможно.
Биомассу прокариот оценивали с помощью метода люминесцентной микроскопии с применением флуоресцентного красителя акридина оранжевого (микроскоп Биомед 5 ПР ЛЮМ (Россия)) при увеличении 1000× с масляной иммерсией [11]. Десорбцию клеток с почвы проводили при помощи ультразвуковой установки УЗДН-1 (2 мин, сила тока 0.40 А, частота 22 кГц).
Число клеток прокариот на 1 г субстрата считали по формуле: N = S1an/VS2C, где N – число клеток на 1 г субстрата; S1 – площадь препарата, мкм2; a – количество клеток в одном поле зрения, усреднение производится по всем препаратам; n – показатель разведения бактериальной смеси, мл; V – объем капли, наносимой на стекло, мл; S2 – площадь поля зрения микроскопа, мкм2; C – навеска субстрата, г. Длину актиномицетного мицелия в 1 г образца, NМА определяли по формуле: NМА = S1a n/vS2c 106, где S1 – площадь препарата, мкм2; а – средняя длина фрагментов актиномицетного мицелия в поле зрения, мкм; n – показатель разведения суспензии, мл; v – объем капли, наносимой на стекло, мл; S2 – площадь поля зрения микроскопа, мкм2; с – навеска образца, г.
Биомассу грибов определяли методом люминесцентной микроскопии с применением флуоресцентного красителя калькофлуора белого [11]. Учет спор и длины мицелия осуществляли на люминесцентном микроскопе Биомед 5 ПР ЛЮМ (Россия) при увеличении 400×. Десорбцию клеток с почвы проводили при помощи вортекса MSV-3500 (Латвия) при скорости 3500 об./мин в течение 10 мин.
Грибную биомассу (мг/г почвы) считали, полагая, что плотность спор равна 0.837 г/см3, а плотность мицелия – 0.628 г/см3 [25]. Содержание грибной биомассы на грамм сухой почвы рассчитывали с учетом ее влажности.
Потенциальную биологическую активность почв (базальное дыхание, субстрат-индуцированное дыхание (СИД) и активность денитрификации) определяли с помощью газохроматографических методов [11, 31]. Для оценки интенсивности СИД навески почвы (5 г) помещали во флаконы объемом 15 мл (в пятикратной повторности), увлажняли дистиллированной водой (до 60% от полной влагоемкости) и инкубировали в течение 3–5 суток во влажной камере, затем в почву добавляли глюкозу (2.5 мг/г почвы). Денитрифицирующую активность исследовали методом, основанном на использовании ацетилена в качестве ингибитора редуктазы закиси азота, что позволяет судить об активности процесса по ее накоплению в газовой фазе. В почву вносили KNO3 (0.4 мг/г), вводили ацетилен (1 мл), флаконы герметично закрывали, создавали анаэробные условия, вытесняя воздух аргоном. Почву во флаконах инкубировали в течение 24 ч при +28°С, затем из газовой фазы во флаконе шприцем отбирали пробы объемом 0.5–1 мл.
Для определения потенциального метаногенеза в почву вносили раствор глюкозы из расчета 2.5 мг/г почвы, после чего флаконы закрывали резиновыми крышками, закрытыми герметизирующей пленкой, и продували аргоном в течение 2 мин для удаления из них кислорода. Таким образом, оценивали максимально возможную интенсивность образования метана анаэробными сообществами изучаемых почв. После продувки флаконы инкубировали в течение 24 ч в термостате при температуре +28°C. Количество накопившегося CH4 определяли на газовом хроматографе путем отбора из флакона газовой пробы (0.5 мл) при помощи шприца.
В работе использовали газовый хроматограф Кристалл 5000.2 производства Хроматэк (Россия), в котором установлено две металлических хроматографических колонки длиной 2 м и внутренним диаметром 1 мм, наполнитель Hayesep-D 80/100. К одной из колонок подключены детектор по теплопроводности и пламенно-ионизационный детектор, позволяющие производить измерение CO2 и CH4; газом-носителем является гелий. Ко второй колонке подключен детектор электронного захвата, на котором проводили измерение N2O; газ-носитель – азот.
РЕЗУЛЬТАТЫ
Результаты работы даны для территории от самого северного до самого южного участков исследований.
Растительный и почвенный покровы. Для всех негидроморфных почв характерно наличие каменных мостовых, которые часто описываются в высоких широтах полярных областей.
В районе мыса Желания описан растительный покров влажного биотопа на побережье оз. Аммонального (76.95064° N, 68.52282° E), где преобладают мхи Bryum cryophilum и редки куртины щучки Deschampsia borealis. Общее проективное покрытие растений достигает здесь 85%. Почва – криозем остаточно-карбонатный сильноскелетный (Skeletic Oxyaquic Cryosol (Loamic; Calcaric)).
В сухом биотопе плакора на мысе Маврикий (76.95493° N, 68.46068° E) цветковых растений не обнаружено. Мхи и накипные лишайники развивались только в микропонижениях. Кустистых лишайников не выявлено. Общее проективное покрытие растений колебалось около 2–3%. Почва – петрозем криотурбированный остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Protic, Turbic)). Его нельзя было отнести к карбопетроземам из-за невысокого содержания карбонатов.
В районе залива Ледяная Гавань описана растительность трех биотопов. В краевой части выровненного плато (уклон 1°–2° на восток) у обрыва в 5–10 м от безымянной реки (76.29833° N, 68.153056° E) отмечены камнеломка Saxifraga oppositifolia, мак Papaver polare, крупка Draba alpina, ясколка Cerastium regelii, занимающие суммарно около 5–7% пробной площади. Лишайников мало – 0.5%, преобладают накипные формы. Почва – карбопетрозем очень сильно скелетный (Calcaric Hyperskeletic Leptosol (Loamic)).
На склоне морской террасы восточной экспозиции (уклон 3°–4°) (76.2975° N, 68.153889° E) отмечены криогенно-обусловленные полигональные полосы сообществ мхов шириной 12–15 см (отдельные участки полос до 45 см ширины) между которыми располагались щебнисто-суглинистые промежутки шириной 20–40 см. Общее проективное покрытие растений составляло до 35% (10–12% – цветковых, 20% – мхов, 2–3% – лишайников). Среди цветковых растений доминировали камнеломки Saxifraga oppositifolia, S. hyperborea, S. cespitosa, а также Cerastium regelii, Papaver polare, Cochlearia groenlandica и Draba alpina. Почва – пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Humic, Turbic)).
В ветровых убежищах (76.29556° N, 68.14861° E) распространена травянисто-моховая группировка подушечников высотой 5–7 см, которые иногда формируют длинные полосы или полигоны до 1 м, обрамленные черной ветошью мхов и лишайников рода Stereocaulon. Проективное покрытие живых мхов составляет до 5%, ветоши мхов – до 10%. Из цветковых растений присутствуют камнеломки Saxifraga oppositifolia, S. hyperborea, фиппсия Phipрsia algida, ясколка Cerastium regelii, крупка Draba sp., мак Papaver polare и щучка Deschampsia borealis. Почва – пелозем гумусовый перегнойный криотурбированный остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Humic Turbic)).
В районе Русской Гавани во влажном биотопе (76.1911° N, 62.67194° E) долин ручьев из цветковых растений доминировали лютик (Ranunculus sulphureus) и щучка Deschampsia borealis. Дополняли растительный покров лисохвост Alopecurus alpinus subsp. borealis, ситник Juncus biglumis, камнеломка Saxifraga hirculus, ясколка Cerastium regelii, ожика Luzula confusa и фиппсия Phippsia algida. Переувлажненная почва определена как криозем глееватый скелетный (Skeletic Oxyaquic Cryosols (Loamic, Humic)).
Для сухих биотопов на повышенных и выровненных участках морских террас без гидроморфной нагрузки (76.1911° N, 62.67194° E) характерны лишайники Alectoria ochroleuca, Ochrolechia frigida, Rhizocarpon geographicum, а также мох Niphotrichum canescens. Отмечена камнеломка Saxifraga oppositifolia, дриада Dryas octopetala, мытник Pedicularis hirsuta и нехарактерный для столь северных территорий о. Северный остролодочник Oxytropis sordida. Почва на бескарбонатных субстратах – пелозем мерзлотный (Leptic Cryosols (Loamic)), а на карбонатных – карбопетрозем гумусовый сильноскелетный (Calcaric Hyperskeletic Leptosol (Loamic, Humic)), пелозем остаточно-карбонатный сильноскелетный (Calcaric Skeletic Leptosol (Loamic, Humic)).
Растительность района у залива Бухта Благополучия характеризовалась двумя биотопами. Сухой биотоп расположен на высокой морской террасе (75.62361° N; 63.814167° E) с уклоном на восток примерно в 1%. Растительность – разнотравно-ясколковая группировка с общим проективным покрытием 15–18% (в прибрежной полосе на плато 30–35%) – представлена ясколкой Сerastium regelii, крупкой Draba alpina, ложечницей Cochlearia groenlandica, фиппсией Phipрsia algida, Oxyria digyna, камнеломкой Saxifraga oppositifolia, маком Papaver polare. Проективное покрытие мхов около 5%. Почва – пелозем гумусовый остаточно-карбонатный среднескелетный (Calcaric Skeletic Leptosol (Loamic, Humic)). В переувлажненном биотопе местного базиса эрозии (75.62805° N; 63.79611° E) доминируют щучка Deschampsia borealis, мхи и камнеломка Saxifraga hyperborea. Почва – криозем грубогумусовый остаточно-карбонатный (Oxyaquic Cryosol (Loamic, Calcaric, Humic)).
Свойства почв указаны в табл. 1. Кислотность исследованных почв варьирует в пределах ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ 7.1–8.2; pHKCl 6.8–7.9. Содержание органического углерода в среднем для всех образцов составляет 3.08%, но достигает 18.69% в поверхностных органогенных горизонтах и остается существенным в мелкоземе (органо)минеральных горизонтов, не опускаясь ниже 0.21% на глубине 30 см. Более того, распределение содержания Сорг по профилю не всегда имеет “классический” аккумулятивный характер. В срединных и надмерзлотных горизонтах содержание Сорг может достигать нескольких процентов. Содержание общего азота (Nобщ) варьирует в широком диапазоне от 0.02 до 1.23% со средним значением 0.21% для всего массива образцов. Отношение Cорг/Nобщ изменяется в пределах 3–26, за исключением пелозема мерзлотного остаточно-карбонатного сильноскелетного (RG-7), в котором эта величина достигает 158. В ряде срединных горизонтов значения Cорг/Nобщ сопоставимы с таковыми в органогенных горизонтах.
Таблица 1.
Свойства почв севера Новой Земли
| Почва | Обра-зец | Горизонт | Глубина, см | Влажность почвы, % | Плотность мелкозема (<2 мм), г/см3 | Содержание фракции >2 мм, % (каменис-тость) | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | рНKCl | Cорг, % | CaCO3, % | Nобщ, % | Cорг/Nобщ | Запасы Сорг, кг/м2 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| в гори-зонте | в слое 0–30 см* | |||||||||||||
| Мыс Желания, 76.95° N, 68.52° E | ||||||||||||||
| Криозем остаточно-карбонатный сильноскелетный | CJ-22 | О | 0–3 | 80.3 | 0.3 | 40.3 | 7.3 | 6.8 | – | – | – | – | – | – |
| CJ-23 | CRсa | 3–28 | 13.1 | 1.2 | 25.3 | 8.1 | 7.6 | 0.76 | 3.42 | 0.11 | 6.9 | 1.7 | ||
| Петрозем криотурбированный остаточно-карбонатный сильноскелетный | CJ-24 | W + С | 0–23 | 9.0 | 1.1 | 23.9 | 8.0 | 7.1 | 0.33 | – | 0.02 | 16.5 | 0.6 | 0.6 |
| CJ-25 | Ссa,sk | 23–33 | 8.2 | 1.1 | 43.5 | 8.1 | 7.5 | 0.23 | 4.41 | 0.03 | 7.7 | 0.1 | ||
| Ледяная Гавань, 76.29° N, 68.15° E | ||||||||||||||
| Карбопетрозем очень сильно скелетный | LG-11 | W + Cca,sk | 0–17 | 8.2 | 1.1 | 58.4 | 8.1 | 7.9 | 2.06 | 40.15 | 0.13 | 15.8 | 1.6 | – |
| Пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный | LG-12 | Wca | 0–4 | 6.2 | 0.5 | 45.9 | 7.6 | 7.2 | 0.82 | 9.91 | 0.14 | 2.6 | 0.2 | 2.2 |
| LG-13 | Сca | 4–19 | 9.1 | 1.0 | 47.0 | 7.9 | 7.4 | 1.16 | 12.50 | 0.14 | 8.9 | 0. | ||
| LG-14 | Сca | 19–32 | 38.6 | 1.1 | – | 8.0 | 7.4 | 1.52 | – | 0.17 | 10.1 | 1.2 | ||
| Пелозем гумусовый перегнойный остаточно-карбонатный сильноскелетный | LG-15 | O + W | 0–5 | 52.8 | 0.4 | 32.0 | 7.4 | 7.4 | 18.69 | – | 1.23 | 15.2 | 3.7 | 5.2 |
| LG-16 | Сca | 4–17 | 14.8 | 1.2 | 26.1 | 8.0 | 7.5 | 1.37 | 33.15 | 0.14 | 9.8 | 1.3 | ||
| LG-17 | Сca | 17–30 | 13.7 | 1.2 | 58.4 | 8.2 | 7.4 | 0.21 | 2.67 | 0.03 | 7.0 | 0.2 | ||
| Русская Гавань, 76.19° N, 62.72° E | ||||||||||||||
| Криозем глееватый скелетный | RG-1 | О | 0–4 | 65.2 | 0.2 | – | 7.1 | 7.2 | 9.80 | – | 0.63 | 15.6 | 0.8 | 6.4 |
| RG-2 | CR | 4–11 | 47.8 | 1.1 | 12.8 | 7.5 | 7.1 | 3.85 | – | 0.32 | 12.0 | 2.6 | ||
| RG-3 | СRg | 11–22 | 38.0 | 1.2 | 65.3 | 7.9 | 7.5 | 2.76 | – | 0.19 | 14.5 | 1.3 | ||
| Петрозем | RG-4 | О + С | 0–21 | 15.4 | 1.0 | 66.7 | 8.0 | 7.4 | 0.83 | – | 0.1 | 8.3 | 0.6 | – |
| Карбопетрозем гумусовый мерзлотный сильноскелетный | RG-5 | Wсa | 0–9 | 11.3 | 0.9 | 46.5 | 8.2 | 7.7 | 2.59 | 28.90 | 0.1 | 25.9 | 1.1 | 4.1 |
| RG-6 | Cсa,sk | 9–16 | 9.3 | 1.2 | 40.9 | 8.2 | 7.7 | 2.13 | 30.57 | 0.1 | 21.3 | 1.1 | ||
| Пелозем остаточно-карбонатный сильноскелетный | RG-7 | О + Ссa | 0–14 | 14.8 | 1.2 | 42.4 | 8.0 | 7.5 | 6.32 | 18.83 | 0.1 | 158.0 | 6.1 | – |
| Бухта Благополучия, 75.62° N; 63.80° E | ||||||||||||||
| Пелозем гумусовый остаточно-карбонатный среднескелетный | ВВ-8 | W + Сca | 0–31 | 11.4 (19.5) | 1.2 | 27.3 | 8.0 | 7.7 | 0.94 | 8.16 | 0.11 | 8.5 | 2.5 | 2.4 |
| Криозем грубогумусовый остаточно-карбонатный | ВВ-9 | АОca | 0–10 | 49.9 | 0.8 | 4.3 | 7.8 | 7.56 | 1.38 | 5.91 | 0.11 | 12.5 | 1.1 | 8.2 |
| ВВ-10 | CR | 10–19 | 11.4 | 1.2 | – | 7.5 | 6.9 | 3.84 | – | 0.29 | 13.2 | 4.1 | ||
Рассчитаны суммарные запасы Сорг стандартизированные на глубину 30 см. Средние значения запасов для всех изученных почв составляют 4.3 кг Сорг/м2. На фактическую величину запасов значительное влияние оказывает большое содержание крупных фракций (более 2 мм), которое достигает 67% (в среднем 38%).
В исследованных почвах велико содержание карбоната кальция, доля которого составляет от 2.67 до 40.15%. Наименьшие значения (единицы процентов) характерны для всех профилей мыса Желания и Бухты Благополучия. Максимум CaCO3 (десятки процентов) выявлен в почвах Ледяной Гавани и Русской Гавани. Однако в случае почвообразования на бескарбонатных субстратах вскипание от HCl и карбонаты в профиле отсутствуют.
Уровень влажности исследованных почв севера НЗ существенно разнится от 6 до 80%, причем для большинства профилей ее уровень резко уменьшается с глубиной.
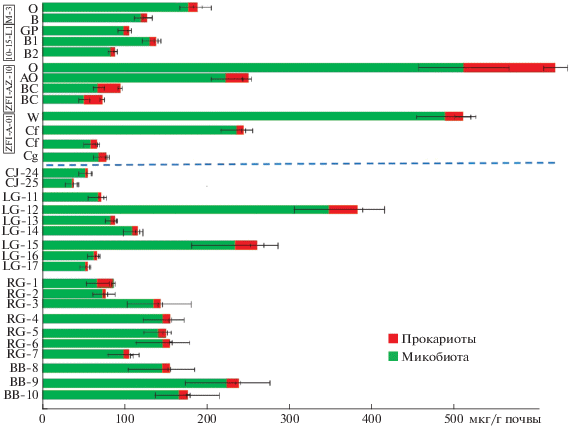
Общая биомасса микроорганизмов в почвах севера НЗ варьирует от 22.50 мкг/г почвы в поверхностном горизонте W + C петрозема криотурбированного остаточно-карбонатного сильноскелетного мыса Желания (профиль СJ-24-25) до 390.18 мкг/г почвы в горизонте Wca пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного района Ледяной Гавани (профиль LG-12-14) (рис. 3). Почти для всех почв НЗ характерно резкое уменьшение микробной биомассы вниз по профилю. Большая часть микробной биомассы (до 50%) сконцентрирована в поверхностном горизонте каждой из почв. В то же время выявлено некоторое увеличение значений биомассы микроорганизмов (локальный максимум) в третьем сверху горизонте по сравнению со вторым для профилей LG-12-14, LG-15-17 и RG-1-3. В профиле RG-5-6 биомасса верхнего и нижнего горизонтов достоверно не отличается. Профиль RG-1-3 уникален, поскольку наибольшие значения биомассы микроорганизмов выявлены в самом глубоком горизонте. Запасы микробной биомассы для исследованных почв НЗ существенно отличаются. Они минимальны (28.63 мкг/г почвы) для профиля петрозема криотурбированного остаточно-карбонатного сильноскелетного мыса Желания CJ-24-25, а максимальны, больше на порядок (201.57 мкг/г почвы), для пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного района Ледяной Гавани LG-12-14. Доля микобиоты в микробной биомассе высока и составляет от 80 до 98%. Наименьшая доля грибов обнаружена в органогенных, а наибольшая – в минеральных горизонтах.
Рис. 3.
Распределение микробной биомассы по профилям почв в точках исследования на о. Северный архипелага Новая Земля. М3 – Восточная Антарктида, оазис Холмы Ларсеманн, почва с поверхностными органогенными горизонтами (данные по [22]); 10-15L1 – Восточная Антарктида, оазис Холмы Ларсеманн, почва с гиполитными органогенными горизонтами (по [22]); ZFI-AX-10 – Земля Франца-Иосифа, о. Земля Александры, литозем грубогумусовый мерзлотный (по [21]); ZFI-A-01 – Земля Франца-Иосифа, о. Алджер, псаммозем глееватый мерзлотный (по [21]).
Биомасса прокариот невелика – от 0.50 до 19.05 мкг/г почвы (табл. 2). Минимальные значения (десятые доли и единицы мкг/г почвы) отмечены для всех минеральных горизонтов, а максимальные (>10 мкг/г почвы) – для органогенных горизонтов. В профилях пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного и пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного Ледяной Гавани (LG-12-14 и LG-15-17 соответственно), а также в криоземе глееватом скелетном Русской Гавани (RG-1-3) биомасса прокариот резко уменьшается вниз по профилю. Также резкое уменьшение прокариот в подповерхностном горизонте по сравнению с поверхностным горизонтом отмечено и в других профилях (CJ-22-23, CJ-24-25, ВВ-9-10, RG-5-6).
Таблица 2.
Структура биомассы прокариот
| Почва | Обра-зец | Гори-зонт | Глуби-на, см | Числен-ность клеток прокариот, ×108 кл./г | Биомасса однокле-точных прокариот, мкг/г почвы | Длина актиноми-цетного мицелия, м/г | Биомасса актиноми-цетного мицелия, мкг/г | Доля мицелия в общей биомассе, % | Общая биомасса прокариот, мкг/г почвы | Средняя биомасса прокариот в профиле, мкг/г почвы | Соотно-шение однокле-точные прокариоты/ актиноми-цеты (по массе) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Мыс Желания, 76.95° N, 68.52° E | |||||||||||
| Криозем остаточно-карбонатный сильноскелетный | CJ-22 | О | 0–3 | 8.85 ± 1.77 | 17.70 ± 3.52 | 23.52 ± 4.87 | 0.87 ± 0.218 | 4.68 | 18.57 ± 3.671 | 10.40 ± 2.01 | 20.3 |
| CJ-23 | CRсa | 3–28 | 0.66 ± 0.13 | 1.32 ± 0.26 | 5.95 ± 1.24 | 0.22 ± 0.05 | 9.9 | 2.23 ± 0.45 | 9.1 | ||
| Петрозем криотурбированный остаточно-карбонатный сильноскелетный | CJ-24 | W + С | 0–23 | 0.36 ± 0.07 | 0.72 ± 0.14 | 1.11 ± 0.23 | 0.04 | 5.3 | 0.76 ± 0.15 | 0.63 ± 0.12 | 18.0 |
| CJ-25 | Ссa,sk | 23–33 | 0.24 ± 0.05 | 0.48 ± 0.09 | 0.58 ± 0.12 | 0.02 | 4.0 | 0.50 ± 0.10 | 24.0 | ||
| Ледяная Гавань, 76.29° N, 68.15° E | |||||||||||
| Карбопетрозем очень сильно скелетный | LG-11 | W + + Cca,sk | 0–17 | 1.16 ± 0.23 | 2.32 ± 0.46 | 3.44 ± 0.71 | 0.13 ± 0.02 | 5.3 | 2.45 ± 0.49 | 2.45 ± 0.47 | 17.8 |
| Пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный | LG-12 | 0–4 | 9.07 ± 1.81 | 18.1 ± 3.60 | 2.10 ± 0.44 | 0.08 ± 0.01 | 0.4 | 18.18 ± 3.63 | 6.57 ± 1.26 | 226.3 | |
| LG-13 | Wca | 4–19 | 0.33 ± 0.076 | 0.65 ± 0.13 | 6.30 ± 0.23 | 0.23 ± 0.05 | 26.1 | 0.88 ± 0.18 | 2.82 | ||
| LG-14 | Сca | 19–32 | 0.23 ± 0.05 | 0.45 ± 0.09 | 5.37 ± 0.20 | 0.20 ± 0.04 | 30.8 | 0.65 ± 0.13 | 23.2 | ||
| Пелозем гумусовый перегнойный остаточно-карбонатный сильноскелетный | LG-15 | O + W | 0–5 | 9.66 ± 1.93 | 18.9 ± 3.75 | 4.09 ± 0.15 | 0.15 ± 0.03 | 0.8 | 19.05 ± 3.81 | 23.56 ± 5.52 | 126.0 |
| LG-16 | Сca | 4–17 | 2.02 ± 0.40 | 4.04 ± 0.80 | 3.39 ± 0.12 | 0.13 ± 0.02 | 3.1 | 4.17 ± 0.83 | 31.1 | ||
| LG-17 | Сca | 17–30 | 0.15 ± 0.03 | 0.30 ± 0.06 | 1.05 ± 0.37 | 0.04 | 11.8 | 0.34 ± 0.07 | 7.5 | ||
| Русская Гавань, 76.19° N, 62.72° E | |||||||||||
| Криозем глееватый скелетный | RG-1 | О | 0–4 | 7.77 ± 1.55 | 16.58 ± 3.29 | 10.33 ± 0.37 | 0.39 ± 0.07 | 2.3 | 16.97 ± 3.39 | 6.51 ± 1.25 | 42.5 |
| RG-2 | CR | 4–11 | 0.40 ± 0.08 | 0.84 ± 0.17 | 8.76 ± 0.31 | 0.33 ± 0.06 | 28.2 | 1.17 ± 0.23 | 2.54 | ||
| RG-3 | СRg | 11–22 | 0.61 ± 0.12 | 1.28 ± 0.25 | 3.13 ± 0.11 | 0.12 ± 0.02 | 8.6 | 1.40 ± 0.28 | 10.7 | ||
| Петрозем | RG-4 | О + С | 0–21 | 1.73 ± 0.35 | 3.46 ± 0.69 | 3.42 ± 0.68 | 0.13 ± 0.02 | 3.6 | 3.59 ± 0.72 | 3.59 ± 0.69 | 26.6 |
| Карбопетрозем гумусовый мерзлотный сильноскелетный | RG-5 | Wсa | 0–9 | 3.79 ± 0.76 | 8.09 ± 1.61 | 1.74 ± 0.06 | 0.07 ± 0.01 | 0.8 | 8.16 ± 1.64 | 4.85 ± 0.93 | 120.7 |
| RG-6 | Cсa,sk | 9–16 | 0.55 ± 0.11 | 1.10 ± 0.22 | 11.77 ± 0.42 | 0.44 ± 0.09 | 28.6 | 1.54 ± 0.31 | 2.5 | ||
| Пелозем остаточно-карбонатный сильноскелетный | RG-7 | О + Ссa | 0–14 | 1.58 ± 0.31 | 3.18 ± 0.63 | 7.19 ± 0.25 | 0.27 ± 0.05 | 33.8 | 3.45 ± 0.69 | 3.45 ± 0.66 | 11.8 |
| Бухта Благополучия, 75.62° N; 63.80° E | |||||||||||
| Пелозем гумусовый остаточно-карбонатный среднескелетный | ВВ-8 | W + Сca | 0–31 | 2.83 ± 0.57 | 5.65 ± 1.12 | 11.26 ± 2.33 | 0.42 ± 0.08 | 6.9 | 6.07 ± 1.21 | 6.07 ± 1.17 | 13.5 |
| Криозем грубогумусовый остаточно-карбонатный | ВВ-9 | АОca | 0–10 | 1.56 ± 0.31 | 17.80 ± 3.54 | 3.21 ± 0.67 | 0.12 ± 0.02 | 0.7 | 17.92 ± 3.58 | 12.38 ± 2.38 | 148.3 |
| ВВ-10 | CR | 10–19 | 0.30 ± 0.06 | 6.30 ± 1.25 | 14.53 ± 3.01 | 0.54 ± 0.11 | 7.9 | 6.84 ± 1.37 | 11.7 | ||
Численность прокариот в исследованных почвах колеблется от 1.5 × 107 до 9.66 × 108 кл./г почвы. Наименьшие и наибольшие значения численности выявлены в глубинном Сca и поверхностном О + Wh горизонтах соответственно пелозема гумусового перегнойного остаточно-карбонатного ветрового убежища района Ледяной Гавани (профиль LG-15-17). Верхний органогенный горизонт каждого из исследованных почвенных профилей содержал порядка 108 кл./г почвы, а подповерхностные горизонты – порядка 107 кл./г почвы.
Длина актиномицетного мицелия в образцах мала и варьирует от 0.58 до 23.52 м/г почвы. Минимум выявлен в минеральном горизонте Ссa,sk петрозема остаточно-карбонатного сильноскелетного на мысе Желания (CJ-25), а максимум – в органогенном горизонте О криозема остаточно-карбонатного сильноскелетного также в этом районе архипелага (CJ-22). Доля актиномицетного мицелия в биомассе прокариот колебалась от десятых долей и единиц процента в верхних горизонтах до трех десятков процентов в срединных. Минимальная доля мицелия (0.4%) выявлена в поверхностном органогенном горизонте Wca (LG-12), а максимальная (30.8%) – в минеральном горизонте Сca (LG-14) пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного Ледяной Гавани.
Образцы почв мыса Желания беднее прокариотами, чем остальные исследованные почвы. Средняя биомасса прокариот на образец здесь составляет лишь 2.76 мкг/г почвы, несмотря на наличие над криоземом остаточно-карбонатным сильноскелетным (профиль CJ-22-23) обильного мохового очеса. В данном профиле так же, как в петроземе криотурбированном остаточно-карбонатном сильноскелетном (профиль CJ-24-25) выявлено уменьшение биомассы прокариот от поверхностных горизонтов к глубинным. Длина актиномицетного мицелия для образцов почв из района мыса Желания сильно разнится. Поверхностный горизонт О криозема остаточно-карбонатного сильноскелетного (профиль CJ-22–23) имеет максимальные значения (23.52 м/г почвы) по всем исследуемым образцам архипелага, в то время как нижележащий горизонт CRсa содержал только 5.95 м/г почвы актиномицетного мицелия; а петрозема криотурбированного остаточно-карбонатного сильноскелетного (профиль CJ-24-25) характеризуется минимальными значениями – 1.11 м/г почвы для верхнего горизонта W + С и 0.58 м/г почвы для нижнего Ссa,sk. Доля актиномицетного мицелия для криозема остаточно-карбонатного мыса Желания возрастает от поверхностного горизонта (4.7%) к глубинному (9.9%), но убывает вниз по профилю петрозема круотурбированного остаточно-карбонатного сильноскелетного с 5.3 до 4.0%.
Длина мицелия актиномицетов во всех профилях Ледяной Гавани мала (до 6.3 м/г почвы) и имеет различное распределение по профилям. В пелоземе гумусовом круотурбированном остаточно-карбонатном сильноскелетном (профиль LG-12-14) минимальное развитие мицелия (2.1 м/г почвы) выявлено в верхнем горизонте Wca, а максимальное (6.3 м/г почвы) – в подповерхностном горизонте Сca. Напротив, профиль LG-15-17 характеризуется постепенным уменьшением длины мицелия от поверхностных (3–4 м/г почвы) к глубинным горизонтам (1.1 м/г почвы).
Для района Русской Гавани было заложено больше почвенных разрезов, чем на других исследованных территориях НЗ, и варьирование значений прокариотной биомассы здесь также шире. Минимум прокариотной биомассы (1.17 мкг/г почвы) отмечен в подповерхностном горизонте CR, а максимум (16.97 мкг/г почвы) – для горизонта О профиля RG-1-3 криозема глееватого скелетного. Для этого профиля характерно резкое сокращение обилия прокариот вниз по профилю. Профиль RG-5-6 карбопетрозема гумусового мерзлотного сильноскелетного, имеющего всего два горизонта также демонстрирует резкое уменьшение прокариотной биомассы от органогенного горизонта Wсa (8.16 мкг/г почвы) к минеральному Cсa,sk (1.54 мкг/г почвы).
Содержание прокариотной биомассы для петрозема и пелозема остаточно-карбонатного сильноскелетного Русской Гавани – 3.59 и 3.45 мкг/г почвы – соответственно RG-4 и RG-7. Длина актиномицетного мицелия в почвах района Русской Гавани колеблется от 1.77 в горизонте Wсa профиля RG-5 карбопетрозема гумусового мерзлотного сильноскелетного до 10.33 м/г почвы в органогенном горизонте О криозема глееватого RG-1-3. Длина мицелия прокариот резко сокращается с глубиной для всех профилей, кроме RG-5-6 карбопетрозема гумусового мерзлотного сильноскелетного с обратной тенденцией. Доля мицелия актиномицетов низка (3.6%) в петроземе RG-4, но значительно выше в пелоземе остаточно-карбонатном сильноскелетном RG-7 (33.8%); в криоземе глееватом скелетном (профиль RG-1-3) максимум (28.2%) в подповерхностном горизонте CR; для карбопетрозема гумусового мерзлотного сильноскелетного RG-5-6 резко увеличивается от поверхностного Wca (0.8%) к срединному глубинному горизонту Ссa,sk11 (28.6%).
Пелозем гумусовый остаточно-карбонатный среднескелетный и криозем грубогумусовый остаточно-карбонатный района Бухты Благополучия достаточно богаты прокариотами, биомасса которых составляет в среднем 9.23 мкг/г почвы. Биомасса прокариот в криоземе грубогумусовом остаточно-карбонатном ВВ-9-10 уменьшается от поверхностного горизонта АОсa (17.92 мкг/г почвы) к нижнему CR (6.84 мкг/г почвы). В единственном горизонте W + Сca пелозема гумусового остаточно-карбонатного среднескелетного (профиль ВВ-8) биомасса составляет 6.07 мкг/г почвы, а длина актиномицетного мицелия больше (11.26 м/г почвы), чем для образцов района Ледяной Гавани. В криоземе грубогумусовом остаточно-карбонатном Бухты Благополучия длина мицелия актиномицетов возрастает с глубиной от 3.21 м/г почвы для горизонта АОсa до 14.53 м/г почвы для криогенного горизонта CR. Доля актиномицетного мицелия резко увеличивается с глубиной для профиля криозема грубогумусового остаточно-карбонатного от 0.7% в АОсa до 7.9% в CR; а в горизонте W + Сca пелозема гумусового остаточно-карбонатного среднескелетного тоже весьма велика – 6.9%.
Биомасса грибов минимальна (0.022 мг/г почвы) в минеральном горизонте Ссa,sk петрозема криотурбированного остаточно-карбонатного сильноскелетного района мыса Желания (профиль CJ-24-25), а максимальна (0.372 мг/г почвы) – в органогенном органо-минеральном горизонте Wсa пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного (профиль LG-12-14) в районе Ледяной Гавани. Грибная биомасса в профилях всех исследованных почв резко уменьшается от поверхностных к срединным горизонтам. Однако для криозема глееватого скелетного (разрез RG-1-3) и карбопетрозема гумусового мерзлотного сильноскелетного (профиль RG-5-6) Русской Гавани биомасса грибов, наоборот, повышается с увеличением глубины.
Наименьшее содержание мицелия (1.30 м/г почвы) обнаружено в нижнем горизонте Ссa,sk петрозема криотурбированного остаточно-карбонатного сильноскелетного района мыса Желания (профиль CJ-24-25), а наибольшее (166.61 м/г почвы) – выявлено в поверхностном горизонте Wсa пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного Ледяной Гавани (профиль LG-12-14) (табл. 3). Более половины биомассы (54.22–68.08%) приходится на мицелий только в пяти образцах преимущественно из верхних органогенных горизонтов, тогда как в остальных случаях преобладают споры, а доля гиф составляет от 3.76 до 45.18%. Около 65% мицелия представлено тонкими формами до 3 мкм в диаметре. Не обнаружены базидиомицетные пряжки на мицелии грибов, а также ризоморфы и склероции.
Таблица 3.
Структура биомассы грибов
| Почва | Обра-зец | Гори-зонт | Глуби-на, см | Грибной мицелий (d = 3 мкм) | Доля мицелия в общей биомассе, % | Споры | Общая биомасса спор, мг/г почвы | Суммарная биомасса грибов, мг/г почвы | Средняя биомасса грибов в профиле, мг/г почвы | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| биомасса мицелия грибов, мг/г | длина мицелия грибов, м | d = 2 мкм | d = 3 мкм | ||||||||||
| числен-ность, шт./г ×105 | масса, мг/г | численность, шт./г ×104 | масса, мг/г | ||||||||||
| Мыс Желания, 76.95° N, 68.52° E | |||||||||||||
| Криозем остаточно-карбонатный сильноске-летный | CJ-22 | О | 0–3 | 0.096 ± ± 0.019 | 76.32 ± ± 10.47 | 63.82 | 0.75 ± ± 0.12 | 0.025 ± ± 0.004 | 2.62 ± ± 0.42 | 0.030 ± ± 0.006 | 0.055 ± ± 0.011 | 0.151 ± ± 0.032 | 0.104 ± ± 0.022 |
| CJ-23 | CRсa | 3–28 | 0.011 ± ± 0.002 | 8.56 ± ± 1.17 | 18.63 | 0.63 ± ± 0.10 | 0.021 ± ± 0.003 | 2.27 | 0.026 ± ± 0.005 | 0.047 ± ± 0.010 | 0.058 ± ± 0.012 | ||
| Петрозем криотурбированный остаточно-карбонатный сильноскелетный | CJ-24 | W + С | 0–23 | 0.005 | 4.28 ± ± 0.59 | 15.88 | 0.30 ± ± 0.05 | 0.010 ± ± 0.002 | 1.66 | 0.019 ± ± 0.003 | 0.029 ± ± 0.006 | 0.034 ± ± 0.007 | 0.028 ± ± 0.006 |
| CJ-25 | Ссa,sk | 23–33 | 0.002 | 1.30 ± ± 0.18 | 7.48 | 0.09 ± ± 0.14 | 0.003 | 1.48 | 0.017 ± ± 0.003 | 0.020 ± ± 0.004 | 0.022 ± ± 0.004 | ||
| Ледяная Гавань, 76.29° N, 68.15° E | |||||||||||||
| Карбопетрозем очень сильно скелетный | LG-11 | W + + Cca,sk | 0–17 | 0.004 | 2.79 ± ± 0.38 | 9.21 | 0.48 ± ± 0.08 | 0.016 | 1.55 | 0.018 ± ± 0.003 | 0.034 ± ± 0.007 | 0.038 ± ± 0.008 | 0.038 ± ± 0.008 |
| Пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный | LG-12 | Wca | 0–4 | 0.211 ± ± 0.042 | 166.61 ± ± 22.97 | 56.61 | 1.65 ± ± 0.26 | 0.055 ± ± 0.011 | 9.12 | 0.106 ± ± 0.022 | 0.161 ± ± 0.032 | 0.372 ± ± 0.077 | 0.195 ± ± 0.040 |
| LG-13 | Сca | 4–19 | 0.028 ± ± 0.005 | 21.78 ± ± 3.00 | 30.90 | 0.66 ± ± 0.11 | 0.022 ± ± 0.004 | 3.35 | 0.039 ± ± 0.008 | 0.061 ± ± 0.012 | 0.089 ± ± 0.0021 | ||
| LG-14 | Сca | 19–32 | 0.055 ± ± 0.011 | 43.56 ± ± 6.00 | 44.35 | 0.84 ± ± 0.13 | 0.028 ± ± 0.006 | 3.53 | 0.041 ± ± 0.009 | 0.069 ± ± 0.013 | 0.124 ± ± 0.029 | ||
| Пелозем гумусовый перегнойный остаточно-карбонатный сильноскелетный | LG-15 | O + W | 0–5 | 0.147 ± ± 0.029 | 116.35 ± ± 16.04 | 64.47 | 1.38 ± ± 0.22 | 0.046 ± ± 0.010 | 3.05 | 0.035 ± ± 0.007 | 0.081 ± ± 0.015 | 0.228 ± ± 0.054 | 0.111 ± ± 0.023 |
| LG-16 | Сca | 4–17 | – | нет | 0.00 | 1.17 ± ± 0.19 | 0.039 ± ± 0.008 | 1.66 | 0.019 ± ± 0.003 | 0.058 ± ± 0.011 | 0.058 ± ± 0.011 | ||
| LG-17 | Сca | 17–30 | 0.015 ± ± 0.003 | 11.54 ± ± 1.59 | 29.59 | 0.81 ± ± 0.13 | 0.027 ± ± 0.006 | 0.61 | 0.007 | 0.034 ± ± 0.007 | 0.049 ± ± 0.010 | ||
| Русская Гавань, 76.19° N, 62.72° E | |||||||||||||
| Криозем глееватый скелетный | RG-1 | О | 0–4 | 0.028 ± 0.005 | 22.66 ± ± 3.12 | 58.22 | 0.15 ± ± 0.02 | 0.005 | 3.05 | 0.035 ± ± 0.007 | 0.040 ± ± 0.009 | 0.068 ± ± 0.016 | 0.089 ± ± 0.0021 |
| RG-2 | CR | 4–11 | 0.036 ± ± 0.007 | 28.60 ± ± 3.94 | 54.29 | 0.18 ± ± 0.03 | 0.006 | 3.22 | 0.037 | 0.043 ± ± 0.009 | 0.079 ± ± 0.019 | ||
| RG-3 | СRg | 11–22 | 0.030 ± ± 0.006 | 23.77 ± ± 3.28 | 25.50 | 1.68 ± ± 0.27 | 0.056 ± ± 0.011 | 3.05 | 0.035 ± ± 0.007 | 0.091 ± ± 0.0109 | 0.121 ± ± 0.029 | ||
| Петрозем | RG-4 | О + С | 0–21 | 0.008 ± ± 0.001 | 6.50 ± ± 0.90 | 32.73 | 0.18 ± ± 0.03 | 0.006 | 2.96 | 0± .034 ± 0.007 | 0.040 ± ± 0.009 | 0.122 ± ± 0.029 | 0.122 ± ± 0.029 |
| Карбопетрозем гумусовый мерзлотный сильноскелетный | RG-5 | Wсa | 0–9 | 0.004 | 3.42 ± ± 0.47 | 3.76 | 0.33 ± ± 0.05 | 0.011 ± ± 0.002 | 5.24 | 0.060 ± ± 0.012 | 0.071 ± ± 0.014 | 0.114 ± ± 0.027 | 0.121 ± ± 0.029 |
| RG-6 | Cсa,sk | 9–16 | 0.008 ± ± 0.001 | 6.02 ± ± 0.83 | 5.98 | 0.30 ± ± 0.05 | 0.010 ± ± 0.002 | 3.53 | 0.041 ± ± 0.009 | 0.051 ± ± 0.010 | 0.127 ± ± 0.030 | ||
| Пелозем остаточно-карбонатный сильноскелетный | RG-7 | О + Ссa | 0–14 | 0.005 | 4.23 ± ± 0.58 | 5.39 | 0.30 ± ± 0.05 | 0.010 ± ± 0.002 | 3.05 | 0.035 ± ± 0.007 | 0.045 ± ± 0.009 | 0.098 ± ± 0.023 | 0.098 ± ± 0.023 |
| Бухта Благополучия, 75.62° N; 63.80° E | |||||||||||||
| Пелозем гумусовый остаточно-карбонатный среднескелетный | ВВ-8 | W + Сca | 0–31 | 0.032 ± ± 0.006 | 24.95 ± ± 3.44 | 22.34 | 1.65 ± ± 0.26 | 0.055 ± ± 0.011 | 4.72 | 0.054 ± ± 0.011 | 0.109 ± ± 0.023 | 0.141 ± ± 0.029 | 0.141 ± ± 0.029 |
| Криозем грубогумусовый остаточно-карбонатный | ВВ-9 | АОca | 0–10 | 0.131 ± ± 0.026 | 104.06 ± ± 14.34 | 68.08 | 0.69 ± ± 0.11 | 0.023 ± ± 0.004 | 3.41 | 0.039 ± ± 0.008 | 0.062 ± ± 0.013 | 0.193 ± ± 0.040 | 0.179 ± ± 0.037 |
| ВВ-10 | CR | 10–19 | 0.075 ± ± 0.015 | 59.01 ± ± 8.13 | 45.18 | 1.08 ± ± 0.17 | 0.036 ± ± 0.007 | 4.72 | 0.054 ± ± 0.011 | 0.090 | 0.165 ± ± 0.034 | ||
Грибные споры, выявленные в исследованных образцах, представлены мелкими формами до 3 мкм. Для каждого горизонта численность пропагул микобиоты составляет от 104 до 105 шт./г почвы, причем до 75% спор диаметром 2 мкм и одноклеточно. Крупные споры более 5 мкм не обнаружены. Около 62% пропагул округлой формы с гладкой поверхностью; 11% округлы и шероховаты; 23% – овальны с гладкой поверхностью; 4% – имеют овальную форму с неровностями.
Как и для покариот, в профилях пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного и пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного (LG-12-14 и LG-15-17 соответственно) Ледяной Гавани биомасса грибов резко уменьшается вниз по профилю от сотен до десятков мг/г почвы, а длина мицелия сокращается с величин более сотни до нескольких десятков м/г почвы. Однако в разрезе LG-12-14 обилие грибов вновь увеличивается в наиболее глубоком горизонте Ссa до 0.124 мг/г почвы. Единственный горизонт W + Ссa,sk карбопетрозема очень сильно скелетного Ледяной Гавани (профиль LG-11) характеризуется чрезвычайно малым развитием микобиоты – биомасса 0.038 мг/г почвы, а длина мицелия – 2.79 м/г почвы. Подповерхностный горизонт Ссa пелозема гумусового перегнойного остаточно-карбонатного сильноскелетного (LG-15-17) – единственный среди всех исследованных образцов НЗ, где не обнаружен мицелий.
Таблица 4.
Биологическая активность почв
| Почва | Образец | Индекс горизонта | Денитрификация мкг N–N2O/(г сут) | Базальное дыхание (мкг C–CO2) | СИД (мкг C–CO2) |
Метаногенез, нг CH4/(г сут) |
|---|---|---|---|---|---|---|
| Мыс Желания, 76.95° N, 68.52° E | ||||||
| Криозем остаточно-карбонатный сильноскелетный | CJ-22 | О | 8.55 | 158.00 | 957.19 | 5.62 |
| CJ-23 | CRсa | 7.28 | 7.50 | 22.08 | 2.21 | |
| Петрозем криотурбированный остаточно-карбонатный сильноскелетный | CJ-24 | W + С | 2.93 | 1.49 | 6.47 | 2.78 |
| CJ-25 | Ссa,sk | 3.86 | 1.45 | 4.48 | 1.62 | |
| Ледяная Гавань, 76.29° N, 68.15° E | ||||||
| Карбопетрозем очень сильно скелетный | LG-11 | W+Cca,sk | 4.96 | 2.17 | 3.36 | 2.17 |
| Пелозем гумусовый криотурбированный остаточно-карбонатный сильноскелетный | LG-12 | Wca | 14.27 | 211.91 | 661.90 | 4.20 |
| LG-13 | Сca | 8.92 | 0.26 | 14.89 | 0.48 | |
| LG-14 | Сca | 4.17 | 0.41 | 6.20 | 0.72 | |
| Пелозем гумусовый перегнойный остаточно-карбонатный сильноскелетный | LG-15 | O + W | 16.64 | 149.18 | 757.40 | 6.18 |
| LG-16 | Сca | 5.29 | 0.27 | 9.24 | 1.28 | |
| LG-17 | Сca | 6.61 | 3.13 | 16.75 | 1.60 | |
| Русская Гавань, 76.19° N, 62.72° E | ||||||
| Криозем глееватый скелетный | RG-1 | О | 46.03 | 243.73 | 1476.07 | 5.62 |
| RG-2 | CR | 9.73 | 18.01 | 97.18 | 0.65 | |
| RG-3 | СRg | 6.11 | 12.86 | 56.43 | 1.28 | |
| Петрозем | RG-4 | О + С | 0.67 | 3.58 | 10.03 | 0.59 |
| Карбопетрозем гумусовый мерзлотный сильноскелетный | RG-5 | Wсa | 0.52 | 4.50 | 20.42 | 0.86 |
| RG-6 | Cсa,sk | 0.50 | 3.51 | 17.32 | 1.71 | |
| Пелозем остаточно-карбонатный сильноскелетный | RG-7 | О + Ссa | 1.78 | 6.42 | 35.22 | 1.07 |
| Бухта Благополучия, 75.62° N; 63.80° E | ||||||
| Пелозем гумусовый остаточно-карбонатный среднескелетный | ВВ-8 | W + Сca | 1.13 | 2.06 | 9.86 | 1.82 |
| Криозем грубогумусовый остаточно-карбонатный | ВВ-9 | АОca | 14.72 | 27.83 | 73.89 | 2.81 |
| ВВ-10 | CR | 18.81 | 24.34 | 103.29 | 0.80 | |
Биологическая активность. Базальное почвенное дыхание из исследованных образцов варьирует в широком диапазоне от 0.27 до 243.73 мкг C–CO2/(г сут). Минимальные значения (десятые доли и единицы мкг C–CO2/(г сут) выявлены во всех минеральных горизонтах исследованных профилей, кроме криозема глееватого скелетного Русской Гавани (профиль RG-1-3), где базальное дыхание достигает десятков мкг C–CO2/(г сут). Максимальное базальное дыхание (149.18–243.73 мкг C–CO2/(г сут)) отмечено в органогенных горизонтах, представленных моховыми очесами или альго-бактериальными матами. Интенсивность базального дыхания резко снижается от поверхностных к срединным горизонтам, однако в минеральных горизонтах убывает гораздо менее резко.
СИД изменялось от 3.36 до 1476.07 мкг C–CO2/(г сут), то есть на порядок больше базального дыхания. Наименьшие значения (единицы мкг C–CO2/(г сут)) характерны для минеральных горизонтов, а наибольшие (сотни и тысячи единиц мкг C–CO2/(г сут)) – для мохово-лишайниковых подстилочно-торфяных горизонтов и горизонтов, обогащенных альго-бактериальными ассоциациями. Интенсивность СИД резко снижается от поверхностных горизонтов к глубинным, однако в минеральных убывает более плавно. Исключение составляет криозем грубогумусовый остаточно-карбонатный Бухты Благополучия (BB-9-10), в котором наблюдается увеличение значений СИД с увеличением глубины. Для органогенных горизонтов разница с актуальной эмиссией в среднем составляет 1.5 раза, а для минеральных горизонтов – до порядка.
Потенциальная активность метаногенеза (эмиссия CH4) в изученных почвах НЗ варьировала от 0.48 до 6.18 нг CH4/(г сут). Минимальный метаногенез характерен для срединных минеральных горизонтов, а максимальный – для поверхностных органогенных. В то же время имела место локальная активность процесса (до 1.28 нг CH4/(г сут)) в оглеенных и окарбоначенных горизонтах.
Интенсивность денитрификации изменялась от 0.50 до 18.81 мкг N–N2O/(г сут). Однако в поверхностном горизонте О криозема глееватого склетного Русской Гавани (профиль RG-1-3) интенсивность процесса доходила до 46.03 мкг N–N2O/(г сут). Наименьшие значения (десятые доли и единицы мкг N–N2O/(г сут)) приурочены к профилям петрозема (RG-4), карбопетрозема гумусового мерзлотного сильноскелетного (RG-5-6) и пелозему остаточно-карбонатному сильноскелетному (RG-7) Русской Гавани вне зависимости от глубины. Максимальные показатели интенсивности процесса выявлены в поверхностных органогенных горизонтах и криогенном горизонте CR криозема грубогумусового остаточно-карбонатного Бухты Благополучия (профиль ВВ-9-10). В целом денитрификация уменьшалась вниз по профилю всех исследованных почв, кроме профиля ВВ-9-10, где обнаружена обратная закономерность.
ОБСУЖДЕНИЕ
Растительный покров. Состав растительных ассоциаций изученных территорий сходен с данными геоботаников, работавших на северной части о. Северный НЗ [1, 16, 20, 27, 32]. По нашим данным доминантными семействами на севере архипелага являются Poaceae и Brassicaceae, как указано в других работах [1, 16, 20]. Однако нами впервые отмечен нехарактерный для о. Северный остролодочник грязноватый Oxytropis sordida, появление которого может быть связано с локальными теплыми микроклиматическими условиями [71].
Почвенные свойства. Присутствие бескарбонатных почв в почвенном покрове, а также обусловленность наличия карбонатов в профиле исходной карбонатностью субстратов позволили заключить, что большинство почвенных разностей и структур почвенного покрова более характерно для высокоарктических (тундро)пустошей [3, 21], чем для арктических пустынь, к которым принято относить ландшафты севера НЗ [1, 2, 20].
Среди изученных почв НЗ преобладали пелоземы, что несколько противоречит данным о доминировании на севере архипелага литоземов и петроземов [4, 19]. Это расхождение, вероятно, является следствием недостаточной изученности почвенного покрова о. Северный. Глубина заложенных профилей не превышала 33 см, а число горизонтов варьировало от 1 до 3. Это характеризует данные почвы как маломощные [33, 54] и подтверждает другие почвенные работы по северу НЗ [5, 15, 19].
Содержание органического углерода и азота исследованных почв НЗ несколько меньше, чем для более северных территории архипелага Земля Франца-Иосифа (ЗФИ), но в целом сходно по порядку значений [21]. Увеличение количества углерода и азота в нижней части некоторых изученных профилей может быть вызвано морозобойным растрескиванием грунта, высокой порозностью щебнистых субстратов и перемещением органического вещества в глубокие горизонты [58]. В срединных и надмерзлотных горизонтах содержание Сорг может достигать нескольких процентов, а в ряде срединных и надмерзлотных горизонтов значения Cорг/Nобщ сопоставимы с таковыми в органогенных горизонтах, что является дополнительным свидетельством поступления органического вещества с поверхности вглубь почвенной толщи.
Значения содержания и запасов органического углерода, а также содержания общего азота и соотношения Сорг/Nобщ характеризуют пул этих элементов в почвах севера НЗ как относительно благоприятный для функционирования почвенных прокариот и грибов [80]. Для почв НЗ этот ресурсный фактор, видимо, не является в значительной мере лимитирующим так же, как для почв отдельных островов ЗФИ [21]. Ограничения могут быть в большей степени связаны с содержанием доступных форм азота, низкими температурами и неравномерным увлажнением субстрата из-за высокой скелетности. Кроме того, существенное влияние на биологическую активность почв может оказывать высокое содержание карбонатов [13].
Уровень влажности почв севера НЗ существенно разнится от единиц до десятков процентов и для большинства профилей резко уменьшается с глубиной. Это зачастую обусловливается обильным разрастанием мохообразных, имеющих высокую влагоемкость [84].
Большие значения содержания CaCO3 объясняются развитием почв на карбонатсодержащих породах, которые во многом обусловливают кислотно-основные свойства почв (${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ 7.1–8.2; pHKCl 6.8–7.9). Кислотность почвенных образцов изменялась в относительно узких пределах в слабощелочном диапазоне. Поэтому можем заключить, что исследованные почвы севера НЗ обладают низкой кислотностью и являются слабо- и среднещелочными. Такие результаты по архипелагу согласуются с литературными данными [3, 19]. Минимальные значения рН отмечены для поверхностных органогенных горизонтов в то время, как большей щелочностью характеризуются окарбоначенные (вскипающие от 10% HCl) срединные горизонты. Однако в случае почвообразования на бескарбонатных породах кислотность сдвигается в нейтральную область, хотя рН может иметь слабощелочные значения, что может быть связано с импульверизацией солей.
Общая биомасса микроорганизмов в почвах севера НЗ в 2–2.5 раза меньше, чем в органогенных субстратах о. Нортбрук [23] и в 2–4 раза меньше по сравнению с почвами островов Алджер, Ферсмана, Хейса, Гукера и Земля Александры [21] архипелага ЗФИ, который на 3°–5° севернее изученных территорий НЗ [20]. Такое существенное различие можно объяснено тем, что уровень микробной биомассы в почве определяется содержанием и распределением в нем органического вещества [36, 45, 74, 76], что обусловлено абиогенными факторами (см. ниже). Полученные данные по биомассе микроорганизмов почв НЗ почти в 1.5 раза больше по сравнению с почво-грунтами Восточной Антарктиды [17]. Такая информация подтверждает гипотезу о том, что развитие как про-, так и эукариот в условиях Высокой Арктики менее лимитировано абиотическими факторами, чем в Антарктике [59].
Основные запасы микробной биомассы (до 80%) для большинства изученных образцов сосредоточены в поверхностном горизонте так же, как для почв ЗФИ [21, 23] и северной части Таймыра [75]. Предположительно, этот факт может быть объяснен относительно высоким обилием корней, которые могут существенно повышать вокруг себя численность микроорганизмов особенно в почвах бедных питательными веществами [61]. По-другому складывается ситуация в антарктических оазисах без сосудистых растений, то есть без корневых систем. Наибольшее развитие микроорганизмов почв Антарктиды происходит в экранированных от негативных воздействий подповерхностных горизонтах почв и почвоподобных тел [17, 22, 83].
Высокая доля грибов (80–98%) в общей биомассе микроорганизмов для почв севера НЗ характерна и для других почв высокой Арктики и Антарктики [17, 21, 81]. Однако это не означает, что практически всю биологическую активность местных почв обеспечивают грибы.
Таким образом, структура биомассы микроорганизмов в почвенных профилях севера НЗ имеет, как черты сходства с таковой для других высокоширотных областей, так и обладает специфическими особенностями.
Парадоксальность севера НЗ в плане биомассы микроорганизмов заключается в том, что она меньше, чем в почвах расположенной на 3°–5° севернее ЗФИ и ненамного больше, чем в почвах Антарктиды. Мы это связываем с сильным влиянием самого крупного покровного ледника России на о. Северный НЗ, который оказывает влияние на климат (прежде всего, на ветровой и температурный режим), а также предопределил высокую щебнистость почвообразующих пород. Что полностью соответствует выявленным ранее закономерностям для других областей Высокой Арктики [3, 4]. Конечно, ЗФИ также находится под влиянием современного оледенения. Но в связи с мелкоостровным характером этого архипелага, ледники не образуют крупного единого массива, который бы оказывал такое мощное влияние на прилегающие перигляциальные территории. С позиций концепции экстремального почвоведения [6] почвы ЗФИ можно отнести к клима-экстремальным, а в почвах перигляциальной зоны покровного ледника на севере НЗ проявляется двойная литоклиматическая мультиэкстремальность.
Биомасса прокариот. Численность и биомасса прокариот в различных биотопах НЗ низка, как и в других арктических территориях [10, 23, 21, 74, 75 ]. Показатели коррелируют с обилием органического углерода в почве, что отмечалось в работах [38, 71]. Полученные значения численности прокариот на порядок меньше по сравнению со значениями для более северной территории ЗФИ [23, 21 ] и Восточной Антарктиды [17, 22], и на два порядка ниже по сравнению с почвами умеренного климата [25, 39].
Резкое уменьшение биомассы прокариот вниз по профилю изученных почв НЗ характерно и для антарктических почв [17, 24]. Биомасса прокариот в криоземе грубогумусовом остаточно-карбонатном (профиль ВВ-9-10) Бухты Благополучия уменьшается от поверхностного горизонта АОсa (1.780 мкг/г почвы) к нижнему CR (0.630 мкг/г почвы), что можно объяснить сокращением уровня кислорода, необходимого для метаболизма аэробных бактерий и архей [72].
Длина мицелия актиномицетов в исследованных почвах севера НЗ на порядок меньше, чем для ЗФИ [21], но доля представителя данного порядка грамположительных бактерий относительно велика для полярных экосистем [10, 65]. Вероятно, длина мицелия актиномицетов коррелирует с генетическими особенностями почвенных профилей и распределением в них органического вещества [46]. Доля актиномицетного мицелия резко возрастает с глубиной от 6.3 в АОсa до 46.1% в CR для профиля криозема грубогумусового остаточно-карбонатного профиля BB-9-10 района Бухты Благополучия; а в единственном горизонте W + Ссa пелозема гумусового остаточно-карбонатного среднескелетного (профиль ВВ-8) весьма велика 34.1%. Развитие актиномицетов в срединных горизонтах может быть связано с их адаптацией к олиготрофным условиям [8, 36], а также со стремлением избежать жестких климатических факторов, проявляющихся более явно в верхних горизонтах [46, 83].
Подробно рассмотрена структура прокариотной биомассы для каждого из изученных районов севера НЗ из-за специфичности почвенно-экологических и климатических условий в каждом из них [3, 4]. Почвы мыса Желания беднее прокариотами, чем остальные исследованные территории. Средняя биомасса прокариот на образец здесь составляет лишь 0.313 мкг/г почвы, несмотря на наличие над криоземом остаточно-карбонатным сильноскелетным (профиль CJ-22-23) обильного мохового очеса, обычно содержащего много бактерий [8, 17]. Криозем глееватый скелетный Русской Гавани (профиль RG-1-3) имеет два максимума прокариотной биомассы – в подстилочно-торфяном горизонте О (1.628 мкг/г почвы) и наиболее глубоком горизонте СRg (1.286 мкг/г почвы). Вероятно, из-за активной миграции микроорганизмов по профилю вместе с растворами в вегетационный сезон и последующей задержкой на мерзлотном водоупоре [30].
Биомасса грибов. Из-за разнообразия эколого-географических условий исследованных территорий [20] запасы и структура биомассы грибов в почвах севера НЗ варьируют в широких пределах. Минимальные значения сходны, а максимальные примерно в 8 раз меньше по сравнению с таковыми для почв ЗФИ [21, 23], видимо, из-за локально более сурового климата и преобладания сильноскелетных горных пород, обедненных биогенными элементами [15], обусловленных влиянием крупнейшего ледника России. Биомасса микобиоты в изученных почвенных профилях Ледяной Гавани, мыса Желания и Бухты Благополучия резко уменьшается от поверхностных горизонтов к глубинным, что типично для многих зональных почв, как высоких [74], так и средних широт [34]. Такое распределение может быть обусловлено активным развитием эккрисотрофной микобиоты в зоне ризоидов мхов и около лишайников [51]. Однако для профилей района Русской Гавани (RG-1-3 и RG-5-6) биомасса грибов, наоборот, возрастает с увеличение глубины, что характерно для почв оазисов Восточной Антарктиды, где большая часть микобиоты развивается в подповерхностных горизонтах [17, 22]. Полагаем, это связано с миграцией органического вещества из верхних горизонтов в нижние из-за большей щебнистости грунтов [30] или криотурбаций [58] по сравнению с другими рассмотренными районами.
Мицелий – важный компонент грибной биомассы, на долю которого приходится до 100% содержания грибов в почвах [53, 56]. Тем не менее, один из изученных подповерхностных горизонтов профиля пелозема перегнойно-гумусового остаточно-карбонатного сильноскелетного (LG-15-17) не содержал гиф микобиоты. Это свидетельствует об угнетенном состоянии данной группы микроорганизмов в олиготрофных условиях минеральных горизонтов высокоарктических почв, что подтверждается наблюдениями для высокоарктических пустошей ЗФИ [21].
Около 65% мицелия грибов представлено тонким мицелием до 3 мкм в диаметре, что, вероятно, является следствием воздействия сурового климата [22]. Не обнаружены пряжки на мицелии грибов, что косвенно может свидетельствовать о низком содержании в этих арктических почвах отдела Basidiomycota и подтверждается другими исследователями [53]. Не выявлены ризоморфы и склероции, которые могли разрушиться на отдельные гифы при механической обработке почвенных образцов на вортексе.
Грибные споры, обнаруженные в исследованных образцах, мелкие (диаметром 2–3 мкм), что характерно для биотопов с экстремальными условиями [17, 82]. Преобладание пропагул столь малых размеров обычно связано с экстремальными условиями полярного климата и выявлено для других высокоширотных территорий [17]. Форма грибных спор является маркером, по которому можно определить принадлежность микобиоты к тому или иному таксону [14, 53, 55], однако не выявлены пропагулы специфической морфологии.
Биологическая активность. Поскольку распределение биомассы прокариот по изученным почвенным профилям существенно отличается от пиков эмиссии СО2, предполагаем, что основной вклад в базальное и СИД вносят грибы [34]. Интенсивность эмиссии резко уменьшается от поверхностных органогенных к срединным минеральным горизонтам, что может быть связано, как с уменьшением доступности кислорода [72], низким содержанием углерода [74], а также обилием карбонатов кальция в нижних горизонтах. Для органогенных горизонтов разница значений базального дыхания и СИД составляет 3–5 раз, а для минеральных горизонтов – до порядка. Можно предположить, что одним из факторов, лимитирующих развитие почвенного микробиома в высокоарктических биогеоценозах, является низкий уровень содержания доступных форм органического вещества [38, 45, 70, 75]. По сравнению с другими полярными областями эмиссия CO2 из почвенных горизонтов севера НЗ на 2 порядка больше (для органогенных горизонтов), чем из максимально биогенных гиполитных альго-бактериальных горизонтов каменных мостовых Антарктиды [17, 22]. Это косвенно подтверждает гипотезу о большей продуктивность экосистем Арктики по сравнению с Антарктикой [59]. Полученные в нашем исследовании значения СИД в органогенных горизонтах близки к данным для субарктической тундры Швеции [50]. Для некоторых изученных органогенных горизонтов интенсивность базального дыхания сопоставима по порядку с таковой даже для подстилочно-торфяных горизонтов почв Центральной Сибири [48].
Максимальная интенсивность эмиссии CH4 отмечена в моховых подстилочно-торфяных горизонтах, где самая большая численность и биомасса прокариот, судя по методу люминесцентной микроскопии. Во мхах различных регионов мира зачастую активно развиваются метаногены [41]. Полученные в нашем исследовании значения эмиссии CH4 сопоставимы с данными для автоморфных участков полигональной тундры севера Аляски [66] и других высокоширотных регионов [57]. Выявлена положительная корреляция между уровнем органического вещества и влажностью образцов с интенсивностью процесса метаногенеза, что подтверждается литературными данным для некоторых тундровых почв [35, 64, 69].
В Восточной Антарктиде минимальная денитрификация более чем на порядок меньше, чем в исследованных почвах НЗ, однако максимальная в 2–3 раза больше [17, 22]. Такая разница может быть объяснена, с одной стороны, сильным стимулирующим влиянием корневой системы растений на почвенный микробиом в Арктических экосистемах [61], а, с другой, присутствием мощного слоя оторфованного органического вещества в рассматриваемой антарктической почве [17, 22]. Судя по большинству опубликованных данных по эмиссии N2O из почв шестого континента [17, 22], уровень потенциальной денитрификации, как на севере НЗ, так и для гиполитных альго-бактериальных горизонтов каменных мостовых Антарктиды примерно одинаков. Полученные результаты для органогенных горизонтов близки к данным для оторфованных почв европейской части Российской Субарктики [82]. Отмечено, что интенсивность денитрификации положительно коррелирует с уровнем влажности и содержанием азота в почве, что показано в других исследованиях [67].
Таким образом, показатели биологической активности почв, определенные газохроматографическими методами, сходны с данными для почв Высокой Арктики [57], Восточной Антарктиды и значительно меньше, обычно регистрируемых для умеренного климата [31]. Максимальные значения интенсивности процессов эмиссии СО2, CH4 и N2O выявлены для поверхностных органогенных горизонтов, представленных, преимущественно мохово-лишайниковым покровом, а также в горизонтах, более насыщенных влагой, обогащенных органическим углеродом и имеющих значительную биомассу микроорганизмов. Полученные результаты позволяют предположить, что микробные сообщества почв севера НЗ в течение вегетационного сезона способны вносить существенный вклад в эмиссию парниковых газов атмосферы.
ЗАКЛЮЧЕНИЕ
Почвенный покров северной части о. Северный архипелага НЗ (мыс Желания, Ледяная Гавань, Русская Гавань, Бухта Благополучия) имеет мозаичное строение, которое определяется не столько широтным положением районов, сколько сложившимися на них местными условиями. Большинство почвенных разностей и структур почвенного покрова более характерны для высокоарктических (тундро)пустошей, чем для арктических пустынь.
В то же время характерной особенностью почв различных биотопов севера НЗ является низкая микробная биомасса и биологическая активность (базальное и СИД, метаногенез и денитрификация). Численность прокариот, будучи на два порядка меньше по сравнению с почвами умеренного климата, оказалась на порядок ниже, чем в почвах высокоарктических тундр архипелага Земля Франца-Иосифа и даже некоторых почвах оазисов Восточной Антарктиды.
Из-за разнообразия эколого-географических условий севера НЗ, запасы и структура биомассы грибов в почвах варьируют в широких пределах. Минимальные значения сходны, а максимальные примерно в 8 раз меньше по сравнению с таковыми для почв высокоарктических тундр архипелага Земля Франца-Иосифа, что наиболее вероятно связано с составом почвообразующих пород и локально более неблагоприятными климатическими условиями. Для большинства исследованных почв доля мицелия в грибной биомассе составляет менее половины. Основная масса грибных спор и мицелия представлена мелкими формами с размерами от 2 до 3 мкм. Доля микобиоты в общей микробной биомассе значительно превышает долю прокариот, что характерно для многих других почв высокой Арктики, континентальной Антарктики, а также умеренного пояса.
Все параметры биологической активности изученных почв резко снижаются вниз по профилю, что положительно коррелирует с содержанием органического вещества, углерода и азота.
По совокупности изученных показателей биологическая активность почв севера НЗ меньше по сравнению с почвами высокоарктических тундр расположенного на 3°–5° севернее архипелага ЗФИ и больше, чем в почвах оазисов Восточной Антарктиды. Это обусловлено влиянием самого крупного покровного ледника России на о. Северный НЗ и связанных с ним выводными ледниками, превращающими перигляциальную зону в цепь оазисов с разреженным почвенно-растительным покровом и повсеместным развитием каменных мостовых из-за выдувания мелкозема сильнейшими ветрами. Ледник обусловил высокую щебнистость почвообразующих пород и создает жесткий ветровой и температурный режим для почв северной части НЗ. Это приводит к лито-климатической мультиэкстремальности местных почв, что и обусловливает пониженные почвенно-биологические параметры. Таким образом, как и в Южном полушарии, покровное оледенение в Арктике оказывает существенное влияние на почвенно-географические закономерности.
Список литературы
Александрова E Растительность полярных пустынь СССР. Л.: Наука, 1983. 142 с.
Ананко Т.В., Герасимова М.И., Конюшков Д.Е. Арктические и тундровые почвы на новой цифровой почвенной карте России масштаба 1 : 2.5 млн // Бюл. Почв. ин-та им. В.В. Докучаева. 2020. № 101. С. 46–75.
Горячкин С.В. Почвенный покров Севера (структура, генезис, экология, эволюция). М.: ГЕОС, 2010. 414 с.
Горячкин С.В., Караваева Н.А., Таргульян В.О. География почв Арктики: современные проблемы // Почвоведение. 1998. № 5. С. 520–530.
Горячкин С.В., Любова С.В., Левандовская Т.В. Почвенно-геохимические особенности береговых и островных геосистем в экстремальных условиях Арктики // Комплексная научно-образовательная экспедиция “Арктический плавучий университет–2015”: материалы экспедиции САФУ. 2015. С. 35–59.
Горячкин С.В., Мергелов Н.С., Таргульян В.О. Генезис и география почв экстремальных условий: элементы теории и методические подходы // Почвоведение. 2019. № 1. С. 5–19.
Грищенко И.В. Климат // Новая Земля. М.: Европейские издания – Paulsen, 2009. С. 307–311.
Добровольская Т.Г., Головченко А.В., Звягинцев Д.Г. Анализ экологических факторов, ограничивающих деструкцию верхового торфа // Почвоведение. 2014. № 3. С. 304-316. https://doi.org/10.7868/S0032180X14030046
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А, Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1096. https://doi.org/10.7868/S0032180X15090038
Дуброва М.С., Лубсанова Д.А., Макарова Е.П., Кожевин П.А., Манучарова Н.А., Зенова Г.М. Психротолерантные актиномицеты в почвах тундры и северной тайги // Вестник Моск. ун-та. Сер. 17. Почвоведение. 2011. № 2. С. 3–8.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во Моск. ун-та, 1991. 60 с.
Злобин Ю.А. Принципы и методы изучения ценотических популяций растений. Казань, 1989. 147 с.
Казеев К.Ш., Кутровский М.А., Даденко Е.В., Везденеева Л.С., Колесников С.И., Вальков В.Ф. Влияние карбонатности пород на биологические свойства горных почв Северо-Западного Кавказа // Почвоведение. 2012. № 3. С. 327–327.
Кирцидели И.Ю., Власов Д.Ю., Баранцевич Е.П., Крыленков В.А., Соколов В.Т. Комплексы микроскопических грибов в почвах и грунтах полярного острова Известий ЦИК (Карское море) // Микология и фитопатология. 2014. № 48(6). С. 365–371.
Крупская В.В., Мирошников А.Ю., Доржиева О.В., Закусин С.В., Семенков И.Н., Усачева А.А. Минеральный состав почв и донных осадков заливов архипелага Новая Земля // Океанология. 2017. № 57(1). С. 238–245.
Кулиев А.Н. Растительность // Новая Земля. М.: Европейские издания–Paulsen, 2009. С. 334–349.
Лысак Л.В., Максимова И.А., Никитин Д.А., Иванова А.Е., Кудинова А.Г., Соина В.С., Марфенина О.Е. Микробные сообщества почв Восточной Антарктиды // Вестник Моск. ун-та. Сер. 16. Биология. 2018. Т. 73. № 3. С. 132–140.
Манучарова Н.А. Молекулярно-биологические аспекты исследований в экологии и микробиологии. 2010.
Мирошников А.Ю., Лаверов Н.П., Чернов Р.А., Кудиков А.В., Усачева А.А., Семенков И.Н., Алиев Р.А., Асадулин Эн Э., Гаврило М.В. Радиоэкологические исследования на севере архипелага Новая Земля // Океанология. 2017. Т. 57. № 1. С. 227–237
Мосеев Д.С., Сергиенко Л.А. К флоре островов архипелага Земля Франца-Иосифа и северной части архипелага Новая Земля (аннотированный список видов) // Ученые записки Петрозаводского гос. ун-та. 2017. № 4. 165 с.
Никитин Д.А., Лысак Л.В., Мергелов Н.С., Долгих А.В., Зазовская Э.П., Горячкин С.В. Микробная биомасса, запасы углерода и эмиссия СО2 в почвах Земли Франца-Иосифа: высокоарктические тундры или полярные пустыни? // Почвоведение. 2020. № 4. С. 1–19. https://doi.org/10.31857/S0032180X20040115
Никитин Д.А., Марфенина О.Е., Кудинова А.Г., Лысак Л.В., Мергелов Н.С., Долгих А.В., Лупачев А.В. Микробная биомасса и биологическая активность почв и почвоподобных тел береговых оазисов Антарктиды // Почвоведение. 2017. № 9. С.1122–1133. https://doi.org/10.7868/S0032180X17070073
Никитин Д.А., Семенов М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нортбрук (Земля Франца-Иосифа) // Микология и фитопатология. 2019. № 53(4). С. 210–222. https://doi.org/10.1134/S002636481904010X
Никитин Д.А., Семенов М.В., Тхакахова А.К., Железова А.Д., Бгажба Н.А., Кутовая О.В. Численность копий рибосомальных генов микобиоты в почвах и почвоподобных телах Земли Франца-Иосифа и Новой Земли // Комплексная научно-образовательная экспедиция “Арктический плавучий университет – 2017”. Архангельск: КИРА, 2017. С. 35–39.
Полянская Л.М., Звягинцев Д.Г. Содержание и структура микробной биомассы как показатели экологического состояния почв // Почвоведение. 2005. № 6. С. 706–714.
Полянская Л.М., Пинчук И.П., Степанов А.Л. Сравнительный анализ методов люминесцентной микроскопии и каскадной фильтрации для оценки численности и биомассы бактерий в почве: роль разведения почвенной суспензии // Почвоведение. 2017. № 10. С. 1216–1219.
Семенков И.Н. Физико-географическая характеристика архипелага Новая Земля (литературный обзор). 2020. https://doi.org/10.13140/RG.2.2.15583.20642
Семенов В.М., Тулина А.С., Семенова Н.А., Иванникова Л.А. Гумификационные и негумификационные пути стабилизации органического вещества в почве (обзор) // Почвоведение. 2013. № 4. С. 393–393. https://doi.org/10.7868/S0032180X13040114
Смирнов И.П. Динамика прибрежных ландшафтов на северо-востоке острова Северный архипелага Новая Земля // Известия Русского географического общества. 2015. Т. 147. Вып. 3. С. 30–41.
Соина В.С., Мергелов Н.С., Кудинова А.Г., Лысак Л.В., Демкина Е.В., Воробьева Е.А., Долгих А.В., Шоркунов И.Г. Исследования микробных сообществ почв и почвоподобных тел в экстремальных условиях Антарктиды. M., 2017. С. 149–168.
Степанов А.Л., Лысак Л.В. Методы газовой хроматографии в почвенной микробиологии. М.: МАКС Пресс, 2003. С. 151.
Холод С.С. Растительность в окрестностях мыса Желания (остров Северный архипелага Новая Земля) // Растительность России. 2020. № 38. С. 85–138. https://doi.org/10.31111/vegrus/2020.38.85
Шахин Д.А. Обзор растительного покрова западного побережья Новой Земли // Новая Земля. Природа. История. Археология. Культура: Тр. Морской арктической комплексной экспедиции (МАКЭ). М., 1992. Вып. III(2). С. 98–124.
Ananyeva N.D., Castaldi S., Stolnikova E.V., Kudeyarov V.N., Valentini R. Fungi-to-bacteria ratio in soils of European Russia // Arch. Agronomy Soil Sci. 2015. V. 61(4). P. 427–446. https://doi.org/10.1080/03650340.2014.940916
Arndt K.A., Oechel W.C., Goodrich J.P., Bailey B.A., Kalhori A., Hashemi J., Sweeney C., Zona D. Sensitivity of methane emissions to later soil freezing in Arctic tundra ecosystems // J. Geophys. Res.: Biogeosciences. 2019. V. 124(8). P. 2595–2609. https://doi.org/10.1029/2019JG005242
Baldrian P. The known and the unknown in soil microbial ecology // FEMS microbiology ecology. 2019. V. 95(2). P. fiz005. https://doi.org/10.1093/femsec/fiz005
Ball B.A., Virginia R.A. Microbial biomass and respiration responses to nitrogen fertilization in a polar desert // Polar Biol. 2014. V. 37(4). P. 573–585.
Bakermans C., Emili L.A. Terrestrial systems of the Arctic as a model for growth and survival at low temperatures // Model Ecosystems in Extreme Environments. Academic Press, 2019. P. 1–21.
Bloem J., Hopkins D.W., Benedetti A. (Eds.). Microbiological methods for assessing soil quality. CABI, 2005.
Boyd W.L. Microbiological studies of arctic soils // Ecology. 1958. V. 39(2). P. 332–336. https://doi.org/10.2307/1931879
Bräuer S., Basiliko N., Siljanen H., Zinder S. Methanogenic archaea in peatlands // FEMS Microbiol. Lett. 2020. https://doi.org/10.1093/femsle/fnaa172
Bridge P.D., Spooner B.M. Non-lichenized Antarctic fungi: transient visitors or members of a cryptic ecosystem? // Fungal Ecol. 2012. V. 5(4). P. 381–394. https://doi.org/10.1016/j.funeco.2012.01.007
Chernov T.I., Tkhakakhova A.K., Lebedeva M.P., Zhelezova A.D., Bgazhba N.A., Kutovaya O.V. Microbiomes of the Soils of Solonetzic Complex with Contrasting Salinization on the Volga–Ural Interfluve // Euras. Soil Sci. 2018. V. 51(9). P. 1057–1066. https://doi.org/10.1134/S1064229318090041
Cox F., Newsham K.K., Bol R., Dungait J.A., Robinson C.H. Not poles apart: Antarctic soil fungal communities show similarities to those of the distant Arctic // Ecology Lett. 2016. V. 19(5). P. 528–536. https://doi.org/10.1111/ele.12587
Darrouzet-Nardi A., Steltzer H., Sullivan P.F., Segal A., Koltz A.M., Livensperger C. et al. Limited effects of early snowmelt on plants, decomposers, and soil nutrients in Arctic tundra soils // Ecology Evolution. 2019. V. 9(4). P. 1820–1844. https://doi.org/10.1002/ece3.4870
Fischer T. Humic supramolecular structures have polar surfaces and unpolar cores in native soil // Chemosphere. 2017. V. 183. P. 437–443. https://doi.org/10.1016/j.chemosphere.2017.05.125
Flocco C.G., Mac Cormack W.P., Smalla K. Antarctic Soil Microbial Communities in a Changing Environment: Their Contributions to the Sustainability of Antarctic Ecosystems and the Bioremediation of Anthropogenic Pollution // The Ecological Role of Micro-organisms in the Antarctic Environment. 2019. V. 2. P. 133–161.
Grodnitskaya I.D., Karpenko L.V., Knorre A.A., Syrt-sov S.N. Microbial activity of peat soils of boggy larch forests and bogs in the permafrost zone of central Evenkia // Euras. Soil Sci. 2013. V. 46(1). P. 61–73. https://doi.org/10.1134/S1064229313010043
Handelsman J. Metagenomics: application of genomics to uncultured microorganisms // Microbiol. Molecular Biol. Rev. 2004. V. 68(4). P. 669–685. https://doi.org/10.1128/MMBR.69.1.195.2005
Hartley I.P., Hopkins D.W., Garnett M.H., Sommerkorn M., Wookey P.A. Soil microbial respiration in arctic soil does not acclimate to temperature // Ecol. Lett. 2008. V. 11. P. 1092–1100. https://doi.org/10.1111/j.1461-0248.2008.01223.x
Hassan N., Rafiq M., Hayat M., Shah A.A. Hasan F. Psychrophilic and psychrotrophic fungi: a comprehensive review // Rev. Environ. Sci. Bio/Technol. 2016. V. 15(2). P. 147–172.
Isbell F., Craven D., Connolly J., Loreau M., Schmid B., Beierkuhnlein C. et al. Biodiversity increases the resistance of ecosystem productivity to climate extremes // Nature. 2015. V. 526(7574). P. 574. https://doi.org/10.1038/nature15374
Islam M.R., Tudryn G., Bucinell R., Schadler L., Picu R.C. Morphology and mechanics of fungal mycelium // Scientif. Rep. 2017. V. 7(1). P. 1–12. https://doi.org/10.1038/s41598-018-20637-1
IUSS Working Group WRB. 2015. World Reference Base for Soil Resources 2014, update 2015. International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106. FAO, Rome.
Kavanagh K. Fungi: biology and applications. John Wiley & Sons, 2017.
Kaviya N., Upadhayay V.K., Singh J., Khan A., Panwar M., Singh A.V. Role of Microorganisms in Soil Genesis and Functions // Mycorrhizosphere and Pedogenesis. 2019. P. 25–52.
Li F., Zhu R., Bao T., Wang Q., Xu H. Sunlight stimulates methane uptake and nitrous oxide emission from the High Arctic tundra // Sci. Total Environ. 2016. V. 572. P. 1150–1160. https://doi.org/10.1016/j.scitotenv.2016.08.026
Lu Y., Liu S. Cracking in an expansive soil under freeze–thaw cycles // Sciences in Cold and Arid Regions. 2018. V. 9(4). P. 392–397.
Makhalanyane T.P., Valverde A., Velázquez D., Gunnigle E., Van Goethem M.W., Quesada A., Cowan D.A. Ecology and biogeochemistry of cyanobacteria in soils, permafrost, aquatic and cryptic polar habitats // Biodiversity and Conservation. 2015. V. 24(4). P. 819–840.
Malard L.A., Pearce D.A. Microbial diversity and biogeography in Arctic soils // Environ. Microbiol. Rep. 2018. V. 10(6). P. 611–625. https://doi.org/10.1111/1758-2229.12680
Mapelli F., Marasco R., Fusi M., Scaglia B., Tsiamis G., Rolli E., Fodelianakis S., Bourtzis K., Ventura S., Tambone F., Adani F., Borin S., Daffonchio D. The stage of soil development modulates rhizosphere effect along a High Arctic desert chronosequence // ISME J. 2018. V. 12(5). P. 1188–1198. https://doi.org/10.1038/s41396-017-0026-4
Martin R., Sebastian L., Nicole S., Burkhard B. Biodiversity of biological soil crusts from the Polar Regions revealed by metabarcoding // FEMS Microbiol. Ecol. 2018. https://doi.org/10.1093/femsec/fiy036
Mazei Y.A., Tsyganov A.N., Chernyshov V.A., Ivanovsky A.A., Payne R.J. First records of testate amoebae from the Novaya Zemlya archipelago (Russian Arctic) // Polar Biol. 2018. V. 41(6). P. 1133–1142.
Merkel A. Molecular ecology of methanogenic and methanotrophic archaea in hydrothermal habitats. 2015. https://doi.org/10.13140/RG.2.1.2678.2561
Millán-Aguiñaga N., Soldatou S., Brozio S., Munnoch J.T., Howe J., Hoskisson P.A., Duncan K.R. Awakening ancient polar Actinobacteria: diversity, evolution and specialized metabolite potential // Microbiology. 2019. V. 165(11). P. 1169–1180. https://doi.org/10.1099/mic.0.000845
Morrissey L.A., Livingston G.P. Methane emissions from Alaska Arctic tundra: An assessment of local spatial variability // J. Geophys. Res. 1992. V. 97(D15). P. 16661–16670. https://doi.org/10.1029/92JD00063
Nadeau S.A., Roco C.A., Debenport S.J., Anderson T.R., Hofmeister K.L., Walter M.T., Shapleigh J.P. Metagenomic analysis reveals distinct patterns of denitrification gene abundance across soil moisture, nitrate gradients // Environ. Microbiol. 2019. V. 21(4). P. 1255–1266.
Oechel W.C., Vourlitis G., Hastings S.J. Cold season CO2 emission from arctic soils // Global Biogeochem. Cycles. 1997. V. 11(2). P. 163–172. https://doi.org/10.1029/96GB03035
Oh Y., Zhuang Q., Liu L., Welp L.R., Lau M.C., Onstott T.C. et el. Reduced net methane emissions due to microbial methane oxidation in a warmer Arctic // Nature Climate Change. 2020. V. 10(4). P. 317–321.
Pastor A., Freixa A., Skovsholt L.J., Wu N., Romaní A.M., Riis T. Microbial Organic Matter Utilization in High-Arctic Streams: Key Enzymatic Controls // Microbial Ecol. 2019. V. 78(3). P. 539–54. https://doi.org/10.1007/s00248-019-01330-w
Paukkunen J., Kozlov M.V. Stinging wasps, ants and bees (Hymenoptera: Aculeata) of the Nenets Autonomous Okrug, northern Russia // Annales Zoologici Fennici. Finnish Zoological and Botanical Publishing Board. 2020. V. 57(1–6). P. 115–128. https://doi.org/10.5735/086.057.0112
Rusakov A., Makeev A., Khokhlova O., Kust P., Lebedeva M., Chernov T., Golyevae A., Popova A., Kurbanova F., Puzanova T. Paleoenvironmental reconstruction based on soils buried under Scythian fortification in the southern forest-steppe area of the East European Plain // Quatern. Int. 2019. V. 502. P. 197–217. https://doi.org/10.1016/j.quaint.2018.05.016
Russel T.K. Microbial Biomass: A Paradigm Shift. Terrestrial Biogeochemistry. World Scientific, 2017.
Santruckova H., Kotas P., Barta J., Urich T., Capek P., Palmtag J. et al. Significance of dark CO2 fixation in arctic soils // Soil Biol. Biochem. 2018. V. 119. P. 11–21.
Schmidt N., Bölter M. Fungal and bacterial biomass in tundra soils along an arctic transect from Taimyr Peninsula, central Siberia // Polar Biol. 2002. V. 25(12). P. 871–877.
Semenov M.V., Chernov T.I., Tkhakakhova A.K., Zhelezova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Appl. Soil Ecol. 2018. V.127. P. 8–18. https://doi.org/10.1016/j.apsoil.2018.03.002
Shivaji S., Chattopadhyay M.K., Reddy G.S. Diversity of Bacteria from Antarctica, Arctic, Himalayan Glaciers and Stratosphere // Proceedings of the Indian National Science Academy. 2019. V. 85(4). P. 909–923. https://doi.org/10.16943/ptinsa/2019/49717
Sikorski J. The prokaryotic biology of soil // Soil Organisms. 2015. V. 87(1). P. 1–28.
Singh J.S., Gupta V.K. Soil microbial biomass: a key soil driver in management of ecosystem functioning // Sci. Total Environ. 2018. V. 634. P. 497–500. https://doi.org/10.1016/j.scitotenv.2018.03.373
Soong J.L., Fuchslueger L., Marañon-Jimenez S., Torn M.S., Janssens I.A., Penuelas J., Richter A. Microbial carbon limitation: The need for integrating microorganisms into our understanding of ecosystem carbon cycling // Global Change Biol. 2020. V. 26(4). P. 1953–1961. https://doi.org/10.1111/gcb.14962
Sterflinger K., Tesei D., Zakharova K. Fungi in hot and cold deserts with particular reference to microcolonial fungi // Fungal Ecology. 2012. V. 5(4). P. 453–462. https://doi.org/10.1016/j.funeco.2011.12.007
Voigt C., Lamprecht R.E., Marushchak M.E., Lind S.E., Novakovskiy A., Aurela M., Martikainen P.J., Biasi C. Warming of subarctic tundra increases emissions of all three important greenhouse gases – carbon dioxide, methane, and nitrous oxide // Glob Change Biol. 2017. V. 23. P. 3121–3138. https://doi.org/10.1111/gcb.13563
Wei S.T., Lacap-Bugler D.C., Lau M.C., Caruso T., Rao S., de Los Rios A. et al. Taxonomic and functional diversity of soil and hypolithic microbial communities in Miers Valley, McMurdo Dry Valleys, Antarctica // Frontiers in Microbiology. 2016. V. 7. P. 1642. https://doi.org/10.3389/fmicb.2016.01642
Xiao B., Hu K. Moss-dominated biocrusts decrease soil moisture and result in the degradation of artificially planted shrubs under semiarid climate // Geoderma. 2017. V. 291. P. 47–54. https://doi.org/10.1016/j.geoderma.2017.01.009
Zazovskaya E., Mergelov N., Shishkov V., Dolgikh A., Turchinskaya S., Karelin D., Goryachkin S. Cryoconites – as a source of carbon for soils and soil-like bodies of High latitudes // International Conference “Solving the puzzles from Cryosphere”. Program, Abstracts. Pushchino, Russia, April 15–18, 2019. P. 186–187.
Дополнительные материалы отсутствуют.


