Почвоведение, 2021, № 2, стр. 261-270
Биохимическая устойчивость водорастворимого органического вещества почв горной тундры Хибин при постпирогенной сукцессии
М. Н. Маслов a, *, О. А. Маслова a, Е. И. Копеина b
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Полярно-альпийский сад-институт им. Н.А. Аврорина Кольского научного центра РАН
184209 Апатиты, мкр. Академгородок, 18, Россия
* E-mail: maslov.m.n@yandex.ru
Поступила в редакцию 23.01.2020
После доработки 13.04.2020
Принята к публикации 12.05.2020
Аннотация
Изучена динамика содержания и устойчивости к микробиологической трансформации водорастворимого органического вещества (ВОВ) сухоторфяно-подбура (Entic Folic Podzols) при постпирогенной сукцессии кустарничковой экосистемы в горной тундре Хибин. Пожар средней интенсивности не приводит к статистически значимому уменьшению содержания ВОВ в почве по сравнению с фоновым участком. Установлено, что активность минерализации ВОВ определяется в первую очередь его собственными свойствами, а не микробным сообществом. Динамика биодеструкции адекватно описывается двухкомпонентной экспоненциальной моделью первого порядка с установлением статистически достоверного существования быстро- (среднее время существования менее 1 сут) и медленноминерализуемого (среднее время существования от 33 до 111 сут) пулов. Максимальная доля “быстрого” пула характерна для почвы непосредственно после пожара и плавно убывает в ходе дальнейшей постпирогенной сукцессии. В процессе биодеструкции происходит биокинетический отбор наиболее устойчивых к воздействию микроорганизмов гидрофобных соединений ароматического строения, в то время как простые азотсодержащие компоненты ВОВ потребляются микроорганизмами в первую очередь.
ВВЕДЕНИЕ
Водорастворимое органическое вещество (ВОВ) является сложной смесью компонентов и продуктов жизнедеятельности растений, микроорганизмов и почвенной фауны [14] и играет ведущую роль в круговороте углерода и других элементов, прежде всего, азота и фосфора. ВОВ участвует в регулировании множества химических и биологических почвенных процессов, включая интенсивность почвенного дыхания, а также определяет окислительно-восстановительный режим и кислотно-основные равновесия в почве [14, 39, 58]. По своей природе ВОВ представляет собой разнородную по свойствам группу органических веществ, различающихся по устойчивости к микробиологической трансформации. Под микробиологической трансформацией в данном случае следует понимать: 1) процессы деструкции органических молекул с включением углерода в состав микробных клеток и 2) процесс их полного разрушения с образованием СО2 как конечного продукта [39]. В зависимости от источника происхождения от 10 до 93% ВОВ почвы может быть метаболизировано микроорганизмами [21, 32–34, 57]. Устойчивость ВОВ к биодеструкции является важным процессом, контролирующим динамику этой фракции почвенного органического вещества, и оказывает прямое воздействие на баланс связывания и мобилизации углерода почвами. В работах [32, 42] показано, что пул ВОВ почвы может быть разделен на две фракции, различающиеся по скорости минерализации. Для более полного понимания роли ВОВ в общей секвестрации углерода почвами важно определить соотношение этих фракций и определить среднее время пребывания углерода в их составе.
Несмотря на то, что ВОВ является продуктом жизнедеятельности всех почвенных организмов и разделить эти источники сложно [14].Содержание и свойства ВОВ во многом определяются растительным покровом [37, 38, 56]. Установлено, что содержание ВОВ в лесных почвах выше, чем в почвах пастбища или сельскохозяйственных угодий [27, 50, 56]. Однако ВОВ лесных почв более устойчиво к микробиологической деструкции по сравнению с почвами агроэкосистем, а степень этой устойчивости зависит от видового состава деревьев [11, 36, 49]. Изменение фитоценоза влечет за собой смену таксономического состава микроорганизмов, что влияет на способность к биодеструкции ВОВ в почве [15, 33].
Загрязнение почвы, а также природные и антропогенные катастрофы могут оказывать влияние на содержание и устойчивость ВОВ к биодеструкции. Детальное понимание процессов образования и деструкции ВОВ при антропогенных воздействиях на почву важно для прогнозирования скорости восстановления и изменения процессов биологического круговорота углерода, как одной из фундаментальных характеристик почвы. Так, для ВОВ подстилки ельников Кольского полуострова, находящихся в зоне воздействия выбросов предприятия цветной металлургии, показано двукратное снижение устойчивости к микробиологической трансформации по сравнению с ВОВ из подстилок фонового участка [11]. Ранее установлено, что нефтяное загрязнение торфяно-глеезема и его рекультивация с применением осадка сточных вод влияет не только на общее содержание ВОВ в поверхностных горизонтах, но и на его биохимическую устойчивость [8]. Часто противоречивые данные получены при изучении влияния лесных пожаров на ВОВ почвы. Установлено, что воздействие огня повышает водоотталкивающую способность поверхностного слоя почвы, что приводит к увеличению поверхностного стока и потере большого количества ВОВ [52]. В то время как значительное снижение содержания углерода растворенного органического вещества в постпирогенных торфяниках зафиксировано в ряде исследований [18, 55], имеются данные и о кратковременном увеличении содержания ВОВ после пожара [19]. Помимо изменения общего количества, при пожаре изменяется состав ВОВ [18]. Важно отметить, что термическое воздействие приводит к образованию конденсированных ароматических соединений, как правило, имеющих большую устойчивость к воздействию микроорганизмов. В то же время с увеличением срока после пожара происходит постепенное окисление и повышение растворимости этих соединений в воде [25, 44]; их подверженность биологическому разложению увеличивается [40].
Цель работы – оценка устойчивости водорастворимого органического вещества почв на разных стадиях постпирогенной сукцессии к микробиологической трансформации.
ОБЪЕКТЫ И МЕТОДЫ
Исследовали участки горной тундры Хибин (Мурманская область) непосредственно после пожара средней интенсивности (две недели после прохождения огня), а также экосистемы с разными сроками постпирогенного самовосстановления фитоценозов и почв: 1, 2, 3, 7, 12 и 60 лет. Для исследования выбирали участки северной или северо-восточной экспозиции, расположенные на высоте 600–650 м над ур. м. Датирование возраста пожаров проводили по архивным данным Полярного ботанического сада-института им. Н.А. Аврорина и личным наблюдениям. В качестве контрольных выбраны ерниковые кустарничковые экосистемы, наиболее подверженные возникновению пожаров, что связано с их расположением в наиболее сухих участках на гребнях склонов и медленной минерализацией органического вещества в сочетании с обилием кустарничков и лишайников. Подробное описание исследуемых экосистем приведено ранее [9, 10].
Почва контрольного участка – сухоторфяно-подбур иллювиально-гумусовый [5] (Entic Folic Podzols [29]). На всех стадиях постпирогенной сукцессии почвы представлены поверхностными органогенными горизонтами, сохраняющими следы пирогенного воздействия. В нижней части профиля почвы имеют типичное для подбуров строение. Образцы для исследования отбирали из поверхностного органогенного (пирогенного) горизонтов почвы.
Общее содержание углерода (Собщ) и азота в пробах определяли на элементном анализаторе Elementar Vario EL III. Для экстракции ВОВ использовали вытяжки из свежих почвенных образцов. Экстракцию проводили бидистиллированной водой при температуре 20°С при соотношении почва : раствор 1 : 10. Перед определением концентрации ВОВ полученные растворы центрифугировали при 4500 об./мин в течение 20 мин и фильтровали через мембранный фильтр с размером пор 0.45 мкм (ацетат целлюлозы; OE 67, Schleicher and Schuell). Определение концентрации углерода (СВОВ) и азота ВОВ проводили на автоматическом анализаторе liquiTOC Elementar (Германия).
Различия в активности микроорганизмов почв на разных стадиях послепожарной сукцессии оценивали по скорости минерализации раствора глюкозы (10 мг С/л). Для предотвращения ингибирования микроорганизмов доступностью минеральных компонентов в раствор вносили нитрат аммония и фосфат калия для создания стехиометрического соотношения С : N : P, равного 1 : 20 : 200, что соответствует реальному соотношению элементов в экстрактах. Подготовленные растворы инокулировали 100 мкл почвенной суспензии и инкубировали в течение 10 сут при постоянной температуре 20°С. Для приготовления почвенной суспензии для инокуляции почвенную навеску (около 5 г) при естественной влажности инкубировали в течение суток при 20°С, после чего добавляли к ней 30 мл бидистиллированной воды и встряхивали на вортексе в течение 1 мин.
Определение константы минерализации глюкозы проводили с использованием однокомпонентного уравнения экспоненциальной регрессии первого порядка:
где С0 – доля минерализовавшейся глюкозы по отношению к его начальной концентрации, %; а – доля минерализуемого пула, %; t – время инкубации, сутки; k – константа скорости минерализации, сут–1. Расчет проводили с применением пакета нелинейной оценки программы Statistica 10 с использованием метода наименьших квадратов. Точность аппроксимации экспериментальных кривых составляла более 0.95.Кинетику разложения ВОВ определяли в ходе инкубации почвенных растворов. При необходимости перед началом эксперимента почвенные экстракты разбавляли бидистиллированной водой до концентрации водорастворимого углерода, не превышающей 10 мг/л, что необходимо для выравнивания начальных условий эксперимента и предотвращения избыточного роста микробной биомассы [24]. В стеклянные колбы объемом 500 мл помещали по 200 мл раствора ВОВ каждой из исследуемых почв. Содержимое каждой колбы инокулировали 100 мкл почвенной суспензии. В первом варианте опыта пробы инокулировали суспензией из той же почвы, что и приготовленная вытяжка. Это позволило оценить реальную устойчивость к микробиологическому разложению ВОВ почв на разных стадиях постпирогенного развития. Во втором варианте инокуляцию всех вытяжек проводили суспензией из контрольной почвы. Это позволило нивелировать различия активности и состава микроорганизмов в разных почвах и оценить закономерности биодеструкции ВОВ в зависимости от его свойств. После инокуляции колбы закрывали пленкой Parafilm, пропускающей газы, но препятствующей испарению воды. Инкубацию растворов проводили в течение 42 сут в темноте при температуре 20°С при постоянном помешивании на орбитальном шейкере. Отбор проб вели на 1, 2, 3, 5, 7, 10, 14, 28, 36 и 42 сут инкубации. Подготовку проб для анализа проводили по описанному выше методу.
Определение соотношения фракций быстро- и медленноминерализуемого органического вещества в составе ВОВ проводили с использованием двухкомпонентного уравнения экспоненциальной регрессии первого порядка:
Для исходных растворов ВОВ и растворов после инкубации определяли абсорбцию в ультрафиолетовом спектре при длине волны 254 нм (A254) на спектрофотометре Specord 50 (Analitic Jena, Германия). Для определения степени гидрофобности и ароматичности ВОВ рассчитывали показатель удельной ультрафиолетовой абсорбции
Все инкубационные эксперименты проводили в трехкратной повторности. В таблицах и на графиках данные приведены средние величины ± ± ошибка среднего, расчет выполнен на вес абсолютно-сухой почвы (105°С, 12 ч). При обработке данных использовали статистический пакет программы Statistica 10.0. Влияние фактора пожара на свойства почвы и ВОВ оценивали с помощью однофакторного дисперсионного анализа (one-way ANOVA). Значимость различий между выборками оценивали по t-критерию, корреляцию между значениями показателей оценивали по критерию Пирсона. Для ряда показателей провели анализ по методу главных компонент. Для всех видов статистического анализа достоверными считали различия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика содержания общего и водорастворимого органического вещества в почвах. Однофакторный дисперсионный анализ не выявил статистически значимого влияния пожара средней интенсивности на общее содержание углерода в почве (табл. 1). Основные тенденции изменения общего содержания и запасов углерода в постпирогенных почвах описаны ранее [9]. Общее органическое вещество сухоторфяно-подбура слабо обогащено азотом, что соотносится с ранее опубликованными данными для этих почв [2, 6, 7]. Пирогенное воздействие приводит к обогащению органического вещества азотом (статистически достоверная разница между вариантами после пожара и фоном при p = 0.035). Выявленные тенденции схожи с ранее описанными для лесных экосистем, в почвах которых наблюдается обогащение органического вещества азотом в первые годы после прохождения пожаров [1, 13]. В ходе дальнейшего постпирогенного развития происходит возрастание отношения С : N, за исключением почвы трехлетней гари, для которой выявлено увеличение обогащенности органического вещества азотом. Мы связываем этот факт с активным заселением гари 3+ мхами [9] и увеличением связывания атмосферного азота, поскольку в кислых и холодных тундровых и высокогорных почвах основной вклад в азотфиксацию вносят симбиотические организмы [48]. Ранее показано, что в горно-тундровом поясе Хибин основной вклад в азотфиксацию под моховыми синузиями вносят эпифитные цианобактерии, а гетеротрофные микроорганизмы не оказывают существенного влияния на интенсивность процесса азотфиксации [3].
Таблица 1.
Динамика содержания общего и водорастворимого углерода тундровых почв при постпирогенной сукцессии (средние ± ошибка среднего)
| Экосистема | Собщ, % | С/Nобщ | ВОВ | |
|---|---|---|---|---|
| мг С/кг | % от Собщ | |||
| 0+ | 29.6 ± 4.0 | 22.9 ± 2.5 | 1456 ± 200 | 0.49 |
| 1+ | 20.3 ± 3.2 | 23.9 ± 1.1 | 659 ± 39 | 0.32 |
| 2+ | 10.3 ± 2.6 | 23.7 ± 1.5 | 769 ± 92 | 0.75 |
| 3+ | 12.2 ± 3.9 | 19.3 ± 0.3 | 644 ± 72 | 0.53 |
| 7+ | 16.4 ± 2.2 | 21.0 ± 1.5 | 792 ± 87 | 0.48 |
| 12+ | 24.6 ± 4.0 | 23.2 ± 1.3 | 980 ± 85 | 0.40 |
| 60+ | 36.7 ± 2.1 | 27.2 ± 1.1 | 1092 ± 171 | 0.30 |
| Контроль | 31.9 ± 2.7 | 26.5 ± 2.8 | 1521 ± 389 | 0.48 |
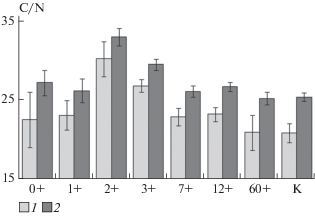
Содержание водорастворимого углерода в почвах постпирогенной сукцессии имеет тесную корреляционную связь (r = 0.81, p < 0.05) с общим содержанием углерода в почве. Пожар не приводит к статистически значимому уменьшению содержания углерода ВОВ в почве по сравнению с контрольным участком. Долгосрочное послепожарное изменение пула ВОВ почвы повторяет динамику Собщ с уменьшением в первые годы после пожара и последующим увеличением по мере восстановления растительности. Подробно эти закономерности рассмотрены ранее [9]. Так же, как для общего органического вещества пожар не оказывает влияния на соотношение C : N в ВОВ (рис. 1). В первые годы после пожара происходит увеличение отношения C : N за счет отсутствия стабильного растительного покрова и поступления опада. В то же время, начиная с трех лет после пожара, обогащенность ВОВ азотом плавно возрастает. Этот факт согласуется с ранее выявленной динамикой азотфиксации в почвах постпирогенных тундровых экосистем [10].
Рис. 1.
Соотношение углерода и азота в ВОВ почв до (1) и после (2) инкубации. 0+ – почва через 2 недели после пожара; 1+, 2+, 3+, 7+, 12+ и 60+ – почва через 1, 2, 3, 7, 12 и 60 лет после пожара соответственно; К – почва кустарничковой экосистемы (контроль).
Прямое пирогенное воздействие приводит к снижению показателя удельной ультрафиолетовой абсорбции (статистически достоверная разница при p = 0.001) (табл. 2). Этот показатель характеризует долю различных, преимущественно гидрофобных, веществ ароматического строения в составе ВОВ [43]. Уменьшение доли ароматических соединений в составе ВОВ при пирогенном воздействии может быть связано с образованием растворимых алифатических продуктов термического разложения гемицеллюлозы и целлюлозы, так как пожар средней интенсивности в первую очередь затрагивает живой напочвенный покров и подстилку, в прямое влияние на органогенный горизонт почвы, как правило, менее значительно. Разложение целлюлозы в почве и подстилке лиственничников при температуре около 200°С показано ранее [12]. Увеличение концентрации гексоз в ВОВ послепожарных почв также может быть связано с лизисом микробных клеток [17]. В ходе дальнейшей постпирогенной сукцессии происходит плавное увеличение показателя SUVA254, связанное с бóльшим поступлением растительного опада и его трансформации с образованием ВОВ с большей долей соединений ароматической природы. Предыдущие исследования показали, что ВОВ состоит в основном из продуктов фотосинтеза. Это подтверждает предположение о том, что ВОВ образуется в процессе разложения подстилки [22, 30, 47]. Ранее показано, что для тундровых растений накопление большого количества фенольных соединений в тканях и, соответственно, растительном опаде, является адаптационным механизмом к стрессовым условиям окружающей среды, прежде всего, низкой температуре и низкой доступности питательных элементов [51].
Кинетика минерализации ВОВ. Минерализация глюкозы. Для почв на разных стадиях постпирогенной сукцессии выявлена схожая динамика минерализации глюкозы микроорганизмами. Для всех изученных почв общая доля глюкозы, минерализованной за 10 сут инкубации, в среднем составила 94.7 ± 2.0%. Константа минерализации глюкозы k коррелирует с содержанием углерода микробной биомассы в почве (r = –0.84, p < 0.05). Среднее время существования (MRT) минерализуемой фракции составляет 1.16 ± 0.12 сут.
Таблица 2.
Показатель удельной ультрафиолетовой абсорбции (SUVA254, л/(мг м)) ВОВ
| Экосистема | До инкубации | После инкубации |
|---|---|---|
| 0+ | 0.99 ± 0.08 | 2.60 ± 0.47 |
| 1+ | 1.40 ± 0.15 | 2.38 ± 0.45 |
| 2+ | 1.93 ± 0.12 | 2.50 ± 0.16 |
| 3+ | 1.70 ± 0.20 | 3.47 ± 0.82 |
| 7+ | 2.38 ± 0.30 | 3.61 ± 0.84 |
| 12+ | 2.25 ± 0.45 | 3.80 ± 0.75 |
| 60+ | 2.00 ± 0.30 | 3.09 ± 0.29 |
| Контроль | 2.22 ± 0.25 | 4.52 ± 0.19 |
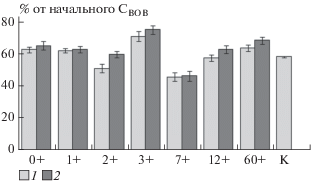
Минерализация ВОВ. За период инкубации (42 сут) микробиологической трансформации подвергается от 45 до 75% ВОВ почвы. Такое соотношение минерализуемых и неминерализуемых компонентов в составе ВОВ в целом соответствует ранее опубликованным данным [21, 32, 33, 46, 57], согласно которым, минерализуется 10–56% ВОВ. В то же время для свежей лесной подстилки этот показатель может составлять 75 [26] и даже 93% [32, 33].
В первые годы после пожара общая доля минерализуемого ВОВ почв (% от СВОВ) плавно снижается и достигает минимума в почве гари двух лет (рис. 2). В ходе дальнейшей сукцессии наблюдается резкое, но непродолжительное увеличение доли минерализуемого органического вещества в общем пуле ВОВ, за которым вновь следует уменьшение этого показателя. В почвах гарей 7–60 лет доля минерализуемого ВОВ плавно увеличивается и для почвы 60+ превышает значения, характерные для контрольного не горевшего участка. Ранее аналогичная временная динамика описана для пула потенциально минерализуемого органического вещества этих почв [9]. Так же, как для потенциально минерализуемого органического вещества почвы, связываем изменения в устойчивости к микробиологической минерализации ВОВ с динамикой растительного покрова гарей. Так, на первых стадиях после пожара поступление свежего органического вещества через прижизненные выделения и опад растений отсутствует, что приводит не только к сокращению самого пула ВОВ, но и к снижению доли легкоминерализуемого органического вещества в нем. Трехлетняя гарь имеет сформированный покров из мхов (прежде всего, Polytrichum juniperum) и начинает активно заселяться травянистыми растениями (Festuca ovina, Chamaenerion angustifolium) и вересковыми кустарничками, что обеспечивает пополнение пула водорастворимого органического вещества. В дальнейшем происходит изменение состава растительного сообщества с постепенным восстановлением доминирования кустарничков и лишайников и снижением доли травянистых растений и мхов, однако их представленность в составе фитоценоза выше, чем в фоновом сообществе, что создает условия для формирования более подверженного к микробиологическому разложению ВОВ.
Рис. 2.
Доля минерализовавшегося ВОВ при постпирогенном восстановлении почв: 1 – инокуляция собственными микроорганизмами почвы, 2 – инокуляция микроорганизмами контрольной почвы.
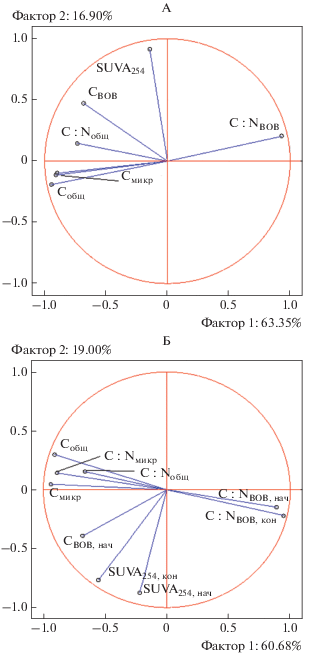
Методом главных компонент установлено, что 80.2% выборочной дисперсии показателя доли минерализуемого органического вещества в общем пуле ВОВ может быть объяснено действием двух факторов (рис. 3). Первый фактор объясняет 63.3% дисперсии и в наибольшей степени коррелирует с такими параметрами, как Cобщ, С/NВОВ, Смикр и С/Nмикр, то есть со свойствами собственно почвы, почвенного ВОВ и микробной биомассы. Второй фактор объясняет 16.9% дисперсии и коррелирует с показателем SUVA254.
Рис. 3.
Проекция совокупности изученных свойств в плоскости двух главных компонент, где группирующая переменная: А – доля минерализуемого ВОВ; Б – доля быстроминерализуемого пула ВОВ.
Сравнение доли минерализуемого ВОВ при инокуляции микроорганизмами собственной почвы и контрольной почвы не выявило значимых различий для большинства образцов (рис. 2). Статистически значимая разница отмечена только для почвы гари 2+, которая характеризуется минимальным содержанием углерода микробной биомассы (912 ± 140 мг/кг [10]). Таким образом, для постпирогенных почв горной тундры на большинстве стадий сукцессии биохимическая устойчивость ВОВ определяется свойствами самого органического вещества, а не характеристиками разлагающего его микробного сообщества. В связи с этим, остальные изученные параметры будут рассмотрены как средние для двух вариантов опыта.
Скорость разложения ВОВ для всех вариантов опыта была наибольшей в первые 3–5 сут инкубации и в дальнейшем сильно снижалась. Подобная динамика ранее выявлена для других почв [4, 11, 24, 32, 53]. Фактические данные по динамике разложения ВОВ почв хорошо аппроксимируются (R2 > 0.95) двухкомпонентным уравнением экспоненциальной регрессии первого порядка, что предполагает существование двух различных по кинетическим характеристикам пулов, соответственно, быстро- и медленноразлагаемого ВОВ. Соотношение этих пулов и их константы скорости минерализации приведены в табл. 3. Максимальная доля быстроминерализуемого пула ВОВ характерна для почвы непосредственно после пожара. Таким образом, несмотря на то, что пожар не оказал статистически влияния на содержание углерода общего и ВОВ в почве, этот фактор статистически значимо влияет на соотношение пулов ВОВ. Увеличение доли быстроминерализуемого ВОВ при пирогенном воздействии может быть связано с термической деполимеризацией части органических компонентов почвы [23], в частности с дегидратацией сложных углеводов и разрушением лигнина [16]. В ходе дальнейшей послепожарной сукцессии происходит плавное уменьшение доли быстроминерализуемого пула ВОВ, однако даже через 60 лет после пожара его доля превышает соответствующий показатель в контрольной почве.
Таблица 3.
Кинетические параметры потенциально минерализуемого пула водорастворимого органического вещества почв
| Экосистема | Быстроминерализуемый пул | Медленноминерализуемый пул | ||||
|---|---|---|---|---|---|---|
| доля, % | k1, сут–1 | MRT, сут | доля, % | k2, сут–1 | MRT, сут | |
| 0+ | 77 | 1.34 ± 0.10 | 0.75 | 23 | 0.031 ± 0.001 | 32.3 |
| 1+ | 64 | 1.36 ± 0.09 | 0.73 | 36 | 0.010 ± 0.001 | 100.0 |
| 2+ | 57 | 1.51 ± 0.10 | 0.66 | 43 | 0.009 ± 0.002 | 111.1 |
| 3+ | 52 | 1.58 ± 0.12 | 0.63 | 48 | 0.016 ± 0.002 | 62.5 |
| 7+ | 48 | 1.44 ± 0.10 | 0.69 | 52 | 0.019 ± 0.002 | 52.6 |
| 12+ | 54 | 1.40 ± 0.08 | 0.71 | 46 | 0.013 ± 0.001 | 76.9 |
| 60+ | 53 | 1.49 ± 0.08 | 0.67 | 47 | 0.010 ± 0.002 | 100.0 |
| Контроль | 36 | 1.55 ± 0.10 | 0.64 | 64 | 0.010 ± 0.001 | 100.0 |
Методом главных компонент установлено, что 79.7% выборочной дисперсии показателя доли быстроминерализуемого органического вещества может быть объяснено действием двух факторов (рис. 3). Первый фактор объясняет 60.7% дисперсии и в наибольшей степени коррелирует с такими параметрами как Cобщ, С/NВОВ в начале и конце инкубации, Смикр и С/Nмикр, то есть со свойствами собственно почвы, почвенного ВОВ и микробной биомассы. Второй фактор объясняет 19.0% дисперсии и коррелирует с показателем SUVA254 в начале инкубации.
Константы минерализации быстроминерализуемого пула для всех почв постпирогенного хроноряда близки и составляют в среднем 1.46 ± 0.08 сут–1, что свидетельствует о том, что среднее время существования этой фракций (MRT) не превышает 0.68 ± 0.02 сут. Среднее время пребывания в почве медленноминерализуемого пула ВОВ составляет от 32 до 111 сут, что свидетельствует о том, что в ходе инкубации ВОВ происходит биокинетический отбор молекул, наиболее устойчивых к микробиологическому воздействию.
Динамика свойств ВОВ при инкубации. Микробиологическая трансформация приводит к уменьшению обогащенности азотом водорастворимого органического вещества почв (рис. 1). Это свидетельствует о том, что микроорганизмы в первую очередь потребляют более богатые азотом соединения, такие как аминосахара, аминокислоты и пептиды, а бедные азотом органические соединения оказываются более устойчивыми к деградации. Необходимо отметить, что растворимые органические соединения азота так же, как углеводы, как правило, приурочены к гидрофильной фракции ВОВ [31, 42], которая в первую очередь подвергается микробиологической трансформации [35, 36]. Избирательная минерализация азотсодержащих соединений, видимо, является ответом микробного сообщества на потребность в источниках азотного питания, поскольку тундровые экосистемы являются одними из самых лимитированных доступностью азота [7, 20]. Поскольку не было зафиксировано накопления минерального (аммонийного и нитратного) азота в процессе инкубации, следует предположить, что минерализованный азот включается в состав микробной биомассы.
При биодеградации ВОВ почв постпирогенного хроноряда происходит увеличение показателя удельной ультрафиолетовой абсорбции, что свидетельствует о повышении доли гидрофобных веществ ароматического строения в его составе. В частности, ранее продемонстрирована тесная корреляция показателя SUVA254 с накоплением в ходе биодеградации ВОВ фенольной фракции [11]. Ароматические соединения обычно считаются биохимически устойчивыми, поэтому содержание этих веществ и подверженность ВОВ к биодеструкции отрицательно коррелируют [39, 41, 49].
ЗАКЛЮЧЕНИЕ
Несмотря на то, что пожар средней интенсивности не оказывает статистически значимого воздействия на содержание ВОВ в почве, полученные данные свидетельствуют о том, что этот фактор влияет на свойства ВОВ, способствуя увеличению доли быстроминерализуемого пула. Постепенное увеличение доли медленноминерализуемого пула ВОВ в процессе постпирогенной сукцессии способствует закреплению углерода в почве. Однако даже через 60 лет после пожара доля быстроминерализуемого пула в составе ВОВ превышает соответствующий показатель фоновой почвы.
Биохимическая устойчивость ВОВ почв горной тундры на большинстве стадий послепожарной сукцессии определяется в первую очередь его собственными свойствами, а не характеристиками разлагающего его микробного сообщества.
При микробиологической трансформации ВОВ происходит значительное изменение его свойств, прежде всего, уменьшение концентрации азотсодержащих компонентов и увеличение доли гидрофобных ароматических соединений, что свидетельствует о первоочередном потреблении микробиотой простых алифатических компонентов ВОВ при относительной устойчивости веществ ароматического ряда. В процессе биодеструкции происходит биокинетический отбор наиболее устойчивых к воздействию микроорганизмов компонентов ВОВ, которые обеспечивают восстановление общего пула углерода при послепожарном развитии почвы.
Список литературы
Безкоровайная И.Н., Тарасов П.А., Иванова Г.А., Богородская А.В., Краснощекова Е.Н. Азотный фонд песчаных подзолов после контролируемых выжиганий сосняков средней Сибири // Почвоведение. 2007. № 6. С. 775–783.
Бузин И.С., Макаров М.И., Малышева Т.И., Кадулин М.С., Королева Н.Е., Маслов М.Н. Трансформация соединений азота в почвах горно-тундровых экосистем Хибин // Почвоведение. 2019. № 5. С. 570–577. https://doi.org/10.1134/S32180X1903002X
Егоров В.И. Азотный режим и биологическая азотфиксация в сообществах мхов (Хибины) // Почвоведение. 2007. № 4. С. 505–509.
Караванова Е.И., Одинцов П.Е., Степанов А.А. Закономерности минерализации органических веществ почвенных растворов подзолистой почвы // Вестник Моск. ун-та. Сер. 17, почвоведение. 2019. № 3. С. 3–9.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Маслов М.Н., Макаров М.И. Органическое вещество почв горной тундры северной Фенноскандии // Вестник Моск. ун-та. Сер. 17, почвоведение. 2013. № 3. С. 3–7.
Маслов М.Н., Макаров М.И. Трансформация соединений азота в тундровых почвах Северной Фенноскандии // Почвоведение. 2016. № 7. С. 813–821. https://doi.org/10.7868/S0032180X16070078
Маслов М.Н., Маслова О.А., Ежелев З.С. Микробиологическая трансформация органического вещества в нефтезагрязненных тундровых почвах после рекультивации // Почвоведение. 2019. № 1. С. 103–110. https://doi.org/10.1134/S0032180X19010106
Маслов М.Н., Маслова О.А., Копеина Е.И. Динамика общего и лабильного пулов органического углерода почв при постпирогенной сукцессии экосистем горной тундры Хибин // Почвоведение. 2020. № 3. С. 1–10. https://doi.org/10.31857/S0032180X20030041
Маслов М.Н., Маслова О.А., Поздняков Л.А., Копеина Е.И. Биологическая активность почв горно-тундровых экосистем при постпирогенном восстановлении // Почвоведение. 2018. № 6. С. 728–737. https://doi.org/10.1134/S1064229318060108
Одинцов П.Е., Караванова Е.И., Степанов А.А. Трансформация водорастворимых органических веществ подстилок подзолов фоновых и техногенных территорий Кольского полуострова // Почвоведение. 2018. № 8. С. 1022–1032. https://doi.org/10.1134/S0032180X18080099
Прокушкин А.С., Токарева И.В. Влияние нагревания на органическое вещество лесных подстилок и почв в условиях эксперимента // Почвоведение. 2007. № 6. С. 698–706.
Старцев В.В., Дымов А.А., Прокушкин А.С. Почвы постпирогенных лиственничников средней Сибири: морфология, физико-химические свойства и особенности почвенного органического вещества // Почвоведение. 2017. № 8. С. 912–925. https://doi.org/10.7868/S0032180X17080111
Шамрикова Е.В., Кубик О.С., Пунегов В.В., Груздев И.В. Влияние разнообразия биоты на состав низкомолекулярных водорастворимых органических соединений почв южной тундры // Почвоведение. 2014. № 3. С. 295–303.
Autio I., Soinne H., Helin J., Asmala E., Hoikkala L. Effect of catchment land use and soil type on the concentration, quality, and bacterial degradation of riverine dissolved organic matter // Ambio. 2016. V. 45. P. 331–349. https://doi.org/10.1007/s13280-015-0724-y
Barcenas-Moreno G., Baath E. Bacterial and fungal growth in soil heated at different temperatures to simulate a range of fire intensities // Soil Biol. Biochem. 2009. V. 41. P. 2517–2526. https://doi.org/10.1016/j.soilbio.2009.09.010
Choromanska U., DeLuca T.H. Microbial activity and nitrogen mineralization in forest mineral soils following heating: evaluation of post-fire effects // Soil Biol. Biochem. 2002. V. 34(2). P. 263–271. https://doi.org/10.1016/s0038-0717(01)00180-8
Clay G.D., Worrall F., Aebischer N.J. Does prescribed burning on peat soils influence DOC concentrations in soil and runoff waters? Results from a 10 year chronosequence // J. Hydrol. 2012. V. 448–449. P. 139–148. https://doi.org/10.1016/j.jhydrol. 2012.04.048.
Clay G.D., Worrall F., Fraser E.D.G. Effects of managed burning upon dissolved organic carbon (DOC) in soil water and runoff water following a managed burn of a UK blanket bog // J. Hydrol. 2009. V. 367. P. 41–51. https://doi.org/10.1016/j.jhydrol. 2008.12.022.
Edwards K.A., McCulloch J., Kershaw G.P., Jefferies R.L. Soil microbial and nutrient dynamics in a wet Arctic sedge meadow in late winter and early spring // Soil Bio-l. Biochem. 2006. V. 38. P. 2843–2851. https://doi.org/10.1016/j.soilbio.2006.04.042
Fellman J.B., D’Amore D.V., Hood E., Boone R.D. Fluorescence characteristics and biodegradability of dissolved organic matter in forest and wetland soils from coastal temperate watersheds in southeast Alaska // Biogeochemistry. 2008. V. 88. P. 169–184. https://doi.org/10.1007/s10533-008-9203-x
Froberg M., Hanson P.J., Trumbore S.E., Swanston C.W., Todd D.E. Flux of carbon from C-14-enriched leaf litter throughout a forest soil mesocosm // Geoderma. 2009. V. 149. P. 181–188. https://doi.org/10.1016/j.geoderma.2008.11.029
Gleixner G., Czimczik C.J., Kramer C., Lukher B., Schmidt M.W.I. Plant compounds and their turnover and stabilization as soil organic matter // Global biogeochemical cycles in the climate system. Academic Press San Diego, 2001. P. 201–215.
Gregorich E.G., Beare M.H., Stoklas U., St-Georges P. Biodegradability of soluble organic matter in maize-cropped soils // Geoderma. 2003. V. 113. P. 237–252. https://doi.org/10.1016/s0016-7061(02)00363-4
Hockaday W.C., Grannas A.M., Kim S., Hatcher P.G. Direct molecular evidence for the degradation and mobility of black carbon in soils from ultrahigh-resolution mass spectral analysis of dissolved organic matter from a fire-impacted forest soil // Org. Geochem. 2006. V. 37. P. 501–510. https://doi.org/10.1016/j.orggeochem.2005.11. 003
Hongve D., van Hees P.A.W., Lundstrom U.S. Dissolved components in precipitation water percolated through forest litter // Eur. J. Soil Sci. 2000. V. 51. P. 667–677. https://doi.org/10.1111/j.1365-2389.2000.00339.x
Huang W., McDowell W.H., Zou X., Ruan H., Wang J., Ma Z. Qualitative differences in headwater stream dissolved organic matter and riparian water-extractable soil organic matter under four different vegetation types along an altitudinal gradient in the Wuyi Mountains of China // Appl. Geochem. 2015. V. 52. P. 67–75. https://doi.org/10.1016/j.apgeochem.2014.11.014
Ilina S.M., Drozdova O.Y., Lapitskiy S.A., Alekhin Y.V., Demin V.V., Zavgorodnyaya Y.A., Shirokova L.S., Jérôme V., Pokrovsky O.S. Size fractionation and optical properties of dissolved organic matter in the continuum soil solution-bog-river and terminal lake of a boreal watershed // Org. Geochem. 2014. V. 66. P. 14–24. https://doi.org/10.1016/j.orggeochem.2013.10.008
IUSS Working Group WRB. World Reference Base for Soil Resources 2014, update 2015 International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106, Rome.
Kaiser K., Kalbitz K. Cycling downwards – dissolved organic matter in soils // Soil Biol. Biochem. 2012. V. 52. P. 29–32. https://doi.org/10.1016/j.soilbio.2012.04.002
Kaiser K., Zech W. Sorption of dissolved organic nitrogen by acid subsoil horizons and individual mineral phases // Eur. J. Soil Sci. 2000. V. 51. P. 403–411. https://doi.org/10.1046/j.1365-2389.2000.00320.x
Kalbitz K., Schmerwitz J., Schwesig D., Matzner E. Biodegradation of soil-derived dissolved organic matter as related to its properties // Geoderma. 2003. V. 113. P. 273–291. https://doi.org/10.1016/s0016-7061(02)00365-8
Kalbitz K., Schwesig D., Schmerwitz J., Kaiser K., Haumaier L., Glaser B., Ellerbrock R., Leinweber P. Changes in properties of soil-derived dissolved organic matter induced by biodegradation // Soil Biol. Biochem. 2003. V. 35. P. 1129–1142. https://doi.org/10.1016/s0038-0717(03)00165-2
Kalbitz K., Solinger S., Park J.H., Michalzik B., Matzner E. Controls on the dynamics of dissolved organic matter in soils: a review // Soil Sci. 2000. V. 165. P. 277–304.
Kiikilla O., Kitunen V., Smolander A. Degradability of dissolved organic carbon and nitrogen in relation to tree species // FEMS Microbiol. Ecol. 2005. V. 53. P. 33–40.
Kiikkila O., Kitunen V., Smolander A. Dissolved soil organic matter from surface organic horizons under birch and conifers: degradation in relation to chemical characteristics // Soil Biol. Biochem. 2006. V. 38. P. 737–746. https://doi.org/10.1016/j.soilbio.2005.06.024
Li J., Tong X., Awasthi M.K., Wu F., Ha S., Ma J., Sun X., He C. Dynamics of soil microbial biomass and enzyme activities along a chronosequence of desertified land revegetation // Ecol. Eng. 2018. V. 111. P. 22–30.
Liu H., Wu Y., Ai Z., Zhang J., Zhang C., Xue S., Liu G. Effects of the interaction between temperature and revegetation on the microbial degradation of soil dissolved organic matter (DOM) – A DOM incubation experiment // Geoderma. 2019. V. 337. P. 812–824. https://doi.org/10.1016/j.geoderma.2018.10.041
Marschner B., Kalbitz K. Controls of bioavailability and biodegradability of dissolved organic matter in soils // Geoderma. 2003. V. 113. P. 211–235. https://doi.org/10.1016/s0016-7061(02)00362-2
Nguyen B.T., Lehmann J., Hockaday W.C., Joseph S., Masiello C.A. Temperature sensitivity of black carbon decomposition and oxidation // Environ. Sci. Technol. 2010. V. 44. P. 3324–3331. https://doi.org/10.1021/es903016y
Olefeldt D., Turetsky M.R., Blodau C. Altered composition and microbial versus UV-mediated degradation of dissolved organic matter in boreal soils following wildfire // Ecosystems. 2013. V. 16. P. 1396–1412. https://doi.org/10.1007/s10021-013-9691-y
Petrone K.C., Richards J.S., Grierson P.F. Bioavailability and composition of dissolved organic carbon and nitrogen in a near coastal catchment of south-western Australia // Biogeochemistry. 2009. V. 92. P. 27–40. https://doi.org/10.1007/s10533-008-9238-z
Piirsoo K., Viik M., Koiv T., Kairo K., Laas A., Noges T., Pall P., Selberg A., Toomsalu L., Vilbaste S. Characteristics of dissolved organic matter in the inflows and in the outflow of Lake Vortsjarv, Estonia // J. Hydrol. 2012. V. 475. P. 306–313.
Preston C.M., Schmidt M.W.I. Black (pyrogenic) carbon: A synthesis of current knowledge and uncertainties with special consideration of boreal regions // Biogeosciences. 2006. V. 3. P. 397–420. https://doi.org/10.5194/bg-3-397-2006
Qualls R.G., Haines B.L. Biodegradability of dissolved organic matter in forest through fall, soil solution, and stream water // Soil Sci. Soc. Am. J. 1992. V. 56. P. 578–586.
Sachse A., Babenzien D., Ginzel G., Gelbrecht J., Steinberg C.E.W. Characterization of dissolved organic carbon (DOC) in a dystrophic lake and an adjacent fen // Biogeochemistry. 2001. V. 54. P. 279–296.
Sanderman J., Baldock J.A., Amundson R. Dissolved organic carbon chemistry and dynamics in contrasting forest and grassland soils // Biogeochemistry. 2008. V. 89. P. 181–198. https://doi.org/10.1007/s10533-008-9211-x
Stark S. Nutrient cycling in the tundra // Nutrient cycling in terrestrial ecosystems. Soil Biology. 2007. V. 10. P. 309–331.
Sun S., Liu J., Li Y., Jiang P., Chang S.X. Similar quality and quantity of dissolved organic carbon under different land use systems in two Canadian and Chinese soils // J. Soils Sediments. 2013. V. 13. P. 34–42. https://doi.org/10.1007/s11368-012-0604-z
Sun S., Liu J., Chang S. Temperature sensitivity of soil carbon and nitrogen mineralization: impacts of nitrogen species and land use type // Plant Soil. 2013. V. 372. P. 597–608. https://doi.org/10.1007/s11104-013-1758-1
Sundqvist M.K., Wardle D.A., Olofsson E., Giesler R., Gundale M.J. Chemical properties of plant litter in response to elevation: subarctic vegetation challenges phenolic allocation theories // Functional Ecology. 2012. V. 26. P. 1090-1099. https://doi.org/10.1111/j.1365-2435.2012.02034.x
van Gaelen N., Verschoren V., Clymans W., Poesen J., Govers G., Vanderborght J., Diels J. Controls on dissolved organic carbon export through surface runoff from loamy agricultural soils // Geoderma. 2014. V. 226–227. P. 387–396. https://doi.org/10.1016/j.geoderma.2014.03.018
Wagai R., Sollins P. Biodegradation and regeneration of water-soluble carbon in a forest soil: leaching column study // Biol. Fertil. Soils. 2002. V. 35. P. 18–26. https://doi.org/10.1007/s00374-001-0434-4
Weishaar J.L., Aiken G.R., Bergamaschi B.A., Fram M.S., Fujii R., Mopper K. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon // Environ. Sci. Technol. 2003. V. 37. P. 4702–4708. https://doi.org/10.1021/es030360x
Worrall F., Armstrong A., Adamson J.K. The effects of burning and sheep-grazing on water table depth and soil water quality in a upland peat // J. Hydrol. 2007. V. 339. P. 1–14. https://doi.org/10.1016/j.jhydrol.2006.12.025
Xiao H., Li Z., Dong Y., Chang X., Deng L., Huang J., Nie X., Liu C., Liu L., Wang D., Liu Q., Zhang Y. Changes in microbial communities and respiration following the revegetation of eroded soil // Agric. Ecosyst. Environ. 2017. V. 246. P. 30–37. https://doi.org/10.1016/j.agee.2017.05.026
Yano Y., McDowell W.H., Aber J.D. Biodegradable dissolved organic carbon in forest soil solution and effects of chronic nitrogen deposition // Soil Biol. Biochem. 2000. V. 32. P. 1743–1751. https://doi.org/10.1016/s0038-0717(00)00092-4
Zsolnay A. Dissolved organic matter: artefacts, definitions and functions // Geoderma. 2003. V. 113. P. 187–209. https://doi.org/10.1016/s0016-7061(02)00361-0
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение


