Почвоведение, 2021, № 3, стр. 372-384
Микробиологические показатели агродерново-подзолистых почв разной гумусированности при внесении тяжелых металлов и углеродсодержащих препаратов
В. А. Терехова a, b, *, Е. В. Прудникова a, С. А. Кулачкова a, М. В. Горленко a, П. В. Учанов b, С. В. Сушко c, d, Н. Д. Ананьева c
a МГУ им. М.В. Ломоносова
119992 Москва, Ленинские горы, 1, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр., 33, Россия
c Институт физико-химических и биологических проблем почвоведения РАН
142290 Пущино, Московская обл., ул. Институтская, 2, Россия
d Агрофизический научно-исследовательский институт
195220 Санкт-Петербург, Гражданский просп., 14, Россия
* E-mail: vterekhova@gmail.com
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 26.07.2020
Аннотация
В условиях модельного вегетационного эксперимента (30 суток) изучен отклик микробного сообщества: углерод микробной биомассы (Смик), базальное дыхание (БД), функциональное разнообразие (ФР), агродерново-подзолистой почвы (Albic Glossic Retisols (Loamic, Aric Cutanic, Ochric)) двух участков (Чашниково, Московская область) с разным содержанием органического углерода (Сорг 3.86 и 1.30%) на загрязнение тяжелыми металлами (ТМ: Cu 660, Zn 1100, Pb 650 мг/кг) и обогащение углеродсодержащими препаратами (биоуголь, 5%; лигногумат, 0.25%). Смик определяли методом субстрат-индуцированного дыхания, ФР – мультисубстратным тестированием (47 субстратов). Внесение ТМ снижало Смик в среднем на 49–57%, БД – 23–52% и ФР – 45%, однако микробный метаболический коэффициент (qCO2 = БД/Смик) повышало в среднем на 9–46%. Наибольшие изменения отмечены на бедной Сорг (1.30%) почве. Углеродсодержащие препараты показали низкую эффективность в обеих почвах с ТМ и не способствовали изменению Смик, БД и qCO2, хотя увеличивали ФР. Сделано заключение об индикаторной значимости изученных микробиологических показателей для оптимизации оценки качества почв, среди которых к наиболее чувствительным отнесены функциональное разнообразие и микробная биомасса Смик, к менее чувствительным – БД и qCO2.
ВВЕДЕНИЕ
Для эффективной системы оценки качества почвы важен набор чувствительных показателей, отражающих ее способность оптимально функционировать [23] и выполнять экосистемные сервисы, направленные на поддержание циклов питательных элементов, деградацию поллютантов и регулирование климата [46]. Микроорганизмы почв обеспечивают разложение органического вещества и высвобождение минеральных элементов питания, способствуя разнообразию и продуктивности растений [50], что позволяет использовать их в качестве индикаторов состояния почвенных ценозов. Так, микробная биомасса почвы и ее дыхательная активность могут в определенной степени служить показателями ее изменения при разных воздействиях [2, 44], а значит – характеризовать ее “здоровье” [23]. Эти показатели включены в программы экологического мониторинга почв и наземных экосистем ряда европейских стран [30, 33]. Перспективным подходом к оценке качества почв представляется анализ их микробных сообществ по спектру потребления органических субстратов, называемый “метаболическим профилированием”. В мировой практике этот анализ осуществляют на основе системы “B-IOLOG” [27]. В России подобная технология реализуется с помощью метода мультисубстратного тестирования (МСТ), получившего название “Эко-Лог” [6].
Оценка качества почв агроэкосистем является предметом большого количества исследований [9, 23], которые основаны на широком спектре индикаторных показателей [23, 49]. Одним из таких регулярно оцениваемых показателей является содержание тяжелых металлов (ТМ) в почве [4, 5]. Показано, что поступление ТМ в почвы агроценозов происходит в результате применения минеральных [38] и органических [29, 55] удобрений, орошения [32, 39] и разных почвоулучшителей [8, 11], что, в свою очередь, может приводить к их накоплению в сельскохозяйственной продукции [31].
В почвах агро- и урбоэкосистем содержание ТМ, в частности свинца (Pb), цинка (Zn) и меди (Cu), подлежит обязательному контролю в нашей стране и за рубежом [3, 23]. Следует отметить, что Pb и Zn относят к I классу опасности (высокоопасные), Cu – ко II (умеренно опасные) (ГОСТ 17.4.1.0283). Одним из способов уменьшения их содержания в почвах является применение углеродсодержащих материалов – биоуглей [28] и гуминовых препаратов [43].
Биоуголь (биочар, от анг. biochar) – продукт пиролиза различных материалов, в том числе растительных, отходов и осадков сточных вод, содержащий большую долю углерода (70–80%) и обладающий высокой сорбционной емкостью. Такие свойства древесного биоугля позволяют активно связывать различные поллютанты в объектах окружающей среды и сохранять влагу в почве [25]. Биоуголь хорошо изучен и с позиций депонирования углерода, восстановления обедненных гумусом почв, а также при нефтяном и других видах загрязнений [19, 22, 35, 40 ]. Показано также, что внесение биоугля в почву приводит к существенному уменьшению содержания обменных форм ТМ [42]. Наибольший эффект от внесения биоугля отмечали на бедных гумусом и кислых почвах [45]. В зерне риса, выращенном на слабокислой глинистой почве с внесением биоугля, выявили уменьшение содержания Cd и Pb [21]. Следует отметить, что адсорбционная способность биоугля в почве зависит от источника его получения (сырья) и вида ТМ. Показано, что мульчирование почвы биоуглем увеличивало подвижность As и Cu, но значимо снижало подвижность Cd и Zn [18].
Для улучшения почв агроэкосистем широко применяют и продукты так называемой “зеленой химии”, среди которых наиболее распространены гуминовые препараты, производимые из углей, торфов, сапропелей и органических отходов [43]. Биологическая активность гуминовых препаратов в значительной степени зависит от природы исходного сырья [52]. Эффективным гуминовым препаратом считают лигногумат (производят из лигносульфоната – отхода деревоперерабатывающей промышленности), который содержит высоко- и низкомолекулярные гуминовые соединения (70–80%), а также микроэлементы.
Имеются сведения и о положительном ремедиационном эффекте после совместного внесения в загрязненные почвы биоугля и гуминовых препаратов [15, 56]. Показано, что подвижность катионов Zn, Cd и Pb в аллювиальных почвах после внесения смеси лигногумата и биоугля уменьшалась значительнее по сравнению с их внесением по отдельности [15].
Изучено изменение показателей функционирования микробных сообществ агродерново-подзолистых почв разной степени гумусированности под влиянием загрязнения ТМ и обработки углеродсодержащими препаратами (биоуголь, лигногумат) в условиях модельного вегетационного эксперимента для оценки их биоиндикационной значимости и в целях обеспечения продуктивности растений. Задача эксперимента заключалась в анализе откликов микробных сообществ на основе их функциональных и структурных показателей (микробной биомассы, базального дыхания, метаболического коэффициента и функционального разнообразия) для оценки нарушенности почв под влиянием загрязнения ТМ и препаратов, обеспечивающих его уменьшение.
МАТЕРИАЛЫ И МЕТОДЫ
Исследовали пахотные (агро) горизонты агродерново-подзолистых почв тяжелосуглинистого гранулометрического состава (Albic Glossic Retisols (Loamic, Aric Cutanic, Ochric)) (Солнечногорский район, Московская область, территория Учебно-опытного почвенно-экологического центра МГУ имени М.В. Ломоносова “Чашниково”) двух участков, локализованных на расстоянии 1.1 км друг от друга (56°02′01.9° N/37°10′04.9° E и 56°01′41.7° N/37°11′04.3° E). Почва первого участка (1) характеризовалась высоким (Сорг 3.86%, сильногумусированная), второго (2) – низким (Сорг 1.30%, слабогумусированная) содержанием органического углерода. Образцы почв отбирали из верхнего (0–20 см) слоя пробных площадок (40 м2) методом “конверта” в начале мая 2019 г., усредняли смешиванием и доставляли в лабораторию (масса около 25 кг) для использования в вегетационном эксперименте (исходная влажность образца 35–40%).
В образцы почв вносили смесь водных растворов соли (10 мл/кг) меди (CuSO4), цинка (ZnSO4) и свинца (PbСl2) для достижения концентрации Cu, Zn и Pb, равной 660, 1100 и 650 мг/кг почвы соответственно. Эти концентрации отвечали трем ориентировочно-допустимым концентрациям (ОДК) для каждого из этих элементов [5]. Помимо металлов в отдельные варианты опыта добавляли по отдельности и вместе углеродсодержащие препараты (биоуголь, лигногумат).
Биоуголь (продукт пиролиза древесины березы, фракции 2–8 мм, производитель ООО “Метаком”, Россия) добавляли в количестве 5% от массы почвенного образца. Биоуголь содержал С (88.2%), N, Н и S (0.44, 0.82 и 0.19%, соответственно), золу (2.8%), воду (3%); ${\text{p}}{{{\text{H}}}_{{{\text{CaC}}{{{\text{l}}}_{{\text{2}}}}}}}$ 8.9, отношение С/N = 21.4. Содержание катионов Cu, Zn и Pb в биоугле составляло не более 0.02% его массы. Лигногумат калия получен искусственной гумификацией лигносульфоната (производитель НПО “РЭТ”, Россия), его зольность составляла 40%, содержание С, N, Н, S и К – 37.3, 0.5, 3.72, 4.84 и 9.0% соответственно; C/N = 134.7, ${\text{p}}{{{\text{H}}}_{{{\text{CaC}}{{{\text{l}}}_{{\text{2}}}}}}}$ 9 (1% раствор), содержание гуминовых кислот – 58% органического вещества. Лигногумат хорошо растворим в воде, его водный раствор вносили в почву (0.25% ее массы).
Образцы почвы каждого участка были разделены на две равные части, в одну из которой вносили смесь водных растворов солей ТМ и тщательно перемешивали. Вторую часть почвы увлажняли водой (10 мл/кг), объем которой был равен таковому с солями ТМ. Влажность этих частей почвы составляла около 60% общей влагоемкости. Полученные таким образом образцы почвы оставляли на 7 сут при комнатной температуре для равномерного распределения воды и раствора солей ТМ. Затем почву 1 и 2, в которую были внесены вода или соли металлов, делили на 4 части (варианты), одна из которых служила контролем для углеродсодержащих добавок (биоуголь, лигногумат – отдельно и вместе) и ТМ. Подготовленные таким образом почвы (для каждой почвы восьми вариантов) инкубировали еще 7 сут при комнатной температуре. Затем почву каждого варианта (массой 2.5 кг) помещали в 3 вегетационных сосуда объемом 3 л (повторности). Варианты эксперимента для почв участков 1 и 2 следующие: контроль, биоуголь (Б), лигногумат (Л), биоуголь + лигногумат (БЛ), ТМ-контроль, ТМ + биоуголь (ТМБ), ТМ + лигногумат (ТМЛ), ТМ + биоуголь + лигногумат (ТМБЛ).
Для определения химических показателей почвы отбирали образцы каждого варианта, а затем сосуды с почвой засевали семенами горчицы белой Sinapis alba L. (10 семян на сосуд) и помещали в открытую теплицу (среднесуточная температура воздуха 16.8°C) на 30 сут. Влажность почвы на протяжении эксперимента регистрировали взвешиванием сосудов для последующего добавления воды. По окончании инкубации растения горчицы извлекали из сосудов для определения их биомассы, а образцы почвы – для изучения микробиологических показателей.
В образцах почвы определяли содержание органического углерода (Сорг) (ISO 14235:1998); общего (CNHS анализатор Elementar EL III), аммонийного (ГОСТ 26489-85, фотометр Hach DR 2800) и нитратного (ПНД Ф 16.1.8-98, хроматограф Dionex ICS 2000) азота (Nобщ, ${\text{NH}}_{4}^{ + },$ ${\text{NO}}_{3}^{ - }$); подвижных соединений фосфора (Р) и калия (K) (метод Кирсанова, спектрометр Aglient 5110 ICP-OES) и валовых форм Cu, Zn и Pb (ФР.1.29.2006.02149, спектрометр Aglient 5110 ICP-OES). Значение рН водной вытяжки (почва : вода = 1 : 4) определяли потенциометрическим методом (рН метр Hanna HI2211-02).
Содержание углерода микробной биомассы (Смик) определяли методом субстрат-индуцированного дыхания (СИД), как описано в работе [1]. Метод основан на дыхательном отклике почвенных микроорганизмов на внесение в почву легкодоступного субстрата (глюкозы), который пропорционален содержанию микробной биомассы [16]. Навеску почвы (3 г) помещали в стеклянный флакон (объем 15 мл), добавляли по каплям раствор глюкозы (0.2 мл/г) для получения ее результирующей концентрации 10 мг/г, закрывали герметично и инкубировали не менее 3 ч при 22°С. Затем из воздушной фазы флакона отбирали шприцом пробу воздуха (0.5 мл) и вводили ее в газовый хроматограф “КристалЛюкс 4000М” для измерения концентрации СО2. Время инкубации почвы с глюкозой строго фиксировали. Скорость СИД (мкл CO2/(г ч)) рассчитывали с учетом концентрации CO2, объема газовой фазы флакона, навески почвенного образца и времени его инкубации. Содержание Смик (мкг C/г почвы) определяли по формуле: СИД × 40.04 + 0.37 [16].
Базальное дыхание почвы (БД) измеряли аналогично определению СИД, только вместо раствора глюкозы в почву вносили дистиллированную воду и инкубировали 24 ч при 22°C, результат выражали в мкг С-СО2/(г ч).
Рассчитывали отношение БД/Смик, которое иллюстрирует удельное дыхание микробной биомассы (qСО2) и характеризует экологический статус микробного сообщества почвы [2].
Растения горчицы белой извлекали с корнями из вегетационных сосудов каждого варианта эксперимента и высушивали до постоянного веса (105°С, 2 ч). Полученную таким образом сухую биомассу растений выражали в г/сосуд.
Функциональное разнообразие микробного сообщества оценивали методом МСТ (ФР.1.37.2010.08619; патент РФ № 23355432335543). Образец почвы (0.7 г) помещали в центрифужный стакан (объем 50 мл), добавляли 35 мл дистиллированной воды и помещали в шейкер Vortex (2 мин) для отделения клеток микроорганизмов от почвенных частиц. Затем суспензию центрифугировали (10 мин, 3000 об./мин) и отделяли супернатант, в который добавляли индикатор – трифенилтетразолий (2 мл на 20 мл супернатанта). Аликвоту супернатанта с индикатором (200 мкл) помещали в 96 лунок (ячеек) планшета “Эко-Лог”, в которые предварительно были внесены 47 тест-субстратов (сахара, аминокислоты, полимеры, нуклеозиды, соли органических кислот, спирты) и минеральная основа – контроль (две повторности для каждого субстрата и контроля). Планшеты инкубировали 72 ч при 28°С до появления в ячейках визуально регистрируемой красной окраски (восстановление трифенилтетразолия до формазана). Затем оптическую плотность каждой ячейки измеряли в диапазоне 510 нм программно-аппаратным комплексом “Эко-Лог”. Концентрация формазана и обусловленная им оптическая плотность ячейки определялись интенсивностью развития группы микроорганизмов, способной потреблять тот или иной субстрат [6]. На основе оптической плотности рассчитывали следующие показатели функционального разнообразия микробного сообщества [6, 7]: разнообразие (N), отражающее количество потребленных субстратов (от 0 до 47); удельную метаболическую работу (W) – сумму оптической плотности всех потребленных субстратов, деленную на их число (от 0 до 4000 ед., мера интенсивности потребления субстратов); коэффициент рангового распределения спектров потребления субстратов (d) в интервале от 0.01 до ≥2.00. Меньшее значение этого коэффициента характеризует “благополучие и стабильность” микробного сообщества почвы, а значит – оптимальные условия его функционирования, большее – “неблагополучие” и стресс [6, 7].
Статистическую обработку результатов – измерение биомассы растений, микробиологических (Смик, БД) и химических показателей почвы – проводили в трех повторностях. Расчет Смик, БД и химических показателей выполнен на вес сухой почвы (105°C, 2 ч). Субстратное тестирование – для смешанного образца (3 сосуда) каждого варианта исследуемых почв. Сравнение величин Смик, БД, qCO2 и биомассы горчицы между экспериментальными вариантами (биоуголь, лигногумат, ТМ) выполняли однофакторным дисперсионным анализом с последующим попарным множественным сравнением средних (тест Тьюки). Анализ главных компонент (ГК) выполнен на основе матрицы корреляций показателей Смик, БД, qCO2 и биомассы горчицы для экспериментальных вариантов почв двух участков. Предварительная подготовка данных для анализа ГК включала их масштабирование согласно формуле (xi – среднее)/стандартное отклонение. Взаимосвязь между Смик и биомассой горчицы оценивали корреляционным анализом (коэффициент корреляции Пирсона). Статистический анализ данных и их визуализация выполнены в программной среде R c помощью пакетов “FactoMineR”, “factoextra” (анализ ГК), “car” (однофакторный дисперсионный анализ) и “agricolae” (тест Тьюки).
Кластерный анализ образцов по спектру потребления субстратов проводили с использованием квадрата евклидова дистанционного сходства и процедур связи Варда, расчет показателей функционального разнообразия – с помощью программного обеспечения “Eco-log” [6] в программе Statistica 7.0.
РЕЗУЛЬТАТЫ
Химические показатели почвы. Содержание Сорг в пахотном горизонте сильногумусированной почвы участка 1 почти в 3 раза превышало таковое участка 2 (табл. 1). Содержание других биогенных элементов в почве 1 было также больше, чем в почве 2 (Nобщ, N-${\text{NH}}_{4}^{ + },$ K – в 2–3 раза; Р – в 7.6). По содержанию N-${\text{NO}}_{3}^{ - },$ отношению С : N и значению рН исследуемые почвы различались незначительно. Содержание Cu, Pb и Zn в почве 1 было в 2.3–2.8 раза больше, чем в почве 2, однако оно существенно меньше их ОДК, что дает основание считать исследуемые почвы незагрязненными этими ТМ.
Таблица 1.
Исходные химические показатели агродерново-подзолистых почв разных участков (слой 0–20 см, Московская область)
| № участка | Cорг | Nобщ | С : N | рН | ${\text{NH}}_{4}^{ + }$ | ${\text{NO}}_{3}^{ - }$ | Р2О5 | К2О | Cu | Pb | Zn |
|---|---|---|---|---|---|---|---|---|---|---|---|
| % | мг/кг | ||||||||||
| 1 | 3.86 | 0.33 | 12 | 6.74 | 21.9 | 60.7 | 1685.3 | 701.5 | 22.0 | 23.7 | 89.1 |
| 2 | 1.30 | 0.14 | 9.6 | 6.28 | 8.6 | 65.8 | 220.4 | 193.6 | 9.3 | 10.1 | 32.0 |
Внесение биоугля в исследуемые почвы увеличило содержание Сорг примерно на 4%, лигногумата – почти не оказало влияния на этот показатель. Значение рН почв с внесением биоугля и лигногумата практически не менялось по сравнению с контрольными вариантами.
Микробиологические показатели почвы. Содержание Смик в исходной богатой Сорг почве 1 было в среднем почти в 2 раза больше такового в бедной (326 и 173 мкг С/г) (рис. 1, А). Внесение ТМ в исследуемые почвы значимо уменьшало (почти в 2 раза) содержание Смик. Углеродсодержащие добавки в почвах 1 и 2 (без ТМ) не вызывали изменение величин Смик, за исключением стимулирующего действия лигногумата в почве 2. Внесение углеродсодержащих препаратов в почвы с ТМ не привело к значимому изменению Смик этих вариантов.
Рис. 1.
Углерод микробной биомассы (Смик, А) и скорость базального дыхания (БД, Б) в агродерново-подзолистых почвах (0–20 см) с разным содержанием органического углерода (Сорг) и способов обработки. Обозначения здесь и далее на рисунках: контроль (К), биоуголь (Б), лигногумат (Л), Б + Л (БЛ), тяжелые металлы (ТМ), ТМ + Б (ТМБ), ТМ + Л (ТМЛ), ТМ + Б + Л (ТМБЛ). Среднее ± стандартная ошибка среднего (n = 3); величины с разными буквами различаются значимо (p ≤ 0.05) для каждого показателя и значения Сорг отдельно (p ≤ 0.05, критерий Тьюки).
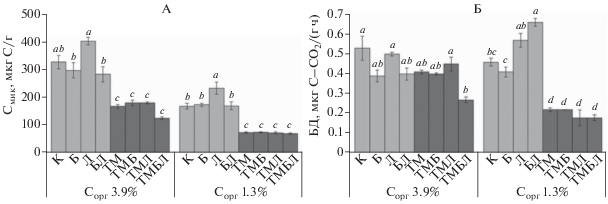
Скорость БД в исходных почвах 1 и 2 составила в среднем 0.53 и 0.46 мкг С-СО2/(г ч) соответственно (рис. 1, Б). ТМ в почве 1 не оказали значимого влияния на скорость БД, а в почве 2 – уменьшали ее в 2.1 раза. Внесение биоугля и лигногумата (отдельно и в смеси) в загрязненные ТМ почвы не вызвало значимых различий скорости БД по сравнению с вариантами только с ТМ. В незагрязненных ТМ почвах биоуголь и лигногумат также не влияли значимо на этот показатель, за исключением варианта их совместного внесения в почву 2 (увеличение БД почти на 40%).
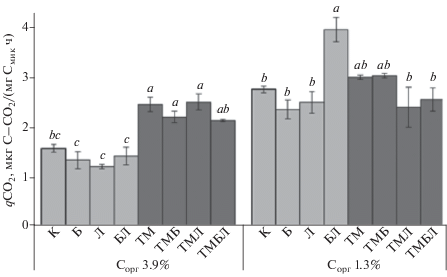
В контрольных вариантах почвы 1 показатель qCO2 был почти в 1.7 раза меньше такового почвы 2, что свидетельствует о “худшем” функционировании микробного сообщества последней (рис. 2). Внесение ТМ, в том числе и с углеродсодержащими добавками, вызвало в основном значимое увеличение qCO2 в почве 1 и не значимое – в почве 2. Биоуголь и лигногумат не вызывали значимых изменений этого показателя в исходных почвах, однако смесь этих добавок в почве 2 способствовала значимому увеличению qCO2 по сравнению с контрольным вариантом (в среднем на 43%), а в почве 1 – нет.
Рис. 2.
Удельное дыхание микробной биомассы (qCO2) агродерново-подзолистой почвы (0–20 см) с разным содержанием органического углерода (Сорг) и способов обработки.
Взаимосвязь микробных показателей (Смик, БД, qCO2) и биомассы растений в образцах почв с тяжелыми металлами и углеродсодержащими добавками. Добавка смеси ТМ (ZnPbCu) подавляла развитие растений: в сильногумусированной почве 1 с 1.38 ± 0.05 (контроль) до 0.40 ± 0.13 г сухой биомассы с. в./сосуд, а в слабогумусированной почве 2 с 0.68 ± 0.09 (контроль) – до полной гибели проростков растений. В незагрязненных образцах (без ТМ) внесение биоугля уменьшало биомассу растений в почве 1 до 0.77 ± 0.05, лигногумата – до 0.70 ± 0.11, в почве 2 биоуголь уменьшал количество фитомассы до 0.46 ± 0.11, а лигногумат повышал ее на 22% – до 0.83 ± 0.14, однако это изменение оказалось незначимым. Добавки углеродсодержащих препаратов не повлияли на токсичность слабогумусированной почвы с ТМ и незначительно изменили показатели сухой биомассы в загрязненной ТМ почве 1: биоуголь несколько увеличил их до 0.47 ± 0.05, лигногумат – уменьшил до 0.28 ± 0.06, а при совместно внесенных биомасса была близка к контролю – 0.41 ± 0.13.
Анализ, проведенный методом главных компонент (ГК), позволил обобщить и выявить закономерности в изменении изученных свойств почвенной микробиоты и ее способности обеспечивать развитие растений при внесении ТМ и углеродсодержащих препаратов. Показано, что первые две ГК являются наиболее значимыми (собственные значения >1) и объясняют суммарно 95% общей изменчивости экспериментальных данных (рис. 3).
Рис. 3.
Проекция показателей (Смик, углерод микробной биомассы; БД, базальное дыхание; qCO2, удельное дыхание микробной биомассы; биомасса растений горчицы) агродерново-подзолистых почв разной гумусированности на первую и вторую главные компоненты (ГК).
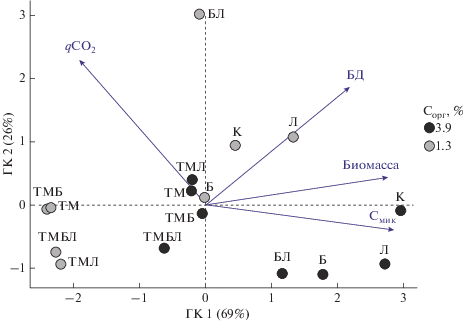
ГК 1 отражает преимущественно градиент изменения Смик и растительной биомассы в почвах с разными вариантами обработки (R2 = 0.69 и 0.67), а ГК 2 – qCO2 (R2 = 0.55). Вдоль ГК 1 показана четкая дифференциация почв с ТМ (слева) и без их внесения (справа). Распределение почв вдоль ГК 2 связано преимущественно с внесением биоугля и лигногумата. Анализ выявил также, что биомасса горчицы наиболее тесно коррелировала с содержанием Смик почвы (коэффициент корреляции Пирсона r = 0.81, p < 0.001).
Функциональное разнообразие микробного сообщества. Количественные показатели функционального разнообразия микробных сообществ почв с разным содержанием Сорг представлены на рис. 4. Число потребляемых субстратов микробным сообществом (N) почвы 1 оказалось больше, чем почвы 2, оно составило 37 и 11 соответственно. ТМ вызвали заметное уменьшение функционального разнообразия в почве 2 (всего 6 потребленных субстратов), а в почве 1 оно почти не менялось. Добавка углеродсодержащих препаратов в загрязненную ТМ почву 2 заметно увеличила ее микробное функциональное разнообразие, причем лигногумат его практически восстановил до исходного уровня (с 6 до 11), а в сочетании с биоуглем – повысил еще больше (с 6 до 16). В почве 1 с ТМ биоуголь способствовал лишь незначительному изменению показателя N (с 37 до 40), лигногумат – не оказал видимого эффекта, а совместное применение этих добавок – даже уменьшило показатель N до 32. В почве 2 (без ТМ) внесение органических добавок способствовало увеличению микробного разнообразия (N = 28 и 32 для биоугля и лигногумата). В почве 1 (без ТМ) эффект от внесения лигногумата и биоугля был сглажен (N = = 40), а при совместном – разнообразие почти не менялось по сравнению с контролем.
Рис. 4.
Показатели функционального разнообразия микробных сообществ агродерново-подзолистых почв (слой 0–20 см) с высоким (1) и низким (2) содержанием Сорг и разными способами обработки. Обозначения здесь и на рис. 5: N – количество потребленных субстратов, ед.; W – удельная метаболическая работа, отн. ед.; d – коэффициент рангового распределения спектра потребления субстратов.
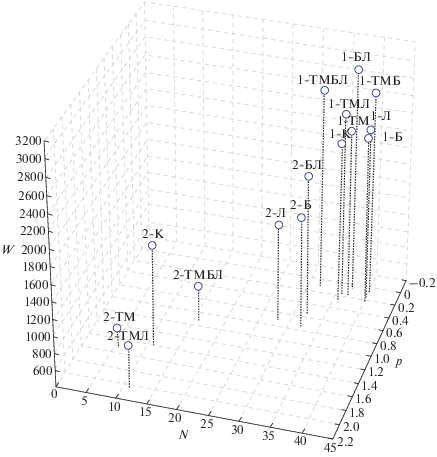
Метаболическая работа микробного сообщества (W) в почве 2 составила 1500 единиц, а в почве 1 – более 2200. ТМ вызывали уменьшение показателя W в бедной Сорг почве 2 почти в 2 раза, а в богатой – лишь слабо стимулировали (~ на 100). Внесение ТМ и органических добавок в почву 2 не способствовали увеличению W, однако в почве 1 – слабо повышали этот показатель (на 200–300 ед.). В незагрязненных ТМ вариантах обеих почв внесение биоугля и лигногумата приводило к увеличению показателя W. В почве 1 биоуголь и лигногумат способствовали увеличению W всего на 100 ед., а при их комбинации – уже на 700 (до наибольшего значения, ~3000). В почве 2 биоуголь увеличивал показатель W на 200 ед., а лигногумат– не влиял, однако их совместное внесение способствовало существенному его повышению (~ на 500 ед.).
Функционирование микробного сообщества в сильногумусированной почве 1 можно характеризовать как более стабильное (d = 0.29) по сравнению со слабогумусированной почвой 2 (d = 1.38). Загрязнение ТМ слабогумусированной почвы 2 вызвало заметное увеличение этого коэффициента – до 2.03, что свидетельствует о возрастании “нестабильности” функционирования ее микробного сообщества, однако в сильногумусированной почве 1 этот коэффициент менялся незначительно (d = 0.20). В почве 2, загрязненной ТМ, внесение биоугля способствовало большему снижению коэффициента d (с 2.03 до 0.96), а лигногумата – меньшему (с 2.03 до 1.54). В почве 1 с ТМ и углеродсодержащими препаратами также отмечали уменьшение этого коэффициента (биоуголь – с 0.20 до 0.05, лигногумат – до 0.19, совместно – до 0.13).
В целом внесение биоугля и лигногумата способствовало уменьшению коэффициента во всех вариантах исследуемых почв, что может свидетельствовать об увеличении стабильности (устойчивости) микробных систем исследованных почв к внешним воздействиям.
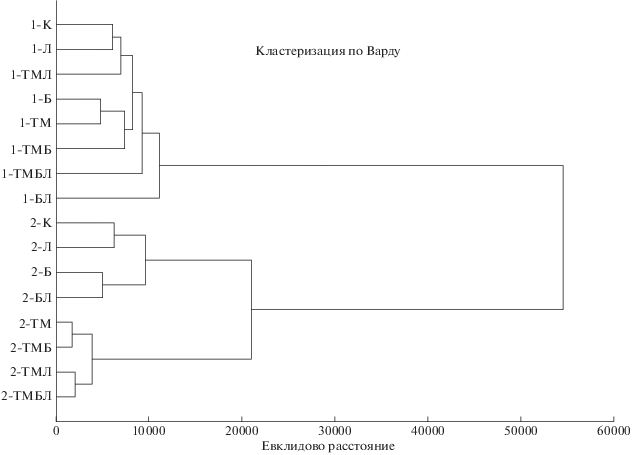
Кластерный анализ результатов метода МСТ позволил дифференцировать микробное сообщество исследованных почв по спектрам потребляемых субстратов (рис. 5). Выделено 2 крупных кластера, соотносящихся с содержанием Сорг. Влияние загрязнения ТМ наиболее выражено в слабогумусированной почве 2, варианты которой четко выделяются в отдельный подкластер.
ОБСУЖДЕНИЕ
Комплексное загрязнение тяжелыми металлами (Cu 660, Zn 1100 и Pb 650 мг/кг) агродерново-подзолистой почвы, различающейся по содержанию Сорг, привело к изменению ее микробиологических показателей, выраженному в уменьшении микробной биомассы и скорости базального дыхания, в увеличении микробного метаболического коэффициента (qCO2). Полученные результаты экспериментов согласуются с таковыми при внесении в солонцеватую почву в модельном опыте низких и высоких доз Cd и Pb [51].
Показатели почвенного дыхания, в том числе и эмиссия CО2 почвы, используются в ряде стран в качестве индикаторов ее экологического состояния [30, 33, 37]. Отмечают, что загрязнение почв ТМ и металлоидами вызывает замедление деструкционных процессов, уменьшение интенсивности выделения СО2 и активности ферментов (полифенолоксиды, дегидрогеназы и липазы) [54]. Однако низкие концентрации некоторых ТМ могут стимулировать развитие микроорганизмов, выступая, в частности, как коферменты.
Индикаторная ценность функциональных микробиологических показателей зависит, очевидно, от почвенных условий, среди которых большое значение имеет содержание гумуса. Показано, что изменение микробных показателей почв разной гумусированности различается. В слабогумусированной почве полиметаллическое загрязнение вызвало угнетение микробной биомассы более чем в 2 раза, а в сильногумусированной – менее чем на треть. Однако заметное снижение БД отмечено только для слабогумусированной почвы с ТМ, а возрастание qCO2, напротив, – в сильногумусированной.
Показано, что под действием ТМ в почвах происходит наиболее существенное изменение в содержании микробной биомассы, причем независимо от внесения органических добавок (рис. 3). Имеются сведения, что внесение биоугля (0.5, 1 и 3%) в почву (верхний (0–20 см) слой, модельный эксперимент) не приводит к значимым изменениям БД, биомассы микроорганизмов и qCO2 [47], что, в свою очередь, вызывает избыточную почвенную эмиссию СО2 [35, 41]. В нашем эксперименте содержание микробной биомассы исследуемых почв значимо коррелирует с развитием растений (рис. 3), что повышает биодиагностическую ценность этого микробного показателя, в том числе для характеристики их плодородия [50].
Биоуголь и лигногумат влияли на функционирование микробного сообщества исследуемых почв неодинаково. Так, лигногумат оказывал в основном более выраженное стимулирующее действие на микробные показатели по сравнению с биоуглем. Различие эффекта биоугля и лигногумата можно объяснить разными механизмами их действия на почву. Влияние лигногумата обусловлено его способностью стимулировать развитие почвенных микробных сообществ за счет поступления питательных элементов – азота, калия [20] и тем самым способствовать увеличению численности почвенных микроорганизмов, активности ферментов [14], эмиссии СО2, процессов азотфиксации и денитрификации [12]. Способность биоугля улучшать плодородие почвы агроценозов связывают с увеличением скорости катионного обмена из-за высокого рН и уменьшением поглощения ТМ сельскохозяйственными культурами. Кроме того, внесение биоугля в почву приводит к существенному уменьшению содержания обменных форм ТМ [42], и это происходит за довольно короткий период. Так, содержание растворимой формы Cd в почве после внесения биоугля уже на 12-е сутки сократилось почти на 80%, а Zn и Cd в почвенном растворе – почти на 90% [26].
Положительный эффект биоугля на скорость БД отмечен только в сочетании с лигногуматом (рис. 1). Их синергетическое действие показано для дерново-подзолистой почвы, которое проявлялось стимулированием БД, уменьшением коэффициента qCO2, подвижности катионов Cu и токсичности для растений Sinapis alba и тест-культуры Daphnia magna [15].
Функциональное разнообразие микробных сообществ, оцененное на основании спектров потребления субстратов, показало высокую индикаторную значимость метода МСТ при оценке почв, в том числе и загрязненных ТМ [7, 53]. В ходе кластерного анализа спектров потребления органических субстратов микробными сообществами исследованных почв выделены 2 большие группы, включающие образцы со сходным содержанием гумуса (рис. 5). При этом эффект полиметаллического загрязнения более четко прослеживается для слабогумусированной почвы, в которой варианты с ТМ и без них выделены, в свою очередь, в отдельные группы. Именно в слабогумусированной почве действие металлов оказалось губительным для тест-растений горчицы (гибель на стадии прорастания семян). Таким образом, слабогумусированная почва с истощенными питательными ресурсами оказалась более чувствительной к действию токсикантов (наблюдалось уменьшение функционального разнообразия и устойчивости микробного сообщества).
В сильногумусированной почве с исходно высокими показателями микробного сообщества и его функционального разнообразия токсический эффект ТМ выражен слабее, чем в слабогумусированной. При этом внесение биоугля, в том числе и в комбинации с лигногуматом, “оптимизировало” показатели микробного сообщества.
Со времени публикации первых схем и инструментов оценки и мониторинга качества почвы в 1990-х годах появилось более 60-ти национальных и региональных подходов, разработанных преимущественно в Северной Америке, Европе и Китае [23]. Основное внимание в этих подходах уделено характеристике плодородия почв, которую рассматривают как их способность обеспечивать питательными элементами и водой растения (www.fao.org). В связи с этим некоторые авторы [36] считают необходимым дополнить характеристику качества почв, оптимального для роста сельскохозяйственных культур, показателями биоразнообразия и функциональной активности почвенной микробиоты.
Почвенные организмы играют ключевую роль в функционировании почвы, поэтому биологические и биохимические показатели важны для современных подходов ее оценки [9, 17]. Более того, некоторые авторы подчеркивают, что оценка биологических показателей качества почвы необходима для понимания взаимосвязи ее абиотических свойств, экологических функций и продуктивности надземной растительности [34]. Тем не менее, биологические показатели все еще недостаточно представлены в системах оценки качества почвы. Они пока ограничиваются такими показателями “черного ящика” как микробная биомасса и почвенное дыхание [23].
Полученные данные в целом согласуются с положениями о том, что микробиологические показатели (например, микробная биомасса) могут служить индикаторами экологического состояния почв [24]. При этом очевидна необходимость дифференцирования степени надежности и информативности разных показателей функционирования микробиоты для мониторинга и оценки почв. Обобщая полученные результаты, можно заключить, что такие микробные характеристики почв, как базальное дыхание и метаболический коэффициент, имеют меньшую индикационную ценность по сравнению с показателями микробной биомассы и функционального разнообразия микробного сообщества. Этот факт можно объяснить тем, что при нарушении или стрессе почвенное микробное дыхание одних видов микроорганизмов может быть подавлено, а других – даже стимулировано.
Итак, результаты исследования показали, что структурные и функциональные микробные маркеры, выявленные методом МСТ, и содержание углерода микробной биомассы предоставляют более значимую информацию об изменении микробного сообщества почвы, в том числе и в условиях их загрязнения ТМ, по сравнению с дыхательной микробной активностью и показателем его экофизиологического состояния.
Список литературы
Ананьева Н.Д., Сусьян Е.А., Рыжова И.М., Бочарникова Е.О., Стольникова Е.В. Углерод микробной биомассы и микробное продуцирование двуокиси углерода дерново-подзолистыми почвами постагрогенных биогеоценозов и коренных ельников южной тайги (Костромская область) // Почвоведение. 2009. № 9. С. 1108–1116.
Благодатская Е.В., Ананьева Н.Д. Оценка устойчивости микробных сообществ в процессе разложения поллютантов в почве // Почвоведение. 1996. № 11. С. 1341–1346.
Водяницкий Ю.Н. Формулы оценки суммарного загрязнения почв тяжелыми металлами и металлоидами // Почвоведение. 2010. № 10. С. 1276–1280.
ГН 2.1.7.2041-06 Предельно допустимые концентрации (ПДК) химических веществ в почве.
ГН 2.1.7.2511-09 Ориентировочно допустимые концентрации (ОДК) химических веществ в почве.
Горленко М.В., Кожевин П.А. Мультисубстратное тестирование природных микробных сообществ. М.: МАКС Пресс, 2005. 88 с.
Горленко М.В., Якименко О.С., Голиченков М.В., Костина Н.В. Функциональное биоразнообразие почвенных микробных сообществ при внесении органических субстратов различной природы // Вестник Моск. ун-та. Сер. 17, почвоведение. 2012. № 2. С. 20–27.
Каниськин М.А., Изосимов А.А., Терехова В.А., Якименко О.С., Пукальчик М.А. Влияние гуминовых препаратов на биоактивность почвогрунта с фосфогипсом // Теоретическая и прикладная экология. 2011. № 1. С. 87–95.
Кирюшин В.И. Методология комплексной оценки сельскохозяйственных земель // Почвоведение. 2020. № 7. С. 871–879. https://doi.org/10.31857/S0032180X20070060
О санитарно-эпидемиологическом благополучии населения № 52-ФЗ от 30.03.1999 г.
Плеханова И.О. Влияние условий увлажнения на фракционный состав соединений тяжелых металлов в агродерново-подзолистых почвах, загрязненных осадком сточных вод // Почвоведение. 2012. № 7. С. 735.
Поздняков Л.А., Степанов А.Л., Гасанов М.Э., Семенов М.В., Якименко О.С., Суада А.К., Рай А.Н., Щеголькова Н.М. Влияние лигногумата на биологическую активность почвы о. Бали, Индонезия // Почвоведение. 2020. № 5. С. 601–609.
Положение о государственном санитарно-эпидемиологическом нормировании от 24.07.2000 г. № 554.
Пукальчик М.А., Панова М.И., Терехова В.А., Якименко О.С., Федосеева Е.В. Действие гуминовых препаратов на активность почвенных ферментов в модельном опыте // Агрохимия. 2017. № 8. С. 94–101. https://doi.org/10.7868/S0002188117080105
Пукальчик М.А., Терехова В.А., Якименко О.С., Акулова М.И. Сравнение ремедиационных эффектов биочара и лигногумата на почвы при полиметаллическом загрязнении // Теоретическая и прикладная экология. 2016. № 2. С. 79–85.
Anderson J.P.E., Domsch K.H. Physiological method for quantitative measurement of microbial biomass in soils // Soil Biology&Biochemistry. 1978. V. 10. № 3. P. 215–221. https://doi.org/10.1016/0038-0717(78)90099-8
Barrios E., Coutinho H.I.C., Medeiros C.A. InPaC-S: Participatory Knowledge Integration on Indicators of Soil Quality – Methodological Guide. World Agroforestry Centre (ICRAF). Embrapa, CIAT, Nairobi, 2012. 178 p. http://apps.worldagroforestry.org/downloads/ Publications/PDFS/B17459.pdf
Beesley L., Moreno-Jiménez E., Gomez-Eyles J.L. Effects of biochar and greenwaste compost amendments on mobility, bioavailability and toxicity of inorganic and organic contaminants in a multi-element polluted soil // Environ. Pollut. 2010. № 158. P. 2282–2287. https://doi.org/10.1016/j.envpol.2010.02.003
Beesley L., Moreno-Jiménez E., Gomez-Eyles J.L., Harris E., Robinson B., Sizmur T. A review of biochars’ potential role in the remediation, revegetation and restoration of contaminated soils // Environmental Pollution. 2011. V. 159(12). P. 3269–3282. https://doi.org/10.1016/j.envpol.2011.07.023
Bezuglova O.S., Gorovtsov A.V., Polienko E.A. et al. Effect of humic preparation on winter wheat productivity and rhizosphere microbial community under herbicideinduced stress // J. Soils Sediments. 2019. V. 19. P. 2665–2675. https://doi.org/10.1007/s11368-018-02240-z
ian R., Chen D., Liu X., Cui L., Li L., Pan G., Xie D., Zheng J., Zhang X., Zheng J., Chang A. Biochar soil amendment as a solution to prevent Cd-tainted rice from China: Results from a cross-site field experiment // Ecological Engineering. 2013. V. 58. P. 378–383. 10.1016/j.ecoleng.2013.07.03
Biochar for environmental management: science and technology / Eds.: J. Lehmann, S. Joseph. London, UK: Earthscan, 2009. 404 p.
Bünemann E.K., Bongiorno G., Bai Z., Creamer R., Deyn G., Goede R., Fleskens L., Geissen L., Kuyper T., Mäder P., Pulleman M., Sukkel W., van Groenigen W., Brussaard L. Soil quality – A critical review // Soil Biology and Biochemistry. 2018. V. 120. P. 105–125. https://doi.org/10.1016/j.soilbio.2018.01.030
Creamer R.E., Schulte R.P.O., Stone D., Gal A., Krogh P.H., Lo Papa G., Winding A. Measuring basal soil respiration across Europe: Do incubation temperature and incubation period matter? // Ecological Indicators. 2014. V. 36. P. 409–418. https://doi.org/10.1016/j.ecolind.2013.08.015
de Sousa Lima J.R., de Moraes Silva W., de Medeiros E.V., Duda G.P., Corrêa M.M., Martins Filho A.P., Clermont-Dauphin C., Antonino A.C., Hammecker C. Effect of biochar on physicochemical properties of a sandy soil and maize growth in a greenhouse experiment // Geoderma. 2018. V. 319. P. 14–23. https://doi.org/10.1016/j.geoderma.2017.12.033
Debela F., Thring R.W., Arocena J.M. Immobilization of heavy metals by co-pyrolysis of contaminated soil with woody biomass // Water, Air, Soil Pollut. 2012. V. 223. P. 1161–1170. https://doi.org/10.1007/s11270-011-0934-2
Garland J.L., Mills A.L. Classification and Characterization of Heterotrophic Microbial Communities on the Basis of Patterns of Community-Level Sole-Carbon-Source Utilization // Appl Environ Microbiol. 1991. V. 57. № 8. P. 2351–2359. https://doi.org/10.1128/AEM.57.8.2351-2359.1991
Glaser B., Haumaier L., Guggenberger G., Zech W. The “Terra Pretta” phenomenon: F model for sustainable agriculture in the humid tropics // Naturwissenschaften. 2011. № 88. P. 37–41. https://doi.org/10.1007/s001140000193
Gong Q., Chen P., Shi R., Gao Y., Zheng S.A., Xu Y., Shao C., Zheng X. Health Assessment of Trace Metal Concentrations in Organic Fertilizer in Northern China // International J. environmental research and public health. 2019. V. 16. № 6. P. 1031. https://doi.org/10.3390/ijerph16061031
Gonzalez-Quiñones A., Stockdale E.A., Banning N.C., Hoyle F.C., Sawada Y., Wherrett A.D., Jones D.L., Murphy D.V. Soil microbial biomass – Interpretation and consideration for soil monitoring // Soil Research. 2011. V. 49. P. 287–304. https://doi.org/10.1071/sr10203
Goss M.J., Tubeileh A., Goorahoo D. A Review of the Use of Organic Amendments and the Risk to Human Health // Advances in Agronomy. 2013. V. 120. P. 275–379. https://doi.org/10.1016/b978-0-12-407686-0.00005-1
Gu X., Xiao Y., Yin S., Liu H., Men B., Hao Z., Qian P., Yan H., Hao Q., Niu Y., Huang H., Pe Q. Impact of Long-Term Reclaimed Water Irrigation on the Distribution of Potentially Toxic Elements in Soil: An In-Situ Experiment Study in the North China Plain // International J. environmental research and public health. 2019. V. 16. № 4. P. 649. https://doi.org/10.3390/ijerph16040649
Hofman J., Dusek L., Klanova J., Bezchlebova J., Holoubek I. Monitoring microbial biomass and respiration in different soils from the Czech Republic – a summary of results // Environment International. 2004. V. 30. № 1. P. 19–30. https://doi.org/10.1016/S0160-4120(03)00142-9
Lehman R.M., Cambardella C.A., Stott D. E., Acosta-Martinez V., Manter, D.K., Buyer J. S., Maul J.E., Smith J.L., Collins H.P., Halvorson J.J., Kremer R.J., Lundgren J.G., Ducey T.F., Jin V.L., Karlen D.L. Understanding and Enhancing Soil Biological Health: The Solution for Reversing Soil Degradation // Sustainability. 2015. V. 7. P. 988–1027.
Liu X., Zheng J., Zhang D., Cheng K., Zhou H., Zhang A., Li L., Joseph S., Smith P., Crowley D., Kuzyakov Y., Pan G. Biochar has no effect on soil respiration across Chinese agricultural soils // Science of the total environment. 2016. V. 554–555. P. 259–265. https://doi.org/10.1016/j.scitotenv.2016.02.179
Mäder P., Fliessbach A., Dubois D., Gunst L., Fried P., Niggli U. Soil fertility and biodiversity in organic farming // Science. 2002. V. 296. P. 1694–1697.
Margesin R., Minerbi S., Schinner F. Long-term monitoring of soil microbiological activities in two forest sites in South Tyrol in the Italian Alps // Microbes and Environments. 2014. V. 29. Iss. 3. P. 277–285. https://doi.org/10.1264/jsme2.ME14050
Martínez-Alcántara B., Martínez-Cuenca M.R., Bermejo A., Legaz F., Quiñones A. Liquid Organic Fertilizers for Sustainable Agriculture: Nutrient Uptake of Organic versus Mineral Fertilizers in Citrus Trees // PloS one. 2011. V. 11. № 10. e0161619. https://doi.org/10.1371/journal.pone.0161619
Martínez-Villegas N., Hernández A., Meza-Figueroa D., Sen Gupta B. Distribution of Arsenic and Risk Assessment of Activities on Soccer Pitches Irrigated with Arsenic-Contaminated // Water. International J. environmental research and public health. 2018. V. 15(6). P. 1060. https://doi.org/10.3390/ijerph15061060
Önal E., Özbay N., Yargıç A.Ş., Şahin R.Z.Y., Gök Ö. Performance Evaluation of the Biochar Heavy Metal Removal Produced from Tomato Factory Waste // Progress in Exergy, Energy, and the Environment. Springer International Publishing. 2014. P. 733–740. https://doi.org/10.1007/978-3-319-04681-5_70
Ouyang W., Geng X., Huang W., Hao F., Zhao J. Soil respiration characteristics in different land uses and response of soil organic carbon to biochar addition in high-latitude agricultural area // Environ Sci Pollut Res. 2016. V. 23. P. 2279–2287.
Park J.H., Choppala G.K., Bolan N.S., Chung J.W., Chuasavath T. Biochar reduces the bioavailability and phytotoxicity of heavy metals // Plant Soil. 2011. V. 348. P. 439–451. https://doi.org/10.1007/s11104-011-0948-y
Perminova I.V., Kulikova N.A., Zhilin D.M., Grechischeva N.Yu., Kovalevskii D.V., Lebedeva G.F., Matorin D.N., Venediktov P.S., Konstantinov A.I., Kholodov V.A., Petrosyan V.S. Mediating effects of humic substances in the contaminated environments. Concepts, results, and prospects // Viable Methods of Soil and Water Pollution Monitoring, Protection and Remediation. Ser. IV: Earth and Environmental Sciences. Springer Netherlands. 2006. V. 69. P. 249–274. https://doi.org/10.1007/978-1-4020-4728-2_17
Ritz K., Black H.I.J., Campbell C.D., Harris J.A., Wood C. Selecting biological indicators for monitoring soils: A framework for balancing scientific and technical opinion to assist policy development // Ecological Indicators. 2009. V. 9. P. 1212–1221. https://doi.org/10.1016/j.ecolind.2009.02.009
Rizhiya E.Y., Buchkina N.P., Mukhina I.M., Belinets A.S., Balashov E.V. Effect of biochar on the properties of loamy sand spodosol soil samples with different fertility levels: a laboratory experiment // Eurasian Soil Science. 2015. V. 48. № 2. P. 192–200. https://doi.org/10.1134/S1064229314120084
Sacca M.L., Barra Caracciolo A., Di Lenola M., Grenni P. Ecosystem services provided by soil microorganisms Soil biological communities and ecosystem resilience. Sustainability in plant and crop protection. Springer International Publishing, Switzerland. 2017. P. 9–24. https://doi.org/10.1007/978-3-319-63336-7_2
Šlapáková B., Jeřábková J., Voříšek K., Tejnecký V., Drábek O. The biochar effect on soil respiration and nitrification // Plant Soil Environ. 2018. V. 64. P. 114–119. https://doi.org/10.17221/13/2018-PSE
Sohi S., Krull E., Lopez-Capel E., Bol R. A review of biochar and its use and function in soil // Adv Agro. 2010. V. 105. P. 47–82. https://doi.org/10.1016/S0065-2113(10)05002-9
Terekhova V.A. Soil bioassay: Problems and approaches // Eurasian Soil Science. 2011. V. 44. № 2. P. 173–179. https://doi.org/10.1134/S1064229311020141
van der Heijden M.G.A., Bardgett R.D., van Straalen N.M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems // Ecology Letters. 2008. V. 11. P. 296–310. https://doi.org/10.1111/j.1461-0248.2007.01139.x
Xu Y., Seshadry B., Bolan N., Sarkar B., Ok Y.S., Zhang W., Rumpel C., Sparks D., Farrell M., Hall T., Dong Z. Microbial functional diversity and carbon use feedback in soils as affected by heavy metals // Environment International. 2019. V. 125. P. 478–488. https://doi.org/10.1016/j.envint.2019.01.071
Yakimenko O.S., Terekhova V.A. Humic preparations and the assessment of their biological activity for certification purposes // Eurasian Soil Sci. 2011. V. 44. P. 1222–1230. https://doi.org/10.1134/S1064229319070159
Yakimenko O S., Terekhova V.A., Pukalchik M.A., Gorlenko M.V., Popov A.I. Comparison of two integrated biotic indices in assessing the effects of humic products in a model experiment // Eurasian Soil Sci. 2019. V. 52. № 7. P. 736–746. https://doi.org/10.1134/S1064229319070159
Yang Z., Liu S., Zheng D., Feng S. Effects of cadmium, zinc and lead on soil enzyme activities // J. Environ. Sci. 2006. V. 18. № 6. P. 1135–1141.
Yari M., Rahimi G., Ebrahimi E., Sadeghi S., Fallah M., Ghesmatpoor E. Effect of Three Types of Organic Fertilizers on the Heavy Metals Transfer Factor and Maize Biomass // Waste and Biomass Valorization. 2017. V. 8. P. 2681–2691. https://doi.org/10.1007/s12649-016-9719-6
Zhang J., Wei Y., Liu J. Effects of maize straw and its biochar application on organic and humic carbon in water-stable aggregates of a Mollisol in Northeast China: A five-year field experiment // Soil & Tillag Research. 2019. V. 190. P. 1–9. https://doi.org/10.1016/j.still.2019.02.014
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение