Почвоведение, 2022, № 2, стр. 228-243
Микробиологические индикаторы экологических функций почв (обзор)
Д. А. Никитин a, *, М. В. Семенов a, Т. И. Чернов a, Н. А. Ксенофонтова a, А. Д. Железова a, Е. А. Иванова a, Н. Б. Хитров a, А. Л. Степанов b
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 11.06.2021
После доработки 16.07.2021
Принята к публикации 31.07.2021
- EDN: BJIKTJ
- DOI: 10.31857/S0032180X22020095
Аннотация
Обобщены наиболее актуальные микробиологические показатели, которые могут служить индикаторами экологических функций почв: биоресурсной, функций трансформации углерода и обеспечения корневого питания растений, а также фитосанитарной. Для характеристики биоресурсной функции почв оцениваются индексы разнообразия и таксономическая структура микробных сообществ, а также численность определенных групп микроорганизмов. Основными микробиологическими показателями трансформации углерода служат содержание углерода микробной биомассы, соотношение биомассы бактерий и грибов, почвенное дыхание, ферментативная активность и скорость разложения органического вещества почвы. Оптимальными микробиологическими индикаторами функции почвы как источника обеспечения корневого питания растений являются активность ферментов, связанных с процессами циклов азота и фосфора, а также молекулярные видоспецифичные маркеры арбсускулярной микоризы. Индикаторами фитосанитарной функции почвы могут выступать показатели численности копий генов фитопатогенов и их антагонистов. Поскольку на сегодняшний день проблемами микробиологической индикации почвенных функций остаются высокая вариабельность некоторых показателей и сложность их интерпретации, ключевой задачей должен стать тщательный выбор параметров, обладающих наилучшей применимостью в качестве индикаторов экологических функций почв.
ВВЕДЕНИЕ
Почва – основа существования наземных экосистем и ценный невозобновляемый ресурс с точки зрения продовольственной безопасности [134]. Почва выполняет множество ключевых экологических, социальных и экономических функций [58]. Повышение антропогенной нагрузки приводит к деградации почвы [73], поэтому возникает потребность в индикаторах, позволяющих оценивать состояние почв и выявлять первые признаки нарушения осуществления почвой ее экологических функций [86]. Почвенные микроорганизмы являются ключевым звеном в биогеохимических циклах питательных элементов и быстро реагируют на изменения окружающей среды [7]. Микроорганизмы прямо или косвенно участвуют в обеспечении широкого спектра экологических функций почв, и поэтому могут служить эффективными высокочувствительными индикаторами этих функций [71, 120].
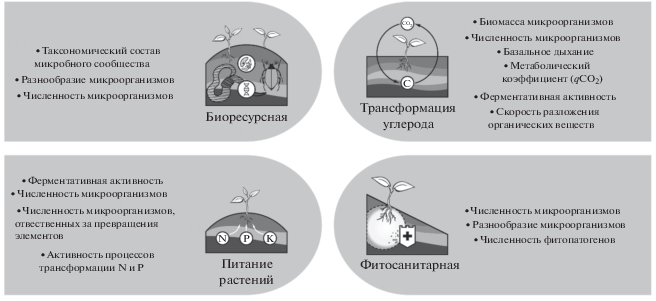
При рассмотрении микробиологических индикаторов необходимо, прежде всего, определить, какую классификацию функций почв использовать. Одна из первых систематизаций функций почв в биосфере и экосистемах выполнена Добровольским и Никитиным [8, 10], были выделены биогеоценотические и глобальные биосферные функции почв. К биогеоценотическим функциям отнесены физические, физико-химические, информационные, целостные, а также почвенное плодородие как отдельная функция [8, 10]. Функции почвы являются частью экологических функций ландшафта [16]. В зарубежных публикациях выделение и группировка почвенных функций часто определяются как промежуточное звено, связывающее традиционно измеряемые свойства почв с экосистемными сервисами; как следствие, формулировки почвенных функций обычно соответствуют названиям экосистемных сервисов [47, 69, 77, 115]. Поскольку в настоящее время еще не выработано единого мнения о почвенных функциях, в данном обзоре мы стремились дать такие формулировки почвенных функций в экосистеме, которые по возможности ясно отражают суть процессов, совершающихся именно в почве и обеспечивающих функционирование других компонентов экосистемы. Для некоторых экологических функций почв (опорной, гидрологической, продукционной) микробиологических индикаторов не существует. Однако микробиологические показатели могут быть использованы при оценке биоресурсной, питательной и фитосанитарной функций почв, а также функции трансформации углерода (рис. 1). В обзоре обсуждается роль микроорганизмов в поддержании почвенных функций, а также обобщены наиболее актуальные микробиологические показатели, которые могут служить индикаторами этих функций.
БИОРЕСУРСНАЯ ФУНКЦИЯ ПОЧВЫ
Почвы являются самым большим резервуаром биоразнообразия, вмещающим не менее четверти видов всех живых организмов планеты [7, 14, 137]. Поэтому одна из важнейших почвенных функций – биоресурсная, которая заключается в поддержании биоразнообразия и численности сообществ организмов, обитающих в почве или связанных с ней [56]. Ключевая роль данной функции состоит в обеспечении механизмов устойчивости и саморегуляции экосистем, что определило включение вопросов о ней в перечень целей устойчивого развития [55] и принятии Глобальной рамочной программы в области биоразнообразия на период после 2020 г. [48]. Биологическое разнообразие почвы играет важнейшую роль в минерализации органических соединений и секвестрации углерода, поддержании циклов биофильных элементов, питании и здоровье растений [82]. Как следствие, снижение разнообразия и численности организмов (то есть биоресурсной функции почв) приводит к замедлению интенсивности биогенных процессов почвообразования, снижению активности разложения органических веществ, общего плодородия, буферности почвы и ее способности к самовосстановлению после деградации [137]. Величины биоразнообразия почв для большинства территорий мира до сих пор неизвестны, поскольку их трудно определить количественно [84]. Однако для отдельных регионов некоторых стран уже существуют прогнозные карты и атласы биоразнообразия почвенных бактерий [68], грибов [136], нематод [144] и дождевых червей [109].
Различают несколько типов биоразнообразия. Альфа-разнообразие характеризует таксоны внутри сообщества, их богатство (количество таксонов в сообществе) и выравненность (относительное обилие) [22, 44, 45]. Бета-разнообразие – разнообразие между разными сообществами, показатель степени дифференцированности распределения видов или скорости изменения видового состава. Для фундаментальной и прикладной экологии простой подсчет числа таксонов малоинформативен из-за различной численности представителей каждого вида, поэтому обычно изучают альфа-разнообразие с учетом четырех теоретических моделей: геометрической, логарифмической, лог-нормальной, а также модели “разломанного стержня Макартура” [146]. Стоит отметить, что если в классической экологии хорошо известна применимость тех или иных способов оценки биоразнообразия сообществ, то для микроорганизмов этот вопрос пока недостаточно исследован [44]. Почвенный микробиом не только имеет специфическую структуру в силу отсутствия доминантов, но и характеризуется колоссальным таксономическим разнообразием, поэтому некоторые классические индексы биоразнообразия оказываются недостаточными для его анализа [146].
Одними из наиболее распространных индексов биоразнообразия, не учитывающих относительное обилие таксонов, являются индексы Маргалефа и Менхиника (табл. 1), для расчета которых необходимы лишь число обнаруженных таксонов и общее число особей [44]. Также широко используется индекс Шеннона–Вивера, спецификой которого является придание большего значения редким видам [26]. Применяют и индекс выровненности Пиелу (Pielou), нормирующий индекс Шеннона между 0 и 1. Кроме того, нередко используют индекс Симпсона (Simpson), который описывает вероятность принадлежности любых двух особей, случайно отобранных из неопределенно большого сообщества, к одному и тому же виду. Чем больше значение данного индекса, тем меньше видовое разнообразие. По мере увеличения индекса Симпсона разнообразие уменьшается [44]; он очень чувствителен к присутствию в выборке наиболее обильных видов, но слабо зависит от видового богатства [26].
Таблица 1.
Индексы биоразнообразия
| Индекс | Формула | Легенда |
|---|---|---|
| Маргалефа | DMg = (S – 1)/lnN | S – число обнаруженных таксонов |
| Менхиника | DMn = S/(N)1/2 | N – общее число особей |
| Шеннона–Вивера | $H = - \sum\limits_{i = 1}^n {{{p}_{i}} \cdot {\text{l}}{{{\text{g}}}_{2}}} \left( {{{p}_{i}}} \right)$ | ${{p}_{i}} = \frac{{{{x}_{i}}}}{{\sum\limits_{i = 1}^n {{{x}_{i}}} }}$ xi – число видов в сообществе |
| Пиелу | $E = \frac{H}{{\lg N}}$ | Н – индекс Шеннона N – число видов в сообществе |
| Симпсона | $D = \frac{{\sum {{{n}_{i}} \cdot \left( {{{n}_{i}} - 1} \right)} }}{{N \cdot \left( {N - 1} \right)}}$ | N – число видов n – число особей i-го вида |
| Индекс полидоминантности Вильямса | $\frac{1}{D}$ | D – индекс Симпсона |
| Chao1 | Chao1 = Sobs+ $\frac{{{{a}^{2}}}}{{2b}}$ | Sobs – обнаруженное количество таксонов a – число таксонов, содержащих один сиквенс b – число таксонов, содержащих два сиквенса |
На разнообразие почвенного микробиома влияет множество естественных (температура, уровень влажности, кислотность, качество и количество органического вещества, характер и состав растительного покрова и др.) и антропогенных факторов (загрязнение поллютантами, обилие и качество удобрений, тип землепользования, характер сельскохозяйственной обработки почвы) [66, 153]. К снижению биоразнообразия микроорганизмов, как естественных, так и сельскохозяйственных почв обычно приводят экстремальные изменения условий окружающей среды (опустынивание, резкая потеря запасов органического вещества, засоление, сильное подкисление/подщелачивание и т.д.), либо сокращение числа экологических ниш (например, вследствие длительной распашки почв) [117]. Например, биоресурсная функция почв нарушается при длительном применении минеральных удобрений [35, 153], распашке почвы [23, 25] или попадании в почву поллютантов [21, 25], поскольку все эти факторы приводят к снижению разнообразия микроорганизмов.
Выявление разнообразия почвенных микроорганизмов долгое время базировалось на их культивировании в питательных средах [57], которые позволяют оценить численность эколого-функциональных групп: азотфиксаторов, целлюлолитиков, амилолитиков и др. [19, 24]. Однако 90–99% всех бактерий, архей и микроскопических грибов на сегодняшний день некультивируемо [132]. Поэтому получили развитие молекулярно-генетические методы оценки общего разнообразия микроорганизмов при помощи тотального генетического материала, извлекаемого напрямую из почвы [35, 146].
Для оценки численности разных групп почвенных микроорганизмов активно используется количественная полимеразная цепная реакция (ПЦР в реальном времени или real-time PCR), которая позволяет детектировать количество копий рибосомальных или функциональных генов в единице массы почвы. Для определения разнообразия прокариот используется ген 16S рРНК, а для грибов – 18S рРНК и ITS [35]. Данный метод позволяет выявлять численность генов, кодирующих ключевые ферменты (например, нитрогеназу, нитратредуктазу и др.), что делает возможным характеризовать потенциальный уровень активности разных эколого-функциональных групп микроорганизмов (см. ниже).
Одними из первых способов оценки генетического разнообразия микроорганизмов являлись денатурирующий градиентный гель-электрофорез (DGGE) [101] и температурный градиентный гель-электрофорез (TGGE) [78]. Однако разрешающая способность DGGE и TGGE невелика по сравнению с реальным разнообразием микроорганизмов в почве [103]. В настоящее время генетическое разнообразие почвенного микробиома оценивают с помощью секвенирования нового поколения (англ. next generation sequencing, NGS), которое позволяет прочитывать сотни тысяч или даже миллионы участков ДНК. Применение NGS-технологий способствовало развитию методов оценки структуры и разнообразия почвенных микробиомов, в частности, метабаркодинга – изучения генетического разнообразия посредством анализа ампликонных библиотек маркерных генов (16S рРНК, 18S рРНК, ITS, функциональные гены) [35, 100].
С помощью высокопроизводительного секвенирования методом случайного фрагментирования “shotgun” появилась возможность анализировать не только маркерные гены, а весь почвенный метагеном [29, 114]. Несмотря на высокую продуктивность методов NGS, анализ такого большого объема информации, как полный метагеном почвы на настоящий момент является крайне трудоемким процессом [54, 140]. Методы высокопроизводительного секвенирования по-прежнему обладают рядом ограничений в контектсте анализа почвенного биоразнообразия, прежде всего, высокой стоимостью анализа и неполнотой генетических баз данных. Тем не менее, стоимость секвенирования за последние 10 лет существенно уменьшилась, и на сегодняшний день эта тенденция сохраняется [35]. Развитие NGS-технологий и пополнение баз данных, в свою очередь, способствуют большей эффективности применения этих методов для анализа биоресурсной функции почв [100].
ФУНКЦИЯ ТРАНСФОРМАЦИИ УГЛЕРОДА
Одна из важнейших функций почвы в биосфере заключается в регулировании цикла углерода [131]. Органический углерод в почвах содержится в очень широком спектре соединений, которые обобщенно принято называть почвенным органическим веществом (ПОВ). Количественный и качественный составы ПОВ определяют большинство свойств почвы, что обусловливает ключевую роль ПОВ в обеспечении функционирования экосистем [31]. В настоящее время из-за интенсификации сельского хозяйства повсеместно происходит активная минерализация ПОВ, что снижает продуктивность пахотных земель [16]. Конверсия растительных остатков в ПОВ, процессы минерализации, стабилизации и дестабилизации ПОВ – исключительно важные этапы динамики почвенного углерода, доступные для микробиологической индикации [33, 122, 130]. Почвенные сапротрофные микроорганизмы выступают главным агентом трансформации ПОВ, а их биомасса является динамическим источником обновления ПОВ и стоком углерода [63]. Основными микробиологическими индикаторами процессов цикла углерода выступают углерод микробной биомассы, почвенное дыхание, скорость разложения и минерализации ПОВ, а также ферментативная активность.
Углерод микробной биомассы (Смик) – самая активная и динамичная часть ПОВ, которая обычно не превышает 3–5% от содержания почвенного органического углерода [80, 135]. Углерод микробной биомассы может быть использован как показатель оценки продуктивности экосистем, а также в качестве раннего индикатора изменений в ПОВ [135]. Отношение Смик/Сорг служит индикатором доступности органического углерода почвы [1, 2].
Методы определения Смик в почвах можно разделить на прямые, физиологические, биохимические (биоцидные) и молекулярные (биомаркерные). К прямым методам относится люминесцентная микроскопия с набором флуоресцентных красителей, с помощью которых можно выявить численность клеток микроорганизмов [27, 57]. К физиологическим – метод субстрат-индуцированного дыхания. Метод заключается в измерении эмиссии СО2, продуцируемого почвенными микроорганизмами в течение 3–5 ч после добавления в почву фиксированного количества легкодоступного субстрата (обычно глюкозы). К молекулярным методам оценки углерода микробной биомассы относятся количественное определение содержания биомаркеров: ДНК и РНК [93, 123], определение жирных кислот фосфолипидов – PLFA [150] и содержание АТФ в клетках [3]. В целом, основной проблемой всех методов определения микробной биомассы почв является непостоянство пересчетных коэффициентов измеряемого показателя (дыхание, фумигированный углерод, ДНК, PLFA) при пересчете в содержание микробного углерода [11, 123].
Почвенное дыхание (ПД) – эмиссия СО2 из почвы при минерализации ОВ и дыхании почвенной биоты [13, 18]. ПД складывается из гетеротрофного (микробного и зоогенного) и автотрофного (корневого) дыхания. ПД хорошо коррелирует с содержанием ПОВ и микробной биомассой, и поэтому является одним из классических методов оценки биологической активности почвы [2, 18, 57]. Определяют ПД путем измерения выделяемого СО2 или потребления О2 [149]. Более чувствительной является оценка СО2, так как его атмосферная концентрация составляет всего около 0.04%, а не около 20%, как у кислорода. Определение ПД проводят с использованием методов, в основе которых лежит принцип поглощения СО2 щелочью с последующим титрованием, либо с помощью газовой хроматографии и инфракрасной спектроскопии. Поскольку от 10 до 90% эмиссии СО2 почвой обеспечивается микроорганизмами [107], обычно оценивают интенсивность углекислого газа, выделяемого при разложении ПОВ в свободных от корней и растительных остатков зонах – базальное дыхание (БД) [1, 36, 149]. Измерение БД важно для моделирования и оценки баланса углерода наземных экосистем [12], а также помогает определить зависимость скорости минерализации ПОВ от различных климатических факторов [5] или агрогенных воздействий [122, 142]. При снижении содержания микробной биомассы уменьшаются запасы почвенного углерода и замедляется интенсивность цикла этого элемента для экосистем в целом [3]. Считается, что показатели биомассы микроорганизмов являются более чувствительным индикаторам количественных и качественных изменений почвенного органического вещества, чем ПОВ [31].
Одним из показателей участия микроорганизмов в цикле углерода является “метаболический” или “дыхательный” коэффициент (qCO2), устанавливаемый по отношению между базальным и субстрат-индуцированным дыханием [49]. qCO2 отражает эффективность преобразования гетеротрофными микроорганизмами органического углерода в микробную биомассу, поэтому может быть использован в качестве индикатора изменений качества почвы [70]. Метаболический коэффициент и скорость минерализации органического углерода в почве имеют решающее значение для углеродного цикла в наземных экосистемах [52]. Кроме того, qCO2 описывает состояние, в котором находятся сообщества: чем больше значения данного показателя, тем менее благоприятные условия в экосистеме. Низкий уровень qCO2 указывает на уменьшение интенсивности биогеохимического цикла углерода в почве [52].
Скорость разложения органического вещества. Разложение компонентов ПОВ обычно оценивают по убыли массы материала в сетчатых мешочках, изменению запасов подстилки, а также по образованию C–CO2 методом закрытых камер [120]. Использование разложения подстилки в роли функционального показателя создает некоторые проблемы стандартизации, поскольку различия в качестве подстилки имеют огромное влияние на скорость ее деградации [89]. Этот недостаток может быть преодолен при использовании стандартного целлюлозного субстрата в качестве заменителя органических остатков [138], например, льняных/конопляных полотен и хлопчатобумажных полосок [81], или пакетиков с черным и зеленым чаем. Быстрое разложение целлюлозных полосок может свидетельствовать о стремительном разрушении подстилки [81, 138]. Биокинетический метод, базирующийся на учете выделения С–СО2 из инкубируемой почвы, позволяет оценить одновременно доступность органического вещества для разложения и способность почвенного сообщества разлагать органическое вещество [30, 32]. Кроме того, эти методы позволяют установить количество разложившегося ПОВ или растительных остатков, а также константу скорости разложения [33, 133]. Обширную информацию о трофическом статусе почвенного микробного сообщества можно получить также путем мультисубстратного тестирования (CLPP) – оценке активности потребления ряда органических субстратов разной степени [4, 92].
Ферментативная активность (ФА). Почвенные ферменты играют важную роль в разложении и трансформации ПОВ, высвобождают доступные питательные вещества для биоты и участвуют в циклах биогенных элементов [59, 121]. Внутриклеточные ферменты существуют только внутри организмов, обеспечивая их жизнедеятельность, а при их отмирании – разрушаются, практически не влияя на почву. Внеклеточные ферменты продуцируются организмами в окружающую среду, окисляют и гидролизуют полимерные органические соединения, контролируя баланс между трансформацией стабильного и лабильного ПОВ [59, 95, 129].
ФА изменяется намного быстрее, чем большинство физических и химических показателей почвы, что обеспечивает выявление трансформации ПОВ на ранних стадиях [88]. Обычно в почве определяют активности амилаз, гликозидаз, целлюлаз, хитиназ, фосфатаз, протеаз и уреаз [126]. Основные методы измерения ФА основываются на спектрофотометрии, флуоресценции и радиоактивно меченых изотопах. Измерения потенциальной ФА почвы основаны на поддержании кинетики нулевого порядка, что позволяет достичь скорости реакции, пропорциональной концентрации фермента [59]. Общепринятых стандартных процедур оценки ФА почвы до сих пор не существует [53, 126]. Оригинальным выглядит определение целлюлазной активности методом целлофановых мембран, заключающимся в регистрации уменьшения прочности мембран на разрыв после инкубирования мембраны в почве [20]. Доказана ведущая роль показателей ФА при оценке влияния поллютантов (пестицидов, тяжелых металлов, нефтепродуктов и др.) на экологическое состояние почв [6, 15]. Использованию ФА в качестве индикатора экологической функции почв, отражающей трансформацию углерода, способствует простота определения и высокая чувствительность метода.
ФУНКЦИЯ ОБЕСПЕЧЕНИЯ РАСТЕНИЙ ПИТАТЕЛЬНЫМИ ЭЛЕМЕНТАМИ
Одной из функций почв служит обеспечение растений питательными элементами, существенную роль в котором играет почвенный микробиом, трансформирующий питательные вещества (прежде всего, соединения азота и фосфора) в доступную для растений форму [82]. Трансформация азотсодержащих веществ микроорганизмами осуществляется за счет процессов азотфиксации, аммонификации, нитрификации, денитрификации и др. [13, 29, 43, 118]. Например, интенсивная обработка сельскохозяйственных полей может приводить к активизации процесса денитрификации и, как следствие, уменьшению запасов общего азота в почве [119]. Для исследования активности этих процессов трансформации азота в почве традиционно используют методы хроматографии [41, 46]. Активность нитрогеназы определяют, главным образом, с помощью классического газохроматографического метода с восстановления ацетилена C2H2 [41, 46]. Интенсивность денитрификации также опредяют путем добавления C2H2, который ингибирует N2O-редуктазу – последнюю стадию пути денитрификации. Перспективным методом является измерение активности микробиологических процессов (например, денитрификации) путем введения в систему субстратов, обогащенных 15N [60].
Для индикации потенциальной активности процессов цикла азота в почве могут быть использованы менее динамичные показатели, основанные на численности микроорганизмов или их функциональных генов и транскриптов. Например, ген nifH кодирует одну из субъединиц нитрогеназы и наиболее часто используется в качестве молекулярного маркера азотфиксации [111]. Гены narG, napA и norB, qnorB, nirS, nirK, nosZ используются в качестве молекулярных маркеров разных этапов денитрификации (табл. 2). Молекулярными маркерами интенсивности нитрификации являются гены amoA (бактериальный и архейный), NxrA, NxrB [74]. В то же время важно понимать, что численность того или иного гена не всегда коррелирует с интенсивностью процесса в почве [35]. С помощью метаанализа показано, что численность функциональных генов, связанных с процессами нитрификации и денитрификации, значительно возрастает при внесении азотных удобрений в разных формах [105], что указывает на возможность использования функциональных генов азотного цикла в качестве индикаторов, по крайней мере, в агробиоценозах. В длительном полевом эксперименте выявлено, что интенсивность процессов денитрификации и нитрификации коррелирует с численностью генов, но не разнообразием сообществ денитрификаторов и нитрификаторов [75]. Связь между численностью копий генов нитрификаторов и активностью нитрификации выявлена во многих исследованиях [147].
Таблица 2.
| Процесс | Функциональный ген |
|---|---|
| Азотфиксация | nifH |
| Аммонификация | amoA |
| Нитрификация, 1-я стадия NH2OH → ${\text{NO}}_{2}^{ - }$ | amoA (бактериальный и архейный) |
| Нитрификация, 2-я стадия ${\text{NO}}_{2}^{ - }$ → ${\text{NO}}_{3}^{ - }$ | Nxr |
| Денитрификация, 1-я стадия ${\text{NO}}_{3}^{ - }$ → ${\text{NO}}_{2}^{ - }$ | narG, napA |
| Денитрификация, 2-я стадия ${\text{NO}}_{2}^{ - }$ → NO | nirS, nirK |
| Денитрификация, 3-я стадия NO → N2O | norB, qnorB |
| Денитрификация, 4-я стадия N2O → N2 | nosZ |
| Гидролиз фосфорорганических соединений | phoD |
| Процесс | Функциональный ген |
| Азотфиксация | nifH |
| Нитрификация, 1-я стадия NH2OH → ${\text{NO}}_{2}^{ - }$ | amoA (бактериальный и архейный) |
| Нитрификация, 2-я стадия ${\text{NO}}_{2}^{ - }$ → ${\text{NO}}_{3}^{ - }$ | NxrA, NxrB |
| Денитрификация, 1-я стадия ${\text{NO}}_{3}^{ - }$ → ${\text{NO}}_{2}^{ - }$ | narG, napA |
| Денитрификация, 2-я стадия ${\text{NO}}_{2}^{ - }$ → NO | nirS, nirK |
| Денитрификация, 3-я стадия NO → N2O | norB, qnorB |
| Денитрификация, 4-я стадия N2O → N2 | nosZ |
| Гидролиз фосфорорганических соединений | phoD |
Микроорганизмы участвуют в минерализации и иммобилизации фосфорорганических соединений и в мобилизации нерастворимых неорганических форм фосфора [82, 152]. Наиболее активно мобилизация фосфора происходит с помощью микоризных грибов и ризосферных микроорганизмов [79]. Для оценки способности микробного сообщества почвы к минерализации фосфорорганических соединений оценивают ферментативную активность фосфатаз [102] и обилие функциональных генов, кодирующих фосфатазы – phoC и phoD [72].
Большинство (до 98%) высших растений находится в симбиозе с микоризными грибами. Мутуалистические отношения между этими организмами заключаются в обеспечении растений элементами минерального питания, витаминами и стимуляторами роста через гифы и в ответном снабжении микобионта фотосинтатом. Различают арбускулярную, эндотрофную, эксотрофную и эрикоидную микоризы [37]. Микориза может стимулировать рост и развитие растений-хозяев, улучшать их питание, повышать устойчивость к засухе, засолению и тяжелым металлам [51], а также запускать механизмы устойчивости к фитопатогенам [112]. Микоризный симбиоз позволяет растениям развиваться в почвах с низким плодородием, где быстро образуются зоны дефицита питательных элементов вблизи корней [64]. Для большинства сельскохозяйственных растений характерна арбускулярная микориза [85]. Применение микоризации сельскохозяйственных культур способствует увеличению их урожайности и улучшению качества урожая [61]. За счет мицелия арбускулярной микоризы существенно увеличивается поглощающая способность корней растений, в том числе по отношению к малодоступным соединениям фосфора – фосфатам и фитатам [61, 110]. Увеличение численности культур микоризообразующих грибов в почве напрямую связано с повышением эффективности азотного питания растений [145].
В качестве индикаторов качества и количества арбускулярной микоризы используют подсчет спор ее микобионта, фосфолипидные жирные кислоты (PLFA) и генетические маркеры [148]. Маркерные фосфолипидные жирные кислоты, характерные для грибов, формирующих арбускулярную микоризу, перечислены в обзоре Олсона [104]. Генетическими маркерами грибов класса Glomeromycota, формирующих арбускулярную микоризу, характерную для 80% сосудистых растений, являются последовательности рибосомальных генов 18S рРНК и LSU [37], обилие которых определяют с помощью метода количественной ПЦР с использованием группо- и видоспецифичных праймеров [116].
ФИТОСАНИТАРНАЯ ФУНКЦИЯ ПОЧВЫ
Фитосанитарная функция почвы заключается в предотвращении роста и развития микроорганизмов, патогенных для растений [38]. При определенных условиях фитопатогенные вирусы, бактерии, микроскопические грибы и оомицеты способны проникать в растения, угнетая их жизнедеятельность [94, 143]. Инфекционные болезни растений, источником которых является почва – одна из основных проблем сельского хозяйства [42, 67, 94]. По данным Продовольственной и сельскохозяйственной организации объединенных наций (ФАО, англ. Food and Agriculture Organization, FAO), болезни и вредители растений приводят к потере до 30% потенциального урожая сельскохозяйственных культур [40].
Одним из базовых слагаемых фитосанитарной функции почв является наличие супрессирующей (биоконтролирующей) активности [28, 42, 143]. Супрессивность почвы (СП) – показатель, характеризующий подавление и/или элиминирование из педоценоза отдельных видов патогенов, обусловленный совокупным действием биологических, физико-химических и агрохимических свойств [38]. Почвы с высокой супрессивностью характеризуются очень низким уровнем развития болезней даже в присутствии вирулентного патогена и восприимчивого растения [62, 97]. СП, в первую очередь, зависит от активности почвенных микроорганизмов и продукции ими метаболитов [87, 127], а также от физико-химических свойств почвы и факторов окружающей среды. Механизмы, лежащие в основе СП, связаны с рядом факторов: микробиостазом и фунгистазом; конкуренцией между фитопатогенами за растение-хозяина; синтезом антибиотиков, литических ферментов и нелетучих противогрибковых соединений; активацией генов устойчивости к болезням растений; улучшением питания и устойчивости к заболеваниям всего растения [67, 87, 92]. Микробиом, характеризующийся высоким биоразнообразием и повышенной численностью микроорганизмов-антагонистов, существенно лимитирует развитие фитопатогенов [87, 113, 121].
Разработка объективных методов оценки СП почвы имеет важное значение для фитопатологии и защиты растений [42]. Оценку СП почвы в целом можно провести посредством метода почвенных пластинок и агаровых блоков [83], а также почвенных разведений. Степень инфицирования растений в данном методе характеризуется по зараженности подземных органов растений с помощью микробиологического посева, а также путем расчета индекса развития болезни. Тороповой и соавт. [42] предложен новый индекс для характеристики СП почвы – коэффициент паразитической активности возбудителя, определяемый отношением индекса развития болезни к плотности популяции инфекционных структур возбудителя. Таким образом, коэффициент паразитической активности возбудителя показывает, какую пораженность растения индуцирует одна инфекционная единица фитопатогена [42].
В настоящее время идет активный поиск микробиологических индикаторов СП, большинство из которых основано на оценке численности микроорганизмов-фитопатогенов или их антагонистов [96, 97, 141, 142]. Численность таких микроорганизмов можно оценивать путем культивирования целевых групп фитопатогенов на питательных средах [28, 39, 42], либо с помощью молекулярно-генетических подходов (ПЦР в реальном времени, метабаркодинг и др.) [50, 94]. Поскольку учет фитопатогенных микроорганизмов на селективных питательных средах – длительная и трудоемкая процедура [42, 139], и многие фитопатогены плохо культивируемы или вовсе не поддаются выращиванию в лаборатории [50, 128], необходимы более надежные индикаторы, которые достоверно помогут оценить СП. Одним из возможных подходов к оценке фитосанитарного состояния почвы может выступать определение численности копий рибосомальных генов микроорганизмов, которые, согласно существующим базам данных [76, 98, 106], относятся к категории наиболее распространенных фитопатогенов: бактерий родов Ralstonia и Erwinia; микроскопических грибов родов Fusarium, Alternaria, Rhizoctonia, Phoma и Verticillium; оомицетов родов Phytophthora и Pythium и др. [50]. Например, повышение численности представителей рода Ralstonia в почвах приводит к росту заболеваемости растений, однако внесение органических удобрений в почву снижает численность фитопатогенов и восстанавливает фитосанитарную функцию почв [99, 151].
ЗАКЛЮЧЕНИЕ
Рассматриваемые микробиологические параметры могут быть использованы для оценки направленности процессов, связанных с обеспечением почвой ряда экологических функций: биоресурсной, функций трансформации углерода и корневым питанием растений, а также фитосанитарной. Основные микробиологические индикаторы экологических функций почвы указаны в табл. 3. У приведенных индикаторов есть свои преимущества и недостатки: одни из них могут дать информацию только об одной, а другие – сразу о двух экологических функциях; существенно варьируют как принципы методов, так и и стоимость получения результатов.
Таблица 3.
Показатели экологических функций почвы
| Показатель | Единица измерения | Метод | Стоимость получения | Почвенная функция |
|---|---|---|---|---|
| Разнообразие и число колониеобразующих единиц культивируемых микроорганизмов | Численность таксонов; КОЕ/г почвы | Микробиологические посевы | Средняя | Биоресурсная; фитосанитарная |
| Общее таксономическое разнообразие микроорганизмов | Численность таксонов, ед./г почвы | NGS | Высокая | Биоресурсная; фитосанитарная |
| Индексы альфа-разнообразия сообщества микроорганизмов | Безразмерная величина | Микробиологический посев; NGS | Низкая/высокая | Биоресурсная |
| Численность копий генов микроорганизмов | Число копий генов/г почвы | ПЦР в реальном времени | Средняя | Биоресурсная |
| Численность колоний культивируемых фитопатогенов | КОЕ/г почвы | Микробиологические посевы | Средняя | Фитосанитарная |
| Численность копий генов фитопатогенов | Число копий генов/г почвы | Количественная ПЦР | Средняя | Фитосанитарная |
| Углерод микробной биомассы | мкг С/г почвы | Газовая хроматография; Фумигация-экстракция; Количество жирных кислот фосфолипидов (PLFA); Количество ДНК; Количество АТФ Люминесцентная микроскопия |
Низкая/средняя | Трансформация C |
| Количество живых и мертвых клеток микроорганизмов | шт./г почвы; % | Люминесцентная микроскопия | Средняя | Трансформация C |
| Соотошение грибы : бактерии | Безразмерная величина | Количество жирных кислот фосфолипидов (PLFA); люминесцентная микроскопия |
Средняя | Трансформация C |
| Базальное дыхание | мкг CO2-С/(г почвы ч) | Газовая хроматография | Средняя | Трансформация C |
| Метаболический коэффициент (qCO2) | мкг СО2-С/(мг Смик ч) | Газовая хроматография | Низкая | Трансформация C |
| Скорость разложения субстратов в почве | сутки, недели | Взвешивание | Низкая | Трансформация C |
| Физиологический профиль микробного сообщества (CLPP) | Величины адсорбции | Измерения адсорбции | Средняя | Трансформация C |
| Потенциальная ферментативная активность | мг фермента/ (100 г почвы ч) | Измерение абсорбции/флуоресценции | Средняя | Трансформация C; питание растений |
| PLFA грибов, формирующих арбускулярную микоризу | нмоль/г почвы | Газохроматографические методы | Средняя | Питание растений |
| Количество генов грибов, формирующих арбускулярную микоризу | Количество копий генов/г почвы | Количественная ПЦР | Средняя | Питание растений |
| Количество спор грибов, формирующих арбускулярную микоризу | Количество спор/г почвы | Прямая светооптическая микроскопия | Низкая | Питание растений |
| Численность функциональных генов, связанных с тем или иным процессом циклов N и P | Количество копий генов/г почвы | Количественная ПЦР | Средняя | Питание растений |
| Потенциальная активность процессов циклов N и P | мг элемента/ кг почвы ч | Газохроматографические методы | Средняя | Питание растений |
Для характеристики биоресурсной функции почв наиболее эффективно использовать индексы разнообразия, таксономическое богатство/профиль микробиома и численность определенных групп микроорганизмов. Основными микробиологическими индикаторами функции трансформации углерода выступают содержание углерода микробной биомассы, почвенное дыхание, ферментативная активность и скорость разложения органического вещества почвы. Оптимальными микробиологическими индикаторами для оценки функции обеспечения растений питательными элементами являются активность ферментов, ответственных за протекание того или иного этапа биогеохимического цикла макроэлементов, численность кодирующих их генов, а также молекулярные видоспецифичные маркеры арбсускулярной микоризы. Индикацию фитосанитарной функции почвы предлагается проводить путем определения количества копий маркерных генов наиболее распространенных фитопатогенов: бактерий Ralstonia и Erwinia; микроскопических грибов Fusarium, Alternaria, Rhizoctonia, Phoma и Verticillium; оомицетов Phytophthora и Pythium.
Поскольку на сегодняшний день проблемами микробиологической индикации почвенных функций остаются высокая вариабельность некоторых показателей и сложность их интерпретации, ключевой задачей должен стать тщательный выбор параметров, которые обладают наилучшей применимостью в качестве индикаторов экологических функций почв.
Большинство рассмотренных классических методов микробиологии позволяют оценить лишь небольшую часть (иногда далекую от реально существующей картины в почве) таксономического и функциониального разнообразия микроорганимов. Молекулярно-биологические методы обладают значительно большей разрешающей способностью, поэтому их использование абсолютно необходимо для решения фундаментальных вопросов и практически орентированных задач по оценке почвенного микробиома. Например, микробиологический посев непригоден для оценки таксономического разнообразия некультивируемых форм, а метод люминесцентной микроскопии допускает существенные ошибки при учете прокариотной и грибной биомассы. Наиболее подходящими для оценки рассмотренных функций почв являются молекулярные методы – количественная ПЦР, метабаркодинг и метагеномика, численность функциональных генов, генетические маркеры арбускулярных микобионтов и фитопатогенов, а также определение содержания жирных кислот фосфолипидов (PLFA) и аденозин-трифосфатов (АТФ).
При использовании микробиологических показателей почвенных функций важно понимать, что не существует “оптимальной” почвы или универсального набора ее характеристик. В основном они должны служить для сравнительной характеристики близких по другим свойствам почв. Проблемами микробиологической индикации почвенных функций также остаются высокая вариабельность многих показателей и сложность их интерпретации. Тем не менее, микробиологические показатели обладают большим потенциалом применения в качестве комплексных чувствительных индикаторов почвенных функций. С учетом прогресса в области молекулярно-биологических методов, количество различных микробиологических показателей почвы, несомненно, будет увеличиваться, а ключевой задачей должен стать тщательный отбор параметров, которые обладают наилучшей применимостью в качестве индикаторов экологических функций почв.
Список литературы
Ананьева Н.Д., Сусьян Е.А., Рыжова И.М., Бочарникова Е.О., Стольникова Е.В. Углерод микробной биомассы и микробное продуцирование двуокиси углерода дерново-подзолистыми почвами постагрогенных биогеоценозов и коренных ельников южной тайги (Костромская область) // Почвоведение. 2009. № 9. С. 1108–1116.
Ананьева Н.Д., Сушко С.В., Иващенко К.В., Васенев В.И. Микробное дыхание почв подтайги и лесостепи европейской части России: полевой и лабораторный подходы // Почвоведение. 2020. № 10. С. 1276–1286. https://doi.org/10.31857/S0032180X20100044
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016.
Горленко М.В., Кожевин П.А. Мультисубстратное тестирование природных микробных сообществ. М.: МАКС Пресс, 2005. 88 с.
Громова М.С., Матвиенко А.И., Макаров М.И., Ченг Ш.К., Меняйло О.В. Температурная чувствительность (Q 10) базального дыхания как функция количества доступного углеродного субстрата, температуры и влажности // Почвоведение. 2020. № 3. С. 366–371.
Денисова Т.В., Казеев К.Ш., Колесников С.И., Вальков В.Ф. Влияние гамма-излучения на биологические свойства почвы (на примере чернозема обыкновенного) // Почвоведение. 2005. № 7. С. 877–881.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А, Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087–1087.
Добровольский Г.В., Никитин Е.Д. Почва в биосфере и экосистемах (экологическое значение почв). М.: Наука, 1990. 261 с.
Добровольский Г.В., Никитин Е.Д. Сохранение почв как незаменимого компонента биосферы. М.: Наука, 2000. 179 с.
Добровольский Г.В., Никитин Е.Д. Экологические функции почвы. М.: Изд-во Моск. ун-та, 1986. 136 с.
Евдокимов И.В. Методы определения биомассы почвенных микроорганизмов // Russ. J. Ecosystem Ecology. 2018. № 3(3). С. 1–20. https://doi.org/10.21685/2500-0578-2018-3-5
Заварзин Г.А., Кудеяров В.Н. Пулы и потоки углерода в наземных экосистемах России. М.: Наука, 2007. С. 315.
Задорожний А.Н., Семенов М.В., Ходжаева А.К., Семенов В.М. Почвенные процессы продукции, потребления и эмиссии парниковых газов // Агрохимия. 2010. № 10. С. 75–92.
Иванова Е.А., Першина Е.В., Карпова Д.В., Тхакахова А.К., Железова А.Д., Рогова О.Б., Семенов М.В., Стифеев А.И., Никитин Д.А., Колганова Т.В., Андронов Е.Е. Прокариотные сообщества почвогрунтов отвалов курской магнитной аномалии // Экологическая генетика. 2020. № 18(3). С. 331–342. https://doi.org/10.17816/ecogen17901
Казеев К.Ш., Лосева Е.С., Боровикова Л.Г., Колесников С.И. Влияние загрязнения современными пестицидами на биологическую активность чернозема обыкновенного // Агрохимия. 2010. № 11. С. 39–44.
Кирюшин В.И. Экологические функции ландшафта // Почвоведение. 2018. № 1. С. 17–25. https://doi.org/10.7868/S0032180X17010026
Корнейкова М.В., Никитин Д.А. Качественные и количественные характеристики почвенного микробиома в зоне воздействия выбросов Кандалакшского алюминиевого завода // Почвоведение. 2021. № 6. С. 725–734. https://doi.org/10.31857/S0032180X21060083
Кудеяров В.Н. Дыхание почв и биогенный сток углекислого газа на территории России (аналитический обзор) // Почвоведение. 2018. № 6. С. 643–658. https://doi.org/10.7868/S0032180X18060011
Кутовая О.В., Тхакахова А.К., Семенов М.В., Чернов Т.И., Ксенофонтова Н.А., Железова А.Д., Гаджиумаров Р.Г., Стукалов Р.С., Иванова Е.А., Никитин Д.А. Сравнительная оценка влияния нулевой и традиционной обработки на биологическую активность агрочерноземов Ставропольского края // Бюл. Почв. ин-та им. В.В. Докучаева. 2019. № 100. С. 159–189. https://doi.org/10.19047/0136-1694-2019-100-159-189
Лаврентьева Е.В., Семенов А.М., Зеленев В.В., Чжун Ю., Семенова Е.В., Семенов В.М., Намсараев Б.Б., Ван Бругген А.К.Х. Ежедневная динамика целлюлазной активности в пахотной почве в зависимости от обработки // Почвоведение. 2009. № 8. С. 1–10.
Лысак Л.В., Лапыгина Е.В. Разнообразие бактериальных сообществ городских почв // Почвоведение. 2018. № 9. С. 1108–1114. https://doi.org/10.1134/S0032180X18090071
Мэгарран Э. Экологическое разнообразие и его измерение. М.: Мир, 1992. 184 с.
Никитин Д.А., Иванова Е.А., Железова А.Д., Семенов М.В., Гаджиумаров Р.Г., Тхакахова А.К., Чернов Т.И., Ксенофонтова Н.А., Кутовая О.В. Оценка влияния технологии no-till и вспашки на микробиом южных агрочерноземов // Почвоведение. 2020. № 12. С. 1508–1520. https://doi.org/10.31857/S0032180X20120084
Никитин Д.А., Лысак Л.В., Мергелов Н.С., Долгих А.В., Зазовская Э.П., Горячкин С.В. Микробная биомасса, запасы углерода и эмиссия СО2 в почвах Земли Франца-Иосифа: высокоарктические тундры или полярные пустыни? // Почвоведение. 2020. № 4. С. 444–462. https://doi.org/10.31857/S0032180X20040115
Никитин Д.А., Семенов М.В., Железова А.Д., Кутовая О.В. Влияние технологии no-till на численность и таксономический состав микроскопических грибов в южных агрочерноземах // Микология и фитопатология. 2021. Т. 55. № 3. С. 189–202. https://doi.org/10.31857/S0026364821030077
Одум Ю. Экология / Под ред. В.Е. Соколова. М.: Мир, 1986. Т. 2. С. 133–134. 376 с.
Полянская Л.М., Пинчук И.П., Степанов А.Л. Сравнительный анализ методов люминесцентной микроскопии и каскадной фильтрации для оценки численности и биомассы бактерий в почве: роль разведения почвенной суспензии // Почвоведение. 2017. № 10. С. 1216–1219. https://doi.org/10.7868/S0032180X17100082
Семенов А.М., Соколов М.С. Концепция здоровья почвы: фундаментально-прикладные аспекты обоснования критериев оценки // Агрохимия. 2016. № 1. С. 3–16.
Семенов В.М. Функции углерода в минерализационно-иммобилизационном обороте азота в почве // Агрохимия. 2020. № 6. С. 78–96. https://doi.org/10.31857/S0002188120060101
Семенов В.М., Иванникова Л.А., Кузнецова Т.В., Семенова Н.А., Ходжаева А.К. Биокинетическая индикация минерализуемого пула органического вещества почвы // Почвоведение. 2007. № 11. С. 1352–1361.
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: ГЕОС, 2015. 233 с.
Семенов В.М., Когут Б.М., Зинякова Н.Б., Масютенко Н.П., Малюкова Л.С., Лебедева Т.Н., Тулина А.С. Биологически активное органическое вещество в почвах европейской части России // Почвоведение. 2018. № 4. С. 457–472.
Семенов В.М., Паутова Н.Б., Лебедева Т.Н., Хромычкина Д.П., Семенова Н.А. Разложение растительных остатков и формирование активного органического вещества в почве инкубационных экспериментов // Почвоведение. 2019. № 10. С. 1172–1184. https://doi.org/10.1134/S0032180X19100113
Семенов В.М., Тулина А.С. Сравнительная характеристика минерализуемого пула органического вещества в почвах природных и сельскохозяйственных экосистем // Агрохимия. 2011. № 12. С. 53–63.
Семенов М.В. Метабаркодинг и метагеномика в почвенно-экологических исследованиях: успехи, проблемы и возможности // Журн. общ. биол. 2019. Т. 80. № 6. С. 403–417. https://doi.org/10.1134/S004445961906006X
Семенов М.В., Стольникова Е.В., Ананьева Н.Д., Иващенко К.В. Структура микробного сообщества почвы катены правобережья р. Оки // Изв. РАН. Сер. Биол. 2013. № 3. С. 266–274.
Смит С.Э., Рид Д.Д. Микоризный симбиоз. М.: Товарищество научных изданий КМК, 2012.
Соколов М.С., Марченко А.И., Санин С.С., Торопова Е.Ю., Чулкина В.А., Захаров А.Ф. Здоровье почвы агроценозов как атрибут ее качества и устойчивости к биотическим и абиотическим стрессорам // Известия ТСХА. 2009. № 1. С. 13–22.
Соколов М.С., Спиридонов Ю.Я., Торопова Е.Ю., Глинушкин А.П., Семeнов А.М. Экологические и фитосанитарные функции почвенного органического вещества (проблемно-аналитический обзор) // Агрохимия. 2018. № 5. С. 79–96.
Статистика ущерба, наносимого сельскохозяйственным культурам, по данным ООН (ФАО). http://www.fao.org/statistics (дата обращения: 12.11.2017).
Степанов А.Л., Лысак Л.В. Методы газовой хроматографии в почвенной микробиологии: учебно-методическое пособие. М.: МАКС Пресс, 2002.
Торопова Е.Ю., Соколов М.С., Глинушкин А.П. Индукция супрессивности почвы-важнейший фактор лимитирования вредоносности корневых инфекций // Агрохимия. 2016. № 8. С. 44–55.
Умаров М.М., Кураков А.В., Степанов А.Л. Микробиологическая трансформация азота в почве. М.: ГЕОС, 2007. 136 с.
Чернов Т.И., Тхакахова А.К., Кутовая О.В. Оценка различных индексов разнообразия для характеристики почвенного прокариотного сообщества по данным метагеномного анализа // Почвоведение. 2015. № 4. С. 462–462. https://doi.org/10.7868/S0032180X15040036
Чернов Ю.И. Биологическое разнообразие: сущность и проблемы // Успехи современной биологии. 1991. Т. 111. № 4. С. 499–509.
Эмер Н.Р., Костина Н.В., Голиченков М.В., Нетрусов А.И. Динамика активности денитрификации и аммонификации в залежной и интенсивно возделываемой серой лесной почве (Тульская область) // Почвоведение. 2017. № 4. С. 449–456. https://doi.org/10.7868/S0032180X17040037
Adhikari K., Hartemink A. E. Linking soils to ecosystem services – A global review // Geoderma. 2016. V. 262. P. 101–111.
Alkemade R., Van Oorschot M., Miles L., Nellemann C., Bakkenes, M., Ten Brink B. GLOBIO3: a framework to investigate options for reducing global terrestrial biodiversity loss // Ecosystems. 2009. V. 12. № 3. P. 374–390.
Anderson T.H., Domsch K.H. Soil microbial biomass: the eco-physiological approach // Soil Biol. Biochem. 2010. V. 42. № 12. P. 2039–2043.
Aslam S., Tahir A., Aslam M.F., Alam M.W., Shedayi A.A., Sadia S. Recent advances in molecular techniques for the identification of phytopathogenic fungi–a mini review // J. Plant Interactions. 2017. V. 12(1). P. 493–504. https://doi.org/10.1080/17429145.2017.1397205
Augé R.M., Toler H.D., Saxton A.M. Arbuscular mycorrhizal symbiosis alters stomatal conductance of host plants more under drought than under amply watered conditions: a meta-analysis // Mycorrhiza. 2015. V. 25(1). P. 13–24.
Babur E. Effects of parent material on soil microbial biomass carbon and basal respiration within young afforested areas // Scand. J. Forest Res. 2019. V. 34(2). P. 94–101.
Baldrian P. Microbial enzyme-catalyzed processes in soils and their analysis // Plant, Soil and Environment. 2009. V. 55(9). P. 370–378.
Baveye P.C. To sequence or not to sequence the whole-soil metagenome? // Nature Rev. Microbiology. 2009. V. 7(10). P. 756–756. https://doi.org/10.1038/nrmicro2119-c2
Bebbington J., Unerman J. Achieving the United Nations sustainable development goals // Accounting, Auditing & Accountability. 2018. V. 31(1). P. 2–24. https://doi.org/10.1108/AAAJ-05-2017-2929
Bhargava P., Singh A.K., Goel R. Microbes: bioresource in agriculture and environmental sustainability // Plant-microbe interactions in agro-ecological perspectives. 2017. P. 361–376. https://doi.org/10.1007/978-981-10-5813-4_18
Blagodatskaya E., Kuzyakov Y. Active microorganisms in soil: critical review of estimation criteria and approaches // Soil Biol. Biochem. 2013. V. 67. P. 192–211. https://doi.org/10.1016/j.soilbio.2013.08.024
Blum W.E.H. Functions of soil for society and the environment // Rev. Environ. Sci. Bio/Technology. 2005. V. 4(3). P. 75–79. https://doi.org/10.1007/s11157-005-2236-x
Burns R., DeForest J., Marxsen J., Sinsabaugh R., Stromberger M., Wallenstein M., Weintraub M., Zoppini A. Soil enzymes in a changing environment: current knowledge and future directions // Soil Biol. Biochem. 2013. V. 58. P. 216–234. https://doi.org/10.1016/j.soilbio.2012.11.009
Capone D.G., Montoya J.P. Nitrogen fixation and denitrification // Methods in microbiology. 2001. V. 30. P. 501–515. https://doi.org/10.1016/S0580-9517(01)30060-0
Cardoso Filho J.A., Sobrinho R.R., Pascholati S.F. Arbuscular mycorrhizal symbiosis and its role in plant nutrition in sustainable agriculture // Agriculturally important microbes for sustainable agriculture. Singapore: Springer, 2017. P. 129–164. https://doi.org/10.1007/978-981-10-5343-6_5
Cha J.Y., Han S., Hong H.J., Cho H., Kim D., Kwon Y., Kwon S.K., Crüsemann M., Lee Y.B., Kim J.F., Giaever G. Microbial and biochemical basis of a Fusarium wilt-suppressive soil // ISME J. 2016. V. 10(1). P. 119–129.
Coonan E.C., Kirkby C.A., Kirkegaard J.A., Amidy M.R., Strong C.L., Richardson A.E. Microorganisms and nutrient stoichiometry as mediators of soil organic matter dynamics // Nutrient Cycling in Agroecosystems. 2020. V. 117. P. 273–298. https://doi.org/10.1007/s10705-020-10076-8
Corradi N., Bonfante P. The arbuscular mycorrhizal symbiosis: origin and evolution of a beneficial plant infection // PLoS Pathog. 2012. V. 8(4). P. e1002600. https://doi.org/10.1371/journal.ppat.1002600
Dai Z., Liu G., Chen H., Chen C., Wang J., Ai S. et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems // ISME J. 2020. V. 14(3). P. 757–770.
Daws S.C., Cline L.A., Rotenberry J., Sadowsky M.J., Staley C., Dalzell B., Kennedy P.G. Do shared traits create the same fates? Examining the link between morphological type and the biogeography of fungal and bacterial communities // Fungal Ecology. 2020. V. 46. P. 100948.
De Corato U. Disease-suppressive compost enhances natural soil suppressiveness against soil-borne plant pathogens: A critical review // Rhizosphere. 2020. V. 13. P. 100192. https://doi.org/10.1016/j.rhisph.2020.100192
Delgado-Baquerizo M., Oliverio A.M., Brewer T.E., Benavent-González A., Eldridge D.J., Bardgett R.D., Maestre F.T., Singh B.K., Fierer N. A global atlas of the dominant bacteria found in soil // Science. 2018. V. 359(6373). P. 320–325. https://doi.org/10.1126/science.aap9516
Drobnik T., Greiner L., Keller A., Grêt-Regamey A. Soil quality indicators–From soil functions to ecosystem services // Ecological indicators. 2018. V. 94. P. 151–169. https://doi.org/10.1016/j.ecolind.2018.06.052
Fernandes S.A.P., Bettiol W., Cerri C.C. Effect of sewage sludge on microbial biomass, basal respiration, metabolic quotient and soil enzymatic activity // Appl. Soil Ecol. 2005. V. 30(1). P. 65–77.
Fierer N., Wood S.A., de Mesquita C.P.B. How microbes can, and cannot, be used to assess soil health // Soil Biol. Biochem. 2021. V. 153. P. 108111. https://doi.org/10.1016/j.soilbio.2020.108111
Fraser T.D., Lynch D.H., Gaiero J., Khosla K., Dunfield K.E. Quantification of bacterial non-specific acid (phoC) and alkaline (phoD) phosphatase genes in bulk and rhizosphere soil from organically managed soybean fields // Appl. Soil Ecol. 2017. V. 111. P. 48–56. https://doi.org/10.1016/j.apsoil.2016.11.013
Gomiero T. Soil degradation, land scarcity and food security: Reviewing a complex challenge // Sustainability. 2016. V. 8(3). P. 281. https://doi.org/10.3390/su8030281
Guo J., Ling N., Chen H., Zhu C., Kong Y., Wang M., Shen Q., Guo S. Distinct drivers of activity, abundance, diversity and composition of ammonia-oxidizers: evidence from a long-term field experiment // Soil Biol. Biochem. 2017. V. 115. P. 403–414. https://doi.org/10.1016/j.soilbio.2017.09.007
Hallin S., Jones C.M., Schloter M., Philippot L. Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment // ISME J. 2009. V. 3. P. 597–605. https://doi.org/10.1038/Ismej.2008.128
Hamilton J.P., Neeno-Eckwall E.C., Adhikari B.N., Perna N.T., Tisserat N., Leach J.E., Levesque C.A., Buell C.R. The Comprehensive Phytopathogen Genomics Resource: a web-based resource for data-mining plant pathogen genomes // Database. 2011. V. 2011. https://doi.org/10.1093/database/bar053
Haslmayr H.P., Geitner C., Sutor G., Knoll A., Baumgarten A. Soil function evaluation in Austria–development, concepts and examples // Geoderma. 2016. V. 264. P. 379–387.
Heuer H., Smalla K. Application of denaturing gradient gel electrophoresis and temperature gradient gel electrophoresis for studying soil microbial communities // Modern Soil Microbiology. Amsterdam, Netherlands. 1997. P. 353–373.
Hinsinger P., Herrmann L., Lesueur D., Robin A., Trap J., Waithaisong K., Plassard C. Impact of roots, microorganisms and microfauna on the fate of soil phosphorus in the rhizosphere // Annual Plant Rev. Online. 2018. P. 377–407. https://doi.org/10.1002/9781119312994.apr0528
Horwath W.R. The role of the soil microbial biomass in cycling nutrients // Microbial Biomass: A Paradigm Shift in Terrestrial Biogeochemistry. World scientific, 2017. P. 41–66.
Jabiol J., Colas F., Guérold F. Cotton-strip assays: Let’s move on to eco-friendly biomonitoring! // Water Res. 2020. V. 170. P. 115295. https://doi.org/10.1016/j.watres.2019.115295
Jacoby R., Peukert M., Succurro A., Koprivova A., Kopriva S. The role of soil microorganisms in plant mineral nutrition–current knowledge and future directions // Frontiers in Plant Science. 2017. V. 8. P. 1617. https://doi.org/10.3389/fpls.2017.01617
Janvier C., Villeneuve F., Alabouvette C., Edel-Hermann V., Mateille T., Steinberg C. Soil health through soil disease suppression: which strategy from descriptors to indicators? // Soil Biol. Biochem. 2007. V. 39(1). P. 1–23.
Jeffery S., Gardi C. Soil biodiversity under threat – a review // Acta Societatis Zoologicae Bohemicae. České Budějovice, 2010. V. 74(1–2). P. 7–12.
Kapoor R., Evelin H., Mathur P., Giri B. Arbuscular mycorrhiza: approaches for abiotic stress tolerance in crop plants for sustainable agriculture // Plant acclimation to environmental stress. N.Y.: Springer, 2013. P. 359–401. https://doi.org/10.1007/978-1-4614-5001-6_14
Karlen D.L., Rice C.W. Soil degradation: Will humankind ever learn? // Sustainability. 2015. V. 7(9). P. 12490–12501. https://doi.org/10.3390/su70912490
Klein E., Ofek M., Katan J., Minz D., Gamliel A. Soil suppressiveness to Fusarium disease: shifts in root microbiome associated with reduction of pathogen root colonization // Phytopathology. 2013. V. 103(1). P. 23–33. https://doi.org/10.1094/PHYTO-12-11-0349
Kotroczó Z., Veres Z., Fekete I., Krakomperger Z., Tóth J.A., Lajth K., Tóthmérész B. Soil enzyme activity in response to long-term organic matter manipulation // Soil Biol. Biochem. 2014. V. 70. P. 237–243.
Lecerf A., Chauvet E. Intraspecific variability in leaf traits strongly affects alder leaf decomposition in a stream // Basic Appl. Ecol. 2008. V. 9(5). P. 598–605. https://doi.org/10.1016/j.baae.2007.11.003
Lehman R.M., Acosta-Martinez V., Buyer J.S., Cambardella C.A., Collins H.P., Ducey T.F., et al. Soil biology for resilient, healthy soil // J. Soil Water Conservation. 2015. V. 70(1). P. 12A–18A. https://doi.org/10.2489/jswc.70.1.12A
Liu B., Li Y., Zhang X., Wang J., Gao M. Effects of chlortetracycline on soil microbial communities: Comparisons of enzyme activities to the functional diversity via Biolog EcoPlates // Eur. J Soil Biol. 2015. V. 68. P. 69–76.
Liu H., Xiong W., Zhang R., Hang X., Wang D., Li R., Shen Q. Continuous application of different organic additives can suppress tomato disease by inducing the healthy rhizospheric microbiota through alterations to the bulk soil microflora // Plant and Soil. 2018. V. 423(1). P. 229–240. https://doi.org/10.1007/s11104-017-3504-6
Loeppmann S., Semenov M., Kuzyakov Y., Blagodatskaya E. Shift from dormancy to microbial growth revealed by RNA: DNA ratio // Ecological Indicators. 2018. V. 85. P. 603–612. https://doi.org/10.1016/j.ecolind.2017.11.020
Lucas J.A. Plant pathology and plant pathogens. John Wiley & Sons, 2020.
Makoi J.H.J.R., Ndakidemi P.A. Selected soil enzymes: examples of their potential roles in the ecosystem // Afr. J. Biotechnol. 2008. V. 7(3). P. 181–191.
Mazzola M. Assessment and management of soil microbial community structure for disease suppression // Annu. Rev. Phytopathol. 2004. V. 42. P. 35–59.
Mazzola M. Mechanisms of natural soil suppressiveness to soilborne diseases // Antonie van Leeuwenhoek. 2002. V. 81(1). P. 557–564. https://doi.org/10.1023/A:1020557523557
McCluskey K. Plant pathology related culture collection resources // APSnet Features Online. 2003. https://doi.org/10.1094/ APSnetFeature-2003-1203
Messiha N.A.S., Van Diepeningen A.D., Farag N.S., Abdallah S.A., Janse J.D., Van Bruggen A.H.C. Stenotrophomonas maltophilia: a new potential biocontrol agent of Ralstonia solanacearum, causal agent of potato brown rot // Eur. J. Plant Pathology. 2007. V. 118(3). P. 211–225. https://doi.org/10.1007/s10658-007-9136-6
Metzker M.L. Sequencing technologies–the next generation // Nature Rev. Genetics. 2010. V. 11(1). P. 31–46. https://doi.org/10.1038/nrg2626
Muyzer G., De Waal E.C., Uitterlinden A.G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA // Appl. Environ. Microbiol. 1993. V. 59(3). P. 695.
Nannipieri P., Giagnoni L., Landi L., Renella G. Role of phosphatase enzymes in soil // Phosphorus in action, Springer, Berlin, Heidelberg. 2011. P. 215–243. https://doi.org/10.1007/978-3-642-15271-9
Nielsen M.N., Winding A., Binnerup S. NERI Technical Report No. 388 National Environmental Research Institute, Denmark (2002) // Microorganisms as indicators of soil health. 2002. P. 1–85.
Olsson P.A. Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil // FEMS Microbiology Ecology. 1999. V. 29(4). P. 303–310. https://doi.org/10.1016/S0168-6496(99)00021-5
Ouyang Y., Evans S.E., Friesen M.L., Tiemann L.K. Effect of nitrogen fertilization on the abundance of nitrogen cycling genes in agricultural soils: A meta-analysis of field studies // Soil Biol. Biochem. 2018. V. 127. P. 71–78. https://doi.org/10.1016/j.soilbio.2018.08.024
Pedro H., Maheswari U., Urban M., Irvine A.G., Cuzick A., McDowall M.D., Staines D.M., Kulesha E., Hammond-Kosack K.E., Kersey P.J. PhytoPath: an integrative resource for plant pathogen genomics // Nucleic Acids Research. 2016. V. 44(D1). P. D688–D693. https://doi.org/10.1093/nar/gkv1052
Pell M., Stenstróm J., Granhall U. Soil Respiration // Microbiological Methods for assesing soil quality / Ed. J. Bloem et al. Cambridge: Cabi Publishing, 2005. P. 117–126.
Philippot L., Hallin S., Schloter M. Ecology of denitrifying prokaryotes in agricultural soil // Adv. Agronomy. 2007. V. 96. P. 249–305. https://doi.org/10.1016/S0065-2113(07)96003-4
Phillips H.R.P., Guerra C.A., Bartz M.L.C., Briones M.J.I., Brown G., Crowther T.W., Ferlian O. et al. Global distribution of earthworm diversity // Science. 2019. V. 366(6464). P. 480–485.
Pichardo S.T., Su Y., Han F.X. The potential effects of arbuscular mycorrhizae (AM) on the uptake of heavy metals by plants from contaminated soils // J. Bioremed. Biodeg. 2012. V. 3(10). P. 1–4. https://doi.org/10.4172/2155-6199.1000e124
Poly F., Ranjard L., Nazaret S., Gourbière F., Jocteur Monrozier L. Comparison of nifH gene pools in soils and soil microenvironments with contrasting properties // Appl. Environ. Microbiol. 2001. V. 67(5). P. 2255. https://doi.org/10.1128/AEM.67.5.2255-2262.2001
Pozo M.J., López-Ráez J.A., Azcón-Aguilar C., García-Garrido J.M. Phytohormones as integrators of environmental signals in the regulation of mycorrhizal symbioses // New Phytologist. 2015. V. 205(4). P. 1431–1436. https://doi.org/10.1111/nph.13252
Qiu M., Li S., Zhou X., Cui X., Vivanco J.M., Zhang N., Shen Q., Zhang R. De-coupling of root–microbiome associations followed by antagonist inoculation improves rhizosphere soil suppressiveness // Biology Fertility Soils. 2014. V. 50(2). P. 217–224. https://doi.org/10.1007/s00374-013-0835-1
Quince C., Walker A.W., Simpson J.T., Loman N.J., Segata N. Shotgun metagenomics, from sampling to analysis // Nature Biotechnology. 2017. V. 35(9). P. 833–844. https://doi.org/10.1038/nbt.3935
Rabot E., Wiesmeier M., Schlüter S., Vogel H.J. Soil structure as an indicator of soil functions: A review // Geoderma. 2018. V. 314. P. 122–137. https://doi.org/10.1016/j.geoderma.2017.11.009
Redecker D., Hijri I., Wiemken A. Molecular identification of arbuscular mycorrhizal fungi in roots: perspectives and problems // Folia Geobotanica. 2003. V. 38(2). P. 113–124. https://doi.org/10.1007/BF02803144
Rillig M.C., Lehmann A., Lehmann J., Camenzind T., Rauh C. Soil biodiversity effects from field to fork // Trends in Plant Science. 2018. V. 23(1). P. 17–24.
Robertson G., Groffman P. Nitrogen transformations / Ed. E.A. Paul // Soil Microbiology, Ecology, Biochemistry. 2007. V. 3. P. 341–364. https://doi.org/10.1016/B978-0-08-047514-1.50017-2
Rusu T., Moraru P.I. Soil Tillage and Denitrification: Source from Depollution the Soil // Nitrogen in Agricultural Landscape. 2021. P. 40.
Schloter M., Nannipieri P., Sørensen S.J., van Elsas J.D. Microbial indicators for soil quality // Biology and Fertility of Soils. 2018. V. 54(1). P. 1–10. https://doi.org/10.1007/s00374-017-1255-4
Schnitzer S.A., Klironomos J.N., Hillerislambers J., Kinkel L.L., Reich P.B., Xiao K., Rillig M.C. et al. Soil microbes drive the classic plant diversity–productivity pattern // Ecology. 2011. V. 92(2). P. 296–303.
Semenov A.M., Bubnov I.A., Semenov V.M., Semenova E.V., Zelenev V.V., Semenova N.A. Daily dynamics of bacterial numbers, CO2 emissions from soil and relationships between their wave-like fluctuations and succession of the microbial community // Eurasian Soil Sci. 2013. V. 46(8). P. 869–884. https://doi.org/10.1134/S1064229313080073
Semenov M., Blagodatskaya E., Stepanov A., Kuzyakov Y. DNA-based determination of soil microbial biomass in alkaline and carbonaceous soils of semi-arid climate // J Arid Environ. 2018. V. 150. P. 54–61. https://doi.org/10.1016/j.jaridenv.2017.11.013
Semenov M.V., Krasnov G.S., Semenov V.M., van Bruggen A.H.C. Long-term fertilization rather than plant species shapes rhizosphere and bulk soil prokaryotic communities in agroecosystems // Appl. Soil Ecol. 2020. V. 154. Art. 103641. https://doi.org/10.1016/j.apsoil.2020.103641
Setia R., Verma S.L., Marschner P. Measuring microbial biomass carbon by direct extraction–comparison with chloroform fumigation-extraction // Eur. J. Soil Biol. 2012. V. 53. P. 103–106. https://doi.org/10.1016/j.ejsobi.2012.09.005
Sherene T. Role of soil enzymes in nutrient transformation: A review // Bio Bull. 2017. V. 3(1). P. 109–131.
Siegel-Hertz K., Edel-Hermann V., Chapelle E., Terrat S., Raaijmakers J.M., Steinberg C. Comparative microbiome analysis of a Fusarium wilt suppressive soil and a Fusarium wilt conducive soil from the Châteaurenard region // Frontiers in Microbiology. 2018. V. 9. P. 568. https://doi.org/10.3389/fmicb.2018.00568
Singh U.S., Singh R.P. Molecular methods in plant pathology. Boca Raton, Florida: CRC Press, 2017.
Sinsabaugh R.L., Lauber C.L., Weintraub M.N., Ahmed B., Allison S.D., Crenshaw C., Contosta A.R., et al. Stoichiometry of soil enzyme activity at global scale // Ecology Lett. 2008. V. 11(11). P. 1252–1264.
Smith P., Lutfalla S., Riley W.J., Torn M.S., Schmidt M.W., Soussana J.F. The changing faces of soil organic matter research // Eur. J. Soil Sci. 2018. V. 69(1). P. 23–30. https://doi.org/10.1111/ejss.12500
Smith C.J., McKew B.A., Coggan A., Whitby C. Primers: functional genes for nitrogen-cycling microbes in oil reservoirs // Hydrocarbon and Lipid Microbiology Protocols. Berlin: Springer, 2015. P. 207–241. https://doi.org/10.1007/8623_2015_184
Steen A.D., Crits-Christoph A., Carini P., DeAngelis K.M., Fierer N., Lloyd K.G., Thrash J.C. High proportions of bacteria and archaea across most biomes remain uncultured // ISME J. 2019. V. 13(12). P. 3126–3130. https://doi.org/10.1038/s41396-019-0484-y
Sun L., Teramoto M., Liang N., Yazaki T., Hirano T. Comparison of litter-bag and chamber methods for measuring CO2 emissions from leaf litter decomposition in a temperate forest // J. Agricultural Meteorology. 2017. P. D-16-00012. https://doi.org/10.30486/ijrowa.2020.1885285.1002
Tate III R.L. Soil microbiology. New Brunswick: John Wiley & Sons, 2020.
Tate K.R. (ed.). Microbial Biomass: A Paradigm Shift in Terrestrial Biogeochemistry / World Scientific. 2017. https://doi.org/10.1142/q0038
Tedersoo L., Bahram M., Põlme S., Kõljalg U., Yorou N.S., Wijesundera R., Villarreal Ruiz L. et al. Global diversity and geography of soil fungi // Science. 2014. V. 346(6213). P. 1256688. https://doi.org/10.1126/science.1256688
Tibbett M., Fraser T.D., Duddigan S. Identifying potential threats to soil biodiversity // PeerJ. 2020. V. 8. P. e9271.
Tiegs S.D., Langhans S.D., Tockner K., Gessner M.O. Cotton strips as a leaf surrogate to measure decomposition in river floodplain habitats // J. North Am. Benthol. Soc. 2007. V. 26(1). P. 70–77.
Toropova E.Y., Kirichenko A.A., Stetsov G.Y., Suhomlinov V.Y. Soil infections of grain crops with the use of the resource-saving technologies in Western Siberia, Russia // Biosci. Biotechnol. Res. Asia. 2015. V. 12(2). P. 1081. https://doi.org/10.13005/bbra/1761
Tringe S.G., Hugenholtz P. A renaissance for the pioneering 16S rRNA gene // Current Opinion Microbiol. 2008. V. 11(5). P. 442–446. https://doi.org/10.1016/j.mib.2008.09.011
Van Agtmaal M., Straathof A.L., Termorshuizen A., Lievens B., Hoffland E., de Boer W. Volatile-mediated suppression of plant pathogens is related to soil properties and microbial community composition // Soil Biol. Biochem. 2018. V. 117. P. 164–174. https://doi.org/10.1016/j.soilbio.2017.11.015
Van Bruggen A.H.C., He M., Zelenev V.V., Semenov V.M., Semenov A.M., Semenova E.V. et al. Relationships between greenhouse gas emissions and cultivable bacterial populations in conventional, organic and long-term grass plots as affected by environmental variables and disturbances // Soil Biol. Biochem. 2017. V. 114. P. 145–159. https://doi.org/10.1016/j.soilbio.2017.07.014
Van der Plank J.E. Plant diseases: epidemics and control. Elsevier, 2013.
Van den Hoogen J., Geisen S., Routh D., Ferris H., Traunspurger W. et al. Soil nematode abundance and functional group composition at a global scale // Nature. 2019. V. 572(7768). P. 194–198.
Verzeaux J., Hirel B., Dubois F., Lea P.J., Tétu T. Agricultural practices to improve nitrogen use efficiency through the use of arbuscular mycorrhizae: basic and agronomic aspects // Plant Sci. 2017. V. 264. P. 48–56. https://doi.org/10.1016/j.plantsci.2017.08.004
Walters K.E., Martiny J.B.H. Alpha-, beta-, and gamma-diversity of bacteria varies across habitats // Plos one. 2020. V. 15(9). P. e0233872.
Wessén E., Hallin S. Abundance of archaeal and bacterial ammonia oxidizers – Possible bioindicator for soil monitoring // Ecol. Indic. 2011. V. 11. P. 1696–1698. https://doi.org/10.1016/j.ecolind.2011.04.018
Wetzel K., Silva G., Matczinski U., Oehl F., Fester T. Superior differentiation of arbuscular mycorrhizal fungal communities from till and no-till plots by morphological spore identification when compared to T-RFLP // Soil Biol. Biochem. 2014. V. 72. P. 88–96. https://doi.org/10.1016/j.soilbio.2014.01.033
Xu M., Shang H. Contribution of soil respiration to the global carbon equation // J Plant Physiology. 2016. V. 203. P. 16–28. https://doi.org/10.1016/j.jplph.2016.08.007
Xue D., Yao H., Ge D., Cy H. Soil microbial community structure in diverse land use systems: a comparative study using Biolog, DGGE, and PLFA analyses // Pedosphere. 2008. V. 18(5). P. 653–663.
Yadessa G.B., Van Bruggen A.H.C., Ocho F.L. Effects of different soil amendments on bacterial wilt caused by Ralstonia solanacearum and on the yield of tomato // J. Plant Pathology. 2010. P. 439–450.
Yevdokimov I., Larionova A., Blagodatskaya E. Microbial immobilisation of phosphorus in soils exposed to drying-rewetting and freeze-thawing cycles // Biol. Fertil. Soils. 2016. V. 52(5). P. 685–696. https://doi.org/10.1007/s00374-016-1112-x
Zhou Z., Wang C., Luo Y. Meta-analysis of the impacts of global change factors on soil microbial diversity and functionality // Nature Comm. 2020. V. 11(1). P. 1–10.
Дополнительные материалы отсутствуют.