Почвоведение, 2022, № 4, стр. 488-499
Биомасса и функциональное разнообразие почвенных микробных сообществ лесных и пахотных почв (на примере заповедника “Белогорье”)
К. С. Дущанова a, *, Т. Э. Хомутова a, П. А. Украинский b, Н. Н. Каширская a, Ф. Н. Лисецкий b, А. В. Борисов a
a Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская обл., Пущино, ул. Институтская, 2, Россия
b Белгородский государственный национальный исследовательский университет
308015 Белгород, ул. Победы, 85, Россия
* E-mail: kamilla.dushchanova@gmail.com
Поступила в редакцию 26.05.2021
После доработки 29.11.2021
Принята к публикации 30.11.2021
- EDN: CCAAQX
- DOI: 10.31857/S0032180X22040086
Аннотация
Приведены результаты исследования микробной биомассы и функционального разнообразия микробных сообществ лесных почв заповедника “Белогорье” и пахотных почв, расположенных в единых геоморфологических и литологических условиях в катенах, включающих водораздельный участок, среднюю и нижнюю части склона. Проведен анализ содержания углерода суммарной микробной биомассы, углерода биомассы живых клеток по содержанию фосфолипидов и углерода биомассы клеток, дающих респираторный отклик на внесение глюкозы. Дана оценка респираторного отклика почвенного микробного сообщества на внесение разных групп низкомолекулярных органических соединений-индукторов (амино- и карбоновых кислот) методом мультисубстратного тестирования (МСТ). Показано, что сведение леса и распашка ведут к уменьшению суммарной микробной биомассы, биомассы живых клеток и клеток, дающих респираторный отклик на внесение глюкозы. Значения этих показателей были больше в нижней части склона на пахотных участках по сравнению с водораздельным участком и средней частью склона. Функциональное разнообразие микробных сообществ почв естественных и антропогенно-преобразованных экосистем заметно различалось. Распашка привела к существенному снижению способности почвенного микробного сообщества ассимилировать низкомолекулярные органические соединения, использованные в качестве индукторов при МСТ. В наибольшей степени это характерно для аминокислот: аргинина, аланина и глицина (уменьшение в 2.7, 5.4 и 7.1 раза соответственно по сравнению с целинными почвами). Среди карбоновых кислот наиболее заметно сильное сокращение респираторного отклика на внесение янтарной кислоты (8.7 раза). Установлено, что в естественных экосистемах геоморфологическая позиция не оказывает влияния на биомассу микробного сообщества и его функциональное разнообразие, в то время как в пахотных почвах выявлена тенденция к увеличению данных показателей на нижней части склона.
ВВЕДЕНИЕ
Антропогенная деятельность вызывает существенные изменения почвенных микробных сообществ, которые являются важнейшим компонентом экосистем. Наиболее широко используемыми экологическими показателями, характеризующими состояние и разнообразие микробного сообщества почв, являются суммарная микробная биомасса, ее живая часть, биомасса клеток, дающих респираторный отклик на внесение глюкозы [14, 18–20].
Значительная часть микробного сообщества в почвах находится в покоящемся состоянии, поэтому актуальным остается определение углерода суммарной микробной биомассы (C–СМБ) при изучении микробных сообществ почв. Эта биомасса представлена клетками, которые не растут на питательных субстратах, не дают отклика на внесение глюкозы и не разрушаются под действием фумигантов, благодаря наличию органо-минеральных оболочек [8, 10, 11, 30, 41].
Важным показателем, позволяющим понять состояние почвенного микробного сообщества, является содержание углерода живой микробной биомассы, определяемого по количеству фосфолипидов в почвах (C–ФЛ). Фосфолипиды входят в состав клеточных мембран бактерий, актиномицетов, грибов и низших растений, а после гибели клеток быстро разрушаются. Показано, что в клетках микроорганизмов содержание фосфолипидов составляет постоянную величину [34], что позволяет оценить живую микробную биомассу в почвах, в том числе в местообитаниях с очень низким содержанием органического углерода (Сорг). Содержание фосфолипидов может быть выражено в единицах Сорг или численностью клеток [34–36]. Этот показатель широко используется при изучении микробных сообществ почв в различных природных экосистемах [16, 17, 22, 25–27, 33, 48].
Наиболее распространенным и общепринятым показателем состояния почвенного микробного сообщества является биомасса глюкозооткликающихся микроорганизмов, определяемая методом субстрат индуцированного дыхания (C–СИД) [1, 2, 28, 44, 46, 47].
Сопоставление величин C–СМБ, C–ФЛ и C–СИД с содержанием Сорг почвы позволит более полно оценить состояние ее микробного сообщества. Показано, что отношения C–ФЛ/Сорг, C–ФЛ/C–СМБ, C–СИД/Cорг и C–СИД/C–СМБ могут индицировать изменения в функциональном разнообразии микробных сообществ [7, 25, 39, 40]. Данный подход успешно апробирован на разновозрастных погребенных почвах [25, 40].
Под влиянием антропогенной нагрузки помимо количественных показателей микробной биомассы почв может изменяться и функциональное разнообразие почвенного микробного сообщества. Этот аспект функционирования почв в условиях агроценоза недостаточно изучен. Для оценки способности почвенных микроорганизмов ассимилировать различные типы органических соединений используется метод мультисубстратного тестирования. Основа методического подхода заложена в работах С.Н. Виноградского, который рассматривал спектр потребления низкомолекулярных органических соединений почвенным микробным сообществом [3]. Развитием работ в этом направлении стала система BIOLOG [31] и ее отечественная модификация Горленко с соавт. ЭКОЛОГ [5, 6].
В задачи исследования входило выявление особенностей изменения микробной биомассы и ее составляющих, а также микробного функционального разнообразия почвы вдоль катены, включающей водораздельный участок, среднюю и нижнюю части склона, представляющие собой разные зоны нарушения почвенного профиля (эрозия, эрозия + + транзит, аккумуляция соответственно).
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследований. Для работы выбраны темно-серые лесные почвы на территории заповедника “Белогорье”, находящегося в Белгородской области (участок многолетней дубравы “Лес на Ворскле”), и агросерые почвы на пахотном участке. Заповедный и пахотный участки имеют однотипные литологические и геоморфологические условия (рис. 1), что позволяет рассматривать антропогенную деятельность (распашку) как единственный фактор, объясняющий возможные изменения химических свойств этих почв и состояния их микробных сообществ. Район исследования расположен на юго-западном склоне Средне-Русской возвышенности 200–250 м над ур. м. Территорию исследуемого участка “Лес на Ворскле” с трех сторон ограничивают реки Ворскла, Готня и Локня. Климат области умеренно континентальный (среднегодовая температура воздуха составляет +6.0°С, максимальная температура воздуха +40°С; на открытой поверхности пашни – выше +50°С). Минимальная температура воздуха достигает –37°С. Снежный покров лежит 3–4 мес., мощность его в среднем составляет 20–25 см [9]. Преобладающей почвообразующей породой на территории заповедника и прилегающей пашни являются лёссовидные отложения. В почвенном покрове ключевого участка “Лес на Ворскле” преобладают темно-серые лесные почвы (Luvic Retic Greyzemic Phaeozem (Siltic)). Заповедный участок и прилегающие к нему пахотные территории неоднократно исследовались [9, 15, 21].
Рис. 1.
Карта расположения катен на серых лесных пахотных (ПВ – водораздельный участок, ПС – средняя часть склона, ПН – нижняя часть склона) и серых лесных заповедных почв (ЛВ – водораздельный участок, ЛС – средняя часть склона, ЛН – нижняя часть склона). 1 – граница заповедного участка.

Отбор почвенных проб. Почвенные образцы отбирали по катенам участков “лес” и “пашня”. Почвенные разрезы закладывали на склонах южной экспозиции в однотипных литологических условиях, а прикопки (0.5 м, две повторности) – на водораздельном участке, в средней и нижней частях склона. Проводили морфолого-генетическое описание профилей почв. Почвенные образцы отбирали послойно (10 см) до 50 см, удаляли крупные корни и другие растительные остатки, почву высушивали до воздушно-сухого состояния и просеивали через сито с диаметром ячеек 1 мм для физико-химических анализов и 2 мм для микробиологических исследований. Микробиологические анализы проводили только в слое 0–10 см, а физико-химические – во всех отобранных слоях. Для определения микробиологических анализов (C–СМБ, C–ФЛ) использовали почву в воздушно-сухом состоянии, а для проведения МСТ и определения C–СИД почву предварительно увлажняли до 60% ПВ и инкубировали при температуре 22°С в течение суток.
Методы исследований. В образцах определяли содержание органического углерода методом мокрого сжигания по Тюрину (модификация СПбГУ) с окислением концентрированной серной кислотой в термостате при Т = 140°С, содержание карбонатов – ацидометрически, ${\text{р}}{{{\text{Н}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ – потенциометрическим методом, ЕКОст – по методу Бобко–Аскинази (модификации ЦИНАО) гранулометрический состав пипеточным методом [4].
Оценка численности и суммарной биомассы (C‒СМБ) почв включала следующие этапы. Почвенную навеску 3 г размешивали в 90 мл 0.5%-ного раствора пирофосфата натрия, обрабатывали ультразвуком двумя импульсами по 30 с с паузой между ними 30 с [27] с помощью ультразвукового генератора УЗГ 13-0.1/22 при мощности 50 Вт и частоте 22 кГц. Экстракт, содержащий микробные клетки, отделяли от почвенного осадка центрифугированием при 1000 об./мин в течение 30 мин при охлаждении (4°С). К почвенному осадку добавляли 90 мл раствора пирофосфата натрия и все процедуры повторяли. Экстракцию проводили троекратно. Почвенные осадки, полученные из 3 г почвы после трех обработок, доводили до 30 мл и последовательно разводили дистиллированной водой в 100 раз, до разведения 1000 в расчете на 1 г почвы. Экстракты микробной фракции после трех обработок объединяли, доводили до 300 мл и отбирали аликвоты 1 мл для прямого счета. Аликвоты разводили в 10 раз до разведения 1000 в расчете на 1 г почвы. Готовили микропрепараты: 10 мкл окончательного разведения почвенных осадков и экстрактов микробной фракции наносили на предметные стекла, каплю равномерно распределяли по площади 600 мм2. Препараты подсушивали ифламбировали, окрашивали раствором DAPI (5 мкг/мл) в течение 15–20 мин и считали микробные клетки под люминесцентным микроскопом Leica 2000 в 60 полях зрения с площадью 0.02 мм2 (увеличение в 1000 раз). Число клеток на грамм почвы определяли по формуле:
где N – численность клеток в экстрагированной микробной фракции или почвенном осадке из 1 г почвы, а – среднее число клеток в одном поле зрения, 29 857 – число полей зрения в 600 мм2, 100 – число аликвот по 10 мкл в 1 мл, 1000 – окончательное разведение в расчете на 1 г почвы.Полноту экстракции микробной фракции в процентах рассчитывали по формуле:
Экстракты микробной фракции осаждали при 12 000 об./мин. После высушивания при 105°С определяли массу выделенной микробной фракции и содержание в ней органического углерода методом мокрого сжигания со спектрофотометрическим определением остаточного бихромата. Углерод суммарной микробной биомассы рассчитывали по формуле
Углерод живой микробной биомассы рассчитывали по содержанию фосфолипидов, которые присутствуют в мембранах клеток почвенных микроорганизмов (C–ФЛ) [25, 35]. Метод основан на экстракции фосфолипидов из почвенного образца в однофазной смеси (метанол : хлороформ : фосфатный буфер в соотношении объемных долей 1 : 2 : 0.8). К навеске почвы (2 г) приливали однофазную смесь (18, 3 мл), экстрагировали встряхиванием (2 ч при комнатной температуре), осаждали почвенный осадок от супернатантов центрифугированием (15 мин). Полученные супернатанты отбирали, к осадку приливали 5 мл однофазной смеси и снова центрифугировали. К объединенным супернатантам из обоих этапов центрифугирования приливали по 6.2 мл хлороформа и фосфатного буферного раствора для расслаивания. Верхний водный слой, содержащий буферный раствор, удаляли, нижний органический слой, содержащий липиды, в том числе фосфолипиды анализировали дольше. Аликвоту (1 мл) органического слоя переносили в аналитические стаканчики объемом 2 мл и упаривали в токе азота при 34.5°C. Затем для отщепления фосфатных групп от фосфолипидов в стаканчики добавляли насыщенный раствор персульфата калия (900 мкл) и помещали в термостат (98°C) на 4 сут. После этого в каждый стаканчик добавляли молибдат аммония (200 мкл) для взаимодействия с фосфатными группами, затем раствор малахитового зеленого (900 мкл) и анализировали с использованием спекторофотометра.
Углерод микробной биомассы, дающей респираторный отклик на внесение глюкозы (C–СИД) определяли методом субстрат-индуцированного дыхания (VСИД) на газовом хроматографе “Кристаллюкс 4000М” в ЦКП ИФХиБПП РАН. Навески каждого образца почвы (1 г) помещали в пробирки (15 мл) с пластиковыми пробками, инкубировали в течение 12 ч при 22°С, после проветривания, вносили 200 мкл 1%-ного раствора глюкозы и закрывали. Через 4 ч инкубации (22°С) измеряли количество выделившегося СО2 на газовом хроматографе (“Кристаллюкс 4000М” в ЦКП ИФХиБПП РАН). Рассчитывали дыхательную активность микробных сообществ в мкг C‒СО2/(г ч), затем с помощью коэффициента 40.04 пересчитывали дыхательную активность микробных сообществ в мкг С/(г ч) [1, 29].
Функциональное разнообразие микробных сообществ оценивали с помощью мультисубстратного тестирования (МСТ) [5, 6, 12, 13, 37, 43]. Микробное сообщество тестировали на аминокислотах: глицине, аланине, аргинине, гистидине, тирозине и цистеине (L-изомеры) и карбоновых кислотах: аскорбиновой, лимонной, молочной, уксусной, щавелевой, янтарной. Концентрации указанных субстратов соответствовали рекомендованным [32] аминокислотам – 15 мМ (исключение тирозин – 5 мМ), концентрации солей карбоновых кислот варьировали от 20 до 190 мМ (по аниону: лимонная 20 мМ, щавелевая 30 мМ, янтарная 50 мМ, аскорбиновая 100 мМ, молочная 160 мМ, уксусная 190 мМ). Растворы карбоновых кислот и аминокислот доводили до рН 6–7 добавлением 1 н. NaOH или 1 н. НСl. Определение МСТ выполняли аналогично C–СИД [23]. Навески каждого образца почвы (1 г) помещали в пробирки (15 мл) с пластиковыми пробками, инкубировали в течение 12 ч при 22°С, после проветривания, вносили 200 мкл одного из субстратов и закрывали. Через 4 ч инкубации (22°С) измеряли количество выделившегося СО2 на газовом хроматографе (“Кристаллюкс 4000М” в ЦКП ИФХиБПП РАН). Рассчитывали дыхательную активность микробных сообществ в мкг C–СО2/(г ч). Все анализы выполняли в трех повторностях.
Статистическая обработка данных. Все анализы выполняли в 3-кратной повторности. На графиках и в таблицах представлены средние значения ± стандартная ошибка (SE). Статистическую обработку данных проводили с помощью метода главных компонент в программе Statistica 10.
РЕЗУЛЬТАТЫ
Анализ гранулометрического состава почв в катене “лес” показывает существенное увеличение содержания физической глины с глубиной от 20 до 43% (табл. S1 ). Почвы водораздельного участка обогащены фракцией крупной пыли, содержание которой в верхнем слое достигает 47%. Заметно увеличение содержания мелкого песка в почвах средней части склона, в то время как на водораздельном участке и в нижней части склона этот показатель заметно меньше. В средней части склона содержание илистой фракции минимально (от 4 до 13%).
В гранулометрическом составе пахотных почв на водораздельном участке и в средней части склона отмечается некоторое увеличение содержания фракции мелкого песка по сравнению с разрезами на средней и нижней части склона, что возможно связано с литологической неоднородностью почвообразующих пород. Содержание крупной пыли находится на уровне 9–22%, и лишь в нижней части склона заметно некоторое увеличение этого показателя. Содержание ила в верхнем слое варьирует от 4 до 8% и возрастает с глубиной до 18%. Гранулометрический состав пахотных почв близок к лесным аналогам.
Содержание Сорг в профиле почв естественной экосистемы на водораздельном участке и нижней части склона близко (табл. S2). В то же время в средней части склона этот показатель в верхнем слое 0–10 см составляет 1.3%, резко уменьшается вниз по профилю и на глубине 20–30 см не превышает 0.2%. Реакция среды слабокислая, близкая к нейтральной, кроме почв средней части склона, где значения pH более низкие. В этих же почвах емкость катионного обмена заметно меньше. В составе обменных катионов преобладает Ca2+.
В пахотных почвах в нижней части склона заметно увеличение величины pH с глубиной. Содержание Сорг в верхних слоях почвы небольшое, и только в нижнем слое нижней части склона его значения достигают 1%. Емкость катионного обмена на почвах водораздельного участка очень низкая и постепенно увеличивается при движении вниз по склону.
Углерод суммарной микробной биомассы (C–СМБ). В лесных почвах существенно варьирование содержания Сорг в почвах катены, различия в содержании C–СМБ были незначительными и достоверно не различались в почвах различных участков катен (рис. 2).
Рис. 2.
Биомасса микробного сообщества (1 – C–СМБ, 2 – C–ФЛ, 3 – C–СИД, 4 – Сорг в мкг С/г а.с.п.) почв леса и пашни на разных геоморфологических позициях: a – водораздельном участке, b – средней и c – нижней частях склона.
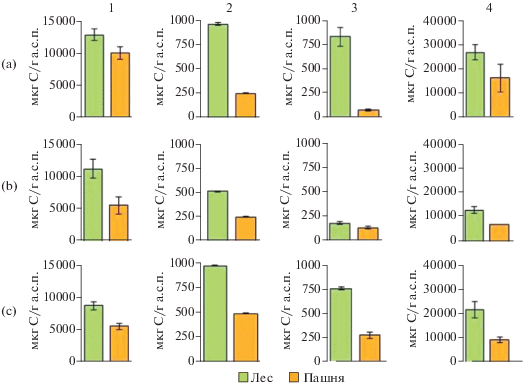
В почвах катены на пашне различия по склону были более заметны. При этом содержание Сорг вследствие распашки уменьшилось в 2 раза, значения C–СМБ сократились в меньшей степени (20–35%). Наибольшее уменьшение (в 2 раза) C‒СМБ зафиксировано в почвах средней части склона.
Содержание углерода живой микробной биомассы (C–ФЛ). По сравнению с указанными выше изменениями C–СМБ содержание углерода живой микробной биомассы в почвах на пашне изменялось более существенно. Так, в пахотных почвах водораздельного участка уменьшение значений C–ФЛ по сравнению с заповедными почвами было в 4 раза в средней части склона и в 2 раза – в нижней.
Содержание углерода микробной биомассы (C‒СИД). Наиболее выражено было уменьшение активной биомассы. Например, на почвах водораздельного участка показатель C–СИД составлял 832 мкг С/г почвы, в то время как на пашне не превышал 100 мкг С/г почвы. В нижней части склона содержание C–СИД пахотного участка (277 мкг С/г почвы) было в 3 раза меньше по сравнению с заповедным участком. В средней части склона подобная тенденция не выявлена.
Таким образом, содержание C–СМБ в почвах естественной экосистемы на всех геоморфологических позициях было больше, чем в почвах пашни. Особенно сильно выделяется C–ФЛ. Это четко видно на почвах водораздельного участка, где этот показатель в 4 раза меньше, чем в почвах естественных экосистем. При этом доля микроорганизмов, дающих респираторный отклик на внесение глюкозы (C–СИД), составляла около 30%. На нижней части склона сохраняется та же закономерность, но с несколько большей долей активных клеток (C–СИД) в пахотных почвах (57%) от всей живой микробной биомассы (C–ФЛ). На средней части склона выявленные различия менее выражены.
Функциональное разнообразие микробных сообществ. Для леса и пашни отклик микробных сообществ на внесение разнообразных субстратов существенно отличался (табл. 1). В почвах катены “лес” в наибольшей степени различались дыхательные отклики на внесение карбоновых кислот (аскорбиновой, молочной, лимонной, янтарной) и аминокислот (глицина, аргинина и аланина) (рис. 3). Респираторный отклик микробного сообщества почвы леса в ответ на внесение аскорбиновой кислоты был наиболее сильным, и в нижней части склона составлял 68 мкг C–СО2/(г ч). Также заметный отклик на внесение аскорбиновой кислоты отмечен в почвах водораздельного участка, он был значительно меньше (28 мкг C–СО2/(г ч)) в центральной части склона. Аналогичная закономерность обнаружена для респираторных откликов на внесение молочной и янтарной кислот.
Таблица 1.
Результаты мультисубстратного тестирования дыхательной активности (мкг/(г ч)) микробных сообществ почв (слой 0–10 см)
| Почва | АК | МК | ЛК | УК | ЩК | ЯК | Гли | Арг | Гис | Ала | Цис | Тир |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| мкг C–СО2/(г ч) | ||||||||||||
| Катена “лес” | ||||||||||||
| Водораздельный участок | 57.7 | 13.2 | 11.9 | 2.5 | 4.8 | 14.0 | 6.2 | 10.2 | 6.3 | 5.9 | 4.0 | 3.4 |
| Средняя часть склона | 28.4 | 7.4 | 16.0 | 2.1 | 4.4 | 2.5 | 2.6 | 3.6 | 3.2 | 3.0 | 3.8 | 2.9 |
| Нижняя часть склона | 68.6 | 11.7 | 9.0 | 1.6 | 4.1 | 15.4 | 9.3 | 5.7 | 5.7 | 15.8 | 3.6 | 3.2 |
| Катена “пашня” | ||||||||||||
| Водораздельный участок | 10.3 | 2.2 | 2.6 | 1.2 | 1.6 | 1.6 | 0.9 | 4.0 | 1.3 | 1.1 | 2.8 | 1.1 |
| Средняя часть склона | 18.7 | 3.8 | 2.7 | 0.8 | 2.5 | 1.9 | 1.7 | 3.8 | 1.9 | 3.0 | 2.2 | 2.3 |
| Нижняя часть склона | 23.5 | 7.5 | 5.6 | 1.8 | 3.2 | 3.2 | 2.6 | 2.1 | 3.5 | 5.5 | 3.7 | 2.7 |
Рис. 3.
Сравнение мультисубстратного тестирования (МСТ) дыхательной активности микробных сообществ (мкг C–СО2/(г ч)) катены “Пашня” и катены “Лес” на: а – водораздельном участке, b – средней и c – нижней частях склона на внесение: 1 – аскорбиновой, 2 – молочной, 3 – лимонной, 4 – янтарной кислот и аминокислот: 5 – глицина, 6 – аргинина и 7 – аланина.
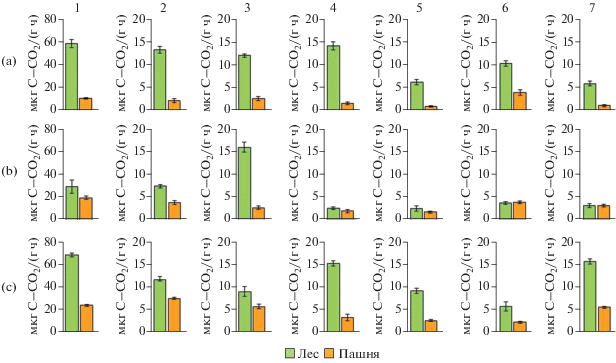
Отклик на внесение уксусной и щавелевой кислот в почвах всех выбранных геоморфологических позиций катены “лес” был минимальным и достоверно не отличался.
В отличие от карбоновых кислот респираторные отклики микробного сообщества почв катены “лес” на внесение аминокислот были, в целом, низкие. Можно отметить, что на разных участках катены отклики на внесение глицина, гистидина, аргинина и аланина были однотипны с ответом на внесение аскорбиновой кислоты.
В пахотных почвах максимальный респираторный отклик микробного сообщества на внесение аскорбиновой кислоты был в нижней части склона (23/5 мкг C–СО2/(г ч)). В средней части склона этот показатель несколько меньше, а на водораздельном участке составлял 10 мкг C–СО2/(г ч). Респираторный отклик на внесение других карбоновых кислот, в целом, был аналогичным: наименьший на водораздельном участке, несколько больше в средней части и наибольший в нижней части склона.
В почве водораздельного участка выявлен наиболее заметный респираторный отклик на внесении аргинина (4 мкг C–СО2/(г ч)) с уменьшением вниз по склону до 2 мкг C–СО2/(г ч). Обратная закономерность выявлена при внесении аланина (5.5 мкг C–СО2/(г ч) в нижней части склона и уменьшение его до 1.1 мкг C–СО2/(г ч) на водораздельном участке).
При сравнении респираторного отклика микробного сообщества на внесение карбоновых кислот (аскорбиновой, молочной, лимонной, янтарной) и аминокислот (глицина, аргинина и аланина) можно отметить во всех случаях более заметный отклик в катене “лес” по сравнению с катеной “пашня”. Дыхательный отклик на аскорбиновую кислоту был самым значимым. В нижней точке склона катены “лес” он составлял 69 мкг C–СО2/(г ч) и превышал значения для катены “пашня” на 45 мкг C–СО2/(г ч). Аналогичная ситуация выявлена на водораздельном участке.
Дыхательные отклики микробного сообщества на внесение наиболее значимых субстратов на водораздельном участке и в нижней части склона катены “лес” значительно превышали таковые на аналогичных элементах рельефа катены “пашня”. Респираторный отклик микробного сообщества на янтарную кислоту, глицин, аргинин и аланин в средней части склона обеих катен достоверно не различался.
Статистический анализ биомассы и функционального разнообразия микробных сообществ лесных целинных и пахотных почв представлен на рис. 4. В результате распашки уменьшение респираторных откликов на внесение низкомолекулярных соединений было неодинаково на различных элементах рельефа (рис. 4, I). На водораздельном участке в пахотной почве дыхательный отклик на внесение глюкозы был в 8 раз меньше, чем в целинной. Респираторные отклики на внесение аланина, глицина, гистидина, янтарной, аскорбиновой и молочной кислот здесь различались в 5–9 раз, максимальное отличие отмечено для янтарной кислоты. Различия откликов на внесение аргинина, тирозина, цистеина, щавелевой, лимонной и уксусной кислот составляли 1.5–4.5 раза; наименьшее отличие выявлено при внесении цистеина.
Рис. 4.
Статистический анализ биомассы и функционального разнообразия микробных сообществ лесных целинных и пахотных почв, приуроченных к различным элементам рельефа, по методу главных компонент: координаты количественных характеристик состояния микробных сообществ на факторной плоскости, обусловленные величиной и направленностью взаимной корреляции (a); соответствующее расположение объектов исследования на факторной плоскости (b). I – респираторные отклики на внесение аминокислот и карбоновых кислот в качестве показателей функционального разнообразия микробного сообщества; II – респираторные отклики, коррелирующие с микробной биомассой, содержанием органического углерода и емкостью катионного обмена лесных целинных и пахотных почв; III – соотношения респираторных откликов, отражающие расположение почв на различных элементах рельефа.

Респираторные отклики на внесение глюкозы в лесных и пахотных почвах на одних и тех же участках склона практически не различались. В почвах средней части склона значения дыхательных откликов на внесение цистеина, уксусной, щавелевой, молочной и аскорбиновой кислот отличались в 1.5–2.5 раза, а на внесение лимонной кислоты – в 6 раз. При этом отклики на внесение глицина, аргинина, аланина и янтарной кислоты в почвах средней части склона достоверно не различались. В нижней части склона наибольшие различия (3–5 раз) выявлены при внесении глицина, аргинина, аланина, аскорбиновой и янтарной кислот.
На рис. 4, II представлены наиболее значимые изменения респираторных откликов на внесение низкомолекулярных соединений в пахотных почвах по сравнению с целинными почвами. С живой и активной микробной биомассой наиболее тесно коррелировал отклик на внесение янтарной кислоты (K = 0.96–0.98). Отклик на внесение аланина показал близкую корреляцию с долей живой микробной биомассы (K = 0.89) и долей активной микробной биомассы (K = 0.90) в суммарной микробной биомассе. Отклик на внесение глицина коррелировал с емкостью катионного обмена почв (K = 0.98), а отклик на внесение аргинина – с содержанием органического углерода (K = 0.88) и суммарной микробной биомассой (K = 0.70). Содержание органического углерода и суммарная микробная биомасса в пахотных почвах на всех элементах рельефа уменьшались равномерно в 1.3–2.3 раза. При этом уменьшение живой и активной микробной биомассы на водораздельном участке достигало 4 и 10 раз, а на склоне – 1.5–3 раза. Наименьшие различия выявлены в средней части склона, где величины C–ФЛ и C–СМБ в верхнем слое целинной почвы были минимальными.
Ранее для выявления присутствия органических веществ в серых лесных и каштановых почвах предложено использовать соотношения дыхательных откликов на внесение аминокислот и карбоновых кислот [23]. По соотношениям респираторных откликов на внесение глицина и янтарной кислоты, аланина и аскорбиновой кислоты, аргинина и аскорбиновой кислоты, почвы заметно различались на разных элементах рельефа (рис. 4, III). При этом на одних и тех же элементах рельефа здесь было выявлено максимальное сходство между пахотными и целинными почвами.
Таким образом, во всех точках катены (водораздельный участок, средняя и нижняя части склона) в почвах естественной экосистемы респираторный отклик почвенного микробного сообщества на внесение низкомолекулярных соединений был значительно больше, чем в пахотных почвах. Следовательно, антропогенная деятельность приводила к резкому уменьшению способности микробного сообщества ассимилировать карбоновые кислоты и аминокислоты. Особенно сильно сокращение функционального разнообразия проявляется на почвах водораздельного участка, где эрозия наиболее сильная. Например, уменьшение респираторного отклика на внесение аскорбиновой кислоты на пашне на водораздельном участке было в 5–6 раз сильнее, чем в почвах естественных экосистем на тех же геоморфологических позициях. Близкие закономерности получены и для других карбоновых кислот.
Иная ситуация выявлена на средней части склона исследованных катен. Выявленные для водораздельных участков закономерности респираторного отклика в данном случае имели место только при внесении в почву лимонной кислоты. Для молочной и аскорбиновой кислот различия не так явно выражены, а в случае с янтарной кислотой различия пахотной и естественной экосистем недостоверны.
В почвах нижней части склона катен способность микробного сообщества усваивать низкомолекулярные соединения заметно больше, что связано с накоплением гумусированного материала в нижней части склона.
Анализируя отклики микробного сообщества на внесение аминокислот, можно заметить ту же закономерность: значительно бóльшие отклики в почвах естественных экосистем. Но при этом на разных геоморфологических позициях респираторный отклик почв микробного сообщества на внесение данных субстратов в естественных ненарушенных почвах неодинаковый. Например, на водораздельных участках респираторный отклик на внесение аргинина был выше, чем в почвах нижней части склона, в то время как для глицина и аланина выявлена обратная закономерность. При этом в средней части склона респираторные отклики на внесение аминокислот (и янтарной кислоты) в почвах естественных и антропогенно-преобразованных экосистем были незначительными и достоверно не различались. Природу этого феномена мы пока не можем объяснить.
ЗАКЛЮЧЕНИЕ
Суммарная биомасса (C–СМБ), биомасса живых клеток (C–ФЛ) и клеток, дающих респираторный отклик на внесение глюкозы (C–СИД), в почвах леса были больше, чем в пахотных аналогах. В антропогенно-преобразованных почвах заметно уменьшение величины C–СИД, менее заметно C–ФЛ, и минимальные различия выявлены для C–СМБ. Для пахотных почв характерна тенденция увеличения показателей C–СИД и C–ФЛ в нижней части склона.
Функциональное разнообразие микробных сообществ почв естественных и антропогенно-преобразованных экосистем заметно различалось. Распашка привела к существенному уменьшению способности почвенного микробного сообщества ассимилировать низкомолекулярные органические соединения. В пахотных почвах способность микробного сообщества усваивать аргинин в 2.7 раза, аланин – в 5.4 раза меньше, чем в лесных почвах. Наиболее сильное уменьшение отмечено при внесении глицина и янтарной кислоты, в 7.1 и 8.7 раза соответственно.
В естественных экосистемах геоморфологическая позиция не оказывает влияния на биомассу почвенного микробного сообщества и его функциональное разнообразие. В пахотных почвах выявлено увеличение показателей (C–СМБ, Сорг, C–ФЛ) в нижней части склона. Отмечена тенденция некоторого уменьшения биомассы и функционального разнообразия в средней части склона в транзитной геоморфологической позиции в обоих катенах.
Список литературы
Ананьева Н.Д., Благодатская Е.В., Орлинский Д.Б., Мякшина Т.Н. Методические аспекты определения скорости субстрат-индуцированного дыхания почвенных микроорганизмов // Почвоведение. 1993. № 11. С. 72–77.
Ананьева Н.Д., Сусьян Е.А., Гавриленко Е.Г. Особенности определения углерода микробной биомассы методом субстрат-индуцированного дыхания // Почвоведение. 2011. № 11. С. 1327–1333.
Виноградский С.Н. Микробиология почвы. Проблемы и методы. Пятьдесят лет исследований. М., 1952.
Воробьева Л.А. Теория и практика химического анализа почв. М.: ГЕОС. 2006. С. 400.
Горленко М.В., Кожевин П.А. Дифференциация почвенных микробных сообществ с помощью мультисубстратного тестирования // Микробиология. 1994. Т. 63. № 2. С. 289–293.
Горленко М.В., Кожевин П.А. Мультисубстратное тестирование природных микробных сообществ. М.: МАКСПресс, 2005. 88 с.
Демкин В.А., Золотарева Б.Н., Демкина Т.С., Хомутова Т.Э., Каширская Н.Н., Ельцов М.В., Удальцов С.Н. Динамика свойств степных палеопочв сарматского времени (II в. до н. э.–IV в. н. э.) в связи с вековой изменчивостью увлажненности климата // Почвоведение. 2012. № 2. С. 142–155.
Демкина Т.С., Хомутова Т.Э., Борисов А.В., Демкин В.А. Микробиологические и молекулярно-генетические исследования подкурганных палеопочв Нижнего Поволжья // Проблемы археологии Нижнего Поволжья. Волгоград: Изд-во ВолГУ, 2004. С. 338–343.
Касаткина Г.А., Федорова Н.Н., Русаков А.В. Почвы и почвенный покров заповедника “Белогорье” // Вестник СПбГУ. 2012. Вып. 1. Сер. 3. С. 121–138.
Каширская Н.Н., Хомутова Т.Э., Демкина Т.С., Демкин В.А. Микробная биомасса подкурганных и современных почв степной зоны Нижнего Поволжья // Почвоведение. 2009. № 5. С. 581–587.
Каширская Н.Н., Хомутова Т.Э., Чернышева Е.В., Ельцов М.В., Демкин В.А. Численность и суммарная биомасса микробных сообществ каштановых почв и солонцов сухостепной зоны Нижнего Поволжья // Почвоведение. 2015. № 3. С. 337–346.
Кожевин П.А., Полянская Л.M., Звягинцев Д.Г. Динамика развития различных микроорганизмов в почве // Микробиология. 1979. Т. 48. Вып. 3. С. 490–494.
Круглов Ю.В. Микробное сообщество почвы: физиологическое разнообразие и методы исследования // Сельскохозяйственная биология. 2016. Т. 51. № 1.
Лысак Л.В., Лапыгина Е.В. Разнообразие бактериальных сообществ городских почв // Почвоведение. 2018. № 9. С. 1108–1114.
Мостовая А.С., Курганова И.Н., Лопес де Гереню В.О., Хохлова О.С., Русаков А.В., Шаповалов А.С. Изменение микробиологической активности серых лесных почв в процессе естественного лесовосстановления // Вестник Воронежского гос. ун-та. 2015. Сер. Химия. Биология. Фармация. № 2. С. 64–72.
Никитин Д.А., Лысак Л.В., Мергелов Н.С., Долгих А.В. Микробная биомасса и биологическая активность почв и почвоподобных тел береговых оазисов Антарктиды // Почвоведение. 2017. № 9. С. 1122–1133.
Никитин Д.А., Лысак Л.В., Мергелов Н.С., Долгих А.В., Зазовская Э.П., Горячкин С.В. Микробная биомасса, запасы углерода и эмиссия СО2 в почвах Земли Франца-Иосифа: высокоарктические тундры или полярные пустыни? // Почвоведение. 2020. № 4. С. 444–462.
Роговая С.В., Елсукова Е.Ю., Ананьева Н.Д. Микробный компонент почв и его дыхательная активность в хвойных лесах северо-западного Приладожья // Вестник Санкт-Петербургского ун-та. Науки о Земле. 2016. Сер. 7. № 3. С. 129–137. https://doi.org/10.21638/11701/spbu07.2016.310
Сушко С.В., Ананьева Н.Д., Иващенко К.В., Васенев В.И., Саржанов Д.А. Микробное дыхание почвы в полевых и лабораторных условиях // Агрофизика. 2016. № 4. С. 17–23.
Сушко С.В., Ананьева Н.Д., Иващенко К.В., Кудеяров В.Н. Эмиссия СО2, микробная биомасса и базальное дыхание чернозема при различном землепользовании // Почвоведение. 2019. № 9. С. 1081–1091.
Счастная Л.С., Касаткина Г.А. Почвенно-географические исследования в заповеднике “Лес на Ворскле” – “Белогорье” // Вестник. C.-Пб. ун-та. Сер. 3. Биология. 2006. Вып. 1. С. 81–88.
Хабибуллина А.Р., Вдовина Т.В., Сироткин А.С., Тр-ёгл Й., Бровдыова Т., Куран П. Анализ микробных фосфолипидов в процессах биомониторинга состояния почв // Известия вузов. Прикладная химия и биотехнология. 2019. Т. 9. № 1. С. 44–52.
Хомутова Т.Э., Дущанова К.С., Смирнов В.Э., Борисов А.В. Сукцессия микробного сообщества серой лесной почвы при разложении различных органических соединений // Почвоведение. 2019. № 8. С. 966–973.
Хомутова Т.Э., Демкина Т.С., Демкин В.А. Оценка суммарной и активной микробной биомассы разновозрастных подкурганных палеопочв // Микробиология. 2004. Т. 73. № 2. С. 241–247.
Хомутова Т.Э., Демкина Т.С., Борисов А.В., Шишлина Н.И. Состояние микробных сообществ подкурганных палеопочв пустынно-степной зоны эпохи средней бронзы (XXVII–XXVI вв. до н. э.) в связи с динамикой увлажненности климата // Почвоведение. 2017. № 2. С. 239–248.
Хомутова Т.Э., Демкин В.А. Оценка биомассы микробных сообществ почв сухих степей по содержанию в них фосфолипидов // Почвоведение. 2011. № 6. С. 748–754.
Хомутова Т.Э., Каширская Н.Н., Демкин В.А. Оценка живой и суммарной биомассы микробных сообществ современной каштановой почвы и подкурганных палеопочв // Почвоведение. 2011. № 12. С. 1496–1503.
Ananyeva N.D., Rogovaya S.V., Ivashchenko K.V., Vasenev V.I., Sarzhanov D.A., Ryzhkov O.V., Kudeyarov V.N. Carbon dioxide emission and soil microbial respiration activity of Chernozems under anthropogenic transformation of terrestrial ecosystems // Eur. J. Soil Sci. 2016. T. 5 № 2. C. 146–154. https://doi.org/10.18393/ejss.2016.2.146-154
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. № 3. P. 215–221.
Bargali K., Manra V., Padalia K., Bargali S.S., Upadhyay V.P. Effect of vegetation type and season on microbial biomass carbon in Central Himalayan forest soils, India // Catena. 2018. V. 171. P. 125–135. https://doi.org/10.1016/j.catena.2018.07.001
Garland J.L., Mills A.L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community level sole-carbon-source utilization // Appl. Environ. Microbiol. 1991. V. 57. P. 2351–2359.
Degens B.P., Harris J.A. Development of physiological approach to measuring the catabolic diversity of soil microbial communities // Soil Biol. Biochem. 1997. V. 29. P. 1309–1320.
Dippold M.A., Kuzyakov Y. Direct incorporation of fatty acids into microbial phospholipids in soils: position-specific labeling tells the story // Geochim. Cosmochim. Acta. 2016. V. 174. P. 211–221. https://doi.org/10.1016/j.gca.2015.10.032
Findlay R.H., King G.M., Watling L. Efficacy of phospholipid analysis in determining microbial biomass in sediments // Appl. Microbiol. 1989. V. 55. № 11. P. 2888–2893.
Findlay R. The use of phospholipid fatty acids to determine microbial community structure // Molecular Microbial Ecology Manual. 1996. 4. V. 1. P. 1–17.
Frostegard A., Tunlid A., Baath E. Microbial biomass measured at total lipid phosphate in soils of different organic content // J. Microbiological Methods. 1991. V. 14. P. 151–163.
Ge Z., Du H., Gao Y., Qiu W. Analysis on metabolic functions of stored rice microbial communities by BIOLOG ECO microplates // Frontiers in microbiology. 2018. V. 9. P. 1375. https://doi.org/10.3389/fmicb.2018.01375
Khomutova T., Kashirskaya N., Demkina T., Kuznet-sova T., Fornasier F., Shishlina N., Borisov A. Precipitation pattern during warm and cold periods in the Bronze Age (around 4.5–3.8 ka BP) in the desert steppes of Russia: Soil-microbiological approach for palaeoenvironmental reconstruction // Quarter. Int. 2019. P. 84–94. https://doi.org/10.1016/j.quaint.2019.02.013
Khomutova T.E., Demkina T.S., Borisov A.V., Kashirskaya N.N., Yeltsov M.V., Demkin V.A. An assessment of changes in properties of steppe kurgan paleosoils in relation to prevailing climates over recent millennia // Quarter. Res. 2007. V. 67. № 3. P. 328–336.
Khomutova T.E., Demkina T.S., Demkin V.A. The state of microbial communities in buried paleosols in relation to prevailing climates in steppes of the Lower Volga region // Quarter. Int. 2014. V. 324. P. 115–123.
Khomutova T.E., Kashirskaya N.N., Demkina T.S., Borisov A.V., Stretovich I.V., Demkin V.A. Microbial biomass in paleosols under burial mounds as related to changes in climatic conditions in the desert-steppe zone // Eurasian Soil Science. 2006. V. 39. Suppl. 1. P. 112–117.
McDaniel M.D., Grandy A.S. Soil microbial biomass and function are altered by 12 years of crop rotation // Soil. 2016. V. 2. № 4. P. 583–599. https://doi.org/10.5194/soil-2-583-2016
Rutgers M., Wouterse M., Drost S.M., Breure A.M., Mulder C., Stone D., Bloem J. Monitoring soil bacteria with community-level physiological profiles using Biolog™ ECO-plates in the Netherlands and Europe // Appl. Soil Ecol. 2016. № 97. C. 23–35. https://doi.org/10.1016/j.apsoil.2015.06.007
Sawada K., Funakawa S., Kosaki T. Short-term respiration responses to drying–rewetting in soils from different climatic and land use conditions // Applied soil ecology. 2016. V. 103. P. 13–21. https://doi.org/10.1016/j.apsoil.2016.02.010
Singh J.S., Gupta V.K. Soil microbial biomass: a key soil driver in management of ecosystem functioning // Sci. Total Environ. 2018. V. 634. P. 497–500. https://doi.org/10.1016/j.scitotenv.2018.03.373
Sradnick A., Oltmanns M., Raupp J., Joergensen R.G. Microbial biomass and activity down the soil profile after long-term addition of farmyard manure to a sandy soil // Org. Agriculture. 2018. V. 8. № 1. P. 29–38.
Sushko S., Ananyeva N., Ivashchenko K., Vasenev V., Kudeyarov V. Soil CO2 emission, microbial biomass and microbial respiration of woody and grassy locations in Moscow (Russia) // J. Soils Sediments. 2019. V. 19. P. 3217–3225. https://doi.org/10.1007/s11368-018-2151-8
Zhang Y., Zheng N., Wang J., Yao H., Qiu Q., Ch-apman S.J. High turnover rate of free phospholipids in soil confirms the classic hypothesis of PLFA methodology // Soil Biol. Biochem. 2019. V. 135. P. 323–330. https://doi.org/10.1016/j.soilbio.2019.05.023
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Гранулометрический состав почв.
Таблица S2. Химические свойства почв.


