Почвоведение, 2022, № 5, стр. 556-570
Комплексный мониторинг окружающей среды около медно-никелевого предприятия на Кольском полуострове
Г. М. Кашулина *
Полярно-альпийский ботанический сад-институт КНЦ РАН
184209 Мурманская обл., Апатиты, ул. Ферсмана, 18а, Россия
* E-mail: galina.kashulina@gmail.com
Поступила в редакцию 24.11.2021
После доработки 13.12.2021
Принята к публикации 30.12.2021
- EDN: YMIYMT
- DOI: 10.31857/S0032180X22050021
Аннотация
На основе результатов комплексного мониторинга в ближайших окрестностях одного из наиболее крупных на севере Европы источников выбросов SO2 и тяжелых металлов проведено сравнение современных уровней загрязнения основных компонентов окружающей среды: атмосферных осадков, почв и семи видов дикорастущих растений. Несмотря на значительное сокращение количества выбросов в течение последних 20 лет, уровень загрязнения окружающей среды в локальной зоне в 2001–2011 гг. оставался экстремально высоким: превышение над фоном концентрации SO2 в воздухе составляло десятки–сотни раз, концентрации Ni и Cu в снеге – тысячи–десятки тысяч раз, концентрации Ni и Cu в верхнем органогенном горизонте подзолов (Podzols) – сотни–тысячи раз, концентрации Ni и Cu в листьях растений – десятки–сотни раз. При повышенных поступлениях с атмосферными осадками концентрации Zn и Mn в почвах остаются на близком к фону уровне, а растения испытывают острый дефицит этих важных микроэлементов. Это обусловлено прекращением потребления их растениями, удерживающими эти элементы в экосистемах. Ближайшие окрестности медно-никелевого индустриального комплекса представляют тот редкий случай антропогенного воздействия, когда его интенсивность и длительность сопровождается серьезными повреждениями растительности, вплоть до полного исчезновения, что, в свою очередь, оборачивается целым комплексом дополнительных к экстремальному загрязнению негативных экологических факторов: нарушением водного режима экосистем и ландшафтов, изменением микроклимата, деградацией почв с изменением их базовых свойств и морфологии, количественными и качественными изменениями биологического круговорота.
ВВЕДЕНИЕ
Наблюдение за состоянием окружающей среды промышленно развитых регионов является одной из важнейших современных экологических задач. На севере Европы одним из наиболее мощных источников выбросов SO2 и тяжелых металлов (ТМ) является медно-никелевый комбинат “Североникель” (ныне площадка Мончегорск КГМК), расположенный в центре Кольского полуострова. Длительное воздействие выбросов этого предприятия сопровождалось не только высоким уровнем химического загрязнения всех поверхностных компонентов окружающей среды [3, 4, 10, 13, 17, 35, 36, 40, 41], но и серьезными повреждениями экосистем [10, 18, 19, 22, 31, 41]. В середине 1990-х, загрязнение почв Ni и Cu от этого источника прослеживалось на расстоянии до 300 км, их концентрации в эпицентре выбросов превышали фоновые значения в 600 раз [3, 36], а территория в радиусе 15 км была отнесена к зоне полного повреждения экосистем [41].
Несмотря на хорошую изученность экологического состояния окружающей среды в регионе, локальная зона медно-никелевого комбината “Североникель” продолжала привлекать внимание по нескольким причинам: слабая изученность наиболее загрязненной и поврежденной территории в ближайших окрестностях от предприятия; значительное варьирование степени повреждения экосистем (от отсутствия только наиболее чувствительных к загрязнению компонентов – мхов и лишайников до полного разрушения); существенное уменьшение объема выбросов в связи с частичной реконструкцией предприятия в 1990-х гг. (http://www.kolagmk.ru) и начало восстановления экосистем [18, 19]. В 2001 г. в локальной зоне воздействия комбината “Североникель” был организован комплексный экологический мониторинг [4, 6, 8, 9, 30]. Методические особенности организованного мониторинга были обусловлены спецификой источника выбросов (большим набором разнообразного спектра действия выбрасываемых компонентов (SO2, Ni, Cu, Al, As, Bi, Ca, Cd, Co, Cr, Fe, Hg, Mg, Mn, Pb, Sb, Sc, Tl, V, Zn и др.) [36, 40], большими объемами выбросов [http://www.kolagmk.ru], длительностью (более 70 лет) воздействия), а также значительным повреждением экосистем [10, 18, 19, 31, 41] и появлением негативных косвенных факторов за счет разрушения растительности [31]. Из-за сложного состава выбросов, интенсивности и длительности воздействия, а также высокой чувствительности северо-таежных экосистем в локальной зоне изменились не только свойства основных компонентов окружающей среды, но и структура и функционирование экосистем и ландшафтов. Поэтому организованный мониторинг имел комплексный характер, и исследованиями были охвачены все основные природные среды. Из-за большого объема полученных результатов они были опубликованы в серии статей, посвященных отдельным средам: атмосферным осадкам [28], почвам [4–8] и растениям [9]. Данная статья представляет обзор всего комплекса проведенных исследований, чтобы, по возможности, показать более полный спектр негативных экологических последствий прямого и косвенного (через разрушение растительности) воздействия длительного экстремального загрязнения выбросами комбината “Североникель”.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения комплексного мониторинга в 2001 г. было заложено 20 стационарных площадок, организованных в 6 катен (I, II, IIA, III, IV и V) и расположенных на расстоянии от 1 до 17 км в разных направлениях от комбината “Североникель” (табл. 1). Катены и площадки выбирались таким образом, чтобы они значительно различались по состоянию экосистем. Регулярные наблюдения на площадках велись в 2001, 2002 и 2005–2011 гг. в 20-х числах августа. На отдельных площадках по некоторым параметрам наблюдения продолжаются по настоящее время.
Таблица 1.
Удаленность площадок мониторинга от источника выбросов, медиана концентрации Ni в верхнем органогенном горизонте почв, а также состав древесного и напочвенного яруса
| Площадка | Расстояние от источника, км |
Ni в гор. О, мг/кг | Древесный ярус | Напочвенный покров |
|---|---|---|---|---|
| I-1 | 17.2 | 1270 | Редкие молодые сосны | Техногенная пустошь |
| I-2 | 17.1 | 1758 | Редкие молодые сосны | Редкие кустарнички |
| I-3 | 17.1 | 1434 | Отсутствует | Осоково-пушицевое низинное болото |
| II-1 | 7.9 | 6830 | Редкие кустистые березы | Техногенная пустошь |
| II-2 | 7.7 | 7002 | Редкие кустистые березы | Редкие кустарнички |
| II-3 | 7.6 | 10 250 | Отсутствует | Пушицевое низинное болото |
| IIА-1 | 11.5 | 1873 | Сосны молодняк | Единичные кустарнички |
| IIА-2 | 11.5 | 834 | Редкие молодые сосны | Редкие кустарнички |
| IIА-3 | 11.3 | 3993 | Отсутствует | Пушицевое низинное болото |
| III-2 | 7.6 | 1781 | Редкие молодые сосны | Техногенная пустошь |
| III-4 | 7.8 | 2754 | Отсутствует | Осоковое низинное болото |
| IV-1 | 3.2 | Нет | Техногенная пустошь | Техногенная пустошь |
| IV-2 | 3.3 | 10 274 | Единичные сосны и березы | Техногенная пустошь |
| IV-3 | 3.4 | 6458 | Отсутствует | Пушицевое низинное болото |
| V-1 | 4.2 | 1081 | Техногенная пустошь | Техногенная пустошь |
| V-2 | 3.1 | 3417 | Ель с березой | Черника |
| V-3 | 2.5 | 2204 | Густой молодой березняк | Кустарнички |
| V-4 | 1 | 2939 | Отсутствует | Пушицевое низинное болото |
Исследуемые среды: суммарные летние осадки на высоте 1.5 м, снежный покров в конце марта [28], основные горизонты почв из индивидуального разреза при базовом обследовании в 2001 г. [5, 6, 8], смешанные образцы слоя 0–3 см верхнего генетического горизонта почв [4, 6]; смешанные образцы листьев/хвои семи видов растений: березы (Betula pubescens Ehrh.); ивы (Salix sp.), сосны (Pinus friesiana Wich.), ели (Picea obovata Ledeb.), черники (Vaccinium myrtillus L.), брусники (Vaccinium vitis-idaea L.); вороники (Empetrum hermaphroditum (Lange) Hager) [9].
Определяемые параметры. В образцах основных горизонтов из индивидуальных разрезов определяли гранулометрический состав, валовой состав (SiO2, Al2O3, Fe2O3, TiO2, CaO, MgO, P2O5, MnO, K2O, Na2O), физико-химические свойства (рН солевой и водной вытяжек, гидролитическую кислотность, обменные Ca и Mg, емкость катионного обмена (ЕКО), степень насыщенности почвенного поглощающего комплекса (ППК) основаниями) [6], содержание и состав органического вещества по Тюрину в модификации Пономаревой и Плотниковой [8] и валовые (разложение смесью HF и HNO3) содержания Ni, Сd, Cu, Co, Mn, Pb и Zn [5]. В смешанных образцах поверхностных горизонтов определяли физико-химические свойства [6] и кислоторастворимые (разложение концентрированной HNO3) формы Ni, Cu, Co, Mn и Zn [4]. В суммарных пробах летних атмосферных осадков и талой снеговой воде определяли основные катионы и анионы, а также Ni, Сd, Cu, Co, Mn, Pb и Zn в растворенной и твердой (осадок на фильтре) формах [31]. В листьях/хвое растений определяли зольные элементы (Si, Al, Fe, Ca, Mg, P, Mn, K), а также Ni, Сd, Cu, Co, Mn, Pb и Zn (разложение концентрированной HNO3) [9].
В системе мониторинга не было собственных фоновых участков. Хорошая изученность региона позволила использовать имеющиеся данные для характеристики естественных уровней всех определенных показателей.
Обработка данных включала определение основных статистических параметров распределения всех исследованных характеристик с использованием Microsoft Excel 2010. Для оценки достоверности различий между наборами данных использовали U‑критерий Манна–Уитни (http:// www.psychol_ok.ru/statistics/mann_whitney).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Разные компоненты выбросов комбината “Североникель” обладают разными химическими свойствами, по-разному ведут себя в окружающей среде и оказывают различное воздействие на окружающую среду.
SO2 – основной компонент выбросов. Объемы его выбросов достигли максимума – более 250 тыс. т/год к середине 1980-х гг. После частичной реконструкции предприятия выбросы SO2 начали сокращаться и к 2001 г. (начало мониторинга) уменьшились до 43.5, к 2011 г. – до 31.3 тыс. т/год (http://www.kolagmk.ru). В начале 1990-х средние за месяц концентрации SO2 в воздухе около медно-никелевых предприятий могли превышать 80, средние за сутки – 1000, а средние за час – 3000 мкг/м3 [29]. Средняя смоделированная концентрация SO2 в радиусе 15 км вокруг комбината “Североникель” с полностью поврежденными экосистемами в 1995 г. превышала 40 мкг/м3 [41].
За время проведения исследований (2001–2011 гг.) концентрация SO2 в воздухе локальной зоны оставалась повышенной. Согласно официальным данным [1], максимальная разовая концентрация SO2 в ближайшем к площадкам мониторинга населенном пункте г. Мончегорск (4 км на ССВ от источника) превышала ПДК – 500 мкг/м3 [ГН 2.1.6.3492-17] в 1–2% случаев, превышения среднесуточных ПДК (50 мкг/м3) не отмечено. Известно, что в воздухе наиболее чистой территории на Севере Финляндии – районе Палласа – средняя концентрация SO2 составляет менее 1 мкг/м3 [20], а концентрация 2–4 мкг/м3 уже вызывает изменения в составе эпифитных лишайников и микроскопические изменения в структуре хвои сосны [22].
Несмотря на высокие объемы выбросов SO2, подкисление атмосферных осадков и почв не было признано международными экспертами серьезной экологической проблемой в регионе [22]. Это обусловлено незначительным увеличением концентрации сульфат-аниона в атмосферных осадках около источника выбросов из-за медленного протекания реакции окисления SO2 до аниона сильной минеральной кислоты ${\text{SO}}_{4}^{{2 - }}$ и наличия достаточного количества основных катионов в выбросах для его нейтрализации [30].
На мониторинговых площадках в 2001–2011 гг. (рис. 1) медиана концентрации ${\text{SO}}_{4}^{{2 - }}$ в талой снеговой воде на самой удаленной пл. I-1 превышала фоновые значения (0.73 мг/л, [28]) в 2.6 раза, на самой загрязненной пл. IV-2 – в 4 раза. При этом увеличение содержания суммы основных катионов в снеговой воде на площадках мониторинга в эквивалентном выражении было в 2–3 раза больше, чем ${\text{SO}}_{4}^{{2 - }}.$ В результате кислотность талой снеговой воды на всех площадках мониторинга была меньше по сравнению с фоном (рН 4.6 [28]): медиана pH на пл. I-1 составила 5.2, на пл. IV-2 – 5.7.
Рис. 1.
Показатели кислотного состояния атмосферных осадков на некоторых площадках мониторинга (I-1–V-2) в локальной зоне воздействия выбросов комбината “Североникель” и в фоновых условиях (Фон): pH талой снеговой воды (а), pH дождевой воды (b), соотношение концентраций ${\text{SO}}_{4}^{{2 - }}$ и суммы основных катионов (Ca2+, Mg2+, K+, Na+) в талой снеговой воде (c) и в дождевой воде (d). Данные на частях рисунка (а) и (b) представлены в виде диаграммы “ящик с усами”, где границами ящика служат первый и третий квартили, линия в середине ящика – медиана, длина усов – пределы 1.5 межквартильного размаха, кружки – выбросы, выходящие за пределы 1.5 межквартильного размаха.
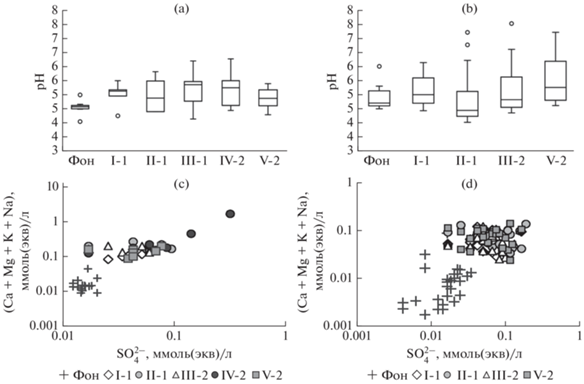
Медиана концентрации ${\text{SO}}_{4}^{{2 - }}$ в дождевой воде на самой удаленной пл. I-1 превышала фоновые значения (0.017 ммоль(экв)/л, [28]) в 3 раза, на пл. II-1 (на пл. IV-2, дождевые осадки не отбирали) – в 4.5 раза. Превышение суммы Ca, Mg, K, Na над фоном (0.017 ммоль(экв)/л, [28]) в дождевой воде было больше и варьировало от 7 (пл. I-1 и III-2) до 9 раз (пл. II-1 и V-2). Но кислотность дождевой воды уменьшилась по сравнению с фоном (pH 4.7) менее значительно и не на всех площадках.
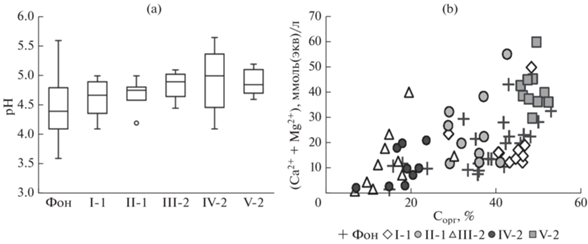
Несмотря на экстремальную и длительную техногенную нагрузку, кислотность верхнего органогенного горизонта подзолов в локальной зоне (рис. 2) оказалась на 0.2 (пл. I-1) – 0.5 (пл. III-2, IV-2 и V-2) единиц pH меньше фоновой (pH 4.4, [6]). Сумма обменных Ca2+ и Mg2+ в деградированном горизонте О подзолов на некоторых площадках оказалась снижена относительно фона (20 смоль(экв)/кг, [6]). Однако это было вызвано косвенным воздействием выбросов через гибель растений, прекращение поступления свежего опада и, как следствие, уменьшение содержания органического вещества [8] и ЕКО в почвах [6]. Распределение содержания обменных оснований как в локальной зоне (r = 0.64, N = 49), так и в фоновых условиях (r = 0.62, N = 31) достоверно (p < 0.01) коррелировало с распределением содержания органического вещества. Минимальное содержание обменных оснований пришлось на площадки III-2 и IV-2, где содержание органического вещества в процессе деградации почв снизилось наиболее значительно.
Рис. 2.
${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ (а) и соотношение суммы обменных Ca2+ и Mg2+ в смоль(экв)/кг и содержания Сорг (% на а. с. п.) (b) в верхнем органогенном горизонте подзолов на некоторых площадках мониторинга (I-1–V-2) в локальной зоне воздействия выбросов комбината “Североникель” и в фоновых условиях (Фон). Данные 2005–2011 гг. Комментарии для части рисунка (а) в подрисуночной подписи рис. 1.
Поведение антропогенной серы в почвах. Предшествующие исследования не выявили влияния выбросов на уровни общего содержания и концентрации подвижных форм S в верхнем горизонте О подзолов [23, 33, 35]. Анализ поведения S в окружающей среде на основе комплексных исследований [29, 30] показал, что антропогенный сульфат-анион не аккумулируется в горизонте О из-за низкой емкости анионного обмена этого горизонта и наличия более сильного конкурирующего аниона – ${\text{PO}}_{4}^{{3 - }}.$ Благодаря способности оксидов и гидроксидов Fe и Al адсорбировать сульфат-анион [24], горизонт BHF подзолов в окрестностях комбината “Североникель” отреагировал небольшим увеличением содержания S и ее подвижности [29]. Баланс S для малого водосбора в окрестностях комбината “Североникель” в 1994 г. подтвердил отсутствие значительной аккумуляции антропогенной S в почвах: вынос этого элемента с поверхностными водами составил 90% от его поступления с атмосферными осадками [3].
Сера в растениях. Как показали предшествующие исследования, растения слабо реагируют на избыток соединений S в окружающей среды около медно-никелевых предприятий [10, 17, 35, 38]. Наиболее очевидными способами проникновения антропогенной S в листья растений являются: непосредственное поступление SO2 из воздуха в листья через устьица и оседание пыли с высоким содержанием сульфидов металлов на поверхности листьев. Как показали результаты экспериментов, концентрация S в листьях растений увеличивается при небольшом повышении концентрации SO2 в воздухе [26]. Однако растения могут регулировать газообмен, закрывая устьица при более высоких концентрациях SO2 в воздухе [34]. Наличие частиц сульфидов и оксидов металлов было обнаружено и в снеге [25], и на поверхности хвои сосны около комбината “Североникель” [41]. Однако увеличение концентрации S на поверхности в восковом налете оказывало очень слабое влияние на ее общее содержание в хвое сосны из-за небольшой доли воска в массе хвоинок [35].
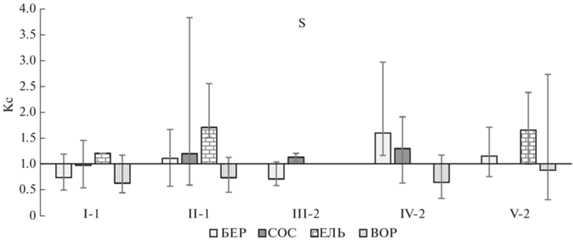
Как показали результаты, реакция растений на повышенные концентрации соединений S в окружающей среде около комбината “Североникель” не является однозначной. Не только степень, но и направленность изменения концентрации S в листьях растений локальной зоны по сравнению с фоном также, как и ее абсолютная концентрация, зависели от вида растений, площадки и года опробования (рис. 3). Наиболее значительное увеличение концентрации S по сравнению с фоном было отмечено в хвое ели, что согласуется с выводами других исследователей [17, 38, 39]. Наиболее значительно (в 1.7 раза) концентрация S в хвое ели возросла на второй по уровню загрязнения пл. II-1 (на самой загрязненной пл. IV-2 ель отсутствует). Концентрация S в хвое сосны в большинстве образцов варьировала на уровне, близком к фоновому, с единичными высокими значениями на самых загрязненных площадках IV-2 (до двух раз превышение над фоном) и II-1 (до 3.8 раз больше фона). В листьях березы только на площадке IV-2 (3 км от источника) концентрация S во всех образцах была больше фоновой, а единичные значения превышали фон до 3 раз. Наоборот, на удаленных площадках с низким плодородием почв (пл. I-1 – 17 км и III-2 – 11 км) содержание S в листьях березы было меньше фонового. В листьях вороники небольшой дефицит S был отмечен на всех площадках независимо от уровня загрязнения. Однако, согласно U-критерию Манна-Уитни, концентрация S в растениях локальной зоны не имеет значимых отличий от фона для всех видов растений и на всех площадках, за исключением березы на самой загрязненной площадке IV-2 в 3 км от источника, где выжили единичные очень угнетенные деревья.
Рис. 3.
Превышение над фоном (Кс) медианы, минимальной и максимальной концентрации S в листьях березы (БЕР), в хвое сосны второго года (СОС) и ели (ЕЛЬ) и листьях вороники (ВОР) на некоторых площадках мониторинга (I-1–V-2) в локальной зоне воздействия выбросов комбината “Североникель”. Данные 2005–2011 гг.
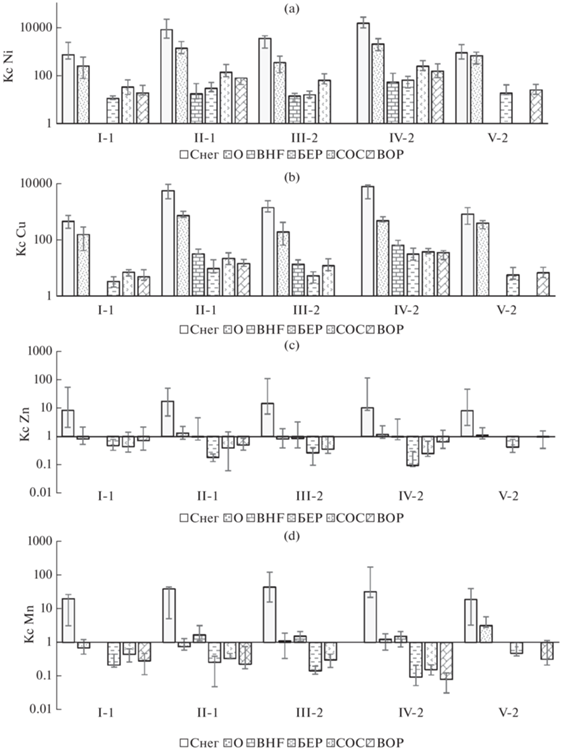
Никель (Ni) – основной металл-загрязнитель. Высокое и масштабное загрязнение окружающей среды этим металлом является наиболее очевидным последствием воздействия медно-никелевых предприятий в регионе [10, 17, 21, 25, 35, 36, 40, 41]. В 2005–2011 гг. общая концентрация Ni в талой снеговой воде на площадках мониторинга превышала фоновые значения (0.27 мкг/л [31]) от 680 на пл. I-1 (17 км от источника) до 13500 раз на пл. IV-2 (в 3 км от источника) (рис. 4). При этом концентрации Ni в талой снеговой воде в локальной зоне сохранились на уровне 1994 г. [21], когда, согласно официальным данным, уровни его выбросов были в 3–4 раз выше. Отсутствие реакции снега на уменьшение выбросов Ni связано с поступлением техногенной пыли от неучтенных низких источников (вентиляции, дверей и окон) с приземными потоками [21].
Рис. 4.
Превышение над фоном (Кс) медианы, минимальной и максимальной концентраций Ni (a), Cu (b), Zn (c) и Mn (d) в талой снеговой воде (Снег), верхнем органогенном (O) и в иллювиальном (BHF) горизонтах подзолов, в листьях березы (БЕР), в хвое сосны второго года (СОС) и листьях вороники (ВОР) на некоторых площадках мониторинга (I-1–V-2) в локальной зоне воздействия выбросов комбината “Североникель”. Данные 2005–2011 гг.
Дождеприемники на высоте 1.5 м над землей улавливали, в основном, только загрязнители, поступающие из труб высотой 90–110 м. Концентрация Ni в дождевой воде в 2005–2011 гг. уменьшилась по сравнению с 1994 г. в 3 раза [21]. Общая концентрация Ni в дождевой воде в 2005–2011 гг. варьировала от 17.2 мкг/л на пл. I-1 (17 км от источника) до 43.4 мкг/л на пл. II-1 (8 км от источника выбросов). Превышение над фоном (0.13 мкг/л [37]) при этом составило от 70 (пл. I-1) до 200 (пл. II-1) раз. Распределение концентрации Ni между площадками определялось, в основном, расположением относительно источника выбросов. Однако различия по концентрации Ni между различными порциями дождевой воды на одной площадке были значительно больше, чем между площадками и составляли десятки–сотни раз [21]. Доля твердого выпадения Ni с атмосферными осадками мало зависела от удаленности площадки и более значительно варьировала по годам. В талой снеговой воде доля твердого выпадения Ni варьировала от 0 (потери при оттепелях) до 90% с медианой 57% (N = 135), в дождевой воде – от 0 до 97%, с медианой 43% (N = 133).
Ni в почве. Почва является той средой, которая взаимодействовала с техногенным потоком с самого начала функционирования предприятия и оказалась способной аккумулировать очень большие количества антропогенного Ni [36, 40, 41]. По данным 2001–2011 гг., концентрация Ni в верхнем органогенном горизонте подзолов в локальной зоне после более 70 лет воздействия выбросов достигла экстремально высокого уровня, приблизившись к уровням, свойственным перерабатываемым рудам (Ni – 0.24–4.2%, www.nornik.ru) [4, 5]. При этом концентрация Ni в деградированном горизонте О на самой удаленной площадке мониторинга I-1 (медиана за 2001–2011 гг.) превышала фоновое значение (5.5 мг/кг, [4]) в 230 раз, на самой близкой к источнику площадке IV-2 – в 1900 раз. Максимальная концентрация Ni в остатках горизонта О на этой площадке достигала 16 000 мг/кг.
Концентрация Ni в нижних горизонтах подзолов была значительно меньше, не только из-за отсутствия прямого контакта с техногенным потоком, но и из-за меньшей сорбционной емкости. Поэтому даже при выходе на поверхность горизонта BHF в случае полного разрушения горизонта О, концентрация Ni превышала фоновые значения (фон – 16.3 мг/кг, [4]) только от 10 (пл. III-2) до 50 раз (пл. IV-2). Загрязнение почв Ni прослеживалось до нижних горизонтов, где его концентрация превышали фоновые значения (29.8 мг/кг) от трех (пл. I-1 и III-2) до восьми (пл. II-1) раз [5].
Распределение степени загрязнения верхних слоев почв Ni между площадками не всегда соответствовало их удаленности от источника выбросов и уровню загрязнения снежного покрова по ряду причин: снижения сорбционной емкости из-за уменьшения содержания органического вещества, достижения предела насыщения на наиболее загрязненных площадках или разбавления концентрации в верхнем слое почв постоянно поступающим свежим опадом листьев растений со значительно меньшей концентрацией Ni в наименее поврежденных экосистемах [4].
Представление содержания загрязняющего элемента в виде концентрации является информативным с точки зрения достижения опасных уровней в самой почве. Однако эта величина не может охарактеризовать аккумулирующую способность отдельных горизонтов или всего профиля. За счет большей плотности сложения и большей мощности отдельные минеральные горизонты сравниваются с горизонтом О по способности аккумулировать Ni. Так, по данным исследования 1994 г., в подзолах, расположенных в 5–10 км от комбината “Североникель”, запасы Ni во всем профиле, включая верхние 10 см горизонта С, составили 40–60 г/м2 [3]. При этом они превышали его запасы в почвах фоновых территорий на 30–40 г/м2. При уровне годового выпадения Ni в 1994 г., оцениваемого в 850 мг/м2, это означало, что почва аккумулировала 40–50-летнюю норму выпадений Ni. В то же время балансовые расчеты показали, что загрязненные почвы продолжали удерживать большую часть Ni, поступающего с атмосферными осадками.
Ni в растениях. В фоновых условиях Ni потребляется растениями в небольших количествах. Медианы концентраций Ni в растениях на северо-востоке Европы вне зоны загрязнения [39] между видами растений распределялись следующим образом: в листьях березы – 3.9, в листьях ивы – 9.0, в хвое сосны второго года – 1.1, в хвое ели второго года – 1.3, в листьях черники – 1, в листьях брусники – 0.7, в листьях вороники – 2.6 мг/кг. В наших исследованиях эти значения были использованы в качестве фоновых.
Значительное повышение концентрации Ni в растениях около медно-никелевых предприятий было отмечено многими исследователями [10, 11, 13, 17, 35, 39, 41]. Уровень загрязнения растений в локальной зоне в 2001–2011 гг. оказался значительно ниже, чем в атмосферных осадках и верхних горизонтах почв. И абсолютная концентрация Ni в листьях растений, и ее превышение над фоном зависели от вида растений. Из наиболее широко представленных в локальной зоне видов растений максимальное превышение над фоновой концентрацией Ni было свойственно хвое сосны: отношение к фону варьировало от 32 (пл. I-1, 17 км от источника) до 230 раз на пл. IV-2 – 3 км от источника. Отношение к фону для листьев березы было значительно меньше: от 11 раз на пл. I-1 до 60 раз на пл. IV-2.
Никель является токсичным элементом [16]. Однако выявленная высокая концентрация Ni не являлась губительной для выживших к началу исследований (2001 г.) растений, поскольку за весь период наблюдений на площадках мониторинга не погибло ни одно растение. Но Ni может быть одной из причин угнетенного состояния растений в локальной зоне.
Медь – второй по уровню выбросов металл-загрязнитель [28]. В 2005–2011 гг. концентрация Cu в талой снеговой воде на самой удаленной площадке I-1 варьировала от 83 до 240 с медианой 146 мкг/л. На самой загрязненной площадке IV-2 – от 930 до 2900, медиана 2550 мг/л. В снеговой воде на всех площадках доля твердого выпадения Cu значительно варьировала в зависимости от года опробования: от 0 до 50–70%. Превышение медианы концентраций Cu в снеге над фоном (0.32 мкг/л [21, 28]) на самой удаленной площадке составило 450 раз, на самой загрязненной пл. IV-2 – почти в 8000 раз, что в 1.5 и 1.7 раза соответственно меньше, чем Ni. Концентрация Cu в дождевой воде на высоте 1.5 м на самой удаленной площадке I-1 (17 км) в 2005–2011 гг. варьировала от 2 до 122, медиана – 38 мкг/л, на второй по уровню загрязнения пл. II-1 (8 км) от 22 до 434, медиана – 78 мкг/л. Медиана доли твердого осадка в дождевой воде варьировала от 32 на пл. II-1 до 42% на пл. V-2.
Сравнение данных 2005–2011 гг. с данными обследования 1994 г. [21] в локальной зоне не выявили уменьшения загрязнения снега Cu за этот период, хотя выбросы сократились почти в 2 раза. За то же время в дожде на высоте 1.5 м концентрация растворенной формы Cu сократилась почти в 5 раз.
Медь в почве. Как и для Ni, по данным 2005–2011 гг. концентрация Cu в верхнем органогенном горизонте подзолов локальной зоны достигла экстремально высокого уровня, приблизившись к уровням, свойственным перерабатываемым рудам – 0.36–5.8% (www.nornik.ru). Ее концентрация в деградированном горизонте О подзола на самой удаленной площадке I-1 варьировала от 300 до 2000 с медианой 1034 мг/кг. Хотя максимальная концентрация Cu в снеге была обнаружена на пл. IV-2, в гор. О она пришлась на пл. II-1 (8 км от источника): варьировала от 4250 до 7000, с медианой 4900 мг/кг. Такое несоответствие распределения нагрузки и содержания Cu в почве обусловлено зависимостью концентрации Cu от содержания органического вещества [4]. Почва на пл. IV-2 находится на более глубокой стадии деградации и потеряла больше органического вещества в гор. О по сравнению с пл. II-1 (рис. 2).
Из-за меньшей концентрации Cu в локальной зоне и большей ее концентрации в фоновых условиях (6.7 мг/кг) степень загрязнения горизонта О подзолов Cu в локальной зоне была меньше по сравнению с Ni: превышение над фоном варьировало от 150 на пл. I-1 до 730 раз на пл. IV-2 (рис. 4). Концентрация и степень загрязнения Cu горизонта BHF значительно меньше по сравнению с горизонтом О: превышала фоновые значения от 13 (пл. III-2) до 65 (пл. IV-2) раз.
Балансовые расчеты по данным комплексного обследования водосбора в 5–10 км от источника выбросов в 1994 г. показали, что несмотря на экстремальное длительное загрязнение и разрушение экосистем, почва продолжала активно аккумулировать Cu: в поверхностные воды выносилось всего около 2% Cu, поступившей с атмосферными осадками [3].
Медь в растениях. Медиана концентрации Cu в листьях растений в фоновых условиях составляла (мг/кг): в листьях ивы –7.7, черники – 6.5, березы –5.7, вороники – 5.2, брусники – 4.1, в хвое сосны – 2.7, ели – 2.1 [39]. Изменение концентрации Cu в листьях растений в локальной зоне по сравнению с фоном также, как и для Ni, зависело от вида растений и было значительно меньше по сравнению с атмосферными осадками и верхним органогенным горизонтом почв (рис. 4). Максимальное превышение концентрации над фоном было свойственно хвое сосны (от 7 на пл. I-1 до 37 раз на пл. IV-2), минимальное – листьям березы (от 3 на пл. I-1 до 31 раз на пл. IV-2).
Различия по загрязнению растений Cu между самой удаленной пл. I-1 и самой загрязненной площадкой IV-2 (для березы – 9.5, для сосны 5.3, для вороники – 7.2 раз) значительно меньше, чем снега (в 17.5 раз), но немного больше, чем гор. О почв (4.7 раза). Концентраций Cu в растениях в разные годы опробования на одной площадке различались в 2–3 раза.
Цинк (Zn) является сопутствующим загрязнителем. На его присутствие в выбросах указывают повышенные концентрации Zn в атмосферных осадках около комбината “Североникель” [21, 28, 37]. По данным 2005–2011 гг. общая концентрация Zn в талой снеговой воде на площадках мониторинга варьировала от 6.7 (пл. I-2 в 2011 г.) до 707 (пл. II-3 в 2005 г.) мкг/л. Для концентраций Zn в снеге свойственно очень высокое (до 8–10 раз) варьирование по годам на одной площадке. Доля твердого выпадения Zn была значительно меньше по сравнению с Ni и Cu и составила 22% (медиана, N = 138). Превышение над фоном общей концентрации Zn в снеге на площадках, на которых представлены все основные среды (рис. 4), варьировало от 7 (пл. I-1) до 17.5 (пл. II-1) раз. Общая концентрация Zn в дождевой воде на высоте 1.5 м варьировала от 0.5 до 472 мкг/л (N = 138). При этом различия между образцами на одной площадке были больше, чем между площадками с различным уровнем загрязнения [28]. Медиана общей концентрации Zn в дождевой воде на самой удаленной площадке I-1 составила 10 мкг/л, на второй по уровню общего загрязнения пл. II-1 – 15 мкг/л. Доля твердого выпадения в дождевой воде была равна 38% (медиана) от его общей концентрации Zn.
Цинк является важным микроэлементом. В естественных подзолах региона его концентрация в гор. О варьирует от 12.7 до 103 мг/кг, медиана 42.8 мг/кг [4]. В гор. BHF – от 3.7 до 209 с медианой 24.7 мг/кг. В отличие от снега, концентрация кислоторастворимых форм Zn в деградированном горизонте О и в оказавшемся на поверхности иллювиальном горизонте BHF подзола на площадках мониторинга не выходила за пределы естественного варьирования. В гор. О концентрация Zn варьировала от 19 (пл. III-2 в 2010 г.) до 116 мг/кг на пл. IV-2 в 2002 г. При этом его распределение между площадками не зависело ни от удаленности источника выбросов, ни от уровня его выпадения за зимний период [4]. Наиболее высокая концентрация Zn в гор. О, однако была обнаружена на дополнительной пл. V-3 (варьировала от 57 до 113 с медианой 75.2 мг/кг) с густым древостоем из молодой березы. Постоянное поступление свежего опада листьев березы с высоким содержанием Zn и поддерживало его более высокое содержание в гор. О на этой площадке в отличие от других более разрушенных площадок.
Отсутствие аккумуляции в наземной части водосбора является характерным для поведения Zn, если только он не потребляется растениями [27]. Поскольку растительность была повреждена и эффективность работы биологического барьера значительно снижена, вынос Zn с поверхностными водами в локальной зоне воздействия комбината “Североникель” превышал его поступление с атмосферными осадками [3].
Zn в растениях. Цинк представляется очень интересным элементом, поскольку с одной стороны – это сопутствующий загрязнитель, c другой стороны – важный и дефицитный для северо-таежных растений микроэлемент. Различия между видами растений в фоновых условиях по концентрации Zn (медианы) составляли около 16 раз: самые низкие 13 мг/кг были свойственны листьям вороники и черники; наибольшие листьям ивы – 125 мг/кг и березы – 205 мг/кг [38]. Несмотря на повышенные концентрации в снеге и близком к фоновому содержанию Zn в гор. О подзолов, его концентрация в растениях локальной зоны была значительно меньше фона. При этом растения сохраняли свои видовые особенности, и так же как в фоновых условиях максимальная его концентрация была свойственна листьям березы (медиана 53 мг/кг, N = 79) и ивы (медиана 34 мг/кг, N = 50), наименьшая – кустарничкам, особенно воронике (медиана 11 мг/кг, N = 53).
Степень обеднения Zn листьев растений в локальной зоне относительно фона зависит не только от вида растений, но и от площадки. Наиболее значительно концентрация Zn в растениях снизилась на наиболее загрязненных площадках IV-2, II-1, II-2 и на пл. III-2, характеризующейся низким естественным плодородием почв. В меньшей степени листья березы, ивы и хвои сосны были обеднены на пл. V-2 и V-3. А в листьях брусники и черники на этих площадках концентрация Zn была даже больше фона. Высокое содержание Zn в почвах [4] и, следовательно, в растениях на этих площадках поддерживалось благодаря меньшей степени повреждения растений и ежегодному поступлению опада листьев березы, характеризующихся высоким содержанием Zn.
Марганец (Mn) также является сопутствующим загрязнителем, его концентрация в атмосферных осадках значительно увеличивалась около источника выбросов [21, 28, 37]. По данным 2005–2011 гг., общая концентрация Mn в талой снеговой воде варьировала от 2 (пл. I-1 в 2010 г.) до 427 (пл. IV-2 в 2005 г.) мкг/л. При этом она превышала фоновую от 19 (пл. I-1 и V-2) до 44 (пл. III-2) раз. Площадки по концентрации Mn в талой снеговой воде различались незначительно – около двух раз, в то время как образцы, отобранные на одной площадке в разные годы, могли различаться от 2 до 11 раз с медианой 8.4 раза. Медиана доли твердого осадка в талой снеговой воде из всего набора данных (N = 138) составила 47%.
Медиана концентрации Mn в дождевой воде на высоте 1.5 м в 2005–2011 гг. варьировала от 6.2 мкг/л на пл. II-1 до 8.4 мкг/л на пл. V-2. Различия между образцами дождевой воды, отобранными на одной площадке в разное время, были значительно больше (от 16 до более 100 раз), чем между площадками (в 2–4 раза) [28]. Доля твердого выпадения в дождевой воде варьировала от 0 (в 27% образцов из 126) до 94% (медиана 34%). Превышение медиан концентраций растворенного Mn в дождевой воде локальной зоны над фоном (2.4 мкг/л) варьировало от 2.5 (пл. II-1) до 3.5 раз (пл. V-2).
Марганец в почве. В отличие от атмосферных осадков, концентрация кислоторастворимых форм Mn и в деградированном горизонте О, и в оказавшемся на поверхности иллювиальном горизонте BHF подзолов на всех площадках мониторинга не выходила за пределы естественного варьирования этих показателей в аналогичных горизонтах подзолов фоновых условий и не зависела ни от удаленности источника выбросов, ни от уровня их выпадения за зимний период. Причиной отсутствия адекватной реакции верхнего органогенного горизонта почв на повышенное поступление Mn, как и Zn, с атмосферными осадками могут быть конкурентные отношения не только с Fe, Ni и Cu [11, 27] но и, теоретически, с основными катионами, поскольку Zn и Mn активно участвуют в обменных реакциях, но их сродство к обменному поглощению значительно ниже [15]. Причем конкуренция с основными катионами представляется более реальной, поскольку эквивалентная концентрация Ca и Mg и в атмосферных осадках [28], и в почве [6]) локальной зоны значительно больше, чем основных загрязнителей.
В фоновых условиях концентрация Mn в гор. О подзолов варьировала от 19 до 1210 мг/кг, медиана – 122 мг/кг (N = 177). Близкий к фоновому интервал был обнаружен в локальной зоне в 2001–2011 г.: от 41 (пл. III-2 в 2007 г.) до 1350 мг/кг на пл. V-3 в 2008 г. Сравнение с фоновыми значениями показало, что в зависимости от площадки, концентрация Mn в гор. О может быть немного снижена (на пл. I-1 и II-1), быть близкой к фону (пл. III-2 и IV-2) или, даже, значительно превосходить фоновые значения (пл. V-2). Значимо, согласно U-критерию Манна–Уитни при p < 0.01, более высокие концентрации Mn в гор. О на пл. V-2 и V-3, как и в случае с Zn, обязаны ежегодному поступлению опада листьев березы и черники с высоким содержанием Mn [9, 39]. Что дало основание предположить, что низкие концентрации Mn на более нарушенных площадках могут быть связаны с косвенным воздействием загрязнения через разрушение растительности и прекращение поступления свежего растительного опада [4].
Как и для Zn, отсутствие аккумуляции в наземной части водосбора является характерным для поведения Mn, если только он не потребляется растениями [27]. Поскольку растительность повреждена, и эффективность работы биологического барьера значительно снижена, вынос Mn с поверхностными водами в локальной зоне воздействия комбината “Североникель” превышал его поступление с атмосферными осадками [3].
Марганец – очень важный и дефицитный микроэлемент для растений в регионе [14]. Самые высокие концентраций (медианы, мг/кг) в фоновых условиях были свойственны листьям черники (2090), брусники (1690) и березы (1450), самые низкие – хвое сосны (700) и листьям вороники (790) [9]. Исследования 2001–2011 гг. показали, что несмотря на повышенные поступления с атмосферными осадками, концентрация Mn в листьях всех видов растений была значимо (согласно U-критерию Манна-Уитни при p < 0.01) ниже по сравнению с фоном. Наиболее значительный дефицит Mn в условиях локальной зоны испытывала береза и вороника. На площадках III-2 (средний уровень техногенного загрязнения, низкое естественное плодородие) и IV-2 (самый высокий уровень загрязнения и самая высокая степень повреждения экосистемы) концентрация Mn в листьях березы снизилась относительно фона почти в 10 раз. В 4–5 раз относительно фона снизилась концентрация Mn в листьях березы на пл. I-1 (наименее загрязненная, низкое естественное плодородие) и пл. II-1 (вторая по уровню загрязнения и разрушения площадка). В меньшей степени (в 2 раза) снижение содержания Mn в листьях березы было отмечено на пл. V-2, где содержание Mn в гор. О было в 3 раза больше фонового. Сосна чуть лучше обеспечивала себя Mn: на большинстве площадок концентрация Mn в ее хвое снизилась только в 3 раза по сравнению с фоном. За исключением самой загрязненной пл. IV-2 с наиболее угнетенными растениями, где концентрация Mn в хвое сосны снизилась в 7 раз. Концентрации Mn в хвое ели и листьях черники снизились в меньшей степени (не более чем в 2 раза), но эти виды присутствовали только на наименее загрязненных и нарушенных площадках.
Наличие острого дефицита Mn в растениях около медно-никелевых предприятий было отмечено ранее многими исследователями [11, 12, 17, 35, 41]. В качестве возможных причин называются недостаток в почве и уменьшение емкости катионного обмена в результате деградации гумуса [35]; снижение потребления из-за антагонизма с Fe и, возможно, с другими элементами [11, 27]. Однако, как показали наши данные, наличие конкурирующих элементов не сказалось на уровне содержания Mn и Zn в гор. О подзолов и растениях в наименее нарушенных экосистемах на пл. V-2 и V-3, где продолжал поступать свежий опад с высоким содержанием этих элементов (листья березы для Zn и листья черники и березы для Mn) [4]. Это дает основание предположить, что именно отсутствие постоянного поступления этих элементов с опадом обусловливает более низкие концентрации Zn и Mn в гор. О почв и, особенно, в растениях в наиболее поврежденных экосистемах.
Состояние экосистем. Первые признаки повреждения растений около комбината “Североникель” были отмечены уже в первые годы работы предприятия в середине 1940-х, к концу 1970-х в радиусе 5 км сформировалась зона полного повреждения экосистем [31], максимального размера она достигла к середине 1990-х и была зафиксирована в радиусе 15 км [41]. Вслед за снижением выбросов зоны полного повреждения вокруг медно-никелевых предприятий в регионе начали сокращаться [22]. На расстоянии 5–10 км от комбината “Североникель” многолетние наблюдения выявили снижение содержания тяжелых металлов в листьях растений [13, 17], увеличение видового разнообразия [18]; и улучшение жизненного состояния древесных растений [19] вслед за снижением выбросов.
На начало нашего мониторинга в локальной зоне (3–17 км) воздействия комбината “Североникель” в 2001 г. объемы выбросов уменьшились почти в 6 раз, и состояние экосистем значительно варьировало в зависимости от удаленности источника, ландшафтного положения и плодородия почв (табл. 1). Горные лесные экосистемы на пл. V-2 и V-3 (высокое плодородие почв, средний уровень загрязнения) и все низинные болотные экосистемы на пл. I-3, II-3, III-4, IV-3 и V-4 (избыточное увлажнение при всех уровнях загрязнения) характеризовались умеренным повреждением, в них отсутствовали только наиболее чувствительные к загрязнению мхи и лишайники, растения древесного и кустарничкового яруса в лесных экосистемах и травяного – в болотных были угнетены, но их обилие сохранилось на фоновом уровне. На площадках, расположенных у подножий склонов с близким уровнем грунтовых вод (пл. I-2, II-2 и IIA-2) было характерно угнетенное состояние и древесного, и кустарничкового яруса с существенным сокращением обилия. Экосистемы, расположенные на вершинах холмов (пл. I-1, II-1, IIA-1, III-2), характеризовались более значительным повреждением: кустарнички отсутствовали, редкие выжившие деревья находились в угнетенном состоянии, верхний органогенный горизонт почв деградировал. Экосистема на пл. IV-2 характеризовалась, как техногенная пустошь с единичными выжившими, очень угнетенными растениями, а также интенсивной почвенной эрозией.
При этом состояние экосистем не всегда определялось удаленностью площадки от источника выбросов и уровнем загрязнения верхних слоев почв тяжелыми металлами. Условия увлажнения и плодородия почв также оказывали значительное влияние на состояние экосистем [4, 5]. Распределение состояния экосистем в ландшафте, значительно улучшающееся от вершин (глубокое залегание грунтовых вод) к подножиям склонов (грунтовые вод в пределах профиля) и низинным болотам, не было связано с уровнями загрязнения почв. Благодаря хорошим условиям увлажнения, растения в подчиненных элементах ландшафта были значительно устойчивее к воздействию загрязнения даже при его экстремальном уровне.
Несмотря на все еще высокий уровень загрязнения, снижение содержания важных питательных элементов в почвах и еще более значительное в растениях (рис. 3, 4), на всех площадках, кроме пл. IV-2, за годы наблюдений (2001–2018 гг.) не погибло ни одно растение. Но состояние выживших сосудистых растений оставалось стабильно угнетенным. У березы прирост побегов на всех площадках был в 1.5 раза ниже фона, а доля отмерших веток составляла около 30%. Прирост побегов второго порядка у сосны в зависимости от площадки был в 2–3 раза меньше, чем в фоновых условиях, продолжительность жизни хвои составляла всего 3–4 года (неопубликованные данные). Вместе с тем, все выжившие древесные растения регулярно плодоносили с образованием жизнеспособных семян. Признаком улучшения состояния экосистем в результате снижения выбросов явилось появление, хотя и очень угнетенных, пионерных мхов (Dicranum и Polytrichum sp.) и лишайников (Cladonia sp., Stereocaulon paschale). Небольшие куртины угнетенных мхов появились в 2006 г. даже на самых загрязненных пл. II-1 и IV-2 г.
Медленное улучшение состояния сосудистых растений в локальной зоне обусловлено не только остающимся высоким уровнем загрязнения, но и деградацией почв, особенно, верхнего органогенного горизонта, где обычно располагаются корни растений. Формирование нового органогенного горизонта и восстановление его плодородия будет проходить очень медленно по мере восстановления растительности и накопления на поверхности почв растительного опада.
Косвенное воздействие выбросов. Экстремальное химическое загрязнение является не единственным фактором негативного воздействия на окружающую среду в локальной зоне воздействия комбината “Североникель”. Не менее серьезный экологический ущерб наносит косвенное воздействие выбросов через повреждение растительности (рис. 5), которая выполняет множество важных функций в экосистеме [2]. Действие косвенных факторов начинается уже на стадии исчезновения наиболее чувствительных к загрязнению компонентов – напочвенных мхов и лишайников, которые составляют значительную часть общей биомассы северо-таежных экосистем [14] и выполняют важные экологические функции: поддерживают водный, питательный и температурный режим почв [31]. Их исчезновение сопровождается сдвигом водного режима экосистем в сторону иссушения, а промерзание почвы при ранних заморозках может повредить корни растений [7, 31].
Рис. 5.
Схема факторов косвенного воздействия выбросов комбината “Североникель” на окружающую среду через разрушение растительности. Звездочкой помечены изменения, наблюдаемые при очень сильном повреждении экосистемы.
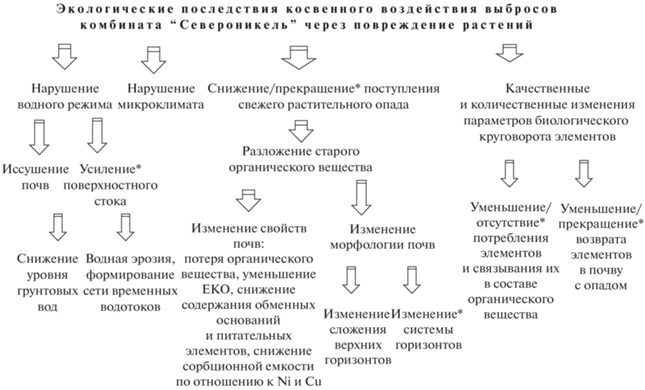
После гибели сосудистых растений и разрушения верхнего органогенного горизонта почв, нарушения водного режима затрагивают не только отдельные экосистемы, но и ландшафт, в целом: усиливается поверхностный сток и снижается уровень грунтовых вод [8]. На более крутых склонах увеличенный поверхностный сток формирует сеть глубоких русел временных водотоков, полностью уничтожающих весь почвенный профиль.
Задокументированными фактами изменения микроклимата в поврежденных экосистемах являются нарушение ветрового режима [32] и промерзание почв осенью до установления снежного покрова на лишенных растительности участках – техногенных пустошах [7].
Из-за повреждения и гибели растений сокращается или даже полностью прекращается поступление растительного опада в почву. При его длительном отсутствии, старое органическое вещество коренной экосистемы, несмотря на экстремально высокие концентрации тяжелых металлов, постепенно минерализуется и содержание органического вещества в почвах уменьшается. На первых этапах техногенной трансформации экосистем это приводит только к деградации верхнего органогенного горизонта [8]. На более поздних этапах – ведет к полному разрушению верхнего органогенного горизонта и изменению системы горизонтов в профиле почвы.
Уменьшение содержания органического вещества в почве сказывается на таких важных ее свойствах, как ЕКО, содержании обменных Ca и Mg [6] и доступных форм питательных элементов. Содержание Ni и, особенно, Cu в гор. О поврежденных экосистем также демонстрирует достоверную положительную корреляцию с содержанием органического вещества [4].
Поступление растительных остатков на поверхность является одним из звеньев биологического круговорота, возвращающих элементы в почву, где они постепенно высвобождаются в процессе разложения. Опад растений является одним из основных источников элементов питания в северо-таежных экосистемах [14]. Как было показано для Zn и Mn, поступление богатого этими элементами опада (листья березы и черники) в менее поврежденных экосистемах (пл. V-2 и V-3) даже при сильном загрязнении, поддерживало концентрации этих важных микроэлементов в почве и растениях (рис. 4) на высоком уровне. Дефицит других важных питательных элементов – Ca, Mg и K в растениях [9], также может быть обусловлен этим фактором.
Из-за обеднения питательными элементами, иссушения в летний период и промерзания осенью, а также частичного или полного разрушения верхнего органогенного горизонта в поврежденных экосистемах этот горизонт перестает быть местом расположения и областью питания растений. Чтобы выжить многие растения увели корни в более глубокие горизонты почв [5, 31], где лучше условия увлажнения, меньше степень загрязнения тяжелыми металлами, но значительно меньше содержание питательных элементов [6].
ЗАКЛЮЧЕНИЕ
Медно-никелевый индустриальный комплекс в центре Кольского полуострова является одним из наиболее крупных и длительно действующих источников выбросов SO2 и тяжелых металлов на севере Европы. Комплексный мониторинг окружающей среды в ближайших окрестностях этого предприятия в 2001–2011 гг. позволил сравнить реакцию различных природных сред (атмосферных осадков, почв и листьев семи видов дикорастущих растений) на экстремальное загрязнение, охарактеризовать поведение основных загрязняющих элементов в окружающей среде; оценить состояние растительности и выявить основные факторы ее угнетенного состояния; обнаружить наличие целого спектра негативных экологических последствий из-за повреждения растительности, которая выполняет множество важных экологических функций.
Несмотря на имеющиеся официальные данные по значительному сокращению выбросов, уровень загрязнения окружающей среды в локальной зоне остается экстремально высоким: концентрация SO2 в воздухе превышает фоновые значения в десятки–сотни раз, концентрация Ni и Cu в снеге больше фоновых в тысячи–десятки тысяч раз; концентрация Ni и Cu в верхнем органогенном горизонте почв превышает фоновые в сотни–тысячи раз и приближается к концентрации в перерабатываемых рудах (Ni в руде – 0.24–4.2%, Cu в руде – 0.36–5.8%); превышения концентрации Ni в листьях растений над фоном составляют десятки–сотни раз, Cu – десятки раз.
Комплексные исследования показали, что при анализе поведения загрязняющих веществ нужно учитывать не только их свойства, но и возможность взаимодействия различных компонентов выбросов. Например, основные катионы частично или полностью нейтрализуют образующийся при окислении SO2 анион сильной минеральной кислоты ${\text{SO}}_{4}^{{2 - }}$ еще на стадии формирования химического состава атмосферных осадков. В результате кислотность атмосферных осадков в локальной зоне оказалась даже меньше фоновой. Fe, Ni, Cu и Co могут конкурировать с Zn и Mn за сорбционные места в почве и за поступление в растения.
При анализе поведения загрязняющего элемента в окружающей среде необходимо учитывать природную способность почв и растений аккумулировать/потреблять тот или иной элемент. Например, в естественных условиях вынос Zn и Mn за пределы водосбора превышает их поступление с атмосферными осадками, если они не потребляются растениями и не находятся какое-то время в составе неразложившегося опада в почве. Точно также ведут себя эти элементы антропогенного происхождения: из-за повреждения растительности и прекращения потребления Zn и Mn в локальной зоне выносятся за пределы водосбора с поверхностными водами. Наоборот, почвы оказались способными аккумулировать Ni и Cu в больших количествах. Оценка запасов этих элементов в почвах около источника выбросов показала, что они способны удерживать большую часть поступившего за все время работы предприятия Ni и, согласно балансовым расчетам, продолжают его активно аккумулировать, несмотря на деградацию и экстремально высокие накопленные запасы.
Состояние экосистем в основном определялось удаленностью источника выбросов, но естественное плодородие почв и, особенно, условия увлажнения оказывали большое влияние на устойчивость растений к загрязнению. Кроме уже известных факторов повреждения растительности – повышенных концентраций SO2 в воздухе, экстремальных концентраций токсичных элементов – Ni и Cu, исследования выявили наличие дополнительных косвенных факторов: иссушение почв, нарушение микроклимата, частичная или полная деградация основного места обитания корней растений – верхнего органогенного горизонта почв, из-за чего они были вынуждены увести корни на глубину, изменив область питания на менее загрязненную и с лучшими условиями увлажнения, но бедную питательными элементами.
Ближайшие окрестности медно-никелевого индустриального комплекса представляют тот редкий случай антропогенного воздействия, когда его интенсивность и длительность сопровождается серьезными повреждениями растительности, вплоть до полного исчезновения, что, в свою очередь, оборачивается целым комплексом дополнительных к экстремальному загрязнению негативных косвенных факторов: нарушение водного режима экосистем и ландшафтов, изменение микроклимата, деградацию почв с изменением их базовых свойств и морфологического сложения, количественные и качественные изменения биологического круговорота элементов.
Список литературы
Ежегодные доклады о состоянии окружающей среды Мурманской области. https://gov-murman.ru/ region/environmentstate/-
Касимов Д.В., Касимов В.Д. Некоторые подходы к оценке экосистемных функций (услуг) лесных насаждений в практике природопользования. М.: Мир науки, 2015. 91 с.
Кашулина Г.М. Аэротехногенная трансформация почв Европейского Субарктического региона. Апатиты: Изд-во КНЦ РАН, 2002. Ч. 1. 158 с.
Кашулина Г.М. Мониторинг загрязнения почв тяжелыми металлами в окрестностях медно-никелевого предприятия на Кольском полуострове // Почвоведение. 2018. № 4. С. 493–505. https://doi.org/10.7868/S0032180X1804010X
Кашулина Г.М. Экстремальное загрязнение почв выбросами медно-никелевого предприятия на Кольском полуострове // Почвоведение. 2017. № 7. С. 860–873. https://doi.org/10.7868/S0032180X17070036
Кашулина Г.М., Кубрак А.Н., Коробейникова Н.М. Кислотность почв в окрестностях медно-никелевого комбината “Североникель”, Кольский полуостров // Почвоведение. 2015. № 4. С. 486–500. https://doi.org/10.7868/S0032180X15040048
Кашулина Г.М., Литвинова Т.И., Коробейникова Н.М. Сравнительны анализ температуры горизонта О подзола на двух в различной степени деградированных участках техногенно трансформированной экосистемы (Кольский полуостров) // Почвоведение. 2020. № 9. С. 1132–1143. https://doi.org/10.31857/S0032180X20090087
Кашулина Г.М., Переверзев В.Н., Литвинова Т.И. Трансформация органического вещества почв в условиях экстремального загрязнения выбросами комбината “Североникель” // Почвоведение. 2010. № 10. С. 1265–1275.
Кашулина Г.М., Салтан Н.В. Химический состав растений в экстремальных условиях локальной зоны комбината “Североникель”. Апатиты: Изд-во КНЦ РАН, 2008. 239 с.
Копцик Г.Н., Копцик С.В., Смирнова И.Е., Кудрявцева А.Д., Турбабина К.А. Реакция лесных экосистем на сокращение атмосферных промышленных выбросов в Кольской Субарктике // Журн. общей биологии. 2016. Т. 77. № 2. С. 145–163.
Копцик Г.Н., Копцик С.В., Смирнова И.Е., Синичкина М.А. Влияние деградации и ремедиации почв техногенных пустошей на поглощение элементов питания и тяжелых металлов растениями в Кольской субарктике // Почвоведение. 2021. № 8. С. 968–982.
Лукина Н.В., Никонов В.В. Питательный режим лесов северной тайги: природные и техногенные аспекты. Апатиты: КНЦ РАН, 1998. 316 с.
Лянгузова И.В. Динамические тренды содержания тяжелых металлов в растениях и почвах при разном режиме аэротехногенной нагрузки // Экология. 2017. № 4. С. 250–260.
Манаков К.Н., Никонов В.В. Биологический круговорот минеральных элементов и почвообразование в ельниках Крайнего Севера. Л.: Наука, 1981. 196 с.
Пинский Д.Л. Ионообменные процессы в почвах. Пущино, 1997. 166 с.
Серегин И.В., Кожевникова А.Д. Физиологическая роль никеля и его токсическое действие на высшие растения // Физиология растений. 2006. Т. 53. № 2. С. 285–308. https://doi.org/10.1134/S1021443706020178
Сухарева Т.А., Лукина Н.В. Минеральный состав ассимилирующих органов хвойных деревьев после снижения уровня атмосферного загрязнения на Кольском полуострове // Экология. 2014. № 2. С. 97–104. https://doi.org/10.7868/80367059714020085
Черненькова Т.В., Кабиров Р.Р., Басова Е.В. Восстановительные сукцессии северотаежных ельников при снижении аэротехногенной нагрузки // Лесоведение. 2011. № 6. С. 49–66.
Ярмишко В.Т., Игнатьева О.В. Многолетний импактный мониторинг состояния сосновых лесов в центральной части Кольского полуострова // Известия РАН. Сер. Биологическая. 2019. № 6. С. 658–668. https://doi.org/10.1134/s0002332919060134
Anttila P. The air quality of Lapland in the early 2000s //Acta Lapponica Fenniane. № 24. 2014. P. 9–24.
Caritat P. de, Ayras M., Niskavaara H., Chekushin V.A., Bogatyrev I., Reimann C. Snow composition in eight catchments in the central Barents Euro-Arctic Region // Atmos. Environ, 1998. V. 32(14–15). P. 2609–2626.
Derome J., Aherne J., Hellstedt P. et al. Chapter 5. Effects on Terrestrial Ecosystems // AMAP Assessment report 2006: Acidifying pollutants, Arctic Haze and Acidification in the Arctic. Arctic Monitoring and Assessment Programme (AMAP), Oslo, 2006. P. 41–63.
Derome J., Lindroos A.-J., Niska K. Effects of SO2 and heavy metal emissions from the Kola peninsula, NW Russia, on soil acidity parameters in NW Russia and Finnish Lapland // Scandinavian J. Forest Research. 1998. V. 13. P. 421–428.
Harrison R.B., Johnson D.W., Todd D.E. Sulfate adsorption and desorption reversibility in a variety of forest soils // J. Environ. Qual. 1989. V. 18. P. 419–425.
Gregurek D., Melcher F., Pavlov V., Reimann C., Stumpfl E.F. Mineralogy and mineral chemistry of snow filter residues in the vicinity of the nickel-copper processing industry, Kola Peninsula, NW Russia // Mineralogy and Petrology. 1999. V. 65. P. 87–111.
Guderian R. Air pollution. Phytotoxicity of acidic gases and its significance in air pollution control // Ecological studies № 22. Springer-Verlag. N.Y., 1977. 122 p.
Kabata-Pendias A., Mukherjee A.B. Trace Elements from Soil to Human. Springer, Berlin, Heidelberg, N.Y., 2007. 550 p.
Kashulina G., de Caritat P., Reimann C. Snow and rain chemistry around the “Severonikel” industrial complex, NW Russia: Current status and retrospective analysis // Atmos. Environ. 2014. V. 89. P. 672–682.
Kashulina G., Reimann C. Sulphur in the Arctic environment (1) – results of a catchment based multi-medium study // Environ. Pollut. 2001. V. 114. P. 3–19.
Kashulina G., Reimann C., Banks D. Sulphur in the Arctic environment (3). Environmental impact // Environ. Pollut. 2003. V. 124(1). P. 151–171.
Kashulina G., Reimann C., Finne T.E., Halleraker J.H., Ayras M., Chekushin V.A. The state of the ecosystems in the Central Barents Region: scale, factors and mechanism of disturbance // Sci. Total Environ. 1997. V. 206. P. 203–225.
Kozlov M.V. Changes in wind regime around a nickel-copper smelter at Monchegorsk, Northwestern Russia // International J. Biometeorology. 2002. V. 46. P. 76–80.
Niskavaara H., Reimann C., Chekushin V., Kashulina G. Seasonal variability of total and easily leachable element contents in topsoil (0–5 cm) from eight catchments in the European Arctic (Finland, Norway and Russia) // Environ. Pollut. 1997. V. 96(2). P. 261–274.
Olszuk D.M., Tibbits T.W. Stomatal response and leaf injury of Pisum sativum L. with SO2 and O3 exposure // Plant Physiol. 1981. V. 67. P. 539–544.
Rautio P., Huttunen S. Total vs. internel elements in Scots pine needles along a sulphur and metal pollution gradient // Environ. Pollut. 2003. V. 122. P. 273–289. https://doi.org/10.1016/S0269-7491(02)00289-0
Reimann C., Ayras M., Chekushin V. et al. Environmental Geochemical Atlas of the Central Barents Region. NGU-GTK-CKE special publication. Geological Survey of Norway, Trondheim, Norway, 1998. 745 p.
Reimann C., Caritat P. de, Halleraker J.H., Volden T., Ayras M., Niskavaara H., Chekushin V.A., Pavlov V.A. Rainwater composition in eight arctic catchments of Northern Europe (Finland, Norway and Russia) // Atmos. Environ. 1997. V. 31(2). P 159–170.
Reimann C., Koller F., Frengstad B., Kashulina G., Niskavaara H., Englmaier P. Total sulphur in leaves of several plant species from 9 catchments within a 1 500 000 km2 area in Northern Europe: local vs. regional variability // Geochemistry, Exploration, Environment, Analysis. 2003. V. 3. P. 205–215.
Reimann C., Koller F., Kashulina G., Niskavaara H., Englmaier P. Influence of extreme pollution on the inorganic chemical composition of some plants // Environ. Pollut. 2001. V. 115. P. 239–252.
Salminen R., Chekushin V., Tenhola M. et al. Geochemical atlas of eastern Barents region // J. Geochemical Exploration. 2004. V. 83 (1–3, Especial issue). 530 p.
Tikkanen E., Niemela I. Kola Peninsula pollutants and forest ecosystems in Lapland. Finland’s Ministry of Agriculture and Forestry, The Finnish Forest Research Institute. Gummerus Kirjapaino Oy Jyvaskyla, 1995. 82 p.
Дополнительные материалы отсутствуют.


