Почвоведение, 2022, № 6, стр. 728-736
Ингибирование ферментативной активности чернозема обыкновенного газообразными продуктами горения растительных материалов
М. С. Нижельский a, *, К. Ш. Казеев a, В. В. Вилкова a, С. И. Колесников a
a Южный федеральный университет
344090 Ростов-на-Дону, Стачки, 194/1, Россия
* E-mail: nizhelskiy@sfedu.ru
Поступила в редакцию 27.11.2021
После доработки 17.01.2022
Принята к публикации 18.01.2022
- EDN: FGBCTH
- DOI: 10.31857/S0032180X22060090
Аннотация
Пирогенное воздействие вызывает коренное изменение природных экосистем и замедляет естественное возобновление территорий. Одним из серьезных факторов пирогенного воздействия на биоту и почвы является дым от пожаров. Негативное воздействие дыма от продуктов горения исследовано на живых организмах, однако подобных работ для почвенной фауны, микробоценозов и биологической активности почв мало. Целью работы было выявление влияния продуктов горения материалов растительного происхождения на ферментативную активность чернозема обыкновенного легкоглинистого в лабораторных и полевых экспериментах. Под воздействием дыма произошло изменение активности почвенных ферментов: каталазы, полифенолоксидазы, пероксидазы, инвертазы. Выявлена четкая зависимость интенсивности ингибирования активности ферментов от времени воздействия (30–120 мин) дыма на чернозем. Проведена оценка глубины проникновения газообразных продуктов горения в почву в зависимости от времени воздействия. В ходе анализа выявлено, что максимальное ингибирование активности ферментов происходит в слое 0–1 см, на глубине 4–5 см воздействие дыма минимально. Во влажной почве ферменты более восприимчивы к негативным последствиям из-за поглощения продуктов горения водой. Прослежена динамика восстановления ферментативной активности почвы без применения биопрепаратов. Самыми чувствительными к продуктам горения оказались ферменты класса оксидоредуктаз (каталаза, полифенолоксидаза и пероксидаза). Полученные результаты свидетельствуют о значительном влиянии дыма на ферментативную активность почв.
ВВЕДЕНИЕ
В последние годы природные пожары возникают все чаще, как следствие произошло увеличение площадей с постпирогенными почвами. Появление подобных условий ведет к ухудшению естественного возобновления поврежденных территорий.
Основные явления, сопровождающие пожар – горение, тепловое воздействие и задымление. Горение представляет собой процесс термической деструкции компонентов экосистем, выделения тепла и свечения горючих материалов [4]. Задымление – это выделение газообразных веществ вследствие возгорания продуктов, подвергшихся термической обработке.
Пожары оказывают негативное воздействие как на флору и фауну, так и на качество почв, изменяя их свойства (физические, химические и биологические). Пирогенное воздействие на почву различается в зависимости от типа пожара (верховой, низовой, подземный), его интенсивности (слабый, средний, сильный), продолжительности (от нескольких минут до нескольких часов) и повторяемости [9, 12, 17, 28]. Фронт огня может продвигаться на многие километры, он способен в кратчайшие сроки преобразовать местность. В результате ухудшаются защитные, водоохранные и другие свойства затронутых огнем территорий, исчезает фауна, уничтожаются сооружения, в отдельных случаях – населенные пункты. Все это говорит о значительных трансформациях, происходящих в экосистемах, в связи с чем пирогенное воздействие вызывает серьезную озабоченность экологическим состоянием окружающей среды.
Огонь оказывает наибольшее влияние из всех явлений, сопровождающих пожары. Известно, что одно из главных условий распространения огня – наличие горючих материалов, количество которых увеличивается с ростом биомассы [13]. Помимо огня колоссальное воздействие на качество почвы, а также на живые организмы, оказывает дым. Образовавшиеся в результате пирогенного фактора продукты горения зависят от их влажности, чем она больше, тем меньше в воздух, а затем в почву при осаждении, поступает газов-загрязнителей. Если происходит неполное сгорание материалов, то выделяется CO, HNC, углеводороды и др. Например, в лесах часто можно наблюдать процесс, который сопровождается выделением угарного газа [2, 28]. Диаметр основного количества частиц, образующихся при лесных пожарах (более 90%), составляет 10 мкм и менее. Они могут быть первичными, выделяющимися в атмосферу вследствие неполного сгорания, или вторичными, образующимися в результате физических или химических превращений. Первичными частицами могут быть элементарный углерод (сажа) или органические частицы углерода. Последние также могут быть получены вторично, путем конденсации горячих паров (смол) [23]. При возникновении пожара частицы сажи поступают в воздух. Как известно, они состоят из углерода и продуктов неполного сгорания (древесины, коры деревьев, лесной подстилки и др.). В свою очередь эти органические вещества, в том числе фенольные соединения, являются опасными токсикантами [2, 16]. Поэтому дым можно считать одним из факторов, который оказывают существенное воздействие на почву и ее биоту.
Биохимические показатели (активность почвенных ферментов) могут служить индикатором качества и плодородия сельскохозяйственных почв, а также оценки их состояния при применении различных способов обработки [1, 7, 19, 22, 31]. При воздействии пирогенного фактора ферментативная активность служит надежным индикатором выявления нарушений в почве, так как является очень чувствительным показателем биогенности [21, 33, 34, 36], особенно при диагностике химического загрязнения [7, 26].
В настоящее время вопрос о влиянии дыма на ферментативную активность почв изучен не достаточно. Большинство работ о пирогенном воздействии посвящены влиянию огня (тепловое излучение) на свойства почв и его воздействия на живые организмы. Возникает необходимость более подробно рассмотреть действие дыма от источников горения на активность почвенных ферментов.
Цель работы – выявить влияние продуктов горения материалов растительного происхождения (листьев, древесины, соломы пшеницы) на активность ферментов (каталазы, полифенолоксидазы, пероксидазы, инвертазы). В задачи исследований входило определение глубины проникновения дыма в чернозем по степени ингибирования ферментов на разных глубинах (0–1, 1–2 и 4–5 см), выявление особенностей реакции ферментов в сухой и влажной почве, а также динамика их восстановления после фумигации.
ОБЪЕКТЫ И МЕТОДЫ
Характеристика района исследования. В качестве объекта исследования выбрали почву пахотного участка (слой 0–20 см) ботанического сада Южного федерального университета, который занимает площадь более 160 га. Географические координаты места исследования: 47.23815° N, 39.64194° E. Среднегодовое количество осадков около 460 мм, среднегодовая температура 8.2°С. Среднегодовая температура января от –5 до –9°С, июля от 22 до 24°С [14]. Почва – чернозем обыкновенный южно-европейской фации карбонатный легкоглинистый (Haplic Chernozem (Aric, Loamic, Pachic)). Черноземы занимают обширную территорию юга России и являются одними из наиболее плодородных в мире [1, 3]. Почва опытного участка характеризуется следующими показателями: мощность гумусовых горизонтов (А + В) – 80 см, содержание органического углерода в пахотном горизонте – 2.0%, легкоглинистый гранулометрический состав (содержание физической глины – 53%), содержание подвижного фосфора – 3.3 мг Р2О5/100 г, обменного калия, K2О – 341 мг/кг, нитратов, N–NO3 – 8.4 мг/кг.
Модельные эксперименты поводили в лабораторных и естественных условиях. Для экспериментов использовали свежевысушенную (при комнатной температуре, в тени через сутки–двое после отбора) почву. Поскольку высокая температура является важным фактором ингибирования ферментов [22, 30], тепловое воздействие от дыма было исключено конструктивными особенностями дымогенераторов. Контейнер, выполняющий роль газовой меры, во всех исследованиях был идентичен – объем 50 л. Вес золы продуктов горения контролировали при помощи аналитических весов Vibra HTR-220CE (Shinco Denshi Co. Ltd., Япония).
Кратковременное и длительное воздействие фумигации на почву. В рекогносцировочном эксперименте определяли пороговые значения токсичности дыма. В краткосрочном опыте исследовали 4 варианта в трехкратной повторности. Воздушно-сухую почву массой 40 г слоем 0.6 см помещали в полипропиленовые контейнеры объемом 200 мл. Площадь поверхности почвы, которая контактировала с дымом, составила 136 см2. Далее контейнеры с почвой помещали в большой контейнер, выполняющего роль газовой камеры, для обработки дымом с помощью дымогенератора Kitfort KT-2033 Smoking Gun (Kitfort, Китай) в течение 15 мин со скоростью подачи дыма около 2 л/мин. Источниками горения были сухие растительные материалы (солома озимой пшеницы, листья клена, хвоя сосны, сигаретный табак). До 10 г каждой из разновидностей продукта горения воздействовало на образцы почвы. Масса всех использованных горючих веществ в общем составила 37.8 г, по 10 г – соломы, листьев клена, хвои сосны и 7.8 сигаретного табака.
Длительный опыт проводили с использованием дымогенератора Merkel Standart (Helicon, Россия). Дым прокачивали через газовую камеру к почвенным образцам с помощью воздушного компрессора Barbus Air 007 (Barbus, Китай), мощностью 4.5 л/мин. В качестве продукта горения использовали щепу яблони, массой 200 г. Исследовали 6 образцов почвы (3 контрольных и 3 для обработки дымом). Образцы почв массой 40 г слоем 0.6 см и площадью поверхности 136 см2, контактируемой с дымом, помещали в контейнер объемом 50 л (газовую камеру) для фумигации. Время обработки каждого образца дымом при работе дымогенератора – 60 мин. В данном опыте оценивали более длительное воздействие дыма на ферментативную активность (каталазы, полифенолоксидазы, пероксидазы, инвертазы) чернозема.
Весь образец почвы, слоем 0.6 см, отобрали целиком для анализа после кратковременного и длительного воздействия фумигации.
Глубина проникновения дыма в почву. Эксперимент выполняли на том же оборудовании. В качестве источника дыма использовали сосновые опилки и стружку массой 210 г. Целью проведения было установление глубины проникновения газообразных веществ в почву в зависимости от времени воздействия (30, 60, 120 мин). Сухую почву насыпали в контейнеры объемом 350 мл, слоем 5 см и весом 310 г, площадь поверхности почвы составила 136 см2. Обрабатывали дымом 9 образцов при трех контрольных вариантах. Идентичный эксперимент выполняли с увлажненной водой до 40 мас. % почвой, масса горючего материала 225 г.
После выполнения опытов почвенные образцы для анализа отбирали послойно из слоев 0–1, 1–2, 4–5 см.
Динамика восстановления почвенных ферментов. Эксперимент выполняли в лабораторных условиях с дымогенератором. Почву массой 40 г, слоем 0.6 см помещали в контейнеры 200 мл, а затем в газовую камеру объемом 50 л для фумигации. Подачу воздуха в отличие от предыдущих экспериментов осуществляли более мощным воздушным компрессором Hailea ACO-208 (Китай), производительность которого составляет 17.5 л/мин. Время обработки дымом чернозема – 30, 60 и 120 мин. В качестве продукта термической деструкции использовали щепу яблони. В данном опыте выявили динамику восстановления почвенных ферментов в лабораторных условиях без применения биопрепаратов, анализ ферментов проводили сразу после эксперимента. Образец почвы для анализа после опыта был отобран целиком. Спустя месяц анализ повторяли, при этом в почве поддерживали оптимальные условия для протекания биологических процессов в течение всего периода хранения образцов (температура 25–30°С и влажность 40%). Процедура отбора почвенных образцов для анализа аналогична, описанной ранее.
Аналогичный эксперимент проводили в естественных условиях в ботаническом саду ЮФУ. При исследовании почву накрывали пластиковым изолятором. Оборудование, условия проведения опыта и хранения почвенных образцов описаны выше. Отбор образцов выполняли из поверхностного слоя 0–1 см. Изменения биохимических показателей исследовали сразу после фумигации и спустя месяц.
Температуру воздуха в газовой камере и почвах контролировали с помощью электронного термометра Hanna Chaktemp, пирометра DT-810 СЕМ и температурных датчиков Термохрон DS1921. Влияние продуктов горения при фумигации на pH воды, помещенной в отдельной от почвы емкости (контейнере), определяли потенциометрическим методом при помощи прибора HANNA HI-98128-pHep-5 (Германия). Реакцию среды почвы определяли при соотношении почва : вода 1 : 2.5. Содержание легкорастворимых солей – кондуктометрически по удельной электропроводности раствора прибором HANNA HI-9034 (Германия). Индикаторами воздействия дыма были почвенные экзоферменты, содержание которых исследовали классическими методами оценки ферментативной активности почв в 3–6-кратной повторности [8]. Активность каталазы определили волюметрическим методом А.Ш. Галстяна по скорости разложения H2O2. Уровень активности пероксидазы и полифенолоксидазы – колориметрическим методом Л.A. Карягиной и Н.А. Михайловой с субстратом гидрохиноном. Для определения инвертазы использовали модифицированный колориметрический метод, основанный на определении оптической плотности реактива Феллинга после восстановлении CuSO4 глюкозой, образующейся из инвертированной сахарозы [8].
Достоверность различий контрольных и опытных вариантов оценивали однофакторным дисперсионным анализом с уровнем значимости p < < 0.05, а также t-тестом Стьюдента при уровне значимости p < 0.01 в программах Microsoft Excel и Statistica.
РЕЗУЛЬТАТЫ
Кратковременное и длительное воздействие фумигации на почву. В результате рекогносцировочного исследования с миниатюрным дымогенератором Kitfort KT-2033 выявлено достоверное уменьшение активности ферментов под воздействием дыма от небольшого количества горючих веществ в течение 15 мин на 7–10%. При этом ингибирование не зависело от источника горения в вариантах с обработкой дымом соломы озимой пшеницы, листьев клена и хвои сосны. Сигаретный дым привел к незначительному увеличению активности фермента – на 9%. Дальнейшие исследования проводили с источниками дыма от продуктов горения для выяснения закономерностей его влияния на ферментативную активность почвы.
В результате более продолжительного модельного опыта (60 мин) установлено, что активность всех рассматриваемых ферментов (каталазы, полифенолоксидазы, пероксидазы и инвертазы) уменьшилась после воздействия дыма в течение 60 мин. Значение активности каталазы уменьшилось на 25% относительно контроля (рис. 1). Выявлено подавление активности полифенолоксидазы и пероксидазы на 33 и 15% соответственно, а инвертазы – на 23%.
Рис. 1.
Изменение активности ферментов под воздействием дыма в течение 60 мин: 1 – каталаза, 2 – полифенолоксидаза, 3 – пероксидаза, 4 – инвертаза (изменения достоверны при p < 0.01).
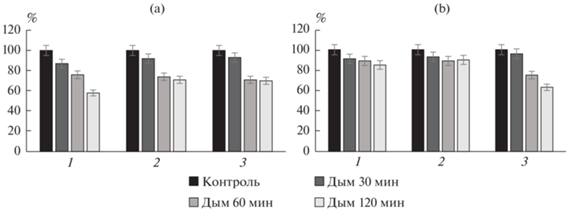
Глубина проникновения дыма в почву от продуктов горения опилок сосны. Активность каталазы после 30 мин фумигации в слоях 0–1, 1–2 и 4–5 см сократилась на 5–19% (рис. 2). После 60 мин в этих же слоях ингибирование составило 10–28%, а после 2 ч зафиксировано подавление на 8–37%.
Рис. 2.
Глубина проникновения дыма от продуктов горения. Изменение активности каталазы в зависимости от времени обработки: 1 – дым 30 мин, 2 – дым 60 мин, 3 – дым 120 мин (различия достоверны при уровне значимости p < 0.05).
Активность полифенолоксидазы уменьшилась в слое 0–1 см на 6–49% после 30–120 мин фумигации. Однако в остальных слоях достоверные различия установить не удалось из-за высокого варьирования активности в образцах, которые перекрывали различия между вариантами опыта.
В рамках этого эксперимента выявлено изменение показателей pH дистиллированной воды, помещенной в газовую камеру в отдельных контейнерах. Его значение достоверно уменьшалось под действием дыма и составило 2.2–2.6 ед., что свидетельствует о высокой степени влияния продуктов горения. Минерализации воды также существенно изменилась в течение 30, 60 и 120 мин фумигации дымом от опилок (табл. 1).
Таблица 1.
Изменение минерализации и показателя pH воды, а также почвенной среды после фумигации дымом от материалов растительного происхождения
| Вариант | Вода | Почва | |
|---|---|---|---|
| pH | минерализация, мг/л | рН | |
| Контроль | 6.6 | 10 | 7.6 |
| 30 мин | 2.6 | 250 | 7.0 |
| 60 мин | 2.5 | 410 | 6.3 |
| 120 мин | 2.2 | 880 | 5.9 |
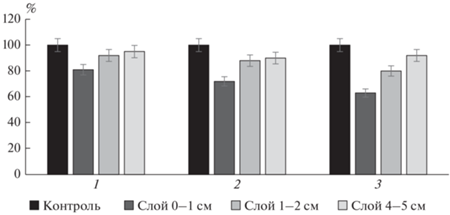
Аналогичный опыт с глубиной проникновения дыма выполнен с влажной почвой, заранее увлажненной водой до оптимальной для биологических процессов влажности (40% от массы почвы). Увлажнение чернозема было выполнено для оценки влияния дыма на влажную почву по сравнению с воздушно-сухой, которую подвергали воздействию в предыдущем эксперименте. При этом предполагалось, что она будет сорбировать больше аэрозолей за счет растворения продуктов горения в условиях увлажнения. Установлено, что активность почвенных ферментов (каталазы и полифенолоксидазы) уменьшилась аналогично предыдущим опытам (рис. 3). Анализ показал, что активность каталазы в слое 0–1 см была ингибирована относительно контроля после 30 мин на 52%, после 60 мин – на 41%, а после 120 мин – на 48%. Данные значения активности фермента несколько больше, чем в прошлом опыте. Содержание полифенолоксидазы также уменьшилось в слое 0–1 см относительно контроля (на 38, 57, 54% за 30, 60 и 120 мин соответственно), что больше, чем в воздушно-сухой почве (6–46%).
Рис. 3.
Изменение активности каталазы и полифенолоксидазы во влажной почве в слое 0–1 см в зависимости от времени обработки дымом: 1 – контроль, 2 – дым 30 мин, 3 – дым 60 мин, 4 – дым 120 мин (различия достоверны при уровне значимости p < 0.05).

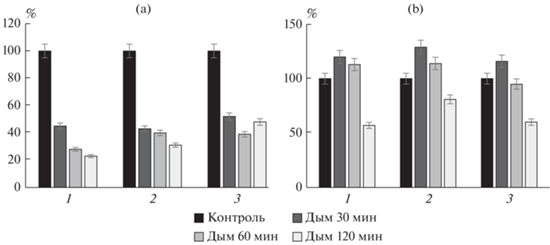
Динамика восстановления почвенных ферментов. Исследования показали, что сразу после модельного эксперимента по фумигации почвы материалами растительного происхождения (щепой яблони) значения оксидоредуктаз (каталазы, полифенолоксидазы, пероксидазы) существенно изменились (рис. 4) относительно контрольных вариантов. При проведении анализов через месяц установили постепенное восстановление ферментативной активности без биопрепаратов. Активность каталазы восстановилась до контрольных значений, за исключением варианта с воздействием дыма 120 мин. Аналогичная ситуация выявлена для пероксидазы. Менее восприимчивым ферментом оказалась полифенолоксидаза. По сравнению с контрольным вариантом полного восстановления не наблюдалось в вариантах с обработкой дымом 60 и 120 мин (95 и 60% соответственно).
Рис. 4.
Влияние фумигации на чернозем в модельном опыте (a) и динамика восстановления (b) спустя 1 месяц: 1 – каталаза, 2 – пероксидаза, 3 – полифенолоксидаза (различия достоверны при уровне значимости p < 0.05).
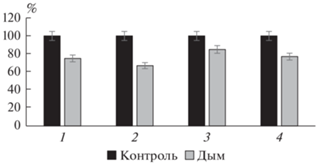
При проведении полевого эксперимента отмечено значительное влияние дыма на биохимические показатели. Однако по сравнению с результатами модельного опыта подавление ферментов не так сильно выражено. Например, активность каталазы в течение 30–120 мин уменьшилась на 13–42%, пероксидазы – на 8–29%, а полифенолоксидазы – на 7–30% (рис. 5). Через месяц результаты перепроверили и выявили, что ни один из показателей не восстановился до контрольных значений, в то время как в лабораторных условиях после фумигации 30–60 мин эти ферменты восстановили активность.
ОБСУЖДЕНИЕ
Выбор ферментов для анализа обусловлен их высокой чувствительностью к антропогенным влияниям. Анализ каталазы часто используют при биомониторинге и биодиагностике почвенного покрова. Данный фермент широко распространен в почвах и является информативным диагностическим показателем при изучении различных видов антропогенного воздействия [7]. Пероксидаза и полифенолоксидазы очень чувствительны к воздействиям разного типа, а их уровень активности может служить важным диагностическим критерием [7, 8, 32, 35]. Активность инвертазы является одним из наиболее информативных показателей, обнаруживающих наиболее четкие коррелятивные связи с плодородием и антропогенными факторами [8, 10, 18].
По результатам исследований выявлена общая закономерность уменьшения активности ферментов от времени обработки дымом. Влияние фумигации на почву рассмотрено некоторыми авторами [25, 27, 29, 39, 40]. Однако в данных работах изучали изменение микробных сообществ под действием дыма и его влияние на ферментативную активность в сельскохозяйственных почвах при обработке различными веществами (бромистым метилом, дазометом и др.). Акцент сделан на увеличение урожайности, а также влиянии на сообщества микроорганизмов почвы. В работах некоторых авторов отмечено подавление болезнетворных организмов вследствие фумигации, а также увеличение количества микроорганизмов, которые способствуют росту растений и увеличению ферментативной активности. Данный процесс происходит за счет обезвреживания почвы с использованием специальных препаратов (дазомет и др.). В настоящем исследовании рассмотрено изменение почвенных ферментов после пирогенного воздействия, где фумигация привела к уменьшению активности ферментов. Такое различие в результатах с другими исследователями говорит о токсичном составе дыма при пожарах. Он существенно отличается от состава фумигантов при обезвреживании почвы дазометом, бромистым метилом и другими препаратами.
Ранее исследовано влияние дыма на почву от продуктов горения соломы [9]. Выявлено изменение микробиологических (микробная биомасса, азотофиксирующие бактерии) и биохимических свойств чернозема обыкновенного. В частности, установлено уменьшение активности оксидоредуктаз и гидролаз при разной влажности в условиях холодной (52°C) и горячей (139°C) обработки почвы дымом от горения соломы. Отмечено, что наибольший подавляющий эффект на ферменты оказал именно горячий дым из-за высоких температур. Уменьшение значений биохимических показателей зависит и от глубины почвы. Зафиксировано изменение микробной биомассы и обилия бактерий рода Azotobacter от воздействия горячего дыма [9]. При этом активность как ферментов, так и обилие живых организмов зависели от времени обработки дымом. Установлено, что содержание гумуса и влажность являются основными показателями, влияющими на почвенные ферменты и микробное сообщество [6, 19].
Основной эффект от пирогенного фактора зафиксирован в слое 0–1 см, где наблюдаются наибольшие изменения ферментативной активности. Уменьшение произошло из-за поглощения почвой токсичных газов и аэрозолей, поскольку при горении древесных остатков в почву выделяются сажа, СО2, СО и разные углеводороды. Значения pH уменьшается до величин, при которых жизнь многих животных и растений крайне ограничена. Изменение рН воды происходит за счет CO2, который хорошо в ней растворяется, образуя угольную кислоту. Реакция среды почвенной суспензии в опытах уменьшается в меньшей степени в результате высокой буферности черноземов (табл. 1). Глубже верхнего слоя эффект пирогенного воздействия уменьшается, а минимальные изменения наблюдались в слое 4–5 см. Известно, что воздействие при пожарах ограничено верхним слоем почвы, глубже которого влияние пирогенного фактора (огня) на почвенные свойства слабо выражено [9, 17, 18, 37]. Установлено, что почва является эффективным фильтром, способным поглощать токсичные газы и предотвращать от негативного воздействия нижележащие слои. Это позволяет почве быстро восстанавливать биологическую активность, распространяя ее снизу на ингибированные дымом поверхностные слои почвы.
Результаты полевого эксперимента по восстановлению ферментативной активности чернозема отличаются от модельного. Это связано с более благоприятными условиями температуры и влажности, способствующими ускоренному протеканию биологических процессов в лаборатории. Во время проведения полевых исследований почва опыта имела такую же температуру, но меньшую влажность (12–22%), что сказалось на скорости протекания в ней биологических процессов. Полученные результаты в обоих случаях говорят о постепенном восстановлении почвы. Для стимулирования биологических процессов и более быстрого восстановления поврежденных территорий многие исследователи рекомендуют применять биопрепараты [5, 11, 15, 24, 38].
ЗАКЛЮЧЕНИЕ
Установлена высокая чувствительность каталазы, полифенолоксидазы, пероксидазы, инвертазы к продуктам горения материалов растительного происхождения. Выявлена четкая закономерности изменения ферментативной активности чернозема обыкновенного в зависимости от времени обработки дымом. При этом ингибирование не зависело от материала, подвергающегося термической деструкции. Более чувствительны к дыму оказались ферменты класса оксидоредуктаз: каталаза (наиболее чувствительный фермент), а также полифенолоксидаза. Подавление произошло даже при незначительном (15 мин) воздействии газообразных веществ. Увеличение срока воздействия дыма приводило к усилению подавления ферментов. Инвертаза из класса гидролаз была менее информативной из-за худшей чувствительности к фумигации и большему варьированию в почве. Глубина проникновения газообразных продуктов в воздушно-сухую и увлажненную почву ограничивается первыми сантиметрами, при этом эффект влияния дыма на увлажненную почву был больше. Это может свидетельствовать о большей чувствительности ферментов в увлажненной почве, так как почвенный раствор поглощает газообразные продукты горения, что воздействует на биологическую активность почв. Выявлена тенденция к восстановлению активности ферментов чернозема после фумигации. Этот эффект зафиксирован в лабораторных условиях, где оксидоредуктазы (каталаза, полифенолоксидаза, пероксидазы) практически восстановили активность до исходных величин через месяц после воздействия дыма в течение 30 и 60 мин. В естественных условиях восстановление активности ферментов в фумигированной почве было неполным, что говорит о различиях протекания биологических процессов в лабораторных и естественных условиях.
Полученные результаты и закономерности воздействия одного из факторов пирогенного воздействия могут быть использованы для оценки состояния почв и почвенного покрова наиболее пострадавших от пожаров территорий.
Список литературы
Азаренко (Мясникова) М.А., Казеев К.Ш., Ермолаева О.Ю., Колесников С.И. Изменение растительного покрова и биологических свойств черноземов в постагрогенный период // Почвоведение. 2020. № 11. С. 1412–1422.
Бердникова Л.Н. Влияние опасных и вредных факторов лесных пожаров на окружающую среду // Безопасность и экология транспортно-технологических средств. Красноярск, 2019. С. 47–55.
Вальков В.Ф., Казеев К.Ш., Колесников С.И. Почвы Ростовской области. Ростов-на-Дону: Изд-во ЮФУ, 2012. 492 с.
Верзилин М.М., Повзик Я.С. Пожарная тактика. М.: ЗАО “Спецтехника НПО”, 2007. 442 с.
Газданова И.О., Гериева Ф.Т., Моргоев Т.А. Эффективность применения биостимуляторов “Эпин-экстра” и “Циркон” на посадках картофеля в агроэкологических условиях РСО-Алания // Аграрный вестник Урала. 2020. № 8. С. 2–8. https://doi.org/10.32417/1997-4868-2020-199-8-2-8
Горобцова О.Н., Гедгафова Ф.В., Улигова Т.С., Темботов Р.Х. Сравнительная оценка биологических свойств почв культурных и естественных ценозов Центрального Кавказа (на примере территорий терского варианта поясности в пределах Кабардино-Балкарии) // Почвоведение. 2016. № 1. С. 100–106.
Даденко Е.В., Денисова Т.В., Казеев К.Ш., Колесников С.И. Оценка применимости показателей ферментативной активности в биодиагностике и мониторинге почв // Поволжский экологический журн. 2013. № 4. С. 385–393.
Казеев К.Ш., Колесников С.И., Акименко Ю.В., Даденко Е.В. Методы диагностики наземных экосистем. Ростов-на-Дону: Изд-во ЮФУ, 2016. 356 с.
Казеев К.Ш., Одабашян М.Ю., Трушков А.В., Колесников С.И. Оценка влияния разных факторов пирогенного воздействия на биологические свойства чернозема // Почвоведение. 2020. № 11. С. 1372–1392.
Казеев К.Ш., Солдатов В.П., Шхапацев А.К., Шевченко Н.Е., Грабенко Е.А., Ермолаева О.Ю., Колесников С.И. Изменение свойств дерново-карбонатных почв после сплошной рубки в хвойно-широколиственных лесах Северо-Западного Кавказа // Лесоведение. 2021. № 4. С. 426–436. https://doi.org/10.31857/S0024114821040069
Максимова Е.Ю. Оценка применения гуминовых препаратов в качестве мелиорантов для рекультивации деградированных постпирогенных почв // Агрохимический вестник. 2018. № 1. С. 46–51.
Медведева М.В., Бахмет О.Н., Ананьев В.А., Мошников С.А., Мамай А.В., Мошкина Е.В., Тимофеева В.В. Изменение биологической активности почв в хвойных насаждениях после пожара в средней тайге Карелии // Лесоведение. 2020. № 6. С. 560–574.
Московченко Д.В., Арефьев С.П., Московченко М.Д., Юртаев А.А. Пространственно-временной анализ природных пожаров в лесотундре Западной Сибири // Сибирский экологический журнал. 2020. Т. 27. № 2. С. 243–245.
Панов В.Д., Лурье П.М., Ларионов Ю.А. Климат Ростовской области: вчера, сегодня, завтра. Ростов-на-Дону, 2006. 488 с.
Рафальский С.В., Рафальская Н.Б., Рафальская О.М., Мельникова Т.В., Щетинин Г.П., Мамонов С.Н. Продуктивность сельскохозяйственных культур при применении биопрепаратов в условиях Приамурья // Вестник Дальневосточного отделения РАН. 2016. № 2(186). С. 57–63.
Синьков О.А., Почапский А.А. Влияние лесных пожаров на окружающую среду // Актуальные проблемы геотехники, экологии и защиты населения в чрезвычайных ситуациях. Минск: БНТУ, 2017. С. 101–103.
Старцев В.В., Дымов А.А., Прокушкин А.С. Почвы постпирогенных лиственничников Средней Сибири: морфология, физико-химические свойства и особенности почвенного органического вещества // Почвоведение. 2017. № 8. С. 912–925.
Шорец М.А., Орлова Д.А., Балаева-Тихомирова О.М. Оценка степени антропогенной нагрузки на почвы г. Витебска по основным диагностическим показателям // Веснік Віцебскага дзяржаўнага універсітэта. 2017. № 2(95). С. 62–69.
Acosta-Martinez V., Tabatabai M.A. Enzyme activities in a limed agricultural soil // Biology and Fertility of Soils. 2000. V. 31(1). P. 85–91. https://doi.org/10.1007/s003740050628
Brockett B.F.T., Prescott C.E., Grayston S.J. Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in Western Canada // Ibid. 2012. V. 44. P. 9–20. https://doi.org/10.1016/j.soilbio.2011.09.003
Burns R.G., DeForest J.L., Marxsen J., Sinsabaugh R.L., Stromberger M.E. Wallenstein M.D., Weintraub M.N., Zoppini A. Soil enzymes in a changing environment: current knowledge and future directions // Soil Biology and Biochemistry. 2013. V. 58. P. 216–234. https://doi.org/10.1016/j.soilbio.2012.11.009
Dadenko E.V., Kazeev K.Sh., Kolesnikov S.I., Val’kov V.F. Changes in the Enzymatic Activity of Soil Samples upon Their Storage // Eurasian Soil Science. 2009. V. 42. P. 1380–1385. https://doi.org/10.1134/S1064229309120084
Dokas I., Statheropoulos M., Karma S. Integration of field chemical data in initial risk assessment of forest fire smoke // Science of the Total Environment. 2007. V. 376. P. 72–85. https://doi.org/10.1016/j.scitotenv.2007.01.064
Fang W., Song Z., Tao S., Zhang D., Huang B., Ren L., Cheng H., Yan D., Li Y., Cao A., Wang Q. Biochar mitigates the negative effect of chloropicrin fumigation on beneficial soil microorganisms // Science of the Total Environment. 2020. V. 738. https://doi.org/10.1016/j.scitotenv.2020.139880
Klose S., Ajwa Husein A. Enzyme activities in agricultural soils fumigated with methylbromide alternatives // Soil Biology and Biochemistry. 2004. P. 1625–1635. https://doi.org/10.1016/j.soilbio.2004.07.009
Kolesnikov S., Timoshenko A., Minnikova T., Tsepina N., Kazeev K., Akimenko Y., Zhadobin A. et al. Impact of Met-al-Based Nanoparticles on Cambisol Microbial Functionality, Enzyme Activity, and Plant Growth // Plants. 2021. V. 10. P. 2080. https://doi.org/10.3390/plants10102080
Li J., Huang B., Wang Q., Li Y., Fang W., Yan D., Guo M., Cao A. Effect of fumi-gation with chloropicrin on soil bacterial communities and genes encoding key en-zymes involved in nitrogen cycling // Environmental Pollution. 2017 P. 534–542. https://doi.org/10.1016/j.envpol.2017.03.076
Liu Y., Goodrick S., Heilman W. Wildland fire emissions, carbon, and climate: Wildfire-climate interactions // Forest Ecology and Management. 2014. V. 317. P. 80–96. https://doi.org/10.1016/j.foreco.2013.02.020
Nicola L., Turco E.R., Albanese D., Donati C., Thalheimer M., Pindo M., Insam H., Cavalieri D., Pertot I. Fumigation with dazomet modifies soil microbiota in apple orchards affected by replant disease // Applied Soil Ecology. 2017. V. 113. P. 71–79. https://doi.org/10.1016/J.APSOIL.2017.02.002
Pingree M.R.A., Kobziar L.N. The myth of the biological threshold: A review of biological responses to soil heating associated with wildland fire // Forest Ecology and Management. 2019. V. 432. P. 1022–1029. https://doi.org/10.1016/j.foreco.2018.10.032
Prietzel J. Arylsulfatase activities in soils of the Black Forest/Germany – seasonal variation and effect of (NH4)2SO4 fertilization // Soil Biology and Biochemistry. 2001. V. 33. P. 1317–1328. https://doi.org/10.1007/978-3-642-14225-3_4
Sinsabaugh R.L. Phenol oxidase, peroxidase and organic matter dynamics of soil // Soil Biology and Biochemistry. 2010. V. 42. P. 391–404. https://doi.org/10.1016/j.soilbio.2009.10.014
Šnajdr J., Valášková V., Merhautová V., Herinková J., Cajthaml T., Baldrian P. Spatial variability of enzyme activities and microbial biomass in the upper layers of Quercus petraea forest soil // Soil Biology and Biochemistry. 2008. V. 40. P. 2068–2075. https://doi.org/10.1016/j.soilbio.2008.01.015
Thiele-Bruhn S., Schloter M., Wilke B.-M., Beaudette L.A., Martin-Laurent F., Cheviron N., Mougin C., Römbke J. Identification of new microbial functional standards for soil quality assessment // Soil. 2020. V. 6. P. 17–34. https://doi.org/10.5194/soil-6-17-2020
Toberman H., Evans C.D., Freeman C., Fenner N., White M., Emmett B.A., Artz R.R.E. Summer drought effects upon soil and litter extracellular phenol oxidase activity and soluble carbon release in an upland Calluna heathland // Soil Biology and Biochemistry. 2008. V. 40. P. 1519–1532. https://doi.org/10.1007/978-3-642-14225-3_3
Trasar-Cepeda C., Leiros M.C., Gil-Sotres F. Biochemical properties of acid soils under climax vegetation (Atlantic oakwood) in an area of the European temperate-humid zone (Galicia, NW Spain): specific parameters // Soil Biology and Biochemistry. 2000. V. 32. P. 747–755. https://doi.org/10.1016/s0038-0717(99)00195-9
Whitman T., Whitman E., Woolet J., Flannigan M.D., Thompson D.K., Parisien M.A. Soil bacterial and fungal response to wildfires in the Canadian boreal forest across a burn severity gradient // Soil Biology and Biochemistry. 2019. V. 138. P. 1–13. https://doi.org/10.1007/s00442-009-1433-7
Zavarzina A.G., Danchenko N.N., Demin V.V., Artemyeva Z.S., Kogut B.M. Humic Substances: Hypotheses and Reality (a Review) // Eurasian Soil Science. 2021. V. 54(12). P. 1826–1854 https://doi.org/10.1134/S1064229321120164
Zhang D., Ji X., Meng Z., Qi W., Qiao K. Effects of fumigation with 1,3-dichloropropene on soil enzyme activities and microbial communities in continuous-cropping soil // Ecotoxicology and Environmental Safety. 2019. V. 169. P. 730–736 https://doi.org/10.1016/j.ecoenv.2018.11.071
Zhu J., Cao A., Wu J., Fang W., Huang B., Yan D., Wang Q., Li Y. Effects of chloropicrin fumigation combined with biochar on soil bacterial and fungal communities and Fusarium oxysporum // Ecotoxicology and Environmental Safety. 2021. V. 220. https://doi.org/10.1016/j.ecoenv.2021.112414
Дополнительные материалы отсутствуют.