Почвоведение, 2022, № 7, стр. 787-794
Проблемы и ограничения дихроматометрического метода измерения содержания почвенного органического вещества (обзор)
Е. В. Шамрикова a, *, Е. В. Ванчикова a, Б. М. Кондратёнок a, Е. М. Лаптева a, С. Н. Кострова a
a Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, Коммунистическая, 28, Россия
* E-mail: shamrik@ib.komisc.ru
Поступила в редакцию 25.12.2021
После доработки 18.01.2022
Принята к публикации 26.01.2022
- EDN: FZGGVQ
- DOI: 10.31857/S0032180X22070097
Аннотация
Основополагающей характеристикой гумусового состояния почв является содержание почвенного органического вещества (ПОВ). В мировой практике для оценки содержания ПОВ активно используется дихроматометрический метод, имеющий значительное разнообразие методик измерения. Унификация способов определения содержания ПОВ, как и других параметров почв, является инструментом международной коммуникации, облегчающим взаимодействие специалистов при создании баз данных по почвам мира, инвентаризации и мониторинге почвенных ресурсов. Приведены сведения о том, что отдельные модификации метода Тюрина могут включать процедуры, снижающие точность измерения содержания ПОВ. Коллективом Института биологии разработана и аттестована новая модификация метода Тюрина, исключающая эти процедуры. Опытным путем установлена корректность введения в расчет содержания ПОВ поправочного коэффициента f = 1.15 для учета неполного окисления углерода органических соединений. Использование коэффициента f при погрешности измерений не более 20% обеспечивает получение результатов, согласованных с методами Уолкли–Блэка и высокотемпературного сжигания органического углерода на анализаторе.
ВВЕДЕНИЕ
Почвенное органическое вещество (ПОВ) является одним из важнейших компонентов почвы и представляет собой смесь специфических и неспецифических органических соединений. Консенсуса о природе гумусовых веществ, их происхождении, механизмах накопления в почвах до сих пор не достигнуто [5]. Развитие современных подходов и методов структурной аналитики существенно расширяют представления о строении гумусовых веществ. Однако начальным этапом изучения их состава и свойств является оценка общего содержания ПОВ.
Традиционно количество ПОВ оценивается путем измерения содержания (массовой доли) углерода органических соединений (Сорг) с последующим умножением результата измерений на 1.724. Значение коэффициента было предложено Э. Вольфом в 1864 г., исходя из условия, что углерод составляет около 58% ПОВ [20]. Однако это допущение вызвало и до сих пор вызывает сомнения, так как гумус имеет сложный состав и неоднороден в различных почвах. Следовательно, расчет содержания гумуса на основании одного и того же коэффициента является условным приемом. В действительности в почвах отношение органического углерода к органическому веществу составляет 1 : 1.4–2.8 [9, 12, 23, 33, 34, 38].
Методы измерений содержания ПОВ остаются до настоящего времени не унифицированными [30, 32, 34], но все они в своей основе имеют реакцию окисления углерода органических соединений, составляющих органическое вещество, до оксида углерода (IV).
В последние время в практику исследований почв вошло и стало широко распространенным определение содержания ПОВ с помощью автоматических элементных анализаторов. Органические соединения, входящие в состав исследуемых материалов, сжигают в присутствии кислорода при высокой температуре (свыше 1000°С). Количество оксида углерода (IV), эквивалентное количеству углерода в органических соединениях, измеряют в автоматическом режиме детекторами различной конструкции. Градуировку анализаторов осуществляют на стандартных образцах с известным содержанием углерода. Это могут быть как органические соединения с известной стехиометрией, так и образцы почв с аттестованным значением углерода органических соединений или органического вещества. При исследовании почв, содержащих карбонаты, дополнительно измеряют массовую долю углерода карбонат-ионов и вычитают из общего содержания углерода.
Данный подход гарантирует полное окисление углерода органических соединений, однако высокая стоимость приборов, расходных материалов и технического обслуживания делают использование хроматографического метода приемлемым не для всех химических лабораторий [24, 27].
В основе наиболее технически доступных и распространенных методик измерений содержания ПОВ лежит окисление органических соединений дихромат-анионами в сернокислой среде при нагревании. В системе протекает реакция:
(1)
$\begin{gathered} 3{{[{{{\text{C}}}_{{{\text{орг}}}}}]}^{0}} + 2{\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }} + 16{{{\text{H}}}^{ + }} = \\ = \,\,3{\text{C}}{{{\text{O}}}_{2}} + 4{\text{C}}{{{\text{r}}}^{{3 + }}} + 8{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $В России, а также в ряде стран Европы и Азии дихроматометрический метод реализуется в методе Тюрина [15]. На протяжении многих лет почвоведы пытались усовершенствовать данный способ. Изменяли условия окисления углерода органических соединений (температура, время); концентрацию дихромат-ионов и серной кислоты в растворе; способы разделения жидкой и твердой фаз; методы оценивания количества выделившегося оксида углерода (IV) – титриметрический или фотометрический и др. (табл. 1).
Таблица 1.
Методики измерений содержания органического вещества почв (окислитель – дихромат-ионы)
| № | Условия окисления углерода органических соединений | Метод оценивания количества | Источник | ||
|---|---|---|---|---|---|
| ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }}$ | Cr3+ | ||||
| температура | время | титриметрия | фотометрия | ||
| 1 | 100°С, водяная баня | 1 ч | – | λ = 590 нм (ГР* – соль Мора) |
4 |
| 2 | >140°С, электроплитка | 5 мин | Раствор соли Мора | – | 14 |
| 3 | >140°С, электроплитка | 5 мин | – | λ = 590 нм (ГР – соль Мора) |
10 |
| 4 | 18–20°С (без нагревания) | 24 ч | – | λ = 590 нм (ГР – соль Мора) |
14 |
| 5 | >140°С, солевая баня | 20 мин | – | λ = 590 нм (ГР – сахароза) |
19 |
| 6 | 150°С, сушильный шкаф | 20 мин | Раствор соли Мора | λ = 590 нм (ГР – сахароза) |
8 |
| 7 | 100°С, водяная баня | 1 ч | – | λ = 590 нм (ГР – соль Мора, сахароза) |
7 |
В первом случае количество эквивалентов окислителя, оставшегося в системе, измеряют титриметрически. В качестве титранта используют раствор гексагидрата сульфата железа (II)-аммония Fe(NH4)2(SO4)2·6Н2О (соль Мора). Точку эквивалентности фиксируют потенциометрическим методом, измеряя окислительно-восстановительный потенциал системы или используя окислительно-восстановительные индикаторы, например, фенилантраниловую кислоту (окисленная форма индикатора – вишнево-красная, восстановленная – бесцветная). В процессе титрования раствор не обесцвечивается, а становится изумрудно-зеленым вследствие появления в растворе комплексных ионов хрома (III).
Во втором варианте оценивание содержания углерода органических соединений в почвах проводят по поглощению излучения при длине волны λ = 590 нм комплексными соединениями хрома (III), количество эквивалентов которого равно количеству эквивалентов углерода органических соединений, вступившего в реакцию с дихромат-ионами. Так как состав органических соединений в почве неизвестен, для градуировки спектрофотометров согласно прописям модификаций метода Тюрина (табл. 1) возможно использование двух восстановителей: соли Мора или сахарозы – C12H22O11 (2), (3).
(2)
${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }} + 6{\text{F}}{{{\text{e}}}^{{2 + }}} + 14{{{\text{H}}}^{ + }} = 2{\text{C}}{{{\text{r}}}^{{3 + }}} + 6{\text{F}}{{{\text{e}}}^{{3 + }}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(3)
$\begin{gathered} 8{\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }} + {{{\text{C}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{22}}}}}{{{\text{O}}}_{{11}}} + 64{{{\text{Н}}}^{ + }} = \\ = \,\,16{\text{C}}{{{\text{r}}}^{{3 + }}} + 12{\text{С}}{{{\text{О}}}_{2}} + 43{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Основной недостаток дихроматометрического метода измерений – неполное окисление углерода органических соединений. Доля окисленного углерода варьирует в зависимости от типа почв и способа нагревания от 27 до 100%, имея среднее значение – 77% [12, 24, 27, 29, 31]. Неполное окисление приводит к значительному занижению результатов измерений [25, 33, 38]. По этой причине в большинстве случаев результаты дихроматометрического метода измерений органического углерода почв ниже его определения “сухим” сжиганием на анализаторе [2, 22, 28, 38], хотя были отмечены случаи отсутствия достоверных различий [6].
Противоположный эффект (завышение результатов измерений дихроматометрическим методом по сравнению с “сухим” анализом) может наблюдаться при исследовании некоторых пахотных почв и почв техногенных участков – почвы близи автодорог, нефтяных скважин и др. [2, 13, 26, 35]. Подобные объекты могут включать органические соединения, такие как, бензин, мазут, нефть, битум, молярная масса эквивалентов углерода которых составляет 1.9–2.5 (табл. 2), что значимо ниже принятой молярной массы эквивалента углерода органических веществ почв М(1/4С) = 3 г/моль. Данное значение рассчитано из условия, что усредненная степень окисления углерода, входящего в состав органических соединений разных типов почв, близка к нулю (реакция (1)). Следовательно, для почв техногенных участков дихроматометрический метод следует применять с осторожностью. Выбирая данный прием, следует помнить, что состав и строение ПОВ является фактором точности определения ключевого интегрального параметра гумусного состояния почв [13], используемого, в том числе, при оценке запасов почвенного органического углерода. Важность корректного расчета последнего для целей картографирования, прогноза возможных изменений планетарного круговорота углерода и др. общеизвестна [11, 16–18].
Таблица 2.
Молярная масса эквивалента углерода в различных органических соединениях
| Соединения | Реакции окисления | М(1/zC) | $\frac{{М\left( {{1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}{\text{С}}} \right)}}{{М\left( {{1 \mathord{\left/ {\vphantom {1 z}} \right. \kern-0em} z}{\text{С}}} \right)}}$ |
|---|---|---|---|
| г/моль | |||
| Парафиновые углеводороды | С8Н18 + 25/2О2 = 8СО2 + 9Н2О | 1.92 | 1.56 |
| С9Н20 + 14О2 = 9СО2 + 10Н2О | 1.93 | 1.56 | |
| С16Н32 + 49/2О2 = 16СО2 + 17Н2О | 1.96 | 1.53 | |
| Олефиновые углеводороды | С9Н18 + 27/2О2 = 9СО2 + 9Н2О | 2.00 | 1.50 |
| Ароматические углеводороды | С6Н6 + 15/2О2 = 6СО2 + 3Н2О | 2.40 | 1.25 |
| С6Н5–С3Н7 + 12О2 = 9СО2 + 6Н2О | 2.25 | 1.33 | |
| Нафтеновые углеводороды | С10Н8 + 12О2 = 10СО2 + 4Н2О | 2.50 | 1.20 |
| Фрагмент фульво- и гуминовых кислот | С47Н33О7N3 + 207/4О2 = = 47СО2 + 33/2Н2О + 3/2N2 |
2.67 | 1.13 |
Отдельные прописи метода (табл. 1) предусматривают нагрев реакционной смеси на электроплитке. Интенсивность нагрева зависит от вида используемого нагревательного прибора, установить одинаковый нагрев для всех систем невозможно. Однако температура нагрева реакционной смеси – важнейший фактор, определяющий полноту окисления ПОВ. Отсутствие единообразия приводит к низкой прецизионности результатов измерений. Следует упомянуть и о значительной токсичности хромовой смеси. Дихромат калия является сильным окислителем, обладает канцерогенными свойствами, что обуславливает вред для здоровья человека и состояния окружающей среды [21]. В сравнении с титриметрическим, фотометрический вариант измерений обеспечивает более безопасные условия работы.
Кроме того, проведенное ранее сравнительное исследование [36] позволило выявить ряд процедур, снижающих точность измерения ПОВ дихроматометрическим методом.
Во-первых, вызывает сомнение возможность использования бумажных фильтров для отделения жидкой и твердой фаз. Бумажные фильтры изготовлены из целлюлозы растений. Углерод органических соединений бумаги в условиях окисления углерода органических соединений почв может также взаимодействовать с дихромат-ионами. Экспериментально показано, что применение бумажных фильтров вызывает значимое завышение значения измеряемого показателя, что подтверждает окисление органического углерода фильтров дихромат-ионами (рис. 1).
Рис. 1.
Градуировочные графики: исходный (1), градуировочные растворы пропущены через обеззоленный фильтр с диаметром пор 2–3 мкм (2, 3) с соответствующими коэффициентами детерминации R2 = 0.99, 0.99, 0.97 соответственно (по [36]).

Во-вторых, не всегда выполнимой оказалась и процедура разделения жидкой и твердой фаз реакционной смеси путем отстаивания суспензий почв до “полного оседания частиц” [36], как это рекомендовано в [4]. В частности, отстаивание суспензий почв после окисления углерода органических соединений в течение суток не гарантирует установления равновесия в гетерогенной системе (рис. 2). Для установления прозрачности раствора в одних системах достаточно 24 ч, в других – даже после 72 ч мелкодисперсные частицы не оседают. Воспроизводимость результатов измерений оптической плотности надосадочных растворов после отстаивания в течение 24–48 ч составляет от 7 до 40%. Получить результаты измерений массовой доли углерода органических соединений с приемлемой точностью не представляется возможным. Установить одинаковое время отстаивания исследуемых систем для получения истинных надосадочных растворов с сохранением их состава также невозможно. Дополнительный отрицательный фактор длительного отстаивания – занижение результатов измерений за счет изменения окраски раствора и уменьшения оптической плотности до 8%. При этом уменьшение поглощения более характерно для растворов с большей концентрацией органического углерода [36]. Следует добавить, что граница видимости частиц в растворе невооруженным человеческим глазом равна 50–80 мкм [3]. При меньшем размере частиц исследователь воспринимает раствор как прозрачный. Однако раствор может отличаться от истинного и не соответствовать требованиям, предъявляемым к растворам, используемым для спектрофотометричеcкого измерения их оптической плотности.
Рис. 2.
Оценка показателя прецизионности результатов измерений содержания углерода органических соединений почв в условиях повторяемости (S(δ), %). Разделение фаз: a – отставанием реакционных смесей в течение 24 ч (1), 48 ч (2), центрифугированием (3) (метод Тюрина); b – отстаивание реакционных смесей в течение 24 ч (4), центрифугированием (5) (метод Уолкли–Блэка); c – центрифугированием методы Тюрина (3), Уолкли–Блэка (5) по [36].
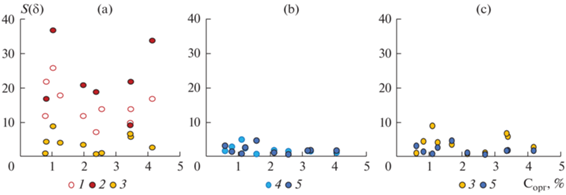
Отстаивание как способ разделения двух фаз после окисления органического вещества (углерода органических соединений) можно рекомендовать только для некоторых почв, взвесь которых достаточно быстро оседает на дно сосуда.
Учитывая названные процессы, в Институте биологии была разработана новая модификация метода Тюрина, которая прошла метрологическую аттестацию в Центре метрологии и сертификации “Сертимет” УрО РАН [7 ] (Федеральный информационный фонд обеспечения единства измерений, Россия, ФР.1.31.2020.38218, https://fgis.gost.ru/fundmetrology/registry/16). Методика рекомендована для почв с содержанием органического углерода от 0.17 до 8.7%, и для всего диапазона измерений Сорг при доверительной вероятности P = 0.95 имеет следующие метрологические характеристики: показатель внутрилабораторной прецизионности (precision) равен 7.6%, показатель правильности (trueness) – 14%, показатель точности (accuracy) – 20%.
Новая модификация предусматривает изменения процедур подготовки почв к измерениям, прописанных в [4], среди них следующие.
1. Введено центрифугирование надосадочной суспензии для получения прозрачного раствора. При центрифугировании надосадочной системы отделение жидкой фазы от осадка приводит к более стабильным результатам измерений массовой доли углерода органических соединений в почвах (рис. 2) и сокращает время данной процедуры.
2. Экспериментально доказано, что для градуировки спектрофотометра в качестве восстановителей допустимо использование и соли Мора, и сахарозы, поскольку оба восстановителя обеспечивают одинаковое качество измерений. Тесная связь между поглощением градуировочных растворов и массой углерода сахарозы или эквивалентным количеством железа (II) для всего диапазона органического углерода подтверждается высоким значением R2 > 0.9994.
3. В расчетную формулу содержания углерода органических соединений почв для учета неполного окисления углерода введен переходный коэффициент f = 1.15. Значение коэффициента f получено экспериментально при анализе 18 стандартных образцов почв (России, Великобритании, Glosolan) и более 100 образцов почв разного генезиса, географического положения и содержания органического углерода (рис. 3) [36]. В качестве референтного использовали метод высокотемпературного сжигания на анализаторе [34, 38]. В современных модификациях метода Тюрина учет неполного окисления углерода органических соединений в почвах не предусмотрен, хотя И.В. Тюрин в своих трудах предлагал ввести коэффициент 1.17, учитывающий неполное окисление углерода органических соединений [1].
Рис. 3.
Отношение измеренных двумя методами (высокотемпературного сжигания на анализаторе (Сорг-Ан) и Тюрина (Сорг)) содержаний органического углерода стандартных образцов почв производства Великобритании (1), Российской Федерации (2, 3), Glosolan (4); образцов почв разного генезиса (5).
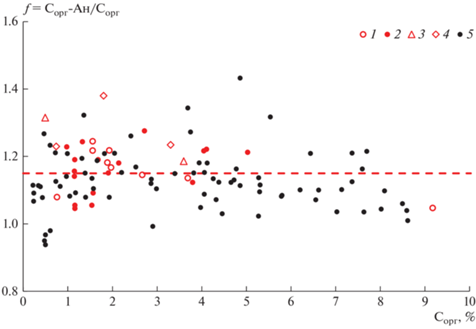
Корректирующий коэффициент f = 1.3 используют и в методе А. Уолкли и И. Блэка (далее – Уолкли–Блэка) [39, 40], причем отмечена тенденция к снижению значения переходного коэффициента с увеличением содержания ПОВ [33, 36]. Этот вариант дихроматометрического метода, широко распространен в практическом почвоведении США, Канады, Австралии и других стран. Имея в основе одну и ту же химическую реакцию (1), метод Уолкли–Блэка по процедурам существенно отличается от метода Тюрина. Во-первых, хромовая смесь в этом варианте дихроматометрического метода не готовится. Во-вторых, нагрев реакционной смеси происходит за счет экзотермического эффекта, возникающего при смешивании концентрированного раствора серной кислоты с дистиллированной водой при последовательном добавлении этих реактивов к образцу почвы. Температура нагрева реакционной смеси при смешении реагентов достигает 120°С [20]. В-третьих, концентрация дихромата калия и серной кислоты в реакционной смеси в 1.5 раза больше, что в методе Тюрина.
Вероятно, названные различия обуславливают большую эффективность окисления углерода органических соединений методом Тюрина по сравнению с методом Уолкли–Блэка (f = 1.15 против 1.3 соответственно). Есть основания полагать, что при подготовке образцов почв к измерениям в условиях первого метода происходит дополнительное диспергирование твердой фазы по сравнению со вторым. В первом случае осуществляется более длительное (один час) нагревание смесей почв с хромовой смесью при температуре (90–100)°С и перемешивание систем. Во втором – нагревание систем кратковременное, перемешивание одноразовое. Вероятно, твердые частицы не успевают разрушиться. Погрешность измерения углерода органических соединений почв даже после центрифугирования суспензий почв в условиях метода Уолкли–Блэка во всех образцах ниже, чем метода Тюрина (рис. 2). Более того, в методе Уолкли–Блэка отстаивание суспензий почв в течение суток, как правило, приводит к осаждению почвы. Показатель воспроизводимости результатов измерений не превышает 5%. Дополнительное центрифугирование надосадочной системы не требуется, поскольку не приводит к значимому улучшению качества результатов измерений.
Следует добавить, что, на наш взгляд, метод Уолкли–Блэка по сравнению с методом Тюрина более экспрессен из-за отсутствия процедуры приготовления хромовой смеси. Исключение процедуры нагревания суспензий почв с хромовой смесью в меньшей степени загрязняет рабочие зоны, следовательно, этот метод более экологичен и менее вреден для исполнителей. Метод Уолкли–Блэка также прошел метрологическую аттестацию в Центре метрологии и сертификации “Сертимет” УрО РАН [7 ] .
В завершение хотелось бы отметить, что единообразное выполнение процедур метода Тюрина и введение поправочного коэффициента позволило бы без проведения специальных исследований объединять сведения, полученные не только на национальном уровне, но и в глобальном масштабе. Продвижение унифицированных методик измерений на законодательном уровне может способствовать экспериментально обоснованному пересмотру устоявшихся подходов с целью глобализации знаний. Первый этап – аттестация методов и внесение их в Федеральный информационный фонд по обеспечению единства измерений. Второй этап предполагает поиск заинтересованных структур и проведение дополнительных межлабораторных испытаний для утверждения аттестованных методов в виде ГОСТа. Третий этап – получение международного стандарта.
Данное исследование выполнено в рамках работы коллектива Института биологии, как Национальной референтной лаборатории Российской Федерации, в Глобальной сети почвенных лабораторий Glosolan (Global Soil Laboratory Network at the Food and Agriculture Organization of the United Nations, Italy-Rome. Пропись модификация метода Тюрина, разработанная в Институте биологии, а также обучающий ролик размещены в открытом доступе на веб-сайте Glosolan https:// www.fao.org/global-soil-partnership/glosolan/soil-analysis/sops/volume-2-2/en/.
ЗАКЛЮЧЕНИЕ
Всплеск интереса к исследованию биогеохимического цикла углерода вообще и структуры гумусовых соединений в частности значительно повысили актуальность унификации методов измерений содержания почвенного органического вещества, разработанных разными научными школами.
Дихроматометрический метод, широко используемый в практике мирового почвоведения, реализуется в разных вариантах – методе Тюрина (и его модификациях) и методе Уолкли–Блэка. Эффективность окисления почвенного органического вещества, определяемая условиями протекания окислительно-восстановительной реакции (температуры, концентрации реагентов, времени окисления), в этих подходах и модификациях различны. Накопление несопоставимых между собой данных, полученных в разных лабораториях, затрудняет обобщение сведений в единые массивы для целей картографирования, моделирования, прогноза, рационального использования почвенных ресурсов.
Общее обсуждение результатов измерений ПОВ разными методами и модификациями, безусловное их объединение возможно только при а) обеспечении одинаковых условий окисления органического углерода; б) единообразном отделении осадка от раствора в методиках фотометрического метода; в) учете неокисленного углерода органических соединений при использовании в качестве окислителя дихромат-ионов.
Список литературы
Аринушкина Е.В. Руководство по химическому анализу почв. М.: Изд-во Моск. ун-та, 1970. 488 с.
Безуглова О.С., Горбов С.Н., Карпушова А.В., Тагивердиев С.С. Сравнительная характеристика методов определения органического углерода в почвах // Биологические науки. 2014. № 8. С. 1576–1580.
Гордеева В.В., Мурашкина И.А. Лекарственные формы для инъекций. Иркутск: Изд-во ИГМУ, 2020. 87 с.
ГОСТ 26213-91 Почвы. Методы определения органического вещества. М.: Изд-во стандартов. 1992. 10 с.
Заварзина А.Г., Данченко Н.Н., Демин В.В., Артемьева З.С., Когут Б.М. Гуминовые вещества – гипотезы и реальность // Почвоведение. 2021. № 12. С. 1449–1480. https://doi.org/10.31857/S0032180X21120169
Когут Б.М., Фрид А.С. Сравнительная оценка методов определения содержания гумуса в почвах // Почвоведение. 1993. № 9. С. 118–122.
Методика измерений № 88-17641-001-2020 (ФР.1.31.2020.38218). Почвы, грунты, почвообразующие породы, донные отложения. Методика измерений массовой доли углерода органических соединений и органического вещества фотометрическим методом (методы Тюрина и Уолкли–Блэка) / Е. В. Ванчикова, Б. М. Кондратёнок, Е. М. Лаптева, Е. В. Шамрикова, С. Н. Кострова, Е. А. Туманова, А. П. Давыдова, Е. И. Лю-Лян-Мин, Т. В. Зонова. ИБ Коми НЦ УрО РАН. Сыктывкар, 2020. 51 с.
Никитин Б.А. Уточнение к методике определения гумуса в почве // Агрохимия. 1983. № 8. С. 18–26.
Околелова А.А., Кокорина Н.Г. Расчет доли гумуса по результатам определения углерода органических соединений в почвах // Земледелие. 2010. № 1. С. 14–15.
Орлов Д.С., Гриндель Н.М. Спектрофотометрическое определение гумуса в почве // Почвоведение. 1967. № 1. С. 112–122.
Пастухов А.В., Каверин Д.А. Запасы почвенного углерода в тундровых и таежных экосистемах Северо-Восточной Европы // Почвоведение. 2013. № 9. С. 1084–1094. https://doi.org/10.7868/S0032180X13070083
Пономарева В.В., Плотникова Т.А. Гумус и почвообразование. Л.: Наука, 1980. 222 с.
Пономарева В.В., Плотникова Т.А. Некоторые данные о степени внутримолекулярной окисленности гумуса разных типов почв (к вопросу о переводном коэффициенте с углерода на гумус) // Почвоведение. 1967. № 7. С. 85–95.
Самофалова И.А., Лобанова Е.С. Почвоведение: лабораторный практикум. Пермь: ИПЦ “Прокростъ”, 2021. 139 с.
Тюрин И.В. Новое видоизменение объемного метода определения гумуса с помощью хромовой кислоты // Почвоведение. 1931. № 5–6. С. 36–47.
Чернова О.В., Голозубов О.М., Алябина И.О., Щепащенко Д.Г. Комплексный подход к картографической оценке запасов органического углерода в почвах России // Почвоведение. 2021. № 3. С. 273–286. https://doi.org/10.31857/S0032180X21030047
Чесных О.В., Замолодчиков Д.Г., Уткин А.И., Коровин Г.Н. Распределение запасов органического углерода в почвах лесов России // Лесоведение. 1999. № 2. С. 13–21.
Щепащенко Д.Г., Мухортова Л.В., Швиденко А.З., Ведрова Э.Ф. Запасы органического углерода в почвах России // Почвоведение. 2013. № 2. С. 123–132. https://doi.org/10.7868/S0032180X13020123
Цыпленков В.П., Попов А.И. Колориметрическое определение органического углерода в растворах // Вестн. Ленингр. ун-та. Сер. биол. 1979. Вып. 4. № 21. С. 112–113.
Allison L.E. Organic Carbon. Methods of Soil Analysis Part 2 Chemical and Microbiological Properties // Agronomy. Am. Soc. of Agronomy. Inc. Madison, Wisconsin, USA. 1965. № 9. P. 1372–1378.
Dias R., Silva D., Abreu C., Abreu M., Paz-Ferreiro J., Matsura E., Gonzálezcle A. Comparison of methods to quantify organic carbon in soil samples from São Paulo State, Brazil // Communications in Soil Science and Plant Analysis. 2013. № 44. P. 429–439. https://doi.org/10.1080/00103624.2013.742345
Gatto A., Barros N.F., Novais R.F., Silva I.R., Mendonça E.S., Villani E.M.A. Comparison of methods for determination of organic carbon in soils under eucalypt plantations // Revista Brasileira de Ciência do Solo. 2009. № 33. P. 735–740 (in Portuguese, with abstract in English).
Guevara M., Vargas R., Arroyo C., Brunsell N., Cruz C.O., Domke G., Equihua J., Etchevers J., Hayes D., Hengl T., Ibelles A., Johnson K., de Jong B., Libohova Z., Nave L., Ornelas J.L., Paz F., Ressl R., Schwartz A., Victoria A., Wills S. Mapping organic carbon in soils of Mexico and United States // Global Biogeochemical Cycles. 2018. V. 34. https://doi.org/10.1029/2019GB006219
Jha P., Biswas A.K., Lakaria B., Saha R., Singh M., Rao S. Predicting total organic carbon content of soils from Walkley and Black analysis // Communications in Soil Science and Plant Analysis. 2014. V. 45(6). P. 713–725. https://doi.org/10.1080/00103624.2013.874023
Kerven G.L., Menzies N.W., Geyer M.D. Soil carbon determination by high temperature combustion – A comparison with dichromate oxidation procedures and the influence of charcoal and carbon on the measured value // Communications in Soil Science and Plant Analysis. 2000. V. 31. № 11–14. P. 1935–1939. https://doi.org/10.1080/00103620009370551
Koegel-Knabner I. Analytical approaches for characterizing soil organic matter // Organic Geochemistry. 2000. V. 31. P. 609–625.
Lettens S., Van Orshoven J., van Wesemael B., De Vos B., Muys B. Stocks and fluxes of soil organic carbon for landscape units in Belgium derived from heterogeneous data sets for 1990 and 2000 // Geoderma. 2005. V. 127. P. 11–23. https://doi.org/10.1016/j.geoderma.2004.11.001
McCarty G.W., Reeves III J.B., Yost R., Doraiswamy P.C., Doumbia M. Evaluation of methods for measuring soil organic carbon in West African soils // African J. Agricultural Research. 2010. V. 5. P. 2169–2177.
Mikhailova E.A., Noble R.R.P., Post C.J. Comparison of soil organic carbon recovery by Walkley-Black and dry combustion methods in the Russian chernozem // Communications in Soil Science and Plant Analysis. 2003. V. 34. № 13–14. P. 1853–1860. https://doi.org/10.1081/CSS-120023220
Minasny B., McBratney A.B., Wadoux M.J-C., Akoeb E.N., Sabrina T. Precocious 19th century soil carbon science // Geoderma Regional. 2020. V. 22. P. 1–6. https://doi.org/10.1016/j.geodrs.2020.e00306
Nelson D.W., Sommers L.E. Total carbon, organic carbon, and organic matter // Methods of Soil Analysis. Part 3, Chemical Methods. Soil Sci. Soc. of Am. Book Series № 5. Soil Sci. Soc. of Am. – Am. Soc. of Agronomy. Madison, WI. 1996. P. 961–1010.
Paustian K., Collier S., Baldock J., Burgess R., Creque J., DeLonge M. Quantifying carbon for agricultural soil management: From the current status toward a global soil information system // Carbon Management. 2019. V. 10(6). P. 567–587. https://doi.org/10.1080/17583004.2019.1633231
Pribyl D.W. A critical review of the conventional SOC to SOM conversion factor // Geoderma. 2010. V. 156. P. 75–83. https://doi.org/10.1016/j.geoderma.2010.02.003
Roper W.R., Robarge W.P., Osmond D.L., Heitman J.L. Comparing four methods of measuring soil organic matter in North Carolina soils // Soil Sci. Soc. Am. J. 2019. V. 83(2). P. 466–474. https://doi.org/10.2136/sssaj2018.03.0105
Schmidt M.W.I., Skjemstad J.O., Gehrt E., Koegel-Knabner I. Charred organic carbo. N in German chernozemic soils // European J. Soil Science. 1999. V. 50. P. 351–365.
Shamrikova E.V., Kondratenok B.M., Tumanova E.A., Vanchikova E.V., Lapteva E.M., Zonova T.V., Lu-Lyan-Min E.I., Davydova A.P., Libohova Z., Suvannang N. Transferability between soil organic matter measurement methods for database harmonization // Geoderma. 2022. V. 412. https://doi.org/10.1016/j.geoderma.2021.115547
Silva A.C., Vidal-Torrado P., Abreu Junior J. Methods of quantification of the organic matter of the soil // Revista Unifenas Alfenas. 1999. V. 5. P. 21–26.
Sleutel S., De Neve S., Singier B., Hofman G. Quantification of organic carbon in soils: A comparison of methodologies and assessment of the carbon content of organic matter // Communications in Soil Science and Plant Analysis. 2007. V. 38. № 19–20. P. 2647–2657. https://doi.org/10.1080/00103620701662877
Van Reeuwijik L.P. Procedures for Soil Analysis. 6th ed., Netherlands: Wageningen International Soil Reference and Information Centre // Technical Paper. 2002. V. 9. 120 p.
Walkley A., Black I.A. An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method // Soil Science. 1934. V. 37. P. 29–38.
Дополнительные материалы отсутствуют.


