Почвоведение, 2022, № 7, стр. 918-928
Влияние фракций растворенного органического вещества с разной молекулярной массой и Cd2+ на рост Scenedesmus obliquus
В. В. Тихонов a, *, Е. Н. Воронова a, М. М. Карпухин a, Р. А. Аймалетдинов a, В. В. Демин a, О. Ю. Дроздова a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: vvt1985@gmail.com
Поступила в редакцию 06.12.2021
После доработки 29.12.2021
Принята к публикации 26.01.2022
- EDN: MVCYPH
- DOI: 10.31857/S0032180X22070115
Аннотация
Изучено влияние фракций растворенного органического вещества (РОВ) с разной молекулярной массой и ионов Cd2+ на скорость роста Scenedesmus obliquus. Исследования проводили как отдельно для РОВ и Cd2+, так и при их совместном присутствии. Фракции РОВ (>30, 10–30, 3–10, 1–3 и <1 кДа) получали методом ультрафильтрации, рост водорослей фиксировали по содержанию хлорофилла, определяемого спектрофотометрически при 678 нм. Установлено, что Cd2+ в концентрации 5.62–22.5 мг/л стимулировал, а в концентрации 56.2 и 112.4 мкг/л подавлял рост водорослей. Фракции РОВ оказывали различное воздействие на S. obliquus. Они как подавляли, так и стимулировали рост водорослей в диапазоне 0.001–1 мг С/л, и эффект воздействия на скорость роста лежал в диапазоне ±10–25%. Наибольший положительный отклик на рост микроводорослей оказала фракция <1 кДа, что, вероятно, связано с активным участием данной фракции в питании организма. При наличии ингибирующих концентраций Cd2+ фракции РОВ 30, 1–3 и <1 кДа оказывали положительное влияние на рост S. obliquus. Возможными механизмами такого влияния РОВ являлось связывание с ним ионов Cd2+ (преимущественно на поверхности клеток водорослей), а также высокая биологическая активность его низкомолекулярной фракции <1 кДа. Впервые получены данные по влиянию тяжелых металлов на водоросли в присутствии фракций РОВ с разной молекулярной массой. Они расширяют наше представление о механизмах регулирования численности и состояния микроводорослей в экосистемах при воздействии на нее тяжелых металлов.
ВВЕДЕНИЕ
Антропогенное поступление тяжелых металлов в поверхностные континентальные воды может отрицательно повлиять на водные организмы, поскольку некоторые из этих металлов очень токсичны даже при относительно низких концентрациях [47]. Растворенное органическое вещество (РОВ) является одним из факторов, контролирующих формы нахождения металлов в природных водах. Биодоступность и токсичность некоторых металлов в поверхностных водах могут уменьшаться за счет образования комплекса с РОВ [18]. Кроме того, РОВ может сорбироваться на биотических поверхностях (например, поверхностях водорослей), препятствуя внутриклеточному поглощению металлов [17]. Доступность ионов металлов также зависит от такого динамичного, меняющегося в зависимости от времени и сезона, параметра, как размер частиц органической фракции, с которой они связаны [10, 11]. Зеленые микроводоросли рода Scenedesmus – обычные пресноводные виды, часто используемые в физиологических исследованиях. Также Scenedesmus spp. широко встречаются в почвах как переувлажненных [34], так и засушливых районов [22, 46], активно участвуя в депонировании C и N в почве [40]. Они в значительной степени устойчивы к металлам и легко накапливают их, включая Cd, Ni [19, 32], Pb [31] или Zn [14].
Основная часть РОВ в природных водах (до 70% от общего органического углерода) представлена гуминовыми веществами [18, 48]. В ряде работ изучалось влияние гуминовых веществ и подобных органических молекул на токсичность и биодоступность металлов как для макро- [55], так и микроводорослей [18, 38]. Отдельно изучалось влияние РОВ и, в частности, гуминовых веществ на скорость роста водорослей [33, 44, 56]. Влияние фракций РОВ на рост водорослей изучен недостаточно, а исследований влияния фракций РОВ разной молекулярной массы на изменения токсичности тяжелых металлов по отношению к водорослям ранее не проводилось.
Таким образом, для оценки потенциальной токсичности кадмия в природных водах необходимо понимание роли различных фракций органических веществ в токсичности металлов.
В данной работе было изучено влияние пяти фракций РОВ, выделенных с использованием метода ультрафильтрации, на рост Scenedesmus obliquus (Turpin) Kuetzing, 1883. Также было исследовано влияние этих фракций на токсичность кадмия по отношению к S. obliquus.
ОБЪЕКТЫ И МЕТОДЫ
РОВ представлено гуминовой кислотой (cas № 1415-93-6, Aldrich), растворенной в 0.01 М NaOH с последующим доведением раствора до pH 7 с помощью 1 M HCl. Основные химические характеристики использованного препарата (Sigma-Aldrich): С – 68.98%, Н – 5.26%, N – 0.74%, S – 4.24% и О – 43.55% СООН-группы – 4.38 ± 0.03 мэкв/г, ОН-фенольные группы – 2.71 ± 0.03 мэкв/г [23, 37]. Дополнительная информация о структуре этой кислоты и ее фракций, полученных методом ультрафильтрации, приведена в следующих работах [16, 23].
Фракционирование РОВ по молекулярным весам. Для дополнительной очистки РОВ перед фракционированием проба была пропущена через фильтр 0.2 мкм. Фракционирование РОВ проводили методом ультрафильтрации с помощью установки фирмы Amicon и фильтров Millipore с размером пор 1, 3, 10 и 30 кДа. В эксперименте исследовали исходное РОВ (РОВНФ), а также его фракции: <1 кДа (РОВ<1 кДа), 1–3 кДа (РОВ1–3 кДа), 3–10 кДа (РОВ3–10 кДа), 10–30 кДа (РОВ10–30 кДа), >30 кДа (РОВ>30 кДа). Концентрации фракций РОВ считали по органическому углероду, который определяли на жидкостном элементном анализаторе (LiquiTOC trace, Elementar).
Определение карбоксильных групп фракций РОВ. Расчет количества карбоксильных групп проводили с учетом их содержания 10 ммоль/г ГK [29].
Растворы ионов кадмия. В опытах по влиянию ионов Cd на рост водорослей использовали водные растворы CdСl2 (рН 7). Контроль количества Cd2+ проводили на оптико-эмиссионном спектрометре с индуктивно связанной плазмой Agilent 5110 ICP-OES.
Анализ связанных форм кадмия с РОВ. С учетом химического состава растворов были выполнены расчеты форм кадмия в исследованных системах с использованием программы Visual MINTEQ ver. 3.1 [13] в сочетании с базой данных и моделями привязки гуминовых веществ NICA-Donnan для вариантов с РОВ.
Водоросли. В качестве объекта исследования выбрана пресноводная зеленая водоросль Scenedesmus obliquus (Turpin) Kutzing. Этот вид широко распространен в природе и является типичным объектом для биоиндикации и биотестирования. Предварительное культивирование альгологически чистой культуры водорослей проводили на среде Тамия в разведении 1/2. Состав среды: KNO3 – 5 г/л, MgSO4∙7H2O – 2.5 г/л, KH2PO4 – 1.25 г/л, FeSO4∙7H2O – 0.003 г/л, Na2ЭДТА – 0.037 г/л, раствор микроэлементов – 1 мл/л. Раствор микроэлементов (состав): H3BO3 – 2.86 г/л, MnCl2∙4H2O – 1.81 г/л, ZnSO4∙4H2O – 0.222 г/л, MoO3 – 176.4 мг/10 л, NH4VO3 – 229.6 мг/10 л.
Для проведения экспериментов с добавлением солей тяжелых металлов и РОВ водоросли пересаживали на среду Тамия в разведении 1/40, из которой были удалены фосфаты и Na2ЭДТА. Такая среда необходима, так как при увеличении содержания в воде кальция, магния и фосфатов токсичность солей тяжелых металлов для большинства видов водорослей уменьшается. Na2ЭДТА способна сорбировать соли тяжелых металлов [2, 36]. Токсичность также зависит от кислотно-щелочных условий. Для поддержания постоянных значений рН в среду был добавлен буферный раствор HEPES. Конечная концентрация HEPES в среде 10–3 М. рН среды составлял 7.5. Водоросли выращивали в конических колбах объемом 50 мл при непрерывном облучении светодиодными лампами (LED) интенсивностью 20 мкМ квантов/(м2 с) при температуре 22°С в накопительной культуре. Для определения относительного содержания хлорофилла а измеряли спектры его поглощения в суспензии водорослей в диапазоне от 350 до 850 нм на однолучевом спектрофотометре с интегрирующей сферой на базе спектрометра USB2000 (Ocean Optics, USA). Спектр поглощения суспензии водорослей вычисляли из двух спектров ослабления света, полученных при установке кюветы с образцом на разных расстояниях от интегрирующей сферы, что позволяло определить и рассеяние света на образце [27]. Относительное содержание хлорофилла определяли из вычисленных спектров как значение оптической плотности на длине волны 678 нм (максимум поглощения хлорофилла). Известно, что существует прямая корреляция между численностью в культуре водорослей и содержанием хлорофилла а. Для выяснения зависимости между относительным содержанием хлорофилла а и численностью водорослей в пробе была проведена калибровка. Для этого численность определяли методом прямого счета клеток в камере Горяева. Начальная концентрация водорослей в экспериментах составляла 0.075–0.11 единиц оптической плотности на длине волны 678 нм, что соответствовало численности 185–230 тыс. клеток/мл.
Постановка экспериментов. В исследованиях влияния РОВНФ на рост водорослей добавляли водные растворы РОВ, конечные концентрации были 0.001, 0.01, 0.1, 0.125, 0.25, 0.5, 1, 1.25, 2.5, 5, 10, 20, 30, 40, 50 мг/л. В контрольный вариант добавляли эквивалентное количество дистиллированной воды.
В исследованиях влияния Cd2+ на рост водорослей в опытные образцы добавляли водные растворы СdСl, в которых конечная концентрация Cd2+ была 5.62, 11.24, 22.5, 56.2, и 112.4 мкг/л. В контрольный вариант добавляли эквивалентное количество дистиллированной воды.
В исследованиях влияния фракций РОВ на рост водорослей добавляли водные растворы РОВ, их конечные концентрации были 0.001, 0.01, 0.1 и 1 мгС/л. В контрольный вариант добавляли эквивалентное количество дистиллированной воды.
В исследованиях с фракциями РОВ в присутствии Cd2+ на рост водорослей исследовали две концентрации металла 56.2 и 112.4 мкг/л и одну концентрацию органического вещества – 0.1 мг С/л. В контрольный вариант добавляли эквивалентное количество РОВ.
В экспериментах была трехкратная повторность для опытных вариантов и 12-кратная для контрольного варианта.
В исследованиях влияния связанных комплексов РОВ-Cd2+ на рост водорослей использовали растворы комплекса РОВ-Cd в соотношении 1 мг Сd2+ к 20 мг С(РОВ). Мы исходили из того, что максимальная емкость связывания Cd2+ (поведение этого катиона в растворах гуминовых веществ сходно с поведением Cu2+) фульвокислотами, выделенными из поверхностных вод, составляет в зависимости от условий эксперимента 1/5 – 1/20 мгCd(II)/мгРОВ [26].
Концентрации комплексов составляли 5.62, 11.24, 22.5, 56.2 и 112.4 мкг/л в пересчете по кадмию. В контрольный вариант добавляли эквивалентное количество кадмия или РОВ. В эксперименте была трехкратная повторность.
Расчет максимальной удельной скорости роста. Измерения спектров поглощения хлорофилла проводили сразу после добавления токсикантов и гуминовой кислоты, через 24, 48 и 72 ч после начала инкубации. Максимальную удельную скорость роста водорослей определяли путем логарифмирования значений численности в экспоненциальную фазу роста. Значения скорости роста культуры соответствовали угловому коэффициенту линейного уравнения вида y = kx + b.
РЕЗУЛЬТАТЫ
Доля фракций в РОВ и содержание карбоксильных групп в них. РОВ состоит преимущественно из фракции РОВ>30 кДа (около 78%), которая содержала меньшее количество карбоксильных групп, чем остальные фракции (табл. 1). Достоверной разницы между содержанием карбоксильных групп в остальных фракциях не выявлено.
Таблица 1.
Процентное содержание фракций в РОВ и карбоксильных групп в них (± ошибка среднего)
| Фракция | [–COOH], ммоль/г РОВ | % фракций |
|---|---|---|
| РОВНФ | 2.7 ± 0.1 | 100 |
| РОВ>30 кДа | 1.9 ± 0.2 | 77.8 |
| РОВ10–30 кДа | 3.4 ± 0.2 | 9.7 |
| РОВ3–10 кДа | 3.3 ± 0.1 | 1.5 |
| РОВ1–3 кДа | 3.7 ± 0.3 | 1.0 |
| РОВ<1 кДа | 3.3 ± 0.2 | 10.0 |
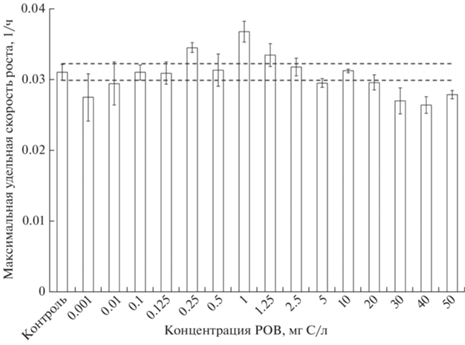
Влияние РОВ на рост водорослей. РОВНФ достоверно увеличивал скорость роста водорослей при концентрациях 0.25 и 1 мг/л на 9 и 19% соответственно. При концентрациях >30 мг/л происходило уменьшение скорости роста водорослей на 13–16% (рис. 1). В остальных вариантах достоверной разницы с контролем обнаружено не было. Слабовыраженная тенденция уменьшения скорости роста водорослей наблюдалась при воздействии сверхнизких доз РОВ (0.001 и 0.01 мг С/л).
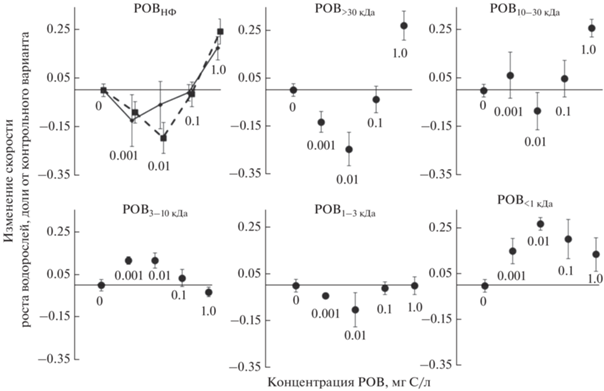
Влияние фракций РОВ на рост водорослей. РОВ>30 кДа подавляла рост водорослей в низких концентрациях (0.01 и 0.1 мг/л) и стимулировали при концентрации 1 мг/л. РОВ10–30 кДа стимулировала рост водорослей при концентрации 1 мг/л. РОВ3–10 кДа увеличивала рост водорослей при концентрации 0.001 и 0.01 мг/л. РОВ1–3 кДа не влияла на рост водорослей во всех концентрациях, а РОВ<1 кДа стимулировла рост водорослей во всех концентрациях (рис. 2). Разнонаправленное влияние на рост было просуммировано с учетом количества фракций в РОВ (табл. 1) и полученная теоретическая кривая доза-эффект хорошо совпала с практической кривой РОВНФ. Таким образом, биологическая активность РОВНФ может быть представлена как сумма биологических откликов индивидуальных фракций РОВ.
Рис. 2.
Влияние РОВНФ и фракций на изменение максимальной удельной скорости роста Scenedesmus obliquus. РОВНФ (сплошная линия) – фактические данные, РОВНФ (пунктирная линия) – теоретическая кривая на основе суммирования эффектов с учетом количества фракций в РОВ.
Влияние Cd на рост водорослей. Cd в концентрациях 5.6, 11.2 и 22.5 мкг/л стимулировал скорость роста водорослей на 9, 17 и 24% соответственно и подавлял рост при концентрации 56 и 112.4 мкг/л на 11 и 65% соответственно (рис. 3).
Рис. 3.
Влияние СdСl2 на скорость роста Scenedesmus obliquus. Концентрация Cd, мкг/л: 1 – контроль, 2 – 5.62, 3 – 11.24, 4 – 22.5, 5 – 56.2, 6 – 112.4.

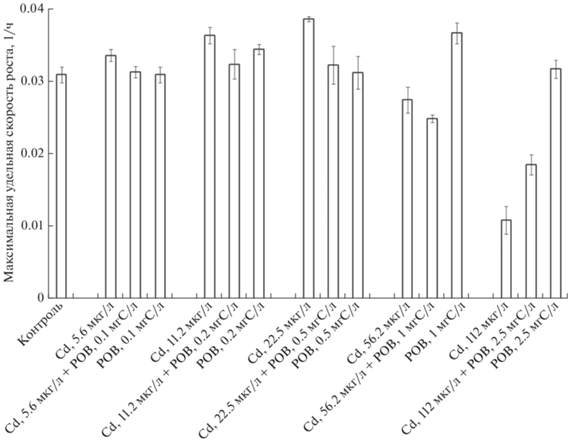
Влияния фракций РОВ на рост водорослей в присутствии Cd. Кадмий во всех вариантах эксперимента подавлял рост водорослей. Наличие в системе РОВНФ, РОВ>30 кДа, РОВ1–3 кДа и РОВ<1 кДа достоверно увеличивало скорость роста S. obliquus. В присутствии РОВ10–30 кДа, РОВ3–10 кДа и 112 мкг/л Сd2+ рост водорослей полностью отсутствовал (рис. 4).
Рис. 4.
Влияние СdСl2 на скорость роста Scenedesmus obliquus в присутствии 0.1 мг С/л РОВ и его фракций.

Влияние комплексов РОВНФ-Cd на рост Scenedesmus obliquus при разном разбавлении. Комплексы РОВ-Cd оказывали меньшее воздействие на рост водорослей, чем свободный Cd (рис. 5). Снижение токсичности Сd было не связано с биологической активностью РОВНФ.
ОБСУЖДЕНИЕ
Полученные в наших экспериментах кривые доза-эффект отличались от классических колоколообразных графиков, характерных для эссенциальных элементов: небольшой, плохо выраженный эффект ингибирования роста клеток водорослей в области сверхнизких концентраций РОВНФ сменялся слабым стимулированием роста и последующим ингибированием размножения клеток при концентрации РОВНФ больше 2.5 мг/л. Ранее в ряде работ отмечено негативное влияние РОВ в концентрациях <0.1 мг/л [43–45]. Негативное влияние высокой концентрации РОВ связывали с повреждением клеточной мембраны и усилением окислительного стресса у микроводорослей [56]. Однако присутствие в среде РОВ в концентрации до 2 мг/л стимулировало синтез хлорофилла и биомолекул [56], а также улучшало питание водорослей, облегчая за счет хелатирования микроэлементов их последующий транспорт в клетки [41]. В наших экспериментах из состава питательной среды был удален хелатирующий агент – ЭДТА, и функцию переносчика ионов Fe2+, Zn2+ и Mn2+ могли играть низкомолекулярные компоненты исходного РОВНФ. Вероятно, этим можно объяснить появление слабовыраженного оптимума на кривой доза-эффект при содержании РОВНФ около 1 мг С/л. При более высоких концентрациях РОВНФ может начинаться повреждение клеточных мембран и действие двух различных механизмов биологического влияния РОВ на клетку вызывает разнонаправленные отклики [56], поэтому, по-видимому, и наблюдаются неклассические кривые доза-эффект. Влияние разных по молекулярной массе фракций РОВ на рост водорослей было ранее исследовано на таких тест-объектах, как динофлагелляты [9, 15, 42], зеленые [50] и диатомовые [9] водоросли, на представителях Scenedesmus sp. такая работа проведена впервые. В одних публикациях отмечалось различное воздействие фракций на рост водорослей: негативное влияние фракций 1–10 кДа [9] и фракции <1 кДа по сравнению с высокомолекулярными фракциями [50], в других, напротив, не обнаружено различий в действии между гуминовыми и фульвокислотами [15].
Анализ представленных на рис. 2 данных позволяет выявить одну из причин, вызывающих эти противоречия, – величина и знак эффекта зависят от использованной в экспериментах концентрации РОВ. Например, при концентрации 0.1 мг С/л влияние РОВ на рост водоросли практически отсутствовало (исключение – фракция РОВ<1 кДа). В то же время эффекты при содержании РОВ в среде 0.01 мг С/л в большинстве случаев максимальны и имеют различный знак: отрицательный для РОВНФ, РОВ>30 кДа, РОВ10–30 кДа и РОВ1–3 кДа и положительный для РОВ3–10 кДа и РОВ<1 кДа. Максимальная амплитуда эффектов отмечается для фракций РОВ>30 кДа и РОВ<1 кДа.
Хорошее совпадение экспериментальной и расчетной кривых доза-эффект для фракции РОВНФ обусловлены в первую очередь тем, что на 80% она состоит из фракции РОВ>30 кДа, но, вероятно, высокая степень аддитивности исключает наличие синергетических эффектов. Высокая биологическая активность РОВ<1 кДа может быть также объяснена возможностью низкомолекулярных органических веществ легче проникать в клетку, участвуя в ее питании [4, 5, 7, 41].
Известно, что Cd подавляет рост водорослей, разрушая клетки и негативно влияя на метаболизм, однако сведений положительного влияния на рост, который мы наблюдали в эксперименте (рис. 3), крайне мало. Так, в концентрациях 46–123 мкг/л Cd стимулировал рост Scenedesmus protuberans [21], при концентрации 21 мкг/л возрастал рост Scenedesmus accuminatus var. biseratus [52], а концентрация 200 мкг/л не влияла на рост Schroederia setigera [28]. Механизмы процесса остаются малоизученными. Отмечалось, что среди родов Ankistrodesmus, Chlorella и Scenedesmus представители рода Scenedesmus являлись наиболее устойчивыми к загрязнению воды Cd [12]. Можно предположить, что при низких концентрациях микроэлементов в растворе (1/40 среды Тамия) ионы Cd2+, занимая отрицательно заряженные центры, ассоциированные с клеточной стенкой водоросли, могли хотя бы частично облегчать поступление Fe2+, Mn2+ и Zn2+ в клетку. В то же время низкая концентрация конкурирующих с Cd2+ ионов эссенциальных микроэлементов ограничивает верхний предел концентраций, при которых наблюдается стимулирующий эффект Cd: 22.5 мкг/л в наших экспериментах и 123–200 мкг/л зарегистрированная в работах, цитированных выше, в которых использовались стандартные питательные среды.
Имеется множество работ, посвященных изучению влияния РОВ на уменьшение токсичности и биодоступности Cd микроводорослям [20, 51]. Часть авторов описывала явление образованием комплексов Cd-РОВ в растворе и уменьшением доступности свободных ионов к клетке [20, 35], другие объясняли явление адсорбцией РОВ на поверхности клеток [30], что уменьшало количество адсорбционных центров для свободного металла. Некоторые авторы при работе со схожим по поведению ионом Сu2+ объясняли снижение токсичности металла защитой РОВ ферментативного аппарата водорослей, что приводило к уменьшению секреции биопленок по сравнению с вариантом Сu2+ без РОВ [39]. Имеются данные, что переход на миксотрофию вызывал большую резистентность к Cd у водорослей, чем чисто автотрофное питание [24]. Миксотрофия известна и для Scenedesmus obliquus [54].
Для оценки возможности образования в достаточном количестве комплексов Cd2+ c РОВ с помощью программы VisualMinteq ver. 3.1 и модели NICA-Donnan, описывающей взаимодействие ионов металлов с РОВ, были выполнены расчеты для концентрации фракций РОВ в среде 0.1 и 2.5 мг/л и соответствующего количества карбоксильных групп. Полученные результаты показывают, что в использованной культуральной среде доля комплексов Cd2+ c РОВ при концентрации последних 0.1 мг С/л равнялась 0.3%, а при 2.5 мг С/л – 10%. Все органическое вещество в растворе было связано в комплексы с катионами питательной среды: абсолютно доминировали комплексы с Mg2+, комплексы с Fe2+, Mn2+ и Zn2+ существовали в минорных количествах. Таким образом, основным механизмом уменьшения токсичности Cd в присутствии РОВ>30 кДа не может быть объяснено связыванием ионов Cd2 в растворе, а компенсация негативного влияния Cd2+ на клетки водоросли за счет положительной биологической активности РОВ возможно только для фракции РОВ < 1 кДа.
Можно предположить, что основным механизмом уменьшения токсичности Cd2+ является ограничение скорости переноса катиона через клеточную стенку к плазматической мембране из-за тех затруднений, которые возникают при связывании РОВ на поверхности клеток. Локализация гуминовых веществ на клетках может рассматриваться как один из механизмов проявления защитного действия этих полимеров на живые организмы [1]. Показано, что РОВ активно адсорбируется на микроводорослях [6], в количестве, близком для клеток бактерий [3]. Прокариоты связывают преимущественно высокомолекулярные фракции РОВ [25, 49] и, вероятно, это может быть справедливо и для водорослей.
Концентрация эссенциальных микроэлементов в очень разбавленных средах является величиной, по порядку близкой к концентрации исследуемого токсичного иона металла и концентрации отрицательно заряженных центров связывания ионов как в молекулах РОВ (СООН-группы), так и в клеточных стенках водоросли (те же СООН-группы). Поэтому наблюдаемые изменения в скоростях роста водоросли следует приписывать не только присутствию ионов Cd2+, но и возможному дефициту эссенциальных микроэлементов.
Эффект смягчения негативного действия Cd2+, вызванный присутствием в культуральной среде фракций РОВ>30 кДа и РОВ<1 кДа следует, вероятно, объяснять разными причинами. Сорбция высокомолекулярных фракций РОВ клеточными стенками водоросли тормозит перенос в клетку и ионов Cd2+, и ионов эссенциальных элементов. Напротив, низкомолекулярные компоненты РОВ, образуя комплексы с ионами микроэлементов, ускоряют их транспорт через клеточную стенку, улучшая снабжение клетки необходимыми элементами, смягчая таким образом негативный эффект присутствия в среде Cd2+.
Хорошо выраженная аддитивность действия различных фракций РОВ, полученная в описанных выше экспериментах, нарушалась с введением в раствор ионов Cd2+. Обращает внимание ярко выраженный отрицательный эффект присутствия в среде фракций РОВ10–30 кДа и РОВ3–10 кДа (рис. 4), в то время как на кривых доза-эффект какие-либо значимые эффекты для этих фракций не наблюдались (рис. 2). Возможно, причиной отклонения от простых закономерностей являлось значительное различие в константах устойчивости комплексов различных фракций РОВ с ионами металлов. Зависимость констант устойчивости РОВ с кадмием от молекулярной массы фракций, по-видимому, не линейна, например для Со [53] получен следующий ряд: kРОВ 5–10 кДа$ \gg $ kРОВ < 5 кДа > > kРОВ 30–100 кДа > kРОВ 10–30 кДа и определено, что низкомолекулярные фракции <10 кДа увеличивали выживаемость дафний в присутствии кобальта, а высокомолекулярные (30–100 и >100 кДа), напротив, подавляли их жизнедеятельность.
ЗАКЛЮЧЕНИЕ
Исследование по влиянию Cd на рост водорослей в присутствии фракций РОВ разных молекулярных масс является первым исследованием на водорослях. Полученные данные свидетельствуют о том, что фракции РОВ могут как усиливать, так и уменьшать токсичность металла. Сложность изучения данного феномена заключается в разнообразии эффектов для РОВ и тяжелых металлов: Cd в микроконцентрациях может оказывать положительное влияние на рост водорослей, в то время как РОВ уже в концентрации 1 мкг/л – подавляет рост. Таким образом, исследования только чистых веществ и использование исключительно критерия скорости роста при оценке воздействия токсикантов на организмы, являются некорректным подходом, хотя они лежат в основе многих экотоксикологических тестов (например, OECD 201, ГОСТ 32293-2013). По-видимому, не совсем точно говорить о РОВ (или гуминовых веществах), как веществах, смягчающих стресс при рассмотрении воздействия на индивидуальную особь, и следует признать, что, находясь в естественных природных условиях, водоросли подвержены большему стрессу, нежели лабораторные культуры, в том числе под действием РОВ. На популяционном и экосистемном уровнях РОВ безусловно являются веществами, ослабляющими негативные эффекты, и при взаимодействии с металлами основным механизмом смягчения воздействия является связывание РОВ и их фракциями токсикантов в неактивные комплексы. На наш взгляд, перспективными являются работы по изучению адсорбционных явлений РОВ и прочих токсикантов на поверхности организмов. Адсорбция веществ на клетках микроорганизмов и ее изменение под действием природных факторов может являться важным фактором устойчивости природных экосистем.
Список литературы
Демин В.В., Терентьев В.А., Завгородняя Ю.А. Вероятный механизм действия гуминовых веществ на живые клетки // Гуминовые вещества в биосфере. М.: Изд-во Моск. ун-та, 2004. С. 37–40.
Мур Д., Раммамурти С. Тяжелые металлы в природных водах. Контроль и оценка влияния. М.: Мир, 1987. 288 с.
Тихонов В.В., Орлов Д.С., Лисовицкая О.В., Завгородняя Ю.А., Бызов Б.А., Демин В.В. Сорбция гуминовых кислот бактериями // Микробиология. 2013. № 82(6). С. 691–697.
Antia N., Harrison P., Oliveira L. Phycological reviews: the role of dissolved organic nitrogen in phytoplankton nutrition, cell biology, and ecology // Phycologia. 1991. V. 30. P. 1–89. https://doi.org/10.2216/i0031-8884-30-1-1.1
Baltazar M., Correia S., Guinan K., Sujeeth N., Bragança R., Goncalves B. Recent advances in the molecular effects of biostimulants in plants: An Overview // Biomolecules. 2021. V. 11. P. 1096. https://doi.org/10.3390/biom11081096
Campbell P., Twiss M., Wilkinson K. Accumulation of natural organic matter on the surfaces of living cells: implications for the interaction of toxic solutes with aquatic biota // Can. J. Fish. Aquat. Sci. 2011. V. 54. P. 2543–2554. https://doi.org/10.1139/cjfas-54-11-2543
Canellas L., Olivares F., Aguiar N., Jones D., Nebbioso A., Mazzei P., Piccolo A. Humic and fulvic acids as biostimulants in horticulture // Sci. Hortic. 2015. V. 196. P. 15–27. https://doi.org/10.1016/j.scienta.2015.09.013
Fagerberg T., Carlsson P., Lundgren M. A large molecular size fraction of riverine high molecular weight dissolved organic matter (HMW DOM) stimulates growth of the harmful dinoflagellate Alexandrium minutum // Harmful Algae. 2009. V. 8. P. 823−831. https://doi.org/10.1016/j.hal.2009.02.002
Fagerberg T., Jephson T., Carlsson P. Molecular size of riverine dissolved organic matter influences coastal phytoplankton communities // Mar. Ecol. Prog. Ser. 2010. V. 409. P. 17−25. https://doi.org/10.3354/meps08616
Giesy J., Briese L. Metals associated with organic carbon extracted from Okefenokee swamp water // Chem. Geol. 1977. V. 20. P. 109–120. https://doi.org/10.1016/0009-2541(77)90040-7
Giesy J., Leversee G., Williams D. Effects of naturally occurring aquatic organic fractions on cadmium toxicity to Simocephalus serrulatus (Daphnidae) and Gambusia affinis (Poeciliidae) // Water Res. 1977. V. 1. P. 1013–1020. https://doi.org/10.1016/0043-1354(77)90160-9
Granda D., Vallejo C., Botero L. Cadmium (Cd) tolerance evaluation of three strains of microalgae of the genus Ankistrodesmus, Chlorella and Scenedesmus // Revista Facultad De Ingeniería Universidad De Antioquia. 2019. V. 92. P. 60–69. https://doi.org/10.17533/udea.redin.20190523
Gustafsson J. Visual MINTEQ Ver. 3.1. [Электронный ресурс] http://vminteq.lwr.kth.se. 2013
Hamed S., Zinta G., Klöck G., Asard H., Selim S., Abdelgawad H. Zinc-induced differential oxidative stress and antioxidant responses in Chlorella sorokiniana and Scenedesmus acuminatus // Ecotoxicol. Environ. Saf. 2017. V. 140. P. 256–263. https://doi.org/10.1016/j.ecoenv.2017.02.055
Heil C. Influence of humic, fulvic and hydrophilic acids on the growth, photosynthesis and respiration of the dinoflagellate Prorocentrum minimum (Pavillard) Schiller // Harmful Algae. 2005. V. 4(3). P. 603–618 https://doi.org/10.1016/j.hal.2004.08.010
Klein O., Kulikova N., Konstantinov A., Zykova M., Perminova I. A systematic study of the antioxidant capacity of humic substances against peroxyl radicals: relation to structure // Polymers. 2021. V. 13. P. 3262. https://doi.org/10.3390/polym13193262
Knauer K., Buffle L. Adsorption of fulvic acid on algal surfaces and its effect on carbon uptake // J. Phycology. 2001. V. 37. P. 47–51. https://doi.org/10.1046/j.1529-8817.2001.037001047.x
Koukal B., Guéguen C., Pardos M., Dominik J. Influence of humic substances on the toxic effects of cadmium and zinc to the green alga Pseudokirchneriella subcapitata // Chemosphere. 2003. V. 53(8). P. 953–961. https://doi.org/10.1016/S0045-6535(03)00720-3
Kováčik J., Klejdus B., Babula P., Hedbavny J. Age affects not only metabolome but also metal toxicity in Scenedesmus quadricauda cultures // J. Hazard. Mater. 2016. V. 306. P. 58–66. https://doi.org/10.1016/j.jhazmat.2015.11.056
Lamelas C., Slaveykova V. Comparison of Cd(II), Cu(II), and Pb(II) biouptake by green algae in the presence of humic acid // Environ Sci Technol. 2007. V. 41. P. 4172–4178. https://doi.org/10.1021/es063102j
Le V., Vo M., Le N., Nguyen N., Hoang N., Vo T., Dao T. Development of freshwater microalgae under exposure to atrazine and cadmium // J. Science Technology Development. 2019. V. 3(4). P. 299–306. https://doi.org/10.32508/stdjns.v3i4.609
Lewis L., Flechtner V. Cryptic species of Scenedesmus (Chlorophyta) from desert soil communities of Western North America // J. Phycology. V. 40(6). P. 1127 – 1137. https://doi.org/10.1111/j.1529-8817.2004.03235.x
Malcolm R., MacCarthy P. Limitations in the use of commercial humic acids in water and soil researches // Environ. Sci. Technol. 1986. V. 20. P. 904–911. https://doi.org/10.1021/es00151a009
Marchello A., Oliveira N., Lombardi A., Polpo A. An investigation onto Cd toxicity to freshwater microalga Chlorella sorokiniana in mixotrophy and photoautotrophy: A Bayesian approach // Chemosphere. 2018. V. 211. P. 794–803. https://doi.org/10.1016/j.chemosphere.2018.08.019
Maurice P., Manecki M., Fein J., Schaefer J. Fractionation of an aquatic fulvic acid upon adsorption to the bacterium Bacillus subtilis // Geomicrobiol. J. 2004. V. 21. P. 69–78. https://doi.org/10.1080/01490450490266235
McKnight D., Wershaw R. Complexation of copper by fulvic acid from the Suwannee River – Effect of counter-ion concentration // Humic substances in the Suwannee River: Interaction, properties, and proposed structures. U.S. Geological Survey Water-Supply Paper. 1994. P. 33–44.
Merzlyak M., Naqvi K. On recording the true absorption and scattering spectrum of a turbid sample: application to cell suspensions of the cyanobacterium Anabaena variabilis // J. Photochem. Photobiol. 2000. V. 58. P. 123–129. https://doi.org/10.1016/S1011-1344(00)00114-7
Nguyen V., Vo T., Tran Q., Vo T., Bui T., Trinh B., Dao T. Growth and metal removal efficiency of the green algae Schroederia setigera and Selenastrum bibraianum exposed to nickel, zinc and cadmium // Vietnam J. Science and Technology. 2020. V. 58(5A). P. 22–31. https://doi.org/10.15625/2525-2518/58/5A/15183
Oliver B., Thurman E., Malcolm R. The contribution of humic substances to the acidity of colored natural waters // Geochimica Cosmochimica Acta. 1983. V. 47. P. 2031–2035. https://doi.org/10.1016/0016-7037(83)90218-1
Pempkowiak J., Kosakowska A. Accumulation of cadmium by green algae Chlorella vulgaris in the presence of marine humic substances // Environ. Int. 1998. V. 24. P. 583–588. https://doi.org/10.1016/S0160-4120(98)00044-0
Piotrowska-Niczyporuk A., Bajguz A., Talarek M., Bralska M., Zambrzycka E. The effect of lead on the growth, content of primary metabolites, and antioxidant response of green alga Acutodesmus obliquus (Chlorophyceae) // Environmental Science and Pollution Research. 2015. V. 22(23). P. 19112–19123. https://doi.org/10.1007/s11356-015-5118-y
Pokora W., Bascik-Remisiewicz A., Tukaj S., Kalinow-ska R., Pawlik-Skowronska B., Dziadziuszko M., Tukaj Z. Adaptation strategies of two closely related Desmodesmus armatus (green alga) strains contained different amounts of cadmium: a study with light-induced synchronized cultures of algae // J. Plant Physiol. 2014. V. 171(2). P. 69–77. https://doi.org/10.1016/j.jplph.2013.10.006
Pouneva I. Effect of humic substances on the growth of microalgal cultures // Russian J. Plant Physiology. 2005. V. 52. P. 410–413. https://doi.org/10.1007/s11183-005-0060-3
Sarwa P., Verma S. Identification and characterization of green microalgae, Scenedesmus sp. MCC26 and Acutodesmus obliquus MCC33 isolated from industrial polluted site using morphological and molecular markers // Int. J. Appl. Sci. Biotechnol. 2017. V. 5(4). P. 415–422. https://doi.org/10.3126/ijasbt.v5i4.18083
Sedlacek J., Kallqvist T., Gjessing E. Effect of an aquatic humus on uptake and toxicity of cadmium to Selenastrum capricornutum Printz // Aquatic and Terrestrial Humic Materials. Ann. Arbor. Science Publishers MI. 1983. P. 495–516.
Serra A., Guasch H., Admiraal W., Van der Geest H., Van Beusekom S. Influence of phosphorus on cooper sensitivity of fluvial periphyton: the role of chemical, physiological and community-related factors // Ecotoxicology. 2010. V. 19. P. 770–780. https://doi.org/10.1007/s10646-009-0454-7
Shin H., Monsallier J., Choppin G. Spectroscopic and chemical characterizations of molecular size fractionated humic acid // Talanta. 1999. V. 50. P. 641–647. https://doi.org/10.1016/s0039-9140(99)00161-7
Shi W., Jin Z., Hu S., Fang X., Li F. Dissolved organic matter affects the bioaccumulation of copper and lead in Chlorella pyrenoidosa: a case of long-term exposure // Chemosphere. 2017. V. 174. P. 447–455. https://doi.org/10.1016/j.chemosphere.2017.01.119
Shi Z., Xu H., Wang Z., Du H., Fu X. Effects of co-exposure to copper and humic acids on microalga Chlorella vulgaris: growth inhibition, oxidative stress, and extracellular secretion // Environ. Pollut. Bioavailability. 2021. V. 33(1). P. 415–424. https://doi.org/10.1080/26395940.2021.1995504
Shtina E. The principal directions of experimental investigations in soil algology with emphasis on the USSR // Geoderma. 1974. V. 12. P. 151–156. https://doi.org/10.1016/0016-7061(74)90047-0
Steinberg C., Meinelt T., Timofeyev M., Bittner M., Menzel R. Humic substances (review series). part 2: interactions with organisms // Environ. Sci. Pollut. Resour. 2008. V. 15. P. 128–135. https://doi.org/10.1065/espr2007.07.434
Stolte W., Panosso R., Gisselson L., Granéli E. Utilization efficiency of nitrogen associated with riverine dissolved organic carbon (>1 kDa) by two toxin-producing phytoplankton species // Aquat. Microb. Ecol. 2002. V. 29. P. 97–105. https://doi.org/10.3354/ame029097
Sun B., Tanji Y., Unno H. Influences of iron and humic acid on the growth of the cyanobacterium Anabaena circinalis // Biochemical Engineering Journal. 2005. V. 24. P. 195–201. https://doi.org/10.1016/j.bej.2005.02.014
Sun B., Tanji Y., Unno H. Extinction of cells of cyanobacterium Anabaena circinalis in the presence of humic acid under light // Applied Microbiology and Biotechnology. 2006. V. 72(4). P. 823–828. https://doi.org/10.1007/s00253-006-0327-4
Suzuki D., Shoji R. Toxicological effects of chlorophenols to green algae observed at various pH and concentration of humic acid // J. Hazard. Mater. 2020. V. 400(5). P. 123079. https://doi.org/10.1016/j.jhazmat.2020.123079
Terlova E., Lewis L. A new species of Tetradesmus (Chlorophyceae, Chlorophyta) isolated from desert soil crust habitats in southwestern North America // Plant and Fungal Systematics. 2019. V. 64(1). P. 25–32. https://doi.org/10.2478/pfs-2019-0004
Tessier A., Turner D. (Eds.) Metal Speciation and Bioavailability in Aquatic Systems. IUPAC Series on Analytical and Physical Chemistry of Environmental Systems. Wiley and Sons Ltd., Chichester, England. 1995. V. 3. P. 696.
Thurman E. Organic geochemistry of natural waters. Springer, Netherlands. 1985. 497 p.
Tikhonov V., Drozdova O., Cheptsov V., Demin V. Sorption of dissolved organic matter by freshwater bacterioplankton // E3S Web of Conferences. 2021. V. 265(04003). P. 7. https://doi.org/10.1051/e3sconf/202126504003
Tulonen T., Salonen K., Arvola L. Effects of different molecular weight fractions of dissolved organic matter on the growth of bacteria, algae and protozoa from a highly humic lake // Hydrobiologia. 1992. V. 229. P. 239– 252. https://doi.org/10.1007/BF00007003
Vigenault B., Campbell P. Uptake of cadmium by freshwater green algae: Effects of pH and aquatic humic substances // J. Phycol. 2005. V. 41. P. 55–61. https://doi.org/10.1111/j.1529-8817.2005.04068.x
Vo M., Nguyen V., Vo T., Bui T., Dao T. Responses of green algae and diatom upon exposure to chromium and cadmium // Vietnam J. Sci. Technol. Eng. 2020. V. 62(1). P. 69–73. https://doi.org/10.31276/VJSTE.62(1).69-73
Watanabe C., Monteiro A., Gontijo E., Lira V., Bueno C., Kumar N., Fracácio R., Rosa A. Toxicity assessment of arsenic and cobalt in the presence of aquatic humic substances of different molecular sizes // Ecotoxicology and Environmental Safety. 2017. V. 139. P. 1–8. ISSN 0147-6513. https://doi.org/10.1016/j.ecoenv.2017.01.018
Yang S., Liu G., Meng Y., Wang P., Zhou S., Shang H. Utilization of xylose as a carbon source for mixotrophic growth of Scenedesmus obliquus // Bioresour. Technol. 2014. V. 172. P. 180–185. https://doi.org/10.1016/j.biortech.2014.08.122
Ytreberg E., Karlsson J., Ndungu K., Hassellöv M., Breitbarth E., Eklund B. Influence of salinity and organic matter on the toxicity of Cu to a brackish water and marine clone of the red macroalga Ceramium tenuicorne // Ecotoxicol. Environ. Saf. 2011. V. 74(4). P. 636–642. https://doi.org/10.1016/j.ecoenv.2010.09.013
Zheng X., Xu Z., Zhao D., Luo Y., Lai C., Huang B., Pan X. Double-dose responses of Scenedesmus capricornus microalgae exposed to humic acid // Science of The Total Environment. 2022. V. 806(1). P. 150547. https://doi.org/10.1016/j.scitotenv.2021.150547
Дополнительные материалы отсутствуют.