Почвоведение, 2023, № 1, стр. 35-45
Ризосферный эффект и структура бактериального сообщества в горизонтах подзолистой почвы под растениями ели обыкновенной (Picea abies L.)
И. В. Евдокимов a, *, М. В. Семенов b, С. С. Быховец a
a Институт физико-химических и биологических проблем почвоведения РАН
142290 Московская область, Пущино, ул. Институтская, 2, Россия
b Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
* E-mail: ilyaevd@yahoo.com
Поступила в редакцию 29.06.2022
После доработки 21.07.2022
Принята к публикации 28.07.2022
- EDN: JKRNSZ
- DOI: 10.31857/S0032180X22700010
Аннотация
На экспериментальных площадках Центрального лесного государственного заповедника (Тверская область, Россия) исследовали взаимосвязь между величинами ризосферного фактора Rf для ряда индикаторов биологической активности в почве, принадлежностью ризосферы ели (Picea abies L.) к почвенному горизонту и структурой микробного сообщества ризосферы ели и внекорневой почвы. Объектами исследования стали гумусовый AEL (3–15 см) и элювиальный EL (15–46 см) горизонты подзолистой почвы (Retisol) под ельником. Наиболее выраженный ризосферный эффект (Rf > 1.6) был выявлен для углерода микробной биомассы, дыхания почвенных микроорганизмов и скорости оборачиваемости почвенного органического вещества (ПОВ). Величина Rf для скорости оборачиваемости ПОВ в гумусовом горизонте AEL оказалась примерно равной 1.5, в то время как в горизонте EL она достигала 6. В ризосфере было выявлено значительно большее микробное разнообразие, с высоким вкладом как грамположительных, так и грамотрицательных бактерий, включая представителей Acidobacteria, Alphaproteobacteria, Betaproteobacteria, Gammaproteobacteria, Solibacteres и Spartobacteria. В неризосферной почве доминировали грамположительные порядки Bacillales и Clostridiales с общим вкладом более чем 80 и 50% для горизонтов AEL и EL соответственно. Судя по количеству показателей микробной активности с высокими величинами Rf (3 для нижнего почвенного горизонта EL и только 1 – для верхнего гумусового горизонта AEL), ризосферу нижнего горизонта можно считать более ярко выраженной “горячей точкой” (“hot spot”) биологической активности, чем ризосферу верхнего горизонта.
ВВЕДЕНИЕ
Почва, находящаяся под воздействием корней, называется ризосферой [19]. Понятие о ризосфере, введенное в научный оборот в 1904 г. немецким почвенным микробиологом Лоренцем Хилтнером [19], в последние десятилетия получило дальнейшее развитие в рамках более обобщающей концепции “горячих зон” (“hot spots”) [21]. Количественно эффект от развития в почве ризосферы (ризосферный эффект) удобно оценивать по величине ризосферного фактора Rf, который рассчитывается как соотношение между почвенными характеристиками в ризосфере и таковыми в неризосферной почве [1, 2]. Как правило, в прикорневой зоне показатели активности микробного сообщества, а также концентрации легкодоступных органических субстратов больше, чем в неризосферной почве [11, 22, 28]. Ранее в наших исследованиях были выявлены закономерности развития ризосферного эффекта под растениями овса [3, 35]. Оказалось, что, помимо зависимости величины ризосферного фактора от фазы роста растений, Rf может как увеличиваться, так и снижаться при приближении к корням растений. Например, для водорастворимых соединений азота была выявлена усредненная по фазам развития однолетних злаковых величина Rf = 0.9, что явно указывало на недостаток данного биофильного элемента вблизи корней растений по сравнению с почвой в целом [3].
При исследовании ризосферы многолетних растений, в частности, растений лесных экосистем, задача усложняется рядом дополнительных факторов, существенным образом влияющих на закономерности развития ризосферного эффекта. Поскольку корневые системы древесных растений могут развиваться на глубину до нескольких метров или даже десятков метров, активность ризосферного эффекта может меняться в зависимости от глубины и почвенного горизонта. Это может быть вызвано тем, что с глубиной уменьшается содержание и доступность биофильных и микроэлементов, а также аэрация межагрегатных пространств в почвенном профиле. Имеющиеся литературные данные в целом подтверждают эту гипотезу. Например, с глубиной происходит увеличение относительного вклада грамположительных бактерий в разнообразие микробного сообщества, то есть таксономический состав почвенного микробиома закономерно смещается в пользу таксонов, приспособленных жить в условиях дефицита питательных элементов [18, 29]. В более глубоких почвенных горизонтах возрастает доля метаболически активных архей, которые также лучше приспособлены к олиготрофным условиям среды, чем бактерии [6]. Кроме того, с глубиной увеличивается стабилизация органического вещества, поступающего в почву в виде некромассы микроорганизмов [27], что делает углеродсодержащие субстраты менее доступными для потребления почвенными микроорганизмами, уже находящимися в условиях постоянного дефицита питательных элементов. В свою очередь, стабилизация органических соединений напрямую связана с взаимодействиями микробных метаболитов и почвенных минералов [10]. Известен также и феномен угнетения почвенных микроорганизмов, а также ухудшения физико-химических показателей качества почвы вследствие развития корневых систем многолетних растений [16]. Как видим, из множества дополнительных факторов, влияющих на развитие ризосферы под древесными растениями, многие из них напрямую связаны с активностью и структурой микробного сообщества почвы и ризосферы. С другой стороны, в результате влияния корневых экссудатов микробиом ризосферы растений отличается по своему таксономическому составу от внекорневой почвы [7, 27]. В ризосферной почве обитает больше копиотрофов и r-стратегов [21, 25], а для каждого вида растения характерны свои определенные таксоны бактерий и грибов [30, 31].
Мы предположили, что: 1) повышенная активность микробного сообщества в ризосфере связана с большим разнообразием микробного сообщества в ризосфере; 2) ризосферный эффект в гумусовом горизонте должен быть более выражен, чем в глубинных корнеобитаемых горизонтах, где должно проявляться угнетение микроорганизмов вследствие дефицита питательных элементов и кислорода; 3) разнообразие микробного сообщества с глубиной должно уменьшаться, причем ожидается сдвиг в пользу грамположительных бактерий, приспособленных к жизни в экстремальных условиях.
Цель исследования – оценить ризосферный эффект для ряда индексов микробной биомассы и активности микробного сообщества в почве, и сравнить величины Rf для верхнего почвенного горизонта AEL и глубинного элювиального горизонта EL; сравнить таксономическую структуру бактериального сообщества ризосферы и внекорневой (неризосферной) почвы в зависимости от принадлежности к горизонту.
ОБЪЕКТЫ И МЕТОДЫ
Объекты исследований. Образцы подзолистой почвы (Retisol, органогенные горизонты L, F, H, горизонт AEL с повышенным содержанием Сорг, подзолистый горизонт EL, горизонт BD, на границе между наносами местами есть переходный горизонт, индексированный как ELBD) были отобраны на мониторинговых площадках в Центрально-лесном государственном природном биосферном заповеднике (ЦЛГБЗ, Тверская обл.) под растениями ели обыкновенной (Picea abies L.) в климаксном ельнике неморальном кисличном. Это особо охраняемая природная территория (ООПТ) с многолетней историей мониторинга продуктивности лесных экосистем, погодных условий и почвенных характеристик; более подробно описание почвенных характеристик и структуры растительного напочвенного покрова представлено в работе Соколовой с соавт. [8].
Образцы из ризосферы и внекорневой (неризосферной) почвы отбирали в соответствии с методикой, описанной в работе Соколовой с соавт. [8]. Отбор производился в пятикратной повторности непосредственно из разреза и с прилегающего участка площадью 6–7 м2 под елями 15–20-летнего возраста. При этом из горизонта АEL отбирали общий образец, а затем отделяли почву от корней ели с комочками налипшей на них почвы. Эту прилипшую почву рассматривали как ризосферную, а остальную часть почвенного образца – как внекорневую (bulk soil). Свежеотобранные образцы почвы транспортировались в охлажденном виде до лаборатории в термобоксе с термоэлементами. Все образцы хранились при 4°С вплоть до начала инкубационных экспериментов. Определяли величины пулов биофильных элементов в составе почвенной микробной биомассы и водорастворимых форм, дыхательной активности, активности выделения диоксида углерода (базальное дыхание) бактериями и грибами при инкубации в лаборатории образцов почвы и ряд других индексов микробиологической активности: субстрат-индуцированное дыхание (СИД), характеризующее общую микробную биомассу; метаболический коэффициент – отношение базального дыхания к СИД, отражающий физиологическое состояние микроорганизмов; актуальную и потенциальную азотфиксацию (после внесения дополнительного источника углерода, глюкозы) и актуальную денитрификацию.
Лабораторные эксперименты. Набор основных показателей микробной биомассы и дыхательной активности микробного сообщества в почве и ризосфере состоял из: концентрации ДНК, экстрагируемой стандартным набором реактивов (MP BIO), лабильного С пула (константы A1 в уравнении (1)), константы разложения почвенного органического вещества (ПОВ) k (уравнение (1)), биомассы микроорганизмов, определенной методом СИД (Смик-СИД), исходных величин скоростей базального дыхания в ризосфере и неризосферной почве, общего содержания ПОВ (Собщ) и почвенного азота (Nобщ).
Помимо перечисленных показателей, для почвы верхнего гумусового горизонта AEL определяли пулы микробного С и N, водорастворимые формы соединений углерода и азота, общее содержание азота в почве, что довело число определяемых показателей микробной активности до 11 (рис. 1a, 1b). Это позволило сравнить величины ризосферного эффекта для корней многолетнего растения (ель обыкновенная) с соответствующими показателями, ранее полученными нами для растений овса [3, 35].
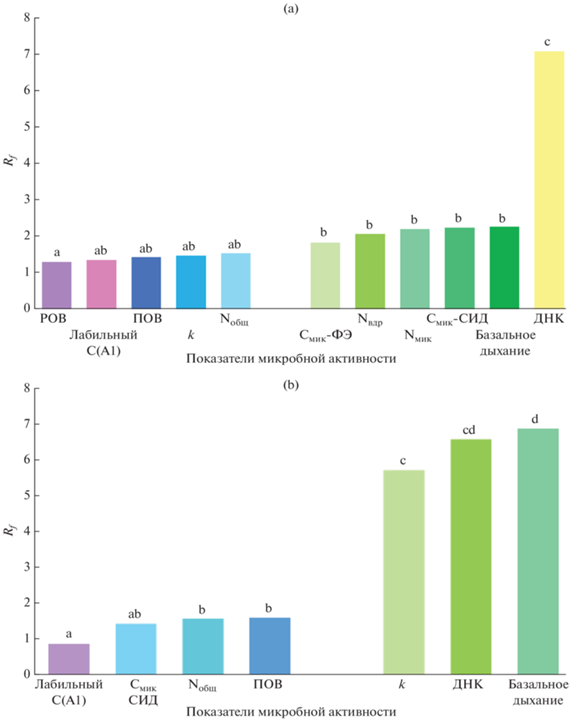
Рис. 1.
Величины ризосферного фактора для показателей микробной активности в горизонтах AEL (a) и EL (b) подзолистой почвы.
Незначительный размер образцов ризосферной почвы в горизонте EL (менее 50 г суммарно для всех пяти повторностях) не позволил провести аналогичную серию анализов для этого горизонта. Тем не менее, считаем, что сравнение широкого ряда показателей для пахотного горизонта сельскохозяйственной почвы под однолетними растениями [3] с таковыми для ненарушенной подзолистой почвы под лесом может дать важную информацию о развитии ризосферы однолетних и многолетних растений – при всех различиях в условиях проведения экспериментов.
Навески почвы массой 5 г помещали в 120 мл герметичные стеклянные флаконы с резиновыми пробками перед началом прединкубации. Прежде, чем начать определения базального дыхания и микробной биомассы, образцы подвергали предварительной инкубации (акклиматизации) в течение 3 сут при 22°С и 60% полной влагоемкости (ПВ) с целью активизации почвенного микробного сообщества [12]. Собственно инкубацию проводили при тех же величинах температуры и влажности, что и предварительную инкубацию. Скорости выделения углекислого газа определяли по накоплению за определенные промежутки времени, периодически отбирая газовые пробы с последующим определением концентрации СО2 на инфракрасном газоанализаторе IRGA Li-820 (фирма LiCor, США), с последующей вентиляцией атмосферы внутри сосудов в течение 30 мин. Влажность поддерживалась периодическим (3–4 раза в месяц) внесением соответствующих количеств де-ионизированной воды.
Эмиссию СО2 при разложении ПОВ (базальное дыхание микроорганизмов, разлагающих эти углеродные субстраты), нормированную на исходное содержание углерода в пробе (С–СO2/C0(t)), аппроксимировали с помощью одинарной экспоненты с константой:
(1)
$\frac{{{\text{C--C}}{{{\text{O}}}_{2}}\left( t \right)}}{{{{{\text{C}}}_{0}}}} = 1 - {{A}_{1}}{{e}^{{ - {{k}_{1}}t}}} - {{A}_{2}},$Методы определения микробной биомассы. Микробную биомассу в ризосферной и неризосферной почве определяли методами фумигации–экстракции (ФЭ) [14, 33] и СИД [9]. Принцип метода фумигации–экстракции основан на экстрагировании солевым раствором K2SO4 биомассы почвенных микроорганизмов, убитых в ходе 24 ч экспозиции образцов почвы в атмосфере, содержащей пары хлороформа. Расчет запасов углерода и азота микробной биомассы (Смик и Nмик) производился по приросту С или N (“С flush” и “N flush”) по сравнению с содержанием С в солевых экстрактах из контрольной нефумигированной почвы, с учетом величин пересчетных коэффициентов (коэффициентов экстракции С и N убитой биомассы микроорганизмов).
В тех же навесках почвы, в которых определяли исходные величины базального дыхания, проводили и определение индекса микробной биомассы методом СИД, разработанным Андерсоном и Домшем [9]. Метод СИД основан на определении начального дыхательного отклика почвенного микробного сообщества в первые 2–4 ч после внесения в почву легкоразлагаемого углеродного субстрата (глюкозы). Концентрация вносимой глюкозы соответствовала 4 мг C/г для почвы. Объем вносимого раствора подбирали с таким расчетом, чтобы итоговая почвенная влажность не превышала 60% ПВ.
Углерод и азот в почве и почвенных солевых экстрактах определяли на масс-спектрометре Delta plus IRMS (Thermo Fisher Scientific, Германия).
Экстракция и количественное определение тотальной почвенной ДНК. Почвенную ДНК экстрагировали из образцов массой 0.5 г помощью набора FastDNA SPIN kit for Soil (MP Biomedicals, Германия) согласно протоколу производителя. Гомогенизацию почвенных образцов производили с использованием гомогенизатора FastPrep (MP Biomedicals, Германия). Выделенные экстракты ДНК до анализа хранили при температуре –20°C. Для количественной оценки ДНК использовали флуоресцентный краситель PicoGreen (Molecular Probes, Life Technologies, Германия). Активность флуоресценции определяли с использованием автоматического флуориметра (Wallac 1420, Perkin Elmer, Turku, Финляндия) в диапазоне возбуждения 485 нм и эмиссии 525 нм [6].
ДНК-метабаркодинг. Для проведения анализа проводили амплификацию регионов V3-V4 гена 16S рРНК с использованием универсальных прямого и обратного праймеров 341F и 805R [20]. После получения ампликонов библиотеки очищали и смешивали эквимолярно с помощью набора SequalPrep™ Normalization Plate Kit (Thermo Fisher Scientific, Waltham, США). Результирующий пул библиотек проверяли на капиллярном электрофорезе и затем секвенировали на приборе Illumina MiSeq.
Биоинформатический анализ результатов секвенирования. Обработку данных, полученных в результате секвенирования ампликонов генов 16S рРНК, проводили при помощи программной среды QIIME [15]. Склеивание прямых и обратных нуклеотидных последовательностей осуществляли методом fastq-join. Операционные таксономические единицы (ОТЕ) идентифицировали с использованием алгоритма UCLUST на основе 97%-ного порога сходства сиквенсов по библиотеке реферативных сиквенсов SILVA database, v. 128. Синглтоны (ОТЕ, содержащие один сиквенс), митохондрии и хлоропласты удаляли. На основе таксономической принадлежности выделяли грамположительные и грамотрицательные филумы и классы.
Статистическую обработку результатов проводили при помощи программы Statistica 12. Определение содержания общего микробного углерода и азота фумигационным методом, водорастворимого азота, растворимого органического вещества, общего ПОВ и общего азота в почве, величины базального дыхания, СИД микробной биомассы и кинетических параметров k и А проводили в 5 биологических повторностях. Группировку по достоверности различий определяли методом Тьюки при P < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ризосферный фактор Rf в верхнем и элювиальном горизонтах. Величины ризосферного фактора для показателей верхнего горизонта AEL находились в промежутке от 1.03 (концентрация извлекаемой ДНК) до 2.29 (базальное дыхание) (рис. 1a). Порядок величин соответствует литературным данным: величины Rf для небобовых растений находились в пределах 3.3–5.9 [22]. В нашей более ранней работе [3] диапазон величин ризосферного фактора варьировал, в зависимости от индекса почвенной активности, от 0.9 до 4.6, причем Rf для относительно “консервативных” показателей (общий пул микробной биомассы, общий пул водорастворимого ПОВ, общий пул микробного азота и др.) находился в диапазоне от 1 до 2. В нашем эксперименте с лесной почвой группировка по тесту Tukey дала разбиение на две группы: группа I с показателем Rf ниже 1.6 и группу II с Rf > 1.6. В первую группу, где показатели должны быть более “консервативными” (если придерживаться концепции, показавшей свою состоятельность для ризосферы растений овса), вошли такие индексы микробной активности, как водорастворимое органическое вещество (РОВ) (1.3) и общее содержание N (Nобщ) в почве (1.6). Кроме того, относительно невысокими оказались величины Rf для кинетических констант разложения k, полученных при аппроксимации кинетических кривых выделения СО2 в долговременном инкубационном эксперименте с ризосферными и неризосферными почвами (рис. 1a). Вероятно, кинетические константы оказались относительно устойчивыми по сравнению с величинами нестабильных пулов (evanescent pools) микробного углерода, микробного азота, а также и водорастворимых N‑соединений. Причина, по которой пул водорастворимых соединений азота показал довольно высокую величину Rf, не совсем ясны. Наиболее вероятными объяснениями могут быть следующие: а) снижение нетто-минерализации соединений N в присутствии корней при низких концентрациях этого элемента в почве [24]; б) в эксперименте с ризосферой овса мы наблюдали динамику развития ризосферного эффекта во времени, привязанную, в частности, к фазам роста растений, то есть величина Rf = 0.9 была получена путем усреднения по девяти точкам отбора в динамике, то есть моментальные значения Rf в тот или иной момент (или в ту или иную фазу роста растений).
Величины ризосферного эффекта для нижнего горизонта EL были определены для более узкого ряда индексов микробной активности (см. “Объекты и методы”) (рис. 1b). Минимальное значение было выявлено для пула лабильного С (константа А в уравнении (1)), максимальное – у базального дыхания (6.9). Если среди индексов микробной активности горизонта AEL экстраординарно высоким значением Rf выделялась только концентрация экстрагируемой ДНК (7.1), то горизонт EL показал целую группу таких показателей, в которой, помимо экстрагируемой ДНК (6.6), вошли кинетическая константа разложения k (5.7) и базальное дыхание (6.9). Хотя формально граница между низкими и высокими значениями также проходила по 1.6 (именно такая величина Rf была у ПОВ), вряд ли можно считать именно эту величину информативной для горизонта EL, поскольку различия между первой и второй группами индексов микробной активности были очень контрастными. Судя по количеству показателей микробной активности с высокими величинами Rf(три для подпочвенного горизонта EL и только один – для верхнего гумусового горизонта AEL), ризосфера нижнего горизонта является более ярко выраженной “горячей точкой” биологической активности, чем ризосфера верхних горизонтов.
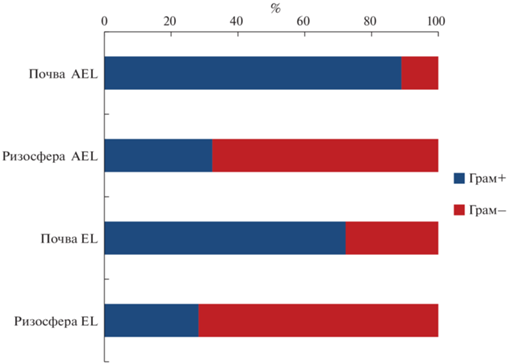
Структура бактериального сообщества ризосферы и неризосферной почвы. Внекорневая почва характеризовалась незначительным микробным разнообразием и полным доминированием представителей лишь одного филума – Firmicutes (82.8 и 59.6% в горизонтах AEL и EL соответственно). Широко представленными филумами являлись также Proteobacteria (7.2% в горизонте AEL и 20.6% в EL) и Actinobacteria (6.2% в AEL и 12.6% в EL). Все остальные филумы входили в состав минорного компонента микробиома внекорневой почвы (рис. 2a). Ризосфера показала значительно более высокое микробное разнообразие по сравнению с внекорневой почвой. Значительно уменьшалась представленность Firmicutes (16.6% в горизонте AEL и 13.8% в EL), тогда как Proteobacteria становились доминантами в составе микробного сообщества (30.6 и 30.8%). В ризосферной почве на порядок повышалась численность Acidobacteria (11.4 и 17.6%) и Verrucomicrobia (6.6 и 5.4%); доля Bacteroidetes (3.6%) и Actinobacteria (17.5%) была больше в верхнем горизонте АЕL, а Chloroflexi (4.2%) и Planctomycetes (1.2%) росла в горизонте EL.
Рис. 2.
Структура микробных сообществ ризосферной и внекорневой почвы горизонтов AEL и EL на уровне филумов (a) и классов (b).
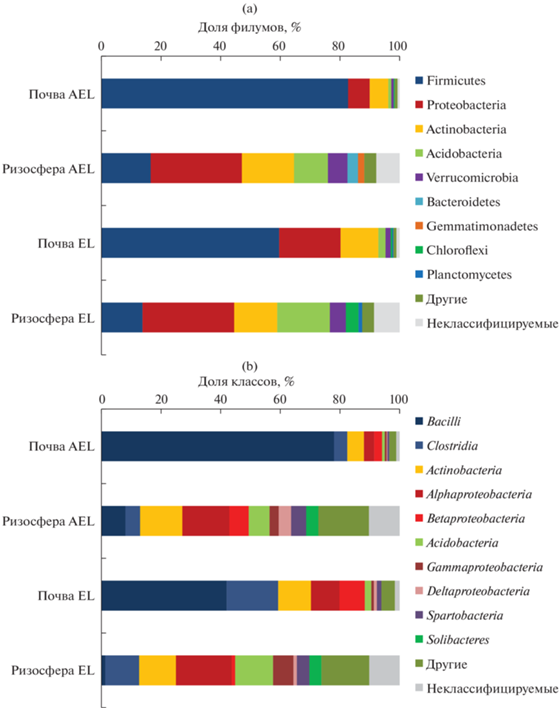
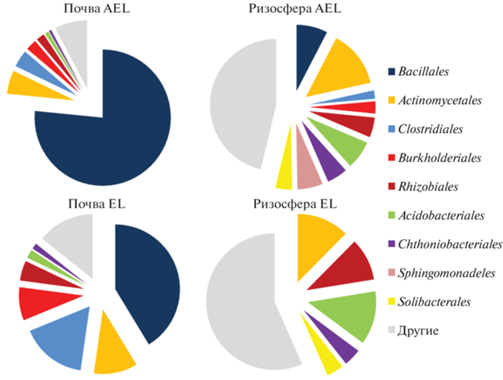
Анализ состава таксонов на уровне классов демонстрирует, что филум Firmicutes в горизонте AEL был представлен, главным образом, классом Bacilli, тогда как в горизонте EL существенную часть составляли представители класса Clostridia (рис. 2b). В случае с представителями Proteobacteria, ризосфера горизонта AEL значительно отличалась от остальных образцов, что проявлялось в более высокой доле классов Gammaproteobacteria и Deltaproteobacteria. В целом для ризосферной почвы было характерно повышение численности представителей классов Spartobacteria и Solibacteres. На уровне порядков внекорневая почва характеризовалась преобладанием таксонов Bacillales и Clostridiales, тогда как в ризосфере было значительно больше представителей Rhizobiales, Acidobacteriales, Chthoniobacteriales, Sphingomonadeles и Solibacterales (рис. 3). В целом ризосферный эффект проявлялся практически для всех основных таксонов бактерий.
Рис. 3.
Структура микробных сообществ ризосферной и внекорневой почвы горизонтов AE и AEL на уровне порядков.
Рост численности Actinobacteria, Alphaproteobacteria, Betaproteobacteria и Gammaproteobacteria в ризосферном микробиоме растений, в том числе древесных, был показан ранее [17, 32]. Большинство представителей Actinobacteria, Betaproteobacteria, Gammaproteobacteria и Bacteroidetes относят к r-стратегам и копиотрофам [23, 34], поэтому в нашем исследовании эти таксоны были более представлены в ризосфере, более богатой субстратом. Тем не менее, в ризосферной почве также росла доля K-стратегов и олиготрофных таксонов – Acidobacteria, Alphaproteobacteria, Chloroflexi и Planctomycetes [23, 34]. Это было вызвано очень резким снижением доли Firmicutes в ризосферной почве, что повлекло за собой повышение доли как копиотрофных (более значительное), так и олиготрофных (в основном, незначительное) таксонов.
Соотношение грамположительных и грамотрицательных микроорганизмов. В неризосферной почве было выявлено доминирование грамположительных бактерий с общим вкладом 89% (из них около 80% вклад порядков Bacillales и Clostridiales) и 72% (вклад порядков Bacillales и Clostridiales свыше 50%) для горизонтов AEL и EL соответственно (рис. 4). Для ризосферы, как и ожидалось, была обнаружена обратная тенденция – доминирование грамотрицательных таксонов: 68% нуклеотидных последовательностей – в верхнем горизонте AEL и 72% – в элювиальном горизонте. Согласно литературным данным, известен феномен увеличения относительного вклада грамположительных бактерий в разнообразие микробного сообщества с глубиной, то есть при этом доминирование закономерно смещается в пользу видов, приспособленных жить в условиях дефицита питательных элементов и в целом ухудшения экофизиологических условий [6, 18]. Кроме того, с глубиной увеличивается стабилизация органического вещества, поступающего в почву в виде некромассы микроорганизмов, что делает углеродсодержащие субстраты менее доступными для потребления почвенными микроорганизмами [26]. Относительный вклад грамположительных таксонов в структуру почвенного бактериального сообщества уменьшался с глубиной как в ризосфере, так и во внекорневой почве. Уменьшение соотношения доли грамположительных бактерий с глубиной было также показано в предыдущих работах, основанных на анализе жирных кислот фосфолипидов [26], так и почвенной ДНК [30]. Хотя некоторые авторы используют относительное содержание PLFA (жирных кислот фосфолипидов) грамположительных бактерий – в качестве индикатора стрессовых условий в почве [13], наши результаты демонстрируют, что данный показатель не может быть использован в таком качестве, если рассматриваются разные горизонты почв.
ЗАКЛЮЧЕНИЕ
В ризосфере подзолистых почв (Retisol, ельник, ЦЛГБЗ, Тверская область) выявлено более высокое разнообразие микробного сообщества по сравнению с таковым в неризосферной почве. В ризосфере представлен широкий ряд доминант – представителей Acidobacteria, Alphaproteobacteria, Betaproteobacteria, Gammaproteobacteria, Solibacteres и Spartobacteria, а в неризосферной почве доминировали Bacillales и Clostridiales. Вопреки ожиданиям ризосферный эффект для нижнего горизонта EL оказался более явным, чем в верхнем горизонте AEL, то есть ризосфера нижних горизонтов является более ярко выраженной “горячей точкой” биологической активности, чем ризосфера верхних горизонтов.
Список литературы
Бабьева И.П., Зенова Г.М. Биология почв. М.: Изд-во Моск. ун-та, 1989. 336 с.
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016. 243 с.
Евдокимов И.В. Динамика ризосферного эффекта в почве // Почвоведение. 2013. № 6. С. 715–724.
Евдокимов И.В., Юсупов И.А., Ларионова А.А., Быховец С.С., Глаголев М.В., Шавнин С.А. Тепловое воздействие факела попутного газа на биологическую активность почвы // Почвоведение. 2017. № 12. С. 1485–1493.
Семенов М.В., Манучарова Н.А., Краснов Г.С., Никитин Д.А., Степанов А.Л. Биомасса и таксономическая структура микробных сообществ в почвах правобережья р. Оки // Почвоведение. 2019. № 8. С. 974–985.
Семенов М.В., Манучарова Н.А., Степанов А.Л. Распределение метаболически активных представителей прокариот (архей и бактерий) по профилям чернозема и бурой полупустынной почвы // Почвоведение. 2016. № 2. С. 239–248.
Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355–369.
Соколова Т.А., Толпешта И.И., Лысак Л.В., Завгородняя Ю.А., Чалова Т.С., Карпухин М.М., Изосимова Ю.Г. Биологические характеристики и содержание подвижных соединений Fe, Al и Si в ризосфере ели в подзолистой почве // Почвоведение. 2018. № 11. С. 1330–1339.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biology & Biochemistry. 1978. V. 10. P. 215–221.
Angst G., Messinger J., Greiner M., Häusler W., Hertel D., Kirfel K., Kögel-Knabner I., Leuschner C., Rethemeyer J.C.W. Soil organic carbon stocks in topsoil and subsoil controlled by parent material, carbon input in the rhizosphere, and microbial-derived compounds // Soil Biology & Biochemistry. 2018. V. 122. P. 19–30.
Bhattacharyya P.N., Jha D.K. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture // World J. Microbiology Biotechnology. 2012. V. 28. P. 1327–1350.
Blagodatsky S.A., Heinemeyer O., Richter J. Estimating the active and total soil microbial biomass by kinetic respiration analysis // Biology and Fertility of Soils. 2000. V. 32. P. 73–81.
Brinton W.F. Phospholipid fatty acid (PLFA) analysis: a robust indicator for soil health? // Agricultural Research & Technology: Open Access J. 2020. V. 24. P. 00018–00020.
Brookes P.C., Landman A., Pruden G., Jenkinson D.S. Chloroform fumigation andrelease of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil // Soil Biology & Biochemistry. 1985. V. 17. P. 837–843.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A. QIIME allows analysis of high-throughput community sequencing data // Nature Methods. 2010. V. 7. P. 335–336.
Chen Y.M., Wang M.K., Zhuang S.Y., Chiang P.N. Chemical and physical properties of rhizosphere and bulk soils of three tea plants cultivated in Ultisols // Geoderma. 2006. V. 136. P. 378–387.
Colin Y., Nicolitch O., Van Nostrand J.D., Zhou J.Z., Turpault M.P., Uroz S. Taxonomic and functional shifts in the beech rhizosphere microbiome across a natural soil toposequence // Scientific Reports. 2017. V. 7. P. 1–17.
Fierer N., Schimel J.P., Holden P.A. Variations in microbial community composition through two soil depth profiles // Soil Biology & Biochemistry. 2003. V. 35. P. 167–176.
Hartmann A., Rothballer M., Schmid M. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research // Plant and Soil. 2008. V. 312. P. 7–14.
Klindworth A., Pruesse E., Schweer T., Peplies J., Quast C., Horn M., Glöckner F.O. Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies // Nucleic Acids Research. 2013. V. 41.
Kuzyakov Y., Blagodatskaya E. Microbial hotspots and hot moments in soil: Concept & review // Soil Biology & Biochemistry. 2015. V. 83. P. 184–199.
Kuzyakov Y., Razavi B.S. Rhizosphere size and shape: temporal dynamics and spatial stationarity // Soil Biology & Biochemistry. 2019. V. 135. P. 343–360.
Li H., Yang S., Semenov M.V., Yao F., Ye J., Bu R., Ma R., Lin J., Kurganova I., Wang X., Deng Y., Kravchenko I., Jiang Y., Kuzyakov Y. Temperature sensitivity of SOM decomposition is linked with a K-selected microbial community. Global Change Biology. 2021. V. 27. P. 2763–2779.
Li J., Zhou M., Alaei S., Bengtson P. Rhizosphere priming effects differ between Norway spruce (Picea abies) and Scots pine seedlings cultivated under two levels of light intensity // Soil Biology and Biochemistry. 2020. V. 145. P. 107788.
Malik A.A., Martiny J.B., Brodie E.L., Martiny A.C., Treseder K.K., Allison S.D. Defining trait-based microbial strategies with consequences for soil carbon cycling under climate change // ISME J. 2020. V. 14. P. 1–9.
Peixoto L., Elsgaard L., Rasmussen J., Kuzyakov Y., Banfield C.C., Dippold M.A., Olesen J.E. Decreased rhizodeposition, but increased microbial carbon stabilization with soil depth down to 3.6 m // Soil Biology & Biochemistry. 2020. V. 150. P. 108008.
Philippot L., Raaijmakers J.M., Lemanceau P., Van Der Putten W.H. Going back to the roots: the microbial ecology of the rhizosphere // Nature Reviews Microbiology. 2013. V. 11. P. 789–799.
Raynaud X. Soil properties are key determinants for the development of exudate gradients in a rhizosphere simulation model // Soil Biology & Biochemistry. 2010. V. 42. P. 210–219.
Semenov M.V., Chernov T.I., Tkhakakhova A.K., Zhelezova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Applied Soil Ecology. 2018. V. 127. P. 8–18.
Semenov M.V., Krasnov G.S., Semenov V.M., van Bruggen A.H. Long-term fertilization rather than plant species shapes rhizosphere and bulk soil prokaryotic communities in agroecosystems // Applied Soil Ecology. 2020. V. 154. P. 103641.
Semenov M.V., Krasnov G.S., Semenov V.M., van Bruggen A.H. Mineral and Organic Fertilizers Distinctly Affect Fungal Communities in the Crop Rhizosphere // J. Fungi. 2022. V. 8. P. 251.
Uroz S., Oger P., Tisserand E., Cébron A., Turpault M.P., Buée M., De Boer W., Leveau J.H.J., Frey-Klett P. Specific impacts of beech and Norway spruce on the structure and diversity of the rhizosphere and soil microbial communities // Scientific Reports. 2016. V. 6. P. 1–11.
Vance E.D., Brookes P.C., Jenkinson D.S. An extraction method for measuring soil microbial biomass C // Soil Biology & Biochemistry. 1987. V. 19. P. 703–707.
Yang S., Wu X., Wang Z., Semenov M.V., Ye J., Yin L., Wang X., Kravchenko I., Semenov V., Kuzyakov Y., Jiang Y., Li H. Temperature sensitivity of SOM decomposition is linked with a K-selected microbial community // Soil Biology & Biochemistry. 2022. V. 172. P. 108758.
Yevdokimov I.V., Ruser R., Buegger F., Marx M., Munch J.C. Microbial immobilisation of 13C rhizodeposits in rhizosphere and root-free soil under continuous 13C labelling of oats // Soil Biology & Biochemistry. 2006. V. 38. P. 1202–1211.
Дополнительные материалы отсутствуют.