Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 6, стр. 68-75
Спектральная фоточувствительность биологических систем
С. И. Супельняк 1, 2, *, В. Г. Косушкин 1
1 Московский государственный технический университет им. Н.Э. Баумана, Калужский филиал,
248000 Калуга, Россия
2 ЛКМ ИК РАН – филиал ФНИЦ “Кристаллография и фотоника” РАН,
248640 Калуга, Россия
* E-mail: supelnyak@gmail.com
Поступила в редакцию 17.05.2017
После доработки 17.06.2018
Принята к публикации 17.06.2018
Аннотация
Проведено экспериментальное и теоретическое исследование влияния спектра света на фотобиологические процессы. Рассчитаны спектры потенциально эффективных потоков видимого излучения для энергетических и регуляторных процессов. На основе полученных данных установлена взаимосвязь спектральной чувствительности и энергетических характеристик фоторецепторных и фотосинтезирующих систем. Представлена качественная модель фоточувствительной органической системы на основе полупроводниковых фотоэлементов. Описаны термодинамические, электрические параметры моделируемой системы. Проводится аналогия функционирования фототранзисторов с фоторецепторными комплексами PHOT, CRY, Ph(660), Ph(730). Определены параметры оценки управления процессом распределения энергии в живой системе на основе математического моделирования, а также модельного эксперимента с применением фотоэлементов.
ВВЕДЕНИЕ
В настоящее время исследования влияния света на живые организмы не только не потеряли актуальности, но определяют развитие важнейших прикладных направлений [1–3], например, использования светодиодного освещения теплиц. Эти технологии позволяют решить не только экономические задачи, но и сделать шаги в направлении управления процессом взаимодействия живого вещества с излучением [4, 5].
Известно [6], что основной системой высших растений, воспринимающей и преобразующей энергию квантов света, т.е. органическим фотоэлементом растения, являются листья. Излучение в диапазоне длин волн 400–700 нм, необходимое для функционирования растения, принято называть фотосинтетически активной радиацией [7]. Для удобства многообразие воздействий оптического излучения разделяют на два вида: энергетические и регуляторные. Воздействия, при которых наблюдается преобразование поглощенной энергии квантов света в тепло и энергию химических соединений синтезированных органических веществ, получили название энергетических. Воздействия, в результате которых за счет поглощенной энергии света происходит активация, регуляция, деактивация различных физиологических процессов, называются регуляторными. В сравнении с энергетическими воздействиями фоторегуляторные требуют в десятки и сотни раз меньше энергии [6], однако точное количество на данный момент не установлено.
Целью работы было построение модели взаимодействия света с органической поверхностью листа растения, удобной для выбора параметров управления процессом на основе математического моделирования.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Объекты исследования. В основе настоящего исследования лежит известное положение о фотосинтезе как ключевом энергетическом процессе, обеспечивающем функционирование и развитие растения. Установлено, что фотосинтетическая реакция является источником потоков химической энергии (АТФ, НАДФ, µH+, С6Н12О6), необходимых для синтеза органических соединений и конструктивных процессов в растительной клетке [8]. Поглощение видимого излучения осуществляют молекулы хлорофилла. В результате поглощения энергии красного фотона молекула хлорофилла переходит в возбужденное первое синглетное состояние, энергия синего фотона способна перевести молекулу хлорофилла во второе синглетное состояние. Время полужизни второго синглетного состояния всего 10–12 с, поэтому оно слишком нестабильно, чтобы использовать избыточную энергию для совершения химической работы. В результате возбужденная молекула рассеивает часть энергии в форме тепла за счет вращений и колебаний.
Оценку энергетической составляющей спектра видимого излучения и управление регуляторными процессами осуществляют фоторецепторы. Они представляют собой пигмент-белковые комплексы, которые преобразуют энергию поглощенных фотонов в биохимический сигнал [8]. В зависимости от типа фоторецептора различают два пути осуществления фотохимической реакции. Функционирование рецепторов красного света, фитохромов Ph660 и Ph730, характеризуется изомеризацией молекулы светочувствительного пигмента, изменением конформации белка и запуском фосфорилирования определенного домена белкового комплекса. В результате поглощения фотона молекула светочувствительного пигмента рецепторов синего света, криптохромов CRY1, CRY2 и фототропинов PHOT1, PHOT2, изменяет свой окислительно-восстановительный потенциал и передает световой сигнал через систему вторичных мессенджеров.
Ранее [9, 10] были описаны общие характеристики воздействия оптического излучения на биологические системы растения на начальном этапе развития. Известно, что фоторецепторы синего и красного света CRY1, CRY2 и Ph660, Ph730 управляют фотоморфогенезом. В частности, эти фоторецепторы контролируют эффективность фотосинтеза, изменяя длину стебля и тем самым положение растения в пространстве с целью увеличения площади листа как органического фотоэлемента, открытой для потока излучения. Фоторецепторы синего света PHOT1, PHOT2 отвечают за фототропизм – образование изгибов у растений, вызванное неравномерным освещением листьев растения. Таким образом, эти рецепторы также управляют эффективностью фотосинтетической реакции и корректируют ориентацию растения в пространстве, изменяя доступную для потока оптического излучения площадь поверхности листа. Известно, что синтез хлорофилла регулируется фоторецепторами [11], однако механизм управления этим процессом недостаточно изучен.
Гипотеза, лежащая в основе модели. При разработке модели в ее основу легло предположение о том, что в зависимости от управляющих сигналов каждой системы формируется интегральный сигнал об энергетической эффективности физиологически важных областей спектра падающего излучения – синей (от 320 до 500 нм) и красной (от 600 до 800 нм). Таким образом, регулируется рост клеток в определенной части растения, т.е. фотоморфогенез и фототропизм.
Принцип работы фоторецепторов можно сравнить с функционированием вентилей, регулирующих существующие потоки синтезированной и поглощенной энергии химических соединений в зависимости от области спектра света и тем самым обеспечивающих эффективный фотосинтез. Потоки химической энергии не проходят непосредственно через фоторецептор, а осуществляется косвенное управление процессом накачки внутрь клетки. В результате управляющих воздействий фоторецепторов активируются ионные насосы, молекулярные механизмы, локализованные в мембране и способные транспортировать вещества за счет энергии, высвобождаемой при расщеплении АТФ, или любого другого вида энергии.
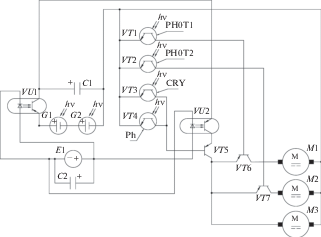
Качественная модель процесса. Предложенная качественная модель схематически отображает зависимость эффективности фотосинтеза и дальнейшего преобразования накопленной химической энергии от потоков макро- и микроэлементов и области спектра света. На основании этой модели возможно создание физической твердотельной модели растения. На рис. 1 схематично изображена физическая модель биологической системы растения. В начальный момент времени большая часть поверхности солнечных элементов (панелей) 1 и 2, имитирующих поверхность листьев, находится под непрозрачной поверхностью 3. Стрелками указано направление перемещения по горизонтали солнечных панелей, в процессе поглощения квантов света. Также стрелкой показано направление, в котором осуществляется перемещение по вертикали элементов 1–3 путем выдвижения элементов телескопической стойки 4 крепления панелей 1–3. Данная физическая модель отражает способность увеличения площади активной поверхности в процессе поглощения энергии квантов света фоточувствительной органической системой.
Рис. 1.
Физическая модель фоточувствительной биологической системы: 1, 2 – солнечные панели; 3 – непрозрачная панель; 4 – телескопическая стойка.

В схеме на рис. 2 солнечные батареи G1 и G2 преобразуют энергию фотонов в электрическую энергию и таким образом имитируют хлорофильные фотосистемы, осуществляющие преобразование энергии фотонов в химическую энергию (глюкоза С6Н12О6, аминокислоты, нуклеотиды, глицерин, жирные кислоты). Сгенерированные под воздействием энергии квантов света электроны накапливаются в электролитическом конденсаторе C1, что отражает способность живой клетки сохранять энергию синтезированных химических соединений. Установлено, что макро- и микроэлементы минеральных питательных веществ играют ключевую роль в процессе фотосинтеза и метаболизма [12]. Азот, фосфор и сера являются составляющими органических соединений, таких как аминокислоты, нуклеотиды, фосфолипиды, пептиды, белки. Остальные элементы находятся в виде ионов или в форме металлобелковых комплексов с органическими молекулами, определяя конформацию и стабильность макромолекул, потенциал мембран и так далее. Батарея C2 заряжается источником эдс с переменной интенсивностью E1, что является аналогом питания корневой системы минеральными элементами. Оптрон VU1 описывает зависимость эффективности фотосинтеза от потока минеральных веществ. Конденсатор C1 не заряжается, если оптрон VU1 не открыт, т.е. отсутствует эдс на источнике E1. Фототранзисторы VT1, VT2, VT3, VT4 имитируют функционирование фоторецепторов криптохромов, фитохромов, фототропинов. В результате поглощения фототранзисторами фотонов снижается потенциальный барьер эмиттерного перехода, и на коллекторе формируется суммарный выходной сигнал. Протекание потока электронов через p–n-переходы транзистора в результате активации светом является аналогией с фосфорилированием домена белка рецептора и включением накачки ионов в клетку. Фоторецепторы характеризуются различной спектральной чувствительностью. Так, криптохромы CRY1 и CRY2 реагируют на излучение в синей области спектра от 320 до 500 нм высокой и низкой интенсивности. Фитохромы Ph(А)660 и Ph(А)730 чувствительны как к красному свету (λ = 660 нм) сверхнизкой интенсивности, так и к дальнему красному свету (λ = 730 нм) высокой интенсивности и не способны к фотоконверсии. Фитохромы Ph(B)660 и Ph(B)730 являются взаимно превращающимися и отвечают за восприятие света низкой интенсивности. Механизм работы фототропина наименее изучен, однако экспериментально установлено, что он также существует в двух формах, реагирующих на синий свет низкой и высокой интенсивности [8]. В данном варианте схемы одноименные транзисторы показаны одним элементом. Фототранзисторы VT1 и VT2 (рис. 2) соответствуют PHOT 1 и PHOT 2. Фототропины PHOT 1 и PHOT 2 отвечают фотоэлементам 1 и 2 (рис. 1). Криптохромы CRY1 и CRY2 показаны фототранзистором VT3 (CRY). Фитохромы Ph(А)660, Ph(А)730, Ph(B)660, Ph(B)730 представлены фототранзистором VT4 (Ph).
Оптрон VU2 определяет поток электронов, поступающих на эмиттер транзистора VT5 и описывает зависимость проникновения глюкозы, аминокислот, нуклеотидов в клетку от концентрации ионов и минеральных веществ, поступающих из корневой системы. Транзистор VT5 интегрирует потоки энергии, управляющим током базы является интегральный сигнал от системы фототранзисторов VT3, VT4.
Транзистор VT6 регулирует ток электродвигателя M1 и чувствительную к свету площадь панели 1, управляющим током базы является сигнал от фототранзистора VT1 (PHOT1). Транзистор VT7 регулирует ток электродвигателя M2 и чувствительную к свету площадь панели 2, управляющим током базы является сигнал от фототранзистора VT2 (PHOT2). Эти элементы имитируют способность фототропина блокировать транспорт гормона роста ауксина и, соответственно, питательных веществ в клетки менее освещенных листьев.
В результате электродвигатели M1, M2, M3 перемещают фоточувствительный элемент G1 в пространстве в зависимости от спектра света. Электродвигатели M1 и М2 осуществляют перемещение фотоэлементов 1 и 2 по горизонтали, что соответствует изменению площади активной поверхности и набору биомассы листьев 1 и 2. Электродвигатель М3 перемещает фотоэлементы по вертикали, что соответствует росту стебля растения.
Запасенная энергия распределяется в ходе функционирования фоторецепторов и активируемых сигнальных каскадов. Анализ спектральных характеристик фотобиологических процессов позволил рассчитать энергию потока фотонов источника искусственного излучения, потенциально пригодную для активации фоторецепторов и фототропической реакции, фотоморфогенеза. Таким образом, по аналогии с фототранзисторами можно узнать спектральную чувствительность фоторецепторов.
МЕТОДИКА
Теоретически можно рассчитать количество синтезированной энергии и запасенной в виде углеводов Сх(Н2О)у. На рис. 3 представлены спектры действия фотобиологических реакций в растении: фотосинтеза Kф(λ); диссипации энергии в виде тепла Kт(λ); фототропической реакции Kфр(λ); синтеза хлорофилла Kхл(λ); фотоморфогенеза по фитохрому Ф660 KФ660(λ); фотоморфогенеза по фитохрому Ф730 KФ730(λ).
Рис. 3.
Спектр действия фотобиологических процессов: фотосинтеза (1); диссипации энергии в виде тепла (2); фототропической реакции (3); синтеза хлорофилла (4); фотоморфогенеза по фитохрому Ф660 (5) и Ф730 (6).

На основе данных о спектральной эффективности фотосинтеза Kф(λ), а также о спектре поглощения листа может быть определено количество синтезированной энергии в виде углеводов в результате поглощения квантов видимого света.
Плотность потока фотонов фотосинтетически активного излучения для длины волны λ может быть рассчитана:
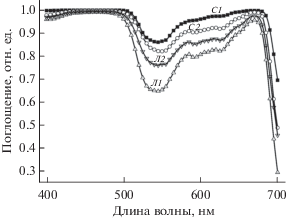
где D(λ) – плотность потока фотонов излучения источника света, Kn(λ) – коэффициент поглощения n-го листа растения (рис. 4). На рис. 4 каждая кривая представляет среднее значение десяти измерений: C1 и C2 означают “семядоля 1” и “семядоля 2” соответственно; Л1 и Л2 означают “взрослый лист 1” и “взрослый лист 2” соответственно.Рис. 4.
Эффект влияния возраста растения на поглощение света листом: С1 – семядоля 1; С2 – семядоля 2; Л1 – взрослый лист 1; Л2 – взрослый лист 2.
Для того чтобы рассчитать количество молекул углеводов, образованных под воздействием некогерентного излучения, необходимо знать энергетическую емкость каждого участка спектра. Количество энергии, переносимой молярным числом Na фотонов с длиной волны λ, вычисляется как:
Теоретически для покрытия энергетических затрат, связанных с преобразованием 1 моль углерода в углеводород из углекислого газа и воды и выделению кислорода, достаточно не менее 120 ккал (502.080 кДж/моль), что соответствует трем квантам красного света (680 нм):
Однако Эмерсон и Арнольд [13] установили, что в реальных условиях требуется большее количество энергии, и квантовый расход составляет от восьми до 10 квантов на одну поглощенную молекулу углекислого газа и полученную молекулу кислорода, т.е. при максимальном потреблении 10 фотонов энергия составит ${{E}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ = 1760 кДж/моль. Исходя из этого потенциальный квантовый расход на длине волны λ составит:
Поскольку считается, что только единичный фотон может дать вклад в каждый элементарный фотохимический акт, то потенциальный квантовый расход γ(λ) необходимо округлять до ближайшего большего или равного целого числа.
На основе данных об эффективном количестве фотонов Dn(λ) и квантовом расходе фотосинтеза γ(λ) рассчитывают интенсивность преобразования углекислого газа в углеводы для n-го листа $[{{I}_{{{\text{C}}{{{\text{O}}}_{2}}n}}}(\lambda )] = \left[ {\frac{{{\text{м к м о л ь }}}}{{{{{\text{м }}}^{{\text{2}}}} \cdot {\text{с }}}}} \right]{\text{:}}$
(4)
${{I}_{{{\text{C}}{{{\text{O}}}_{2}}n}}}(\lambda ) = \frac{{{{D}_{n}}{\text{(}}\lambda {\text{)}}}}{{\gamma (\lambda )}}.$Если S1c, S2c, S1в – площади поверхности первого и второго семядольных листьев и первого взрослого листа соответственно, а λ1–λ2 – диапазон длин волн некогерентного излучения, то количество преобразованных молекул углекислого газа составит:
Для перехода от массы преобразованного углекислого газа к массе сухого вещества необходимо ввести поправочный коэффициент k1 = 0.64, так как 1 г поглощенного углекислого газа соответствует 0.64 г углеводов.
Также лимитирующим фактором является скорость диффузии углекислого газа в клетки фотосинтезирующих органов. Известно, что для нормального протекания процесса фотосинтеза в клетки должен непрерывно поступать углекислый газ. В результате поглощения листом углекислого газа возникает градиент концентраций газа, который вызывает диффузию СО2 в направлении фотосинтезирующих органов растения. Согласно закону Фика скорость диффузии прямо пропорциональна разности концентраций и обратно пропорциональна сопротивлению. Углекислый газ диффундирует из дальних слоев атмосферы в близлежащие к листу и затем в межклеточные пространства, из межклетников в клетки и далее к хлоропластам. Чем быстрее используется углекислый газ в процессе фотосинтеза, тем больше падает его парциальное давление в межклетниках и тем быстрее поступает в них СО2 [14].
Также необходимо учесть потери синтезированных углеводов на дыхание растений. На основе данных рис. 5 о зависимости скорости поглощения СО2 от интенсивности света [15] вводится поправочный коэффициент k2, учитывающий изменение диффузии углекислого газа и потери энергии в процессе дыхания:
(6)
${{k}_{2}} = \frac{{{{V}_{{{\text{п о г л }}}}}{{t}_{{{\text{п о г }}}}}_{{\text{л }}} - {{V}_{{{\text{д ы х }}}}}{{t}_{{{\text{д ы х }}}}}}}{{{{V}_{{{п о г л \_м а к с }}}}{{t}_{{{\text{п о г л }}}}}}},$С учетом всех поправочных коэффициентов масса синтезированных углеводов Сх(Н2О)у будет равна:
(7)
${{M}_{{{{{\text{C}}}_{x}}{{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}}_{y}}}}} = {{k}_{1}}{{k}_{2}}{{N}_{\sum }}M{{r}_{{{\text{C}}{{{\text{O}}}_{2}}}}},$Синтез каждой молекулы глюкозы сопровождается увеличением свободной энергии Гиббса ΔG. Зная общее количество молекул и значение ΔG единичного акта синтеза молекулы глюкозы, можно рассчитать суммарное увеличение свободной энергии системы вследствие поглощения потока излучения при фотосинтезе:
Для описания фотосинтетических окислительно-восстановительных реакций используют величину электрического потенциала ΔE, которая выражается через энергию Гиббса [16]:
где $F$ – количество зарядов в 1 моль, равное 96.480 ${\text{A}} \cdot {\text{c}}$/моль.Значение электрического потенциала, синтезированной химической энергии, может быть использовано для модели фоточувствительной системы растения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Зная линейные характеристики (длину L и ширину W листа) растения (рис. 6) представляется возможным теоретически рассчитать площадь поверхности листа S. Были рассчитаны площади листовой поверхности семядольных и взрослых листьев.
Форма семядольного листа (рис. 6а) близка к эллипсу [17], поэтому площадь листовой поверхности может быть определена по формуле:
Взрослый лист характеризуется более сложной формой (рис. 6б). Для оценки площади листовой поверхности в зависимости от линейных размеров листа применяются регрессионные модели [18]. Так, площадь поверхности первого взрослого листа может быть определена согласно регрессионному уравнению:
Таким образом, можно сравнить теоретические данные о количестве синтезированного и запасенного вещества в растении с экспериментальными данными о сухой массе растений, освещаемых источниками света различного спектрального состава.
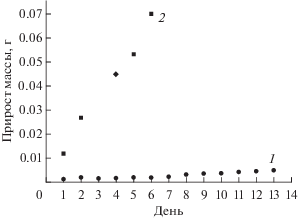
На основе данных ежедневных измерений линейных характеристик листа можно отследить динамику развития биологической системы растения и получить распределение фотосинтезированной химической энергии в процессе развития. Рассмотрен эффект влияния спектра двух источников света (рис. 7) – дуговой натриевой трубчатой лампы ДНаТ 250 Вт и светодиодного светильника СИД 46 Вт [10]. На рис. 8 дню измерения соответствует скорость синтеза углеводов за последующие сутки. В табл. 1 представлены теоретически рассчитанные суммарные массы синтезированных углеводов ${{M}_{{{{{\text{C}}}_{x}}{{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}}_{y}}}}}$ и средняя сухая масса экспериментально полученных образцов.
Таблица 1.
Теоретически рассчитанные массы синтезированных углеводов ${{M}_{{{{{\text{C}}}_{x}}{{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}}_{y}}}}}$ и средняя сухая масса экспериментально полученных образцов
| Масса синтезированных углеводов, г | Сухая масса, г | |
|---|---|---|
| СИД 46 Вт | 0.0374 | 0.052 |
| ДНаТ 250 Вт | 0.2072 | 0.202 |
Используя данные о зависимости спектра поглощения листа растения от стадии развития, также спектры эффективности фотобиологических реакций [6], можно оценить эффект спектра оптического излучения для биологических систем растений различного уровня развития. Тогда потенциальную эффективность спектра Dэф для фотобиологических реакций можно оценить по следующему выражению:
(12)
${{D}_{{{\text{э ф }}}}} = \int\limits_{400}^{700} {{{K}_{{{\text{э ф }}}}}(\lambda )D(\lambda ){{K}_{n}}(\lambda )d\lambda } ,$Известно, что в сравнении с энергетическими воздействиями фоторегуляторные требуют в десятки и сотни раз меньше энергии, однако точное количество на данный момент не установлено. В рамках моделирования эффективности фотобиологических процессов в растении было предложено выражение для регуляторных процессов:
(13)
${{D}_{{{\text{э ф }}}}} = {{K}_{{{\text{и с п }}}}}\int\limits_{400}^{700} {{{K}_{{{\text{э ф }}}}}(\lambda )D(\lambda ){{K}_{n}}(\lambda )d\lambda {\kern 1pt} } .$Пусть Dф, Dт, Dфр, Dхл, DФ660, DФ730 – эффективные потоки излучения для фотобиологических реакций. Поток фотонов, поглощенный листом растения определенной степени развития, определяется как:
(14)
${{D}_{{{\text{п о г л }}}}} = \int\limits_{400}^{700} {D(\lambda ){{K}_{n}}(\lambda )d\lambda } ,$Поскольку элементы системы и система в целом очень сложны, допустим еще одно упрощение – коэффициент Kисп будем рассматривать как один общий для всех регуляторных процессов. Таким образом, суммарный поток поглощенного излучения конкретного спектра будет преобразовываться следующим образом:
(15)
$\begin{gathered} {{D}_{{{\text{п о г л }}}}} = {{D}_{{\text{ф }}}} + {{D}_{{\text{т }}}} + \\ + \,\,{{K}_{{{\text{и с п }}}}}({{D}_{{{\text{ф р }}}}} + {{D}_{{{\text{х л }}}}} + {{D}_{{{\text{Ф }}660}}} + {{D}_{{{\text{Ф }}730}}}), \\ \end{gathered} $(16)
$\begin{gathered} {{K}_{{{\text{и с п }}}}} = \\ = {{({{D}_{{{\text{п о г л }}}}} - {{D}_{{\text{ф }}}} - {{D}_{{\text{т }}}})} \mathord{\left/ {\vphantom {{({{D}_{{{\text{п о г л }}}}} - {{D}_{{\text{ф }}}} - {{D}_{{\text{т }}}})} {({{D}_{{{\text{ф р }}}}} + {{D}_{{{\text{х л }}}}} + {{D}_{{{\text{Ф }}660}}} + {{D}_{{{\text{Ф }}730}}})}}} \right. \kern-0em} {({{D}_{{{\text{ф р }}}}} + {{D}_{{{\text{х л }}}}} + {{D}_{{{\text{Ф }}660}}} + {{D}_{{{\text{Ф }}730}}})}}. \\ \end{gathered} $При низкой плотности потока фотосинтетически активных фотонов тепловые потери в процессе поглощения и преобразования света практически отсутствуют. Тогда для СИД 46 Вт формула (16) примет вид:
(17)
${{K}_{{{\text{и с п }}}}} = {{({{D}_{{{\text{п о г л }}}}} - {{D}_{{\text{ф }}}})} \mathord{\left/ {\vphantom {{({{D}_{{{\text{п о г л }}}}} - {{D}_{{\text{ф }}}})} {({{D}_{{{\text{ф р }}}}} + {{D}_{{{\text{х л }}}}} + {{D}_{{{\text{Ф }}660}}} + {{D}_{{{\text{Ф }}730}}})}}} \right. \kern-0em} {({{D}_{{{\text{ф р }}}}} + {{D}_{{{\text{х л }}}}} + {{D}_{{{\text{Ф }}660}}} + {{D}_{{{\text{Ф }}730}}})}}.$На основе данных моделирования получены значения Dф, Dт, Dфр, Dхл, DФ660, DФ730, и для каждого спектра рассчитаны Kисп (табл. 2).
Таблица 2.
Эффективная для фотобиологических реакций плотность потока фотонов
| Источник излучения | Исходная плотность потока фотонов, мкмоль/м2 ⋅ с | Плотность потока фотонов, мкмоль/м2 ⋅ с | ||||||
|---|---|---|---|---|---|---|---|---|
| Dф | Dт | Dфр | Dхл | DФ660 | DФ730 | |||
| СИД 46 | 63.73 | Семядоля 1 | 53.2 | 14.5 | 1.982 | 3.978 | 3.327 | 0.645 |
| Семядоля 2 | 51.9 | 14.4 | 2.007 | 3.910 | 3.253 | 0.637 | ||
| Лист 1 | 49.2 | 14.1 | 2.062 | 3.827 | 3.141 | 0.625 | ||
| Лист 2 | 50.6 | 14.2 | 2.040 | 3.868 | 3.196 | 0.632 | ||
| ДНаТ 250 | 403.64 | Семядоля 1 | 312.1 | 45.7 | 0.898 | 11.582 | 13.581 | 1.390 |
| Семядоля 2 | 297.3 | 44.2 | 0.872 | 10.750 | 12.579 | 1.252 | ||
| Лист 1 | 265.4 | 40.4 | 0.810 | 9.019 | 10.478 | 1.035 | ||
| Лист 2 | 282.6 | 42.5 | 0.852 | 9.954 | 11.620 | 1.166 | ||
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
К моменту первого определения линейных размеров листовой поверхности уже существовали ткани растения, корневой системы, т.е. масса синтезированных углеводов должна быть меньше сухой массы растений. Рассчитанные значения массы синтезированных углеводов одного порядка со значениями сухой массы экспериментально полученных образцов. Различия могут быть объяснены тем, что поправочный коэффициент k2 не учитывает спектральные особенности рассматриваемых источников излучения, а также является косвенной индикацией зависимости скорости диффузии СО2 от интенсивности газообмена. Также коэффициент k1 среднестатистический, он не учитывает все особенности реальных условий. Таким образом, модель расчета динамики фотосинтеза в зависимости от спектра некогерентного излучения может быть применена для численного моделирования воздействия различных источников света. Также она может быть применена в разработке качественной модели системы растения. В ходе процессов формообразования происходит перераспределение синтезированной энергии углеводов. Измерение сухих масс отдельных органов растения в процессе вегетации, а также теоретические расчеты влияния спектра излучения на динамику синтеза углеводов делает возможным определение значений потоков химической энергии, управляемых различными фоторецепторными системами, что может быть использовано при разработке твердотельной модели биологической системы растения.
ЗАКЛЮЧЕНИЕ
Представленная качественная модель создает предпосылки для теоретического расчета энергетических затрат сложной системы численными методами и прогнозирования эффективности спектра источников света для энергетических и фоторегуляторных процессов с использованием обратной связи с растением. Разработанный метод моделирования влияния спектра света на процессы в растении может быть применен для различных биологических систем (применение низкоэнергетического излучения в медицине, животноводстве, в современных гибридных высокотехнологичных системах преобразования излучения и так далее). Проведено теоретическое исследование воздействия видимого излучения на изменение физических свойств конденсированных веществ на примере биологической структуры растения, а также разработаны и исследованы физико-технологические принципы совершенствования облучательных приборов электронной техники для живых систем с применением методов инженерии.
Список литературы
Bhushan B. // Phil. Trans. R. Soc. A. 2009. V. 367. P. 1445.
Patra J. K., Gouda S. // J. Endocrin. Thyroid Res. 2013. V. 5. № 5. P. 104.
Liu C., Colon B.C., Ziesack M. et al. // Science. 2016. V. 352. № 6290. P. 1210.
Wang X.Y., Xu X.M., Cui J. // Photosynthetica. 2015. V. 53. № 2. P. 213.
Singh D., Basu C., Meinhardt-Wollweber M., Roth B. // Renewable Sustainable En. Rew. 2015. V. 49. P. 139.
Волков В.Н., Свентицкий И.И., Сторожев П.И., Царева Л.А. Искусственное облучение растений. Пущино: Институт агрохимии и почвоведения РАН, 1982. 41 с.
McCree K. J. // Physiological Plant Ecology I. 1981. P. 41.
Алехина Н.Д., Балнокин Ю.В., Гавриленко В.Ф. и др. Физиология растений. М.: Академия, 2005. 640 с.
Супельняк С.И., Косушкин В.Г., Адарчин С.А. // Электромагнитные волны и электронные системы. 2017. Т. 22. № 8. С. 25.
Супельняк С.И., Косушкин В.Г., Адарчин С.А. // Электромагнитные волны и электронные системы. 2017. Т. 22. № 7. С. 21.
Kasemir H. // Cell Biol. Intern. Rep. 1979. V. 3. № 3. P. 197.
Grusak M.A., Broadley M.R., White P.J. Plant Macro-and Micronutrient Minerals. // Encyclopedia of Life Sciences. 2016. https://doi.org/10.1002/9780470015902.a0001306.pub2.
Emerson R. // Ann. Rev. Plant Physiol. 1958. V. 9. № 1. P. 1.
Якушкина Н.И., Бахтенко Е.Ю. Физиология растений. М.: ВЛАДОС, 2004. 464 с.
Alam M.A. Night Time Temperature and Day Time Irradiance on Photosynthesis and Growth of Cucumber: Potential and Possibilities for Energy Saving: Thes. Norwegian University of Life Sciences, 2016.
Хелдт Г.В. Биохимия растений. М.: БИНОМ, 2011. 478 с.
Gregory F.G. // Ann. Botany. 1921. № 1. P. 93.
Blanco F.F., Folegatti M.V. // Horticultura Brasileira. 2003. V. 21. № 4. P. 666.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования