Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 12, стр. 105-112
Способ изготовления микрофлюидных биочипов
А. Н. Генцелев a, *, Ф. Н. Дульцев b, c, А. В. Варанд a, d, В. И. Кондратьев a
a Институт ядерной физики им. Г.И. Будкера СО РАН
630090 Новосибирск, Россия
b Новосибирский государственный университет
630090 Новосибирск, Россия
c Институт физики полупроводников им. А.В. Ржанова СО РАН
630090 Новосибирск, Россия
d Институт химии твердого тела и механохимии СО РАН
630128 Новосибирск, Россия
* E-mail: ang1209@mail.ru
Поступила в редакцию 14.01.2020
После доработки 16.03.2020
Принята к публикации 19.03.2020
Аннотация
Описан новый отличающийся от широко известной LIGA-технологии способ изготовления инструментов формовки, содержащих рельеф, а именно: вкладышей литьевой формы или пресс-формы. Рельеф создается посредством плазмохимического травления поверхности титановой подложки через предварительно сформированную на ней маску (резистивную или металлическую). С помощью полученных инструментов можно формовать (отливать или штамповать) из пластмасс различные изделия, например, микрофлюидные биочипы. Опробованы три варианта их формовки из различных полимеров и выработаны рекомендации по улучшению качества полимерных реплик. Описан новый метод отливки микрофлюидных биочипов из промышленно выпускаемого мономера метилметакрилата (ММА), полимеризуемого без использования катализаторов (или инициаторов) полимеризации. Данный метод позволяет существенно расширить спектральный диапазон использования микрофлюидных биочипов, функционирование трансдьюсеров которых базируется на люминесцентных методах детектирования, в частности самого чувствительного на настоящий момент метода лазер-индуцируемой флуоресценции. Расширение спектрального диапазона происходит из-за существенного уменьшения потока флуоресцентного излучения, идущего непосредственно от материала биочипа при его формировании новым методом, по сравнению с методами-аналогами.
ВВЕДЕНИЕ
В последнее десятилетие происходит интенсивное развитие биосенсорики и микрофлюидики, что привело к разработке многочисленных приборов для экспресс-анализа. В микрофлюидных чипах осуществляется воспроизводимое управление течением жидкостного и газожидкостного потоков нано- и пиколитровых объемов жидкости в микроразмерных каналах, в следствие чего появилась возможность реализации методик анализа и создания приборов с отличными от макроаналогов техническими характеристиками. Приборы на основе микрофлюидных чипов обладают рядом преимуществ, а именно: малым расходом реагентов и пробы; высокой чувствительностью определения компонентов пробы; компактными размерами, низким энергопотреблением [1–3]. Дополнительные преимущества микрофлюидных технологий заключаются и в том, что реакции проходят в закрытых системах, где исключена контаминация (загрязнение пробы под воздействием окружающей среды), чипы имеют тенденцию к дальнейшему уменьшению размеров каналов и увеличению производительности (что выражается в уменьшении себестоимости анализа и времени его проведения), а также потенциально обеспечивают проведение на составе одной биологической пробы нескольких идентичных анализов одновременно, что позволяет, уменьшать суммарную ошибку эксперимента [4].
Наиболее простая и распространенная конструкция микрофлюидного биочипа (далее биочипа или чипa) представляет собой две герметично соединенные пластины: на базовой формируются микроканалы, реакторы, клапаны, электроды и иные функциональные элементы, а другая пластина является защитной и обычно представляет собой оптически прозрачную стеклянную пластинку [5, 6].
Существует множество способов и технологий формирования микрорельефа (т.е. создания элементов микронных размеров) в подложках из различных материалов, но выбор технологического маршрута в значительной степени определяется применяемым материалом базовой пластины и характеристиками формируемых структур, а также теми операциями, которые планируется осуществлять на таком чипе [1–13]. Следует иметь в виду, что все технологии, связанные с активным воздействием на поверхность материала, например, такие как лазерная микрообработка, кислотное травление, плазмохимическое травление и т.п., приводят к изменению свойств поверхности [13], т.е. к закреплению на обработанной поверхности химических радикалов, что приводит к изменению ее исходных свойств, в следствие взаимодействия радикалов с анализируемым жидкостным или газожидкостным потоком. Тем не менее в ряде случаев экспериментаторы, учитывая эти факторы, применяют такие технологии для изготовления чипов определенного назначения.
Известен способ формирования микрорельефа на поверхности пластин из промышленно выпускаемого листового органического стекла, состоящего из полиметилметакрилата (ПММА), посредством трафаретной рентгеновской литографии, т.е. путем облучения рабочей поверхности пластины рентгеновским излучением через рентгеношаблон, содержащий топологический рисунок в виде сети микроканалов, и последующего “проявления” рисунка, путем растворения облученных участков пластины на некоторую глубину [14, 15]. Основными недостатками этого способа являются: 1) необходимость проведения экспонирования синхротронным излучением каждого изготавливаемого чипа, что является сравнительно дорогой операцией и не позволяет на основе данного способа организовать массовое производство; 2) значительная (на уровне несколько микрометров) шероховатость дна каналов, приводящая к существенному ухудшению условий для ламинарного протекания жидкости по ним; 3) изменение свойств поверхности каналов по сравнению с исходным материалом под воздействием химического проявителя; 4) существенный уровень наличия в промышленно выпускаемом оргстекле различных химических добавок, применяемых, как для его полимеризации, так и для придания ему определенных свойств. Последние два из перечисленных факторов приводит к неконтролируемой иммобилизации (фиксации) биологических объектов и к дополнительному фоновому “свечению” материала биочипа в потоках зондирующего излучения при использовании флуоресцентных методов детектирования, что затрудняет анализ слабых полезных сигналов, идущих от исследуемых проб.
Биочипы, выполненные из стекла или кварцевого стекла [4], гораздо лучше вышеописанных из органического стекла, поскольку поверхность сформированных в стекле каналов очень гладкая (шероховатость не превышает 8 нм), а кроме того стекло отличаются высокой химической стойкостью, превосходной оптической прозрачностью и хорошими термическими свойствами. Это позволяет использовать разнообразные растворители и химические реактивы. Использование кварцевого стекла обусловлено прежде всего его однородностью и прозрачностью в УФ-диапазоне, что требуется при применении флуоресцентных методов диагностики биологических проб.
Однако, поскольку для формирования сети каналов используются процессы фотолитографии и жидкостного травления плавиковой кислотой (HF), то это приводит к относительной дороговизне таких чипов [4] и к закреплению на травленной поверхности химических радикалов, изменяющих ее исходные свойства, что необходимо учитывать при проведении анализов с использованием данных биочипов. Решением вышеуказанных проблем может быть изменение технологии изготовления базовых пластин биочипов, а именно: их механическая формовка или отливка из пластических масс.
Известен высокоскоростной способ формирования рельефа в нанесенном на полимерную пленку резисте, посредством проката такой пленки между двумя роликами, один из которых имеет рельефную поверхность, обращенную к резистивному слою (Roll-to-Roll технология) [16]. Полимеризация резиста производится непосредственно в установке под воздействием тепла (тепловой пушки) или УФ-излучения. Хотя при формировании рельефа данным способом отсутствует какое-либо активное химическое воздействие на поверхность, тем не менее его нельзя широко использовать для изготовления биочипов, ориентированных на флуоресцентные методы детектирования, поскольку материалом базовых пластин в этом случае является резист, взаимодействующий с излучением накачки (т.е. поглощающий и переизлучающий его), что неизбежно создает фоновое излучение, затрудняющее анализ слабых полезных сигналов от биологических проб.
ПОСТАНОВКА ЗАДАЧИ
Из вышеизложенного следует, что базовые пластины биочипов предпочтительнее изготавливать посредством формовки из химически чистых пластмасс прозрачных в оптическом и УФ-диапазонах. Это осуществимо посредством широко известной под аббревиатурой LIGA-технология последовательности операций: 1) формирование толстой резистивной маски методом глубокой рентгенолитографии; 2) создание методом гальванопластики вкладыша пресс-формы или литьевой формы (далее штамп), содержащего топологию рельефа; 3) формовка изделий из пластмассы при помощи штампа [17, 18].
LIGA-технология хорошо подходит для массового производства биочипов, однако, у нее есть ряд проблем технологического характера, связанные с формированием рельефа штампа посредством гальванопластики. Если штамп изготавливается путем “приращивания” рельефа к подложке, через сформированную на ней резистивную маску, то возникают проблемы, связанные с различной скоростью гальванического осаждения металла в зависимости от аспектного отношения (от отношения высоты элемента к минимальному топологическому размеру в латеральной плоскости) формируемых элементов топологии, а также с адгезией осаждаемого металла к подложке и с обеспечением гладкости (низкой шероховатости) рабочей поверхности штампа. Если штамп полностью изготавливается методом гальванопластики путем осаждения металла на подложку с резистивной маской с последующим отделением штампа от подложки, то “узкими местами” данного подхода являются: различие скоростей гальванического осаждения металла в зависимости от аспектного отношения и формирование границы перехода выступов рельефа штампа в его цельнометаллическую часть. Последняя из проблем может быть решена путем остановки процесса в момент приближения формируемых элементов штампа к указанной границе, промывки изготавливаемого изделия, его сушке и покрытия верхней поверхности резистивной маски металлом (путем напыления или химического осаждения) и продолжения дальнейшего формирования штампа гальванопластикой. В обоих случаях для выравнивания скоростей гальванического осаждения при формировании рельефных выступов с различным аспектным отношением требуется проведение изыскательских работ, связанных с использованием каталитических добавок, меняющих скорость осаждения, и с поиском оптимальных режимов осаждения, сочетающих подачу прямого и реверсивного токов.
Целью данной работы был поиск технологических решений, обеспечивающих изготовления базовых пластин биочипов путем их формовки из прозрачных в видимом и частично в УФ диапазонах полимеров, что позволит использовать флуоресцентные методы детектирования в том числе и самый высокочувствительный на данный момент времени метод, а именно: лазер-индуцируемой флуоресценции [2]. Кроме того, формовка базовых пластин биочипов позволяет существенно снизить их себестоимость при промышленном производстве и исключает изменение свойств поверхности каналов, как это имеет место в случае их формирования посредством различного вида литографий.
КОНСТРУКЦИЯ ШТАМПА И ТЕХНОЛОГИЯ ЕГО ИЗГОТОВЛЕНИЯ
В обеспечение указанной цели, нами был разработан более простой по сравнению с ранее применяемой LIGA-технологией способ изготовления инструмента для формовки – штампа.
Для изготовления тестового образца штампа (рис. 1) использовалась титановая подложка диаметром ~40 мм и толщиной ~4 мм, ее рабочая поверхность была отполирована. Основные этапы изготовления штампа описаны в работе [19], и они следующие: формирование на рабочей поверхности титановой заготовки, при помощи установки контактной фотолитографии, защитной резистивной маски (рис. 2); создание рельефа (рис. 3) посредством плазмохимического травления через маску; удаление остатков резистивной маски.
Рис. 2.
СЭМ-фото (угол наблюдения 45°) фрагмента сформированной резистивной маски из SU-8, толщиной h ≈ 110 мкм.

Рис. 3.
СЭМ-фото (угол наблюдения 45°) фрагмента рельефа (высотой ~40 мкм) на титановой подложке. Видна вертикальность боковых стенок рельефа и их гладкость.

Плазмохимическое травление проводилось на установке Plasmalab 80 ионами трихлорида бора (BCl3) и аргона (Ar) путем многократного (около 70 раз) повторения двух стадий: травление 2.5 мин и охлаждение 3 мин. Рабочая температура столика ~Т = 5°С. Скорость травления резиста примерно в 1.5 раза больше скорости травления титана (т.е. исходная толщина резистивной маски должна более чем в 1.6 раза превышать требуемую высоту рельефа на подложке). Следует отметить, что в качестве защитной маски для плазмохимического травления может использоваться маска из металла, например, алюминия (Al), скорость травления которого в вышеуказанной плазме существенно (примерно в 250 раз) меньше, чем основного металла – титана. Данный способ позволяет формировать рельеф и на подложках, выполненных из других металлов, например, тантала, вольфрама и др., для которых можно организовать селективное плазмохимического травление.
ОТРАБОТКА ТЕХНОЛОГИИ ИЗГОТОВЛЕНИЯ БАЗОВЫХ ПЛАСТИН БИОЧИПОВ
С помощью полученного штампа было сделано ряд экспериментов по отработке изготовления тестовых образцов базовых пластин биочипов из четырех видов оптически прозрачных полимеров различными способами:
1. Штамповкой на специальном устройстве с прогревом до Т ≈ 180°С под давлением до 60 атм из промышленно выпускаемого листового оргстекла и поликарбоната (рис. 4, 5).
Рис. 4.
Фото полученного при помощи специального устройства образца базовой пластины микрофлюидного биочипа из листового оргстекла.

Рис. 5.
СЭМ-фото (угол наблюдения 45°) фрагментов рельефа полученной в результате штамповки из листового оргстекла базовой пластинки биочипа: верхний левый угол – а, верхний правый угол – б, нижний левый угол – в, нижний правый угол – г.

2. Отливкой из промышленно выпускаемого двухкомпонентного полимера SYLGARD 184 при температурах от комнатной до 150°С (рис. 6).
Рис. 6.
СЭМ-фото (угол наблюдения 45°) сформированного рельефа на поверхности тестового образца базовой пластины биочипа, выполненной из полимера SYLGARD 184.

3. Отливкой из прошедшего специальную обработку промышленно выпускаемого метилметакрилата (ММА), полимеризующегося при температуре Т ≈ 85°С (рис. 7).
Рис. 7.
СЭМ-фото фрагмента рельефа отливки из радиационно-индуцированного ММА с последующей его полимеризацией (угол наблюдения 45°) – а, более крупно (угол наблюдения 30°) – б.

Во втором и третьем вариантах титановый штамп использовался как вкладыш литьевой формы. На изготовленные образцы базовых пластин напылялся тонкий (~10 нм) слой золота для исследования качества полученного рельефа на сканирующем электронном микроскопе.
Отработка технологий изготовления штампа и формовки полимеров производилась с заданной топологией каналов чипа, имеющих размеры ~50 мкм (шириной и глубиной), однако, как показано в работе [19], размеры, могут быть уменьшены до нескольких микрон.
На рис. 3 видно, что большей шероховатостью характеризуется часть поверхности титанового штампа, подвергшаяся плазмохимическому травлению. Именно она формирует верхнюю поверхность базовой пластины биочипа, к которой приклеивается покровное стекло (защитная пластина). Увеличение шероховатости в данном случае приводит к увеличению адгезии и способствует лучшему сцеплению пластин (базовой и защитной), а, следовательно, надежнее обеспечивает герметизацию внутреннего объема биочипа.
Анализируя качество сформированного штамповкой рельефа в первом случае (фото, рис. 5) видно, что внешние края формируемого рельефа заломлены. Это объясняется тем, что температурный коэффициент линейного расширения штампуемых полимеров примерно на порядок больше чем у титана – материала штампа. В результате полимер при температуре его стеклования принимает форму, задаваемую штампом, а затем охлаждаясь сжимается (относительное сжатие полимера на длине 30 мм составляет ~70 мкм на сторону) и из-за этого края сформированного в полимере рельефа ломаются о края рельефа штампа.
Есть два основных подхода для решения данной проблемы, а именно: 1) использовать резиноподобные пластмассы, способные без разрушения упруго деформироваться на десятки микрометров; 2) производить разделение полимерной отливки от штампа (от вкладыша литьевой формы) непосредственно при температуре полимеризации.
Эти подходы были успешно опробованы. Качество рельефа, сформированного на рабочей поверхности полимерных базовых пластин биочипов, иллюстрируется на рис. 6, 7.
Широко известный резиноподобный двухкомпонентный полимер SYLGARD 184 может полимеризоваться при различных температурах (от 25 до 150°С): время полимеризации ~48 ч при комнатной температуре и ~10 мин при 150°С. Качество формируемого рельефа хорошее (рис. 6). К основным недостаткам данного полимера можно отнести его люминесцентное свечение в потоках УФ-излучения, аналогично, как и в случаях с промышленно выпускаемыми листовым оргстеклом и листовым поликарбонатом.
Известно, что промышленное производство оргстекла различных марок основано на полимеризации мономера ММА путем его перемешивания с различными химическими веществами, включающими как инициаторы полимеризации (например, перекись бензоила), так и другие добавки, существенно улучшающие определенные итоговые свойства производимого продукта, но при этом также значительно влияющие на его оптические характеристики и приводящие к флуоресцентному свечению при УФ-облучении.
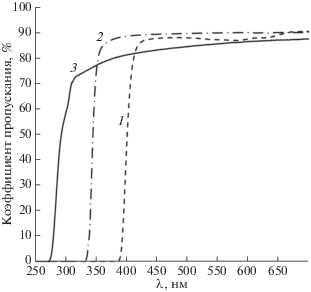
Нами разработана новая технология полимеризации оргстекла из жидкого промышленно выпускаемого мономера ММА без внесения в него каких-либо добавок, которая более подробно описана ниже. Полученное таким образом оргстекло существенно отличалось по своим оптическим характеристикам от непластифицированного оргстекла марки СО-120, что иллюстрируется графиком на рис. 8. Более низкие по сравнению с листовым оргстеклом значения коэффициента пропускания полученного образца в видимой области может быть связано с его ручной полировкой. Явно видно, что полученный образец характеризуется заметно большей областью прозрачности в УФ-диапазоне, что является преимуществом новой технологии полимеризации, исключающей каких-либо добавки, вводимые в состав полимера и приводящих к созданию молекул, генерирующих флуоресцентное излучение. Это расширяет спектральный диапазон использования биочипов, изготавливаемых по данной технологии, в сочетании с методом лазер-индуцируемой флуоресценции для детектирования анализируемых проб. Известно, что определенными химическими добавками можно существенно расширить диапазон прозрачности оргстекла [20], поэтому вполне логично, для конкретных видов биочипов, использующих флуоресцентные методы детектирования, подбирать пластики с определенными оптическими свойствами.
Рис. 8.
Спектральная зависимость коэффициента пропускания образцов толщиной 3 мм из следующих материалов: 1 – поликарбонат, 2 – оргстекло марки СО-120, 3 – полученное нами оргстекло.
Для отработки третьего варианта отливки тестовых образцов базовых пластин с разделением полимерной отливки от штампа без их охлаждения (т.е. при температуре полимеризации) была изготовлена специальная литьевая форма (ее дном являлась деталь с зафиксированным штампом (рис. 1), в которую заливался промышленно выпускаемый мономер ММА, предварительно облученный электронами, ускоренными до энергии Е ≈ 25 МэВ, стимулирующая доза составляла примерно D ≈ 50 кГр ≈ 50 кДж/кг. Литьевая форма прикрывалась крышкой с резиновым уплотнителем, устанавливалась в фиксатор струбцинного типа и герметизировалась, путем прижатия винтом. Затем вся эта сборка устанавливалась в тепловой шкаф и выдерживалась ~15 ч при температуре Т ≈ 85°С, что приводило к полимеризации ММА. Конструкция литьевой формы позволяла разделять ее непосредственно в работающем тепловом шкафу (т.е. при Т ≈ 85°С) путем подачи сжатого газа через штуцер (рис. 1) на две детали, позиционируемые между собой четырьмя штифтами: металлический цилиндр с образцом и дно с фиксированным штампом. Качество рельефа отливки хорошо видно на рис. 7 и характеризуется чистым дном канала и вертикальностью боковых стенок, шероховатость которых ~1 мкм.
Вопросы структурного строения, получаемого таким способом оргстекла и выявление его отличий от видов оргстекла, получаемых посредством добавления в исходный форполимер различных инициаторов полимеризации, являются предметом дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Описан способ изготовления из титана цельнометаллического штампа (вкладыша литьевой формы или пресс-формы) с микронными размерами элементов рельефа. Последовательность операций этого способа существенно отличается от широко известной LIGA-технологии. В предлагаемом способе применяется следующая последовательность операций для формирования рельефа: формирование методом контактной фотолитографии на рабочей поверхности заготовки штампа защитной (резистивной или металлической) маски и создание рельефа штампа путем плазмохимического травления через резистивную маску. Такой подход исключает многие технические проблемы, присущие LIGA-технологии.
С помощью изготовленного штампа можно формовать различные изделия из разного вида пластмасс в частности микрофлюидные биочипы. Описаны и опробованы три способа формовки базовых пластин биочипов с использованием данного штампа. Показано, что при высокотемпературной формовке пластмассовых изделий, в частности микрофлюидных биочипов, и их последующем охлаждении вместе с металлическим штампом неизбежно возникают напряжения на внешних границах рельефа полимерной реплики и в случае с жесткими полимерами (такими как оргстекло и поликарбонат) эти напряжения приводят к необратимым изменениям полимерного рельефа (к сколам). Продемонстрировано, что в случае формовки из резиноподобных полимеров и в случае отделения полимерной отливки от штампа без их охлаждения (т.е. при температуре полимеризации), можно получать качественные недеформированные полимерные реплики.
Показано, что новый метод отливки микрофлюидных биочипов в металлических формах, путем полимеризации оргстекла из предварительно облученного электронами форполимера ММА имеет преимущество, выражающееся в существенном расширении спектрального диапазона прозрачности получаемого оргстекла, по сравнению с известными промышленными способами отливки, где для обеспечения процесса полимеризации (как например, непластифицированного оргстекла марки СО-120) вводятся соответствующие каталитические добавки (агенты). Это преимущество, в свою очередь, позволяет сочетать в более широком спектральном диапазоне изготавливаемые по данной технологии биочипы с методом лазер-индуцируемой флуоресценции детектирования анализируемых проб.
Список литературы
Евстрапов А.А. // Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеева). 2011. Т. LV. № 2. С. 99.
Евстрапов А.А., Буляница А.Л. Нанотехнологии в биологии и медицине // Микрофлюидика: Kурс лекций Красноярск. БИК СФУ. Красноярск: СФУ, 2015. 133 с.
Nanofluidics. Nanoscience and Nanotechnology / Eds. Edel J.B., de Mello A.J. Cambridge: Thomas Graham House, 2009. 198 p.
Родченкова В., Шахнович И. // Аналитика. 2007. Т. 34. № 3. С. 60.
Зимина Т.М. // Нано и микросистемная техника. 2007. № 8. С. 27.
Зимина Т.М. // Биотехносфера. 2009. № 1. С. 11.
Lee L. James // BioMEMS and Biomedical Nanotechnology. Boston, MA, Springer, 2006. V. I: Biological and Biomedical Nanotechnology. P. 51. https://doi.org/10.1007/978-0-387-25842-3_3
Squires T., Quake S. // Revs. Mod. Phys. 2005. № 77. P. 977.
Madou M.J. Fundamentals of Microfabrication. 2nd ed. Boca Raton: CRC Press, 2002. 723 p.
Lab-on-a-Chip Technology. V. 1: Fabrication and Microfluidics. / Eds. Herold K.E., Rasooly A. Norwich: Caister Aca Demic Press, 2009. 410 p.
Santos H.J.D.L. Principles and Applications of NanoMEMS Physics. Dordrecht: Springer, 2005. 254 p.
Fiorini G.S., Chiu D.T. // Biotechniques. 2005. V. 38. № 3. P. 429.
Кухтевич И.В., Букатин А.С., Мухин И.С., Евстрапов А.А. // Научно-технический вестник Санкт-Петербургского государственного университета информационных технологий. Механики и оптики. 2012. № 1(77). P. 111.
Гольденберг Б.Г., Горячковская Т.Н., Елисеев B.C и др. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2008. № 8. С. 61.
Пельтек С.Е., Горячковская Т.Н., Попик В.М. и др. // Российские нанотехнологии. 2008. Т. 3. № 9/10. С. 136.
Se Hyun Ahn, L. Jay Guo // Advanced Materials. 2008. T. 20. P. 2044.
Tolfree D.V.L. // Rep. Prog. Phys. 1998. V. 61. P. 313.
Ehrfeld W., Lehr H. // Radiat. Phys. Chem. 1995. V. 45. № 3. P. 349.
Генцелев А.Н., Дульцев Ф.Н., Кондратьев В.И. и др. // Автометрия. 2018. № 2. С. 20.
Зверев В.А., Кривопустова Е.В., Точилина Т.В. Оптические материалы. Ч. 2. Учебное пособие для конструкторов оптических систем и приборов. СПб.: СПб НИУ ИТМО, 2013. 248 с.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования



