Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 4, стр. 24-34
Подготовка поверхности нанопроволочных кремниевых полевых транзисторов как этап создания биосенсора: обзор
А. М. Никонов a, О. В. Наумова b, В. М. Генералов a, *, А. С. Сафатов a, **, Б. И. Фомин b
a Государственный научный центр вирусологии и биотехнологии “Вектор”
Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
630559
Новосибирская область, р. п., Кольцово, Россия
b Институт физики полупроводников им. А.В. Ржанова СО РАН
630090 Новосибирск, Россия
* E-mail: general@vector.nsc.ru
** E-mail: safatov@vector.nsc.ru
Поступила в редакцию 14.08.2019
После доработки 25.09.2019
Принята к публикации 25.09.2019
Аннотация
Рассмотрены вопросы индикации целевых биомолекул-мишеней с помощью биосенсоров на базе нанопроволочных кремниевых полевых транзисторов. Приведены этапы пробоподготовки поверхности нанопроволок (сенсорных элементов) для эффективной высокочувствительной и селективной индикации различных аналитов. Рассмотрены способы очистки и активации поверхности кремниевых нанопроволок. Описаны “жидкостный” и “сухой” методы очистки, стратегии модификации поверхности сенсорных элементов. Особое внимание уделено модификации путем связывания с производными силана (силанизации) и прикрепления линкеров. Описаны причины нежелательного эффекта экранирования поверхности нанопроволок при индикации аналита в растворах. Обозначены основные требования и стратегии на различных этапах подготовки поверхности сенсоров для улучшения их параметров.
ВВЕДЕНИЕ
Биосенсоры на основе нанопроволочных полевых транзисторов являются универсальными устройствами [1–4] для индикации белков [5–11], ДНК [12–15], вирусов [16, 17] и других объектов. Широко распространены биосенсоры на основе полевых транзисторов с нанопроволоками [2, 18–21], покрытыми диоксидом кремния (SiO2). Принцип действия биосенсоров основан на изменении потенциала на поверхности нанопроволочного сенсорного элемента в ходе реакции с аналитом. Как следствие, изменяются плотность свободных носителей заряда в нанопроволоке и ее проводимость [22, 23]. Таким образом, для индикации целевых биомолекул-мишеней требуется создание на поверхности нанопроволок аффинного монослоя (или слоя рецепторов, зондов), который селективно взаимодействует с мишенью непосредственно или с помощью бифункционального линкера (кросс-линкера). Поскольку селективный слой не всегда может быть непосредственно иммобилизован на поверхности сенсора, основной стратегией его иммобилизации является введение дополнительного, пограничного (между твердотельной поверхностью сенсора и зондами) слоя, который, в идеале, образует ковалентные связи как с поверхностью сенсорного элемента, так и зондами. Данный этап подготовки поверхности назван ее модификацией.
Целью обзора является обобщение средств, методов, последовательности этапов пробоподготовки поверхности кремниевых нанопроволочных сенсоров для эффективной высокочувствительной и селективной индикации различных аналитов. Основное внимание уделено стадиям очистки и активации, а также разным методам модификации поверхности сенсорных элементов.
ОЧИСТКА И АКТИВАЦИЯ ПОВЕРХНОСТИ
После изготовления нанопроволочного кремниевого полевого транзистора поверхность нанопроволоки тщательно очищают и покрывают слоем специально, например термически, выращенного SiO2 или слоем естественного оксида кремния SiOx [24, 25]. Окисленная поверхность кремния содержит как минимум группы трех типов: силанольные, силандиольные и силоксановые (рис. 1, 2) [26, 27]. Соотношение между их концентрациями определяется режимом формирования оксида (температурой, содержанием паров воды). Из всех групп химически наиболее активными являются силанольные, с полярными (обладающими дипольным моментом) гидроксильными группами –ОН. Они делятся на изолированные (сингулярные) силанолы и силанолы, связанные водородной связью. Последние, в свою очередь, делятся на силанолы, образующие водородную связь с соседней силанольной группой (парные или вицинальные силанольные группы), и силанолы, связанные с посторонней молекулой (например, с молекулой воды). Образование водородных связей понижает электронную плотность на атоме кислорода силанольной группы, поэтому такие группы менее реакционноспособны, чем изолированные.
Рис. 1.
Основные типы групп на поверхности SiOx: 1 – силандиольные; 2 – силанольные; 3 – силоксановые [26].
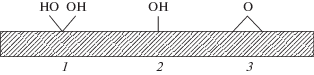
Рис. 2.
Основные типы силанольных групп на поверхности SiO2: А – изолированные; Б –связанные водородными связями: внутримолекулярными (Б1) и межмолекулярными (Б2) [26].
В случае нагревания до 200°С вся физически сорбированная вода удаляется с поверхности нанопроволоки, и она становится гидроксилированной. При этом количество силанольных групп максимально, а силоксановых – минимально. Если продолжить нагревание, силанольные группы переходят в силоксановые с отщеплением воды. Силоксановые группы могут также переходить в силанольные за счет гидролиза [27–29]. Время термообработки для дегидратации поверхности при 200°С оценивается в 10 ч [26]. Увеличение количества изолированных силанольных групп на поверхности оксида кремния также достигается в результате химических или плазменных обработок, например, раствором “пиранья” (H2O2/H2SO4) или кислородной плазмой [18, 30–32].
Во время хранения готовых нанопроволочных кремниевых полевых транзисторов на их поверхности адсорбируется влага и целый ряд микрозагрязнений, содержащих различные ионы (F–, Cl–, ${\text{NO}}_{3}^{--},$ ${\text{SO}}_{4}^{{2--}},$ Na+, ${\text{NH}}_{4}^{ + },$ K+, Mg 2+, среди которых доминируют ионы натрия) и органические соединения (преимущественно имеющие полярные группы –C=O и –S=O) [33]. Основной причиной адсорбции органических частиц считают формирование водородных связей между полярными группами этих частиц и полярными группами ‒OH на поверхности оксида. Полярными свойствами обладают также группы –COOH, –OH, ‒NH2, –CHO органических молекул, которые могут быть использованы на стадии модификации поверхности.
Таким образом, целью очистки и активации поверхности кремниевых нанопроволок перед их модификацией является удаление нежелательных загрязнений и формирование преимущественно полярных групп –ОН. В редких случаях для модификации поверхности сенсоров необходима терминированная водородом (с группами Si–H) поверхность кремния [25]. Основными требованиями к состоянию поверхности на данном этапе подготовки являются воспроизводимость, стабильность, большая плотность активных групп. Для очистки поверхности кремниевых нанопроволок применяют “жидкостный” и “сухой” методы [34, 35].
Жидкостный метод очистки
Традиционно поверхности кремниевых нанопроволок очищают “жидкостным” методом. При изготовлении кремниевых полупроводниковых приборов для обработки кремниевых пластин широкое распространение получил метод, разработанный компанией RCA [34, 36, 37]. Он включает в себя последовательное применение двух растворов, известных как RCA Standard Clean: SC-1 и SC-2 при T = 80–120°C. Раствор SC-1 первой стадии обработки состоит из смеси NH4OH, H2O2 и H2O. Он удаляет органические остатки, растворяет природный оксидный слой с очень низкой скоростью и образует новый слой оксида на поверхности кремния. Регенерация оксидного слоя является важным фактором удаления частиц и химических загрязнений. Перед применением SC‑1 иногда используют горячий раствор “пиранья” (обычно смесь трех объемных частей H2SO4 и одной объемной части 30%-ного раствора H2O2) для удаления органических загрязнений и ионов металлов. После обработки следует отмывка Si-пластин в деионизированной воде. Однако следует отметить, что эффективные для очистки пластин Si режимы обработок SC-1 и “пиранья” способны разрушать элементы кристалла с нанопроволочными кремниевыми транзисторами, содержащие открытые слои SiO2, металлические контактные площадки и нанопроволочные кремниевые элементы. Причина состоит в том, что обработка “пираньей” приводит к травлению металлов, например, Al, Ag, Ni, Ti [35, 38, 39], а перекисно-аммиачная обработка, основанная на окислении и последующем травлении оксида, может приводить к увеличению шероховатости поверхности кремния и оксида и даже к частичному разрушению наноразмерных сенсорных элементов. Это требует адаптации режимов обработок (температуры, длительности, концентрационного состава) для очистки от металлических и органических загрязнений поверхности кристаллов с нанопроволочным кремниевым полевым транзистором или использования других видов обработок. Раствор SC-2 состоит из смеси HCl, H2O2 и H2O. Этот раствор разработан для растворения и удаления с кремниевой поверхности щелочного остатка и любых следов металлов и их гидроксидов. Он не вступает в реакцию с Si или SiO2, но его использование требует защиты металлических площадок кристаллов с нанопроволочным кремниевым полевым транзистором.
Для удаления органических загрязнений с поверхности Si и SiO2 используют также растворы H2O2 : H2O, толуол, ацетон, этанол, обработку ультразвуком в деионизированной воде и другие способы [11, 32, 38, 40]. В работах [41, 42] для первоначальной очистки поверхности оксидной пленки толщиной 8.7 нм использовали промывку этанолом, затем ультразвуковую обработку в моющем 2%-ном растворе Hellmanex (фирмы Hellma, Германия) в течение 5 мин, вновь промывку деионизированной водой и, в заключение, – ультразвуковую обработку в течение 3 мин в деионизированной воде. Для окончательной очистки поверхности кремния часто применяют раствор плавиковой кислоты (HF). Он удаляет оксид с поверхности кремниевой нанопроволоки и вместе с ним молекулы веществ, адсорбированные из раствора или газовой фазы. Применительно к нанопроволочным кремниевым полевым транзисторам, в которых сенсорные элементы не только покрыты слоем оксида, но и размещены на слое SiO2 (например, в случае полевых транзисторов, изготовленных на структурах кремний-на-изоляторе), использование HF-обработки должно проводиться с учетом скорости травления этих слоев. Раствор HF : H2O = 1 : 50 используют в течение 40 с, а HF : CH3OH = 1 : 50 – в течение 30 с [11, 32, 38]. Калугин [43] предлагает удалять слой SiO2 в водном 2%-ном растворе HF, так как более высокая концентрация приводит к увеличению шероховатости поверхности. Время обработки выбирают в зависимости от толщины слоя SiO2, который следует удалить. Зависимость толщины удаляемого слоя SiO2 от времени обработки в водном 2%-ном растворе HF представлена в [43] и носит линейный характер в течение 8 мин.
Скорость травления оксида зависит от метода окисления, состава травящего раствора, его концентрации и температуры. Скорость травления термического оксида при комнатной температуре в 49%-ном растворе HF составляет ~1.7 нм/с [44]. В случае разбавленной в 10 раз 49%-ной плавиковой кислоты скорость травления такого оксида оценивается в ~0.4 нм/с [39]. Скорость травления естественного оксида в водном 2%-ном растворе HF [43] можно оценить в ~0.095 нм/с. После полного удаления оксида поверхность кремния начинает покрываться слоем естественного оксида SiOх приблизительно через 100 мин пребывания в обычных атмосферных условиях, который в течение нескольких часов достигает толщины 1.5 нм [37].
Для активации поверхности SiO2 в [30, 31, 41, 45] исследовали шесть разных растворов: CH3OH : HCl = 1 : 1; CH3OH : HCl = 1 : 1 + конц. H2SO4; раствор “пиранья” (30% H2O2 : конц. H2SO4 = = 1 : 3); конц. H2SO4; K2Cr2O7 + H2SO4 и 1 М NaOH. Наилучшие результаты показал первый из них, который был наиболее эффективным с точки зрения открытия связей Si–O и образования групп Si–H и Si–OH. Изменение толщины первоначального термического оксида (8.7 нм) за 30 мин составило 0.4 нм.
Сухой метод очистки
Для метода “сухой” очистки применяют кислородную, водородную или аргоновую плазму [18, 32, 46–48]. В технологии обработки нанопроволочных кремниевых полевых транзисторов чаще всего применяют кислородную плазму как более эффективную, поскольку в ней процессы очистки и активации происходят одновременно [48]. Режимы обработок подбирают таким образом, чтобы избежать травления наноразмерных элементов транзисторов, чтобы глубина воздействия плазмы была незначительна и сохранились объемные свойства кремния. Для активации поверхности в кислородной плазме важны время экспозиции и приложенная мощность ионизации. Слишком маленькие мощность или время могут привести к неполному образованию гидроксильных групп –OH. Слишком высокие значения указанных параметров могут привести к образованию шероховатых и толстых слоев SiO2. Очистка поверхности в кислородной плазме имеет и свои недостатки. Кислородная плазма может повреждать до двух монослоев нижележащего оксида кремния [49] и тем самым ухудшать электрические характеристики нанопроволочных кремниевых полевых транзисторов.
МОДИФИКАЦИЯ ПОВЕРХНОСТИ
Существует несколько различных стратегий модификации поверхности нанопроволок, например, путем ковалентного и нековалентного связывания производных силана (силанизация), прикрепления линкеров, использование липидных мембран, а также гидросилилирование [20]. Выбор стратегии осуществляют с учетом целевого назначения биосенсора, решения конкретной задачи индикации целевого аналита: ДНК, белков, вирусов, бактерий, химического аналита. Задачу решают путем присоединения к сенсорному элементу функциональных зондов: олигонуклеотидов, аптамеров, антител, лигандов. Именно они обеспечивают селективное распознавание целевых частиц аналита в результате взаимодействия с сенсорным элементом. Таким образом, основная задача этапа модификации – создать слой с активными группами для закрепления функциональных зондов или прямого связывания аналита с поверхностью сенсоров.
Силанизация поверхности нанопроволоки
Наиболее распространенным методом связывания органических соединений с поверхностью кремниевого нанопрволочного сенсора является силанизация. Наличие изолированных полярных групп –OH на активированной поверхности сенсоров позволяет молекулам силанов с функциональными группами (–NH2, –COOH, –OH, –CHO и другими) формировать монослой с высокой химической и физической стабильностью [50]. Наиболее устойчивой из всех возможных комбинаций связей, приводящих к закреплению органических молекул на поверхности SiO2, считается образующаяся в результате силанизации цепочка связей –Si–O–силан и –Si–C–силан [26, 41, 51, 52]. Прочность граничного монослоя и следующего за ним слоя зондов чрезвычайно важна в технологии биосенсоров, так как в дальнейшем они подвергаются долговременному воздействию со стороны буферного раствора. Любое изменение или деградация слоев могут существенно повлиять на свойства биосенсора (например, создавать ложные сигналы обнаружения, пропуска целевых биомолекул). Эта проблема особенно важна при измерении белков с низкой концентрацией [49].
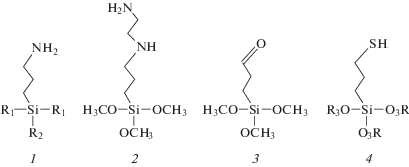
Для связывания биомолекул со слоем SiO2 или SiOx на поверхности сенсоров обычно применяют короткоцепочечные силаны, например: (3-аминопропил) триэтоксисилан ((3-aminopropyl) triethoxysilane, APTES (синонимы: APRTS; APTS [52–54]); (3-аминопропил) триметоксисилан (APTMS) [42]; (3-аминопропил) диметилэтоксисилан (APDMES); 3-альдегид пропилтриметоксисилан (3-aldehyde propyltrimethoxysilane (APMS), синонимы: aldehyde-terminated trimethoxysilane (ALDTMS); 3-(trimethoxysilyl)propyl aldehyde (TMSPA)) и другие (рис. 3). Благодаря низкой стоимости одним из самым популярных из них является APTES, который имеет три этоксигруппы (–OCH2CH3) на одном конце и аминогруппы (–NH2) на другом [55–58]. Для связывания биомолекул с поверхностью сенсоров применяют также хлорсиланы (SiHnCl4 –n) или алкосиланы ((RО)4Si), где R – трифторметил-, меркапто-, амино-, диметиламино-, изоцианат-, карбамат- и другие функциональные группы [59]. Особенно широко используют в биосенсорах взаимодействие аминогрупп алкосиланов с альдегидом, карбоновой кислотой и эпоксигруппами, которые присутствуют на белках и других биомолекулах [2].
Рис. 3.
Силаны, используемые при модификации кремниевых нанопроволочных сенсоров [20]: 1 – (3-аминопропил) триэтоксисилан (APTES) (R1 = R2 = OCH2CH3), диметилэтоксисилан (APDMES) (R1 = CH3, R2 = OCH2CH3); 2 – N-(2-аминоэтил)-3-аминопропилтриметоксисилан (AEAPS); 3 – 3-альдегид пропилтриметоксисилан (APMS); 4 – меркапто пропилтриметоксисилан (MPTMS) (R3 = CH3).
Для нанесения силана на поверхность сенсорных элементов применяют методы осаждения из органического растворителя [15, 60], водного осаждения [61] и парофазного осаждения [56, 62]. Начальная стадия гидролиза может происходить либо в растворе, либо на поверхности сенсора, в зависимости от количества воды, присутствующей в системе [52, 63]. Переизбыток воды приводит к чрезмерной полимеризации в фазе растворителя, а дефицит воды приводит к образованию неполного монослоя силана [52, 64]. Чрезмерная полимеризация снижает однородность монослоя. В частности, аминогруппа APTES может адсорбироваться водородной связью и присоединяться к силановым группам на поверхности оксида [54]. Схематически идеальный и фактический слои APTES изображены на рис. 4.
Рис. 4.
Схематическое изображение идеального (а) и фактического (б) слоя APTES [54]: 1 – поликонденсат; 2 – физическая адсорбция; 3 – молекулярная реверсия.
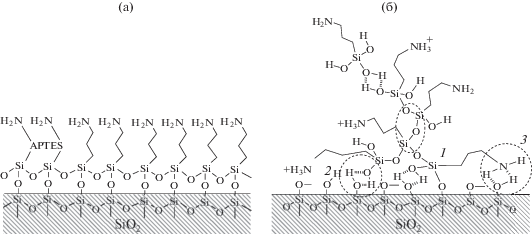
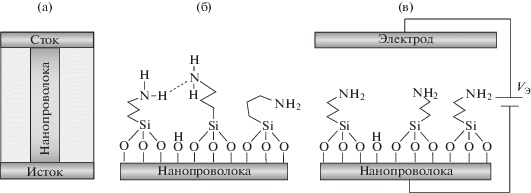
В [56] для осажденного из раствора толуола APTES наблюдались агломераты высотой более 300 нм, несмотря на то, что теоретическая длина одной молекулы APTES составляет 0.61 нм [65]. По данным [41, 56, 60, 62, 65] при жидкофазной силанизации толщина слоя APTES может варьироваться от 0.6 до 140 нм. Минимальная толщина ~0.6 нм, эквивалентная монослою APTES, получена, например, в [66] при осаждении из раствора (0.4% APTES в безводном толуоле в течение 1 ч при комнатной температуре с последующим инкубированием в этаноле и в воде в течение 24 ч) или в [67] адсорбцией в паровой фазе. По данным других работ толщина слоя APTES, нанесенного из паровой фазы на поверхность SiO2 [62] или поверхность нанопроволочных сенсоров [11], типично составляет 0.9–1.2 нм. Поскольку APTES может образовывать многослойные пленки, которые способствуют уменьшению чувствительности биосенсора, его часто заменяют аналогом – APDMES (рис. 3). APDMES одновалентный и не может полимеризоваться в обширные сети. Поэтому он формирует более тонкие пленки с большей механической прочностью, чем APTES [58, 68]. В [56] показано, что использование раствора APDMES в толуоле или водного раствора APTES позволяет получать однородные и воспроизводимые слои силана высокого качества с характеристиками (толщина, гидрофильность и шероховатость поверхности), сопоставимыми в случае слоев, полученных парофазными методами. Отметим, что для последующей высококачественной иммобилизации функционалных зондов и, соответственно, высокочувствительного, высокоспецифичного детектирования аналита требуются однородность и низкая шероховатость пленок силана. В [69, 70] с целью “выравнивания” и получения однородного слоя APTES на поверхности кремниевых нанопроволочных сенсоров использовали воздействие электрического поля на поляризованные под воздействием ультрафиолетового излучения молекулы APTES (рис. 5). Результаты показали эффективность данного подхода – увеличение чувствительности и надежности ДНК-сенсоров [70].
Рис. 5.
Иллюстрация выравнивания APTES электрическим полем: а – схематическое изображение нанопроволочного кремниевого полевого транзистора (ширина, длина и толщина кремниевой нанопроволоки составляет 200 нм, 3 мм и 40 нм, соответственно, проволока покрыта слоем термического оксида толщиной 10 нм); б, в – схематические изображения возможных молекулярных структур APTES, соответственно, до и после процесса выравнивания [70].
Недостатком силанов c концевыми аминогруппами считается то, что они могут взаимодействовать напрямую с биочастицами за счет физической адсорбции, электростатического взаимодействия, формирования водородных связей. Для ковалентной иммобилизации биомолекул требуются либо специальные линкеры, либо силаны с другими активными группами. Чаще всего используют APMS (синоним TMSPA) 3-альдегид пропилтриметоксисилана [5, 16, 18]. Методика модификации поверхности сенсоров с использованием TMSPA (APMS) подробно приведена в [18] и состоит: в очистке поверхности чипа в течение 60 с в кислородной плазме (мощность 30 Вт, 50 н.м3 11 О2) и последующем незамедлительном использовании чипа; приготовлении раствора силан : этанол (1% TMSPA в смеси этанол : вода (95 : 5%)) и его выдерживании в течение 20 мин; фильтрации раствора силан : этанол шприц-фильтром с диаметром пор 0.2 мкм, выдерживании чипа в указанном растворе в течение 30 мин; промывке чипа в потоке этанола в течение 50 с, сушке чипа в потоке горячего азота при 110°С в течение 10 мин.
Чип с силанизированной поверхностью также рекомендуется использовать как можно скорее после его приготовления. Хранить его рекомендуется в сухой атмосфере азота. APMS (TMSPA)-силан позволяет получить толщину слоя ~0.7 нм [5]. Однако его молекулы APMS, как и APTES, способны эффективно полимеризоваться, т.е. формировать неоднородные многослойные структуры. Примеры применения некоторых силанов для поверхностной силанизации кремниевых нанопроволочных сенсоров вместе с целевыми биоаналитами приведены в табл. 1.
Таблица 1.
Примеры подготовки поверхности Si нанопроволочных биосенсоров, покрытых слоями SiOx, и целевые биоаналиты
| № | Очистка/активация | Модифи- кация | Функционали- зация (зонды) | Пассива- ция | Аналитический предел обнаружения | Ссылки |
|---|---|---|---|---|---|---|
| 1 | Н/о | APTES | Анти-IL-8, анти-TNF-α |
Амино-PEG | IL-8, TNF-α (маркеры плоскоклеточного рака полости рта), 1 фг/мл | [71] |
| 2 | H2O2 : H2O 1 : 4 HF : CH3OH 1 : 50, 30 с Озонирование |
APTES | Анти-HBsAg, анти-AFP |
Н/о | HBsAg (маркер гепатита В), 10–14 AFP (альфа-фетопротеин (маркер рака печени), 10–15 |
[11] |
| 3 | H2O2 : H2O 1 : 4 HF : CH3OH 1 : 50, 30 с Озонирование |
APTES + + DTTSP | Олиго-ДНК | Н/о | миРНК (маркер рака молочной железы), 3.3 × 10–15 M; олиго-ДНК (маркер гепатита С), 10–17 M | [72] |
| 4 | Этанол, 2 мин; 2% HCl, 2 мин; “пиранья”, 2 мин; 20% H2SO4, 80°C, 10 мин или 2% Hellmanex (Hellma, Germany), 20 мин, кислородная плазма | APTES | Нет | Н/о | Модифицированный биотин или ДНК | [73] |
| 5 | Кислородная плазма | APTES | Карбоксилмодифицированные ss-ДНК |
Н/о | Комплементарные ss-ДНК, 10–15 М |
[74] |
| 6 | Н/о | APTES | Карбоксилмодифицированные ss-ДНК | Н/о | миРНК21, миРНК205
(онкомаркеры тканей), 10–18 М (600 копий) |
[75] |
| 7 | 2% HF, 3 с | APDMES | ss-ДНК | Н/о | Комплементарные ДНК, 10–11 М | [76] |
| 8 | Пары воды–плазма | MPTMS | ss-ДНК | Н/о | ДНК, 25 × 10–12, одно несоответствие | [77] |
| 9 | HF (1%), 50 с + NH4F, 60 с | APMS | Моноклональные антитела | Н/о | PSA, 2 × 10–15 | [5] |
| 10 | Н/о | APMS | Антитела | EA | Аденовирус группы III, 8 × 10–17 M; вирус гриппа А, единичный | [16] |
| 11 | Н/о | APTES + GA | Fab | BSA или EA | AFP (маркер рака печени), 1 фг/мл |
[78] |
| 12 | Н/о | APTES + GA | Антитела | 0.1% BSA | PSA, 500 фг/мл; CEA, 50 фг/мл (маркеры рака печени) | [79] |
| 13 | Ацетон + толуол | APTES + GA | Aнти-PSA | BSA | PSA, 10–16 M | [80] |
| 14 | NH4F(40%) : HF(49%) 10 : 1, 5 с | Гидрокси-лирование* | Биотин | Н/о | Авидин/cтрептавидин, 10–14 M | [81] |
| 15 | H2SO4/H2O2, кислородная плазма, озонирование |
CDI | PGO | Глицин | Короткие РНК (маркер рака легкого), 10–15 | [82] |
Примечание: н/о – не описаны, IL-8 – интерлейкин-8, TNF-α – фактор некроза опухоли α, AFP – альфа-фетопротеин, PEG – полиэтиленгликоль, DTSSP – линкер (3,3-дитиобис (сульфосукцинимидилпропионат)), ss – одноцепочные, GA – глутаровый альдегид, Fab – функциональный фрагмент антигенов, BSA – бычий сывороточный альбумин, EA – этаноламин, CDI – карбонилдиимидазол, PGO – синтезированные нейтральные олиго-зонды, PSA – простатический специфический антиген; * слой оксида удален, поверхность с концевыми группами S–H.
Модификации поверхности нанопроволоки линкерами
В технологии модификации поверхности сенсоров линкеры используют с целью формирования прочной ковалентной сшивки (связи) между силанами и функциональными зондами или самим аналитом. Например, для ковалентной иммобилизации олиго-ДНК зондов к APTES-силанизированной поверхности сенсоров в [72] использовали линкер DTTSP (3,3'-dithiobis (sulfosuccinimidyl propionate)). Наиболее популярным линкером для связывания слоя APTES и белков является глутаровый альдегид O=CH–(CH2)3–CH=O (табл. 1). Одна из групп (O=CH–) глутарового альдегида взаимодействует с аминогруппой APTES, другая может взаимодействовать, например, с аминогруппой на поверхности белка [57]. Теоретические расчеты предсказывают толщину слоя глутарового альдегида 1.4 нм. Экспериментально полученные толщины этого слоя на APTES-модифицированной поверхности составляют 1.7, 0.7 и 1.3 нм по данным [83–85] соответственно.
На рис. 6 схематично показаны этапы подготовки поверхности сенсоров с использованием модификации APTES + глутаровый альдегид для индикации вирусов гриппа. После APTES-модификации поверхность чипа нанопроволочного кремниевого полевого транзистора обрабатывали 5% глутаровым альдегидом (pH 8) при комнатной температуре в течение 1 ч с заключительной промывкой фосфатным буфером (10 мМ, рН 8) в течение 5 мин [17]. Далее поверхность кремниевой проволоки с альдегидными окончаниями была функционализирована антителами к вирусу гриппа H3N2. Непрореагировавшие альдегидные окончания, как видно из рис. 6 и табл. 1, после иммобилизации зондов могут быть блокированы этаноламином или молекулами бычьего сывороточного альбумина для предотвращения неспецифического связывания.
Рис. 6.
Подготовка поверхности нанопроволочных сенсоров для детектирования вируса гриппа [17]: 1 – APTES-модификация; 2 – обработка глутаровым альдегидом; 3 – функционализация антителами Н3N2; 4 – пассивация этаноламином; 5 – индикация вируса гриппа H3N2.

Таким образом, основными требованиями, предъявляемыми к граничным слоям, создаваемым на этапе модификации поверхности сенсоров, являются: возможность иммобилизации аналита или функциональных зондов (для селективного, высокоспецифичного взаимодействия с аналитом); прочность связи с поверхностью сенсора; однородность и низкая шероховатость поверхности; воспроизводимость. Еще одно требование – минимизация толщины модифицирующих слоев. Оно определяется эффектом экранирования аналита в тестируемых растворах.
ЭКРАНИРУЮЩИЙ ЭФФЕКТ
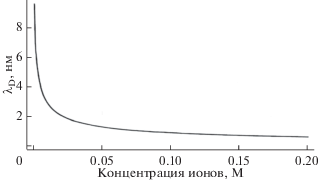
Анализируемые растворы обладают некоторой ионной силой I:
где Сi – молярные концентрации отдельных ионов [моль/л], Zi – заряды ионов. В результате заряженный аналит (в том числе закрепленный на сенсорном элементе) будет окружен подвижными противоионами раствора, которые экранируют заряд аналита в пределах длины Дебая λD [69, 86]. Поэтому чувствительность сенсора будет определяться концентрацией ионов в растворе и расстоянием от аналита до сенсорного элемента L. При значениях L больше, чем λD, биосенсор не способен обнаружить аналит, т.е. длина Дебая является физическим ограничением для детектирования аналита в растворе.Зависимость длины Дебая от концентрации ионов в растворах NaCl [87], KCl [88] и фосфатно-солевом буферном растворе [53, 81] приведены на рис. 7 и 8. Из приведенных зависимостей понятно, что особенно негативно эффекты экранирования заряда будут проявляться в реальных (100–150 мМ) биологических средах, например, крови (λD < 1 нм). Поэтому в большинстве методов индикации используют растворы с низкой ионной силой – от ~1 нМ до 10 мМ [19]. Поскольку расстояние L от сенсорного элемента до аналита определяется суммарной толщиной оксидного слоя на поверхности сенсора, модифицирующего слоя и длиной зондов, уменьшение толщины этих слоев является основной стратегией для снятия дебаевского ограничения (выполнения условия L < λD) и увеличения чувствительности сенсоров в растворах. Так, в [76] показано, что полное удаление оксида и нанесение непосредственно на поверхность кремниевой нанопроволоки с водородными концевыми группами алкильного монослоя с концевыми аминогруппами приводит к увеличению чувствительности и динамического диапазона ДНК-сенсоров на два порядка.
Использование карбонилдиимидазола вместо силанов позволяет уменьшить толщину модифицирующего слоя на поверхности сенсоров до 0.31 нм (длина молекул карбонилдиимидазола) [83]. Уменьшения длины зондов достигают при использовании аптомеров – функциональных фрагментов ДНК или РНК [7, 53] или при использовании функциональных фрагментов антигенов [78]. Однако в некоторых случаях физиологическая концентрации соли абсолютно необходима, например, для сохранения биологической активности некоторых белков или для гибридизации ДНК [89]. В этом случае экранирующий эффект может быть снят, например, при использовании импедансной спектроскопии [78].
ЗАКЛЮЧЕНИЕ
Анализ литературных данных (в частности, табл. 1, где показаны способы подготовки поверхности кремниевых нанопроволочных биосенсоров) показывает, что предлагаемые подходы позволяют обеспечить высокую (на фемто- и субфемтомольном уровне) чувствительность сенсоров при детектировании аналитов разной природы. В настоящее время нет универсального протокола подготовки поверхности сенсоров даже для детектирования одних и тех же биочастиц и даже на таких общих этапах, как очистка–активация и модификация поверхности. Однако в результате исследований установлены различные особенности/требования для разных этапов подготовки поверхности биосенсоров. Достаточно четко сформулированы основные подходы для достижения ими эффективной высокочувствительной и селективной индикации различных аналитов.
Список литературы
Bergveld P. // IEEE Trans. Biomed. Eng. 1972. V. 19. P. 342. https://doi.org/10.1109/TBME.1972.324137
Mu L., Chang Y., Sawtelle S.D. et al. // IEEE Access. 2015. V. 3. P. 287. https://doi.org/10.1109/ACCESS.2015.2422842
Gao N., Zhou W., Jiang X. et al. // Nano Lett. 2015. V. 15. P. 2143. https://doi.org/10.1021/acs.nanolett.5b00133
Pachauri V., Ingebrandt S. // Essays Biochem. 2016. V. 60. P. 81. https://doi.org/10.1042/EBC20150009
Zheng G.F., Patolsky F., Cui Y. et al. // Nature Biotechnol. 2005. V. 23. P. 1294. https://doi.org/10.1038/nbt1138
Kim D., Hee G.L., Jung H., Seong H.K. // Bull. Korean Chem. Soc. 2007. V. 28. P. 783. https://doi.org/10.5012/bkcs.2007.28.5.783
Maehashi K., Katsura T., Kerman K. et al. // Anal. Chem. 2007. V. 79. P. 782. https://doi.org/10.1021/ac060830g
Lee M.H., Lee D.H., Jung S.W. et al. // Nanomed. Nanotechnol. Biol. Med. 2010. V. 6. P. 78. https://doi.org/10.1016/j.nano.2009.04.004
Tian R., Regonda S., Gao J. et al. // Lab Chip. 2011. V. 11. P. 1952. https://doi.org/10.1039/c0lc00605j
Zhang G.J., Chai K.T., Luo H.Z. et al. // Biosens. Bioelectron. 2012. V. 35. P. 218. https://doi.org/10.1016/j.bios.2012.02.052
Ivanov Y.D., PIeshakova T.O., Kozlov A.F. et al. // Lab Chip. 2012. V. 12. P. 5104. https://doi.org/10.1039/c2lc40555e
Hahm J.-I., Lieber C.M. // Nano Lett. 2004. V. 4. P. 51. https://doi.org/10.1021/nl034853b
Gao Z., Agarwal A., Trigg A.D. et al. // Anal. Chem. 2007. V. 79. P. 3291. https://doi.org/10.1021/ac061808q
Lu N., Gao A., Dai P. et al. // Methods. 2013. V. 63. P. 212. https://doi.org/10.1016/j.ymeth.2013.07.012
Japaridze A., Vobornik D., Lipiec E. et al. // Macromolecules. 2016. V. 49. P. 643. https://doi.org/10.1021/acs.macromol.5b01827
Patolsky F., Zheng G., Hayden O., Lieber C.M. // Proc. Natl. Acad. Sci. USA. 2004. V. 101. P. 14017. https://doi.org/10.1073/pnas.0406159101
Shen F., Tan M., Wang Z. et al. // Environ. Sci. Technol. 2011. V. 45. P. 7473. https://doi.org/10.1021/es1043547
Patolsky F., Zheng G., Lieber C.M. // Nature Protocols. 2006. V. 1. P. 1711. https://doi.org/10.1038/nprot.2006.227
Chen K.-I., Li B.-R., Chen Y.-T. // Nano Today. 2011. V. 6. P. 131. https://doi.org/10.1016/j.nantod.2011.02.001
De Smet L.C.P.M., Ullien D., Mescher M., Sudholter E. // Nanowires-Implementations and Applications / Ed. Hashim A. Rijeka: InTech, 2011. P. 267. https://doi.org/10.5772/23861
Namdari P., Daraee H., Eatemadi A. // Nanoscale Res. Lett. 2016. V. 11. P. 406. https://doi.org/10.1186/s11671-016-1618-z
Bergveld P. // IEEE Trans. Biomed. Eng. 1970. V. BME-17. P. 70. https://doi.org/10.1109/TBME.1970.4502688
Molaie M. // Nanomed. J. 2016. V. 3. P. 69. https://doi.org/10.7508/NMJ.2016.02.001
Zhang X.G. Electrochemistry of Silicon and Its Oxide. N.Y.: Kluwer Acad.–Plenum Publ., 2001. 510 p.
Pike A.R., Lie L.H., Eagling R.A. et al. // Angew. Chem. Int. Ed. 2002. V. 41. P. 615. https://doi.org/10.1002/1521-3773(20020215)41:4<615: :AID-ANIE615>3.0.CO;2-Y
Зайцев В.Н. Комплексообразующие кремнеземы. Синтез, строение привитого слоя и химия поверхности. Харьков: Фолио, 1997. 231 с.
Zhuravlev L.T. // Colloids and Surfaces. A. 2000. V. 173. P. 1. https://doi.org/10.1016/S0927-7757(00)00556-2
Стыскин Е.Л., Ициксон Л.Б., Брауде Е.В. Практическая высокоэффективная жидкостная хроматография. М.: Химия, 1986. 284 с.
Тертых В.А., Белякова Л.А. Химические реакции с участием поверхности кремнезема. Киев: Наук. думка, 1991. 246 с.
Puppo F., Doucey M.-A., Delaloye J.-F. et al. // IEEE Sensors J. 2016. V. 16. P. 3374. https://doi.org/10.1109/JSEN.2015.2433836
Szunerits S., Boukherroub R. // Langmuir. 2006. V. 22. P. 1660. https://doi.org/10.1021/la052773c
Иванов Ю.Д., Плешакова Т.О., Козлов А.Ф. и др. // Автометрия. 2013. Т. 49. № 5. С. 119.
Lin I-K., Bai H., Wu B.-J. // IEEE Trans. Dev. 2009. V. 22. № 2. P. 321.
Kern W. // J. Electrochem. Soc. 1990. V. 137. P. 1887. https://doi.org/10.1149/1.2086825
Суворов А.Л., Богданович Б.Ю., Залужный А.Г. и др. Технологии структур КНИ. М.: МИЭТ, 2004. 407 с.
Kern W. RCA Critical Cleaning Process. MicroTech Systems Inc, 2007. 7 p.
Тимошенков С.П., Калугин В.В., Прокопьев Е.П. // Микросистемная техника. 2003. № 1. С. 13.
Naumova O.V., Fomin B.I., Malyarenko N.F., Popov V.P. // J. Nano Res. 2012. V. 18–19. P. 139. doi 10.4028/www.scientific.net/JNanoR.18-19.139
Williams K.R., Gupta K., Wasilik M. // J. MEMS. 2003. V. 12. P. 761. https://doi.org/10.1109/JMEMS.2003.820936
Meng X., Zhou A., Wang B. et al. // Nano Micro Lett. 2016. V. 8. P. 388. https://doi.org/10.1007/s40820-016-0100-x
Han Y., Mayer D., Offenhausser A., Ingebrandt S. // Thin Solid Films. 2006. V. 510. P. 175. https://doi.org/10.1016/j.tsf.2005.11.048
Chauhan A.K., Aswal D.K., Koiry S.P. et al. // Appl. Phys. A. 2008. V. 90. P. 581. https://doi.org/10.1007/s00339-007-4336-7
Калугин В.В. Исследование и разработка процессов подготовки поверхности кремниевых пластин при изготовлении структур кремний на изоляторе: Дис. … канд. техн. наук: 05.27.06. М.: МИЭТ (ТУ), 2001. 187 с.
Ануфриев Л.П., Бордусов С.В., Гурский Л.И. и др. Технология интегральной электроники. Минск: Интегралполиграф, 2009. 379 с.
Chen M.C., Chen H.Y., Lin C.Y. et al. // Sensors. 2012. V. 12. P. 3952. https://doi.org/10.3390/s120403952
Krumpolec R., Čech J., Jurmanová J. et al. // Surf. Coat. Technol. 2017. V. 309. P. 301. https://doi.org/10.1016/j.surfcoat.2016.11.036
Szymanski S.D. Using Argon Plasma to Remove Fluorine, Organic and Metal Oxide Contamination for Improved Wire Bonding Performance. Nordson MARCH, 2008. 8 p.
Steffen H., Schwarz J., Kersten H. et al. // Thin Solid Films. 1996. V. 283. P. 158. https://doi.org/10.1016/0040-6090(96)08535-5
Seitz O., Fernandes P.G., Tian R. et al. // J. Mater. Chem. 2011. V. 21. P. 4384. https://doi.org/10.1039/C1JM10132C
Воронков М.Г., Милешкевич В.П., Южелевский Ю.А. Силоксановая связь. Новосибирск: Наука, 1976. 413 с.
Aswal D.K., Lenfant S., Guerin D. et al. // Anal. Chim. Acta. 2006. V. 568. P. 84. https://doi.org/10.1016/j.aca.2005.10.027
Howarter J.A., Youngblood J.P. // Langmuir. 2006. V. 22. P. 11142. https://doi.org/10.1021/la061240g
Elnathan R., Kwiat M., Pevzner A. et al. // Nano Lett. 2012. V. 12. P. 5245. https://doi.org/10.1021/nl302434w
Recognition Receptors in Biosensors / Ed. Zourob M. N.Y.: Springer, 2010. 863 p.
DNA Microarrays for Biomedical Research: Methods and Protocols / Ed. Dufva M. N.Y.: Humana Press, 2009. 304 p.
Yadav A.R., Sriram R., Carter J.A., Miller B.L. // Mater. Sci. Eng. C. 2014. V. 35. P. 283. https://doi.org/10.1016/j.msec.2013.11.017
Saengdee P., Chaisriratanakul W., Bunjongpru W. et al. // Biosens. Bioelectron. 2015. V. 67. P. 134. https://doi.org/10.1016/j.bios.2014.07.057
Bhushan B., Kwak K.J., Gupta S., Lee S.C. // J. R. Soc. Interface. 2009. V. 6. P. 719. https://doi.org/10.1098/rsif.2008.0398
Okusa H., Kurihara K., Kunitake T. // Langmuir. 1994. V. 10. P. 3577. https://doi.org/10.1021/la00022a034
Moon J.H., Shin J.W., Kim S.Y., Park J.W. // Langmuir. 1996. V. 12. P. 4621. https://doi.org/10.1021/la9604339
Silane Coupling Agents / Ed. Plueddemann E.P. N.Y.–London: Plenum Press, 1991. 263 p.
Yamada K., Yoshii S., Kumagai S. et al. // Jpn. J. Appl. Phys. 2006. V. 45. P. 4259. https://doi.org/10.1143/JJAP.45.4259
Silberzan P., Léger L., Ausserré D., Benattar J.J. // Langmuir. 1991. V. 7. P. 1647. https://doi.org/10.1021/la00056a017
Krasnoslobodtsev A., Smirnov S. // Langmuir. 2002. V. 18. P. 3181. https://doi.org/10.1021/la015628h
Mark S.S., Bergkvist M., Bhatnagar P. et al. // Colloids and Surfaces. B. 2007. V. 57. P. 161. https://doi.org/10.1016/j.colsurfb.2007.01.015
Vandenberg E.T., Bertilsson L., Liedberg B. // J. Colloid Interface Sci. 1991. V. 147. P. 103. https://doi.org/10.1016/0021-9797(91)90139-Y
Kurth D.G., Bein T. // Langmuir. 1993. V. 9. P. 2965. https://doi.org/10.1021/la00035a039
De Stefano L., Oliviero G., Amato J. et al. // J. R. Soc. Interface. 2013. V. 10. P. 1. https://doi.org/10.1098/rsif.2013.0160
Lin M.C., Chu C.J., Tsai L.C. et al. // Nano Lett. 2007. V. 7. P. 3656. https://doi.org/10.1021/nl0719170
Chu C.J., Yeh C.S., Liao C.K. et al. // Nano Lett. 2013. V. 13. P. 2564. https://doi.org/10.1021/nl400645j
Zhang Y., Chen R., Xu L. et al. // Analyt. Sci. 2015. V. 31. P. 73. https://doi.org/10.2116/analsci.31.73
Ivanov Y.D., PIeshakova T.O., Malsagova K.A. et al. // Sensors and Actuators. B. 2018. V. 261. P. 566. https://doi.org/10.1016/j.snb.2018.01.153
Vu X.T., GhoshMoulick R., Eschermann J.F. et al. // Sensors and Actuators. B. 2010. V. 44. P. 354. https://doi.org/10.1016/j.snb.2008.11.048
Gao A., Zou N., Dai P. et al. // ACS Nano Lett. 2013. V. 13. P. 4123. https://doi.org/10.1021/nl401628y
Lu N., Gao A., Dai P. et al. // Small. 2014. V. 10. № 10. P. 2022. https://doi.org/10.1002/smll.20130299
Bunimovich Y.L., Shin Y.S., Yeo W.S. et al. // J. Am. Chem. Soc. 2006. V. 128. № 50. P. 16323. https://doi.org/10.1021/ja065923u
Li Z., Chen Y., Li X. et al. // Nano Lett. 2004. V. 4. № 2. P. 245. https://doi.org/10.1021/nl034958e
Cheng S., Hotani K., Hideshima S. et al. // Materials. 2014 V. 7. P. 2490. https://doi.org/10.3390/ma7042490
Zhu K., Zhang Y., Li Z. et al. // Sensors. 2015. V. 15. P. 19 225. https://doi.org/10.3390/s150819225
Wu C.-C., Pan T.-M., Wu C.-S. et al. // Int. J. Electrochem. Sci. 2012. V. 7. P. 4432.
Stern E., Wagner R., Sigworth F.J. et al. // Nano Lett. 2007. V. 7. P. 3405. https://doi.org/10.1021/nl071792z
Dmitrienko E., Naumova O., Fomin B. et al. // Nanomedicine. 2016. V. 11. P. 2073. https://doi.org/10.2217/nnm-2016-0071
Razumovitch J., de França K., Kehl F. et al. // J. Phys. Chem. B. 2009. V. 113. P. 8383. https://doi.org/10.1021/jp902383m
Ouyang H., Striemer C.C., Fauchet P.M. // Appl. Phys. Lett. 2006. V. 88. P. 163108. https://doi.org/10.1063/1.2196069
Lim S.K., Perrier S., Neto C. // Soft Matter. 2013. V. 9. P. 2598. https://doi.org/10.1039/C3SM27241A
Israelachvili J.N. Intermolecular and Surface Forces. London: Acad. Press, 1991. 450 p.
Heitzinger C., Klimeck G. // J. Comput. Electron. 2007. V. 6. P. 387. https://doi.org/10.1007/s10825-006-0139-x
Schoch R.B., Han J., Renaud P. // Rev. Mod. Phys. 2008. V. 80. P. 839. https://doi.org/10.1103/RevModPhys.80.839
Curreli M., Zhang R., Ishikawa F.N. et al. // IEEE Trans. Nanotechnol. 2008. V. 7. P. 651. https://doi.org/10.1109/TNANO.2008.2006165
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования