Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 1, стр. 10-14
Исследования наноматериалов для рентгеновской фотодинамической терапии
М. А. Солдатов a, П. В. Медведев a, В. В. Бутова a, В. А. Поляков a, И. Е. Горбань a, Чжэню Ли a, А. В. Солдатов a, *
a Международный исследовательский институт интеллектуальных материалов,
Южный федеральный университет
344090 Ростов-на-Дону, Россия
* E-mail: soldatov@sfedu.ru
Поступила в редакцию 28.02.2019
После доработки 22.03.2020
Принята к публикации 25.03.2020
Аннотация
Был разработан прототип установки для исследования рентгенофлуоресцентных свойств наноматериалов для рентгеновской фотодинамической терапии. Проведено исследование рентгенофлуоресцентных характеристик наноматериалов на основе фторидов гадолиния. Для серий образцов были получены спектры рентгенофлуоресценции в области 600–700 нм, что позволяет сделать вывод о перспективности подобных материалов для применения в качестве компонентов радиосенсибилизаторов для рентгеновской фотодинамической терапии. Полученные данные важны для оптимизации характеристик наноматериалов и для дальнейшей модификации параметров методик синтеза новых материалов для рентгеновской фотодинамической терапии.
ВВЕДЕНИЕ
Онкологические заболевания по распространенности и летальности занимают одно из лидирующих мест среди социально значимых патологий [1]. Многие типы онкологических опухолей обладают резистивностью к тем или иным видам противоопухолевой терапии, поэтому развитие новых видов терапии является крайне важной задачей, особенно для развития подходов персонализированной медицины [2]. Фотодинамическая терапия (в оптическом диапазоне излучения) стала в последнее время одним из важных методов лечения целого ряда онкологических опухолей с неглубокой локацией [2, 3]. Однако достаточна малая эффективная глубина проникновения излучения в ткани существенно ограничивает перечень видов опухолей, поддающихся лечению с помощью фотодинамической терапии оптического диапазона [4]. В отличие от излучения оптического диапазона, фотоны рентгеновского и гамма-диапазона с более высокой энергией легко проникают в глубокие ткани организма [5]. Однако в настоящее время практически не существует допущенных к медицинскому применению биосовместимых фотосенсибилизаторов для рентгеновского и гамма-диапазона фотодинамической терапии. Рентгеновская фотодинамическая терапия является новой областью, которая открывает перспективы ее использования для терапии глубоколежащих опухолей [7–17]. Целью настоящей работы было исследование рентгенофлуоресценции наноматериалов для их возможного применения в рентгеновской фотодинамической терапии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для измерения рентгенофлуоресценции была собрана установка на базе рентгеновского прибора Phywe X-ray (U = 35 кВ, I = 1 мА) для генерации рентгеновских лучей и флуориметра Agilent Cary Eclipse для детектирования спектров рентгенофлуоресценции. Для отсечения излучения в видимом диапазоне от рентгеновского спектра использовался фильтр из алюминиевой фольги толщиной 20 мкм. Были протестированы три различные конфигурации размещения приборов.
В конфигурации “А” (рис. 1а) исследуемый образец в виде спрессованной таблетки помещали максимально близко к источнику рентгеновских лучей. Положение и ориентация образца были подобраны таким образом, чтобы плоскость таблетки была под углом 45° и к направлению распространения рентгеновских лучей, и к оси фокусировки детектора флуориметра. Между исследуемым образцом и флуориметром установлено поглощающее рентгеновские лучи стекло. За счет близкого расположения образца к рентгеновской трубке достигается наибольшая светимость. Недостатком же является защитное стекло, поглощающее ~15% света в видимой области.
Рис. 1.
Схема установки: а – конфигурация “А”; б – конфигурация “Б”; в – конфигурация “В”. Слева показана диафрагма рентгеновского прибора, справа – специализированный держатель образцов и кюветное отделение флуориметра.
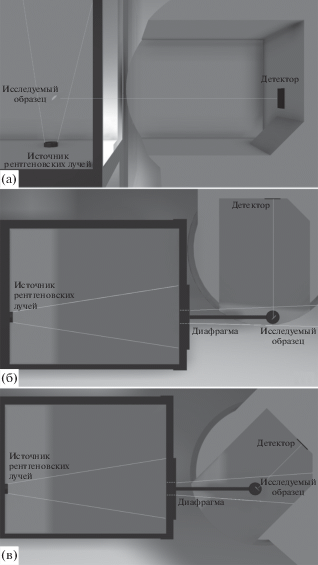
В конфигурации “Б” (рис. 1б) исследуемый образец также помещали на оси распространения рентгеновских лучей на специализированном держателе, распечатанном на 3D принтере. В отличие от конфигурации “А” исследуемый образец находился на большем расстоянии от рентгеновской трубки. В данной конфигурации отсутствует поглощающее рентгеновские лучи стекло, которое также ослабляет интенсивность прошедшего через него света в видимом диапазоне. Однако ввиду большей дистанции от рентгеновской трубки интенсивность свечения образца существенно меньше, чем в случае “А”. Для снижения влияния рентгеновского излучения на соотношение сигнал–шум перед образцом была установлена свинцовая диафрагма.
Конфигурация “В” (рис. 1в) схожа с вышеописанной конфигурацией. Разница заключается в том, что образец установлен ближе к окну детектора флуориметра, и плоскость таблетки параллельна плоскости окна детектора. При данном способе измерения ожидали получить лучшее соотношение сигнал–шум за счет более близкой установки образца к предполагаемому месту фокуса флуориметра. Недостатком является повышенная интенсивность рассеянного на стенках прибора рентгеновского излучения, что при недостатке защитного стекла приводит к ухудшению соотношения сигнал–шум.
Существует несколько классов рентгеновских люминофоров. Весьма перспективными представляются наночастицы, легированные ионами группы редкоземельных элементов. Такие материалы могут поглощать рентгеновское излучение, излучать кванты оптического диапазона. Был предложен наносцинтиллятор на основе LiGa5O8:Cr, который излучает в ближней инфракрасной области [18]. Это позволяет получать оптические изображения глубоких тканей, которые можно использовать для контроля экспозиции. В частности, наночастицы LiGa5O8:Cr и фотосенсибилизатор 2,3-нафталоцианина можно заключать в наночастицы мезопористого диоксида кремния. Такие наноконъюгаты могут эффективно накапливаться в опухолях легких, о чем свидетельствует мониторинг рентгеновской люминесценции LiGa5O8:Cr [18]. Представляет интерес рассмотрение и ряда композиций, легированных ионами Gd3+ и Eu3+ фторидов лантаноидов (например, NaGdF4:Eu3+), которые позволяют оптимизировать параметры излучения при рентгеновском возбуждении [19]. Было показано, что попытка включения иона Ce3+ в NaGdF4:Eu3+ привела к снижению излучения после рентгеновского возбуждения. А покрытие поверхности наночастиц NaGdF4:Eu3+ золотой оболочкой уменьшило рентгеновское свечение в два раза по сравнению с непокрытыми люминофорами.
Синтез NaGdF4:Ce3+,Eu3+–СТ проводили сольвотермальным методом: 0.8 ммоль (210.9 мг) хлорида гадолиния(III), 0.8 ммоль (347.3 мг) гексагидрата нитрата церия(III) и 0.8 ммоль (206.6 мг) хлорида европия(III) растворяли в 4 мл дистиллированной воды. Отдельно растворяли 1.6 ммоль (412.9 мг) цитрата натрия в 8 мл дистиллированной воды. Растворы сливали, немедленно выпадал белый осадок. Суспензию нагревали до температуры 90°С и затем приливали раствор 16 ммоль (672 мг) фторида натрия в 16 мл дистиллированной воды. Полученную дисперсию выдерживали 2 ч при температуре 90°С. Затем частицы промывали три раза дистиллированной водой методом центрифугирования и сушили при 60°С. Полученный образец обозначен как NaGdF4:Ce,Eu. Высушенный образец диспергировали в 30 мл дистиллированной воды и затем помещали в тефлоновый автоклав. Синтез проводили при 210°С в течение 1 ч. Полученный материал снова промывали один раз дистиллированной водой и сушили при 60°С. Полученный образец обозначен как NaGdF4:Ce,Eu–СТ (сольвотермальный).
Синтез NaGdF4:Ce3+,Eu3+–МВ осуществляли микроволновым методом – 0.8 ммоль (210.9 мг) хлорида гадолиния(III), 0.8 ммоль (197.2 мг) хлорида церия(III) и 0.8 ммоль (206.6 мг) хлорида европия(III) растворяли в 4 мл дистиллированной воды. Отдельно растворяли 1.6 ммоль (412.9 мг) цитрата натрия в 8 мл дистиллированной воды. Растворы сливали, немедленно выпадал белый осадок. Суспензию нагревали до 90°С и затем приливали раствор 16 ммоль (672 мг) фторида натрия в 16 мл дистиллированной воды. Полученную дисперсию выдерживали 2 ч при температуре 90°С. Затем смесь переносили в тефлоновую ампулу и помещали в микроволновую печь CEM Mars6. Условия микроволнового синтеза: время подъема температуры 20 мин, время выдерживания 1 ч, температура 210°С, мощность 600 Вт. Полученный материал промывали три раза дистиллированной водой и сушили при 60°С. Образец обозначен NaGdF4:Ce,Eu–МВ (микроволновый).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
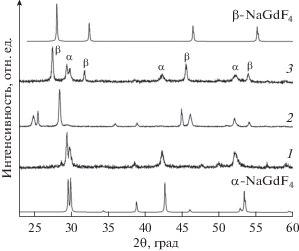
Средний размер синтезированных наночастиц не превышает 100 нм (рис. 2). Как видно из рентгеновских дифрактограмм, синтезированные образцы NaGdF4 представляют собой смесь фаз, основной является гексагональная фаза α-NaGdF4 (рис. 3). Уширение пиков связано с мелким размером частиц. Осадок, полученный при температуре 90°С, соответствует однофазному продукту, однако при дополнительной обработке в автоклаве наблюдается фазовый переход. В образце NaGdF4:Ce,Eu–МВ идентифицируются две фазы – гексагональная α-NaGdF4 (данные из базы PDF #27-0699) и кубическая β-Gd4F6O3 (#27-0697).
Рис. 2.
Изображения NaGdF4:Ce,Eu–МВ, полученные в просвечивающем электронном микроскопе при разных увеличениях.

Рис. 3.
Дифрактограммы синтезированных образцов: NaGdF4:Ce,Eu (1), NaGdF4:Ce,Eu–СТ (2), NaGdF4: Ce,Eu–МВ (3).
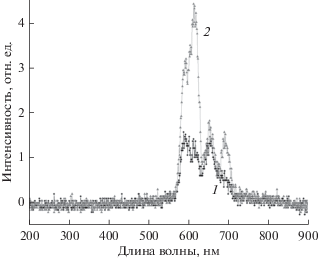
При измерении рентгенофлуоресценции более интенсивный сигнал для стандартного рентгенолюминофора удалось получить в случае конфигурации “А”. Поэтому все измерения проводили с использованием этой конфигурации. Удаленность образца от источника рентгеновских фотонов и детектора оптического излучения, а также малая мощность источника (U = 35 кВ, I = 1 мА) были существенным ограничением при проведении измерений. Тем не менее, для ряда образцов на основе фторидов гадолиния были успешно зарегистрированы спектры рентгенофлуоресценции (рис. 4).
Рис. 4.
Спектры рентгенофлуоресценции образцов на базе фторидов гадолиния: 1 – NaGdF4:Eu3+–СТ, 2 – NaGdF4:Eu3+–МВ.
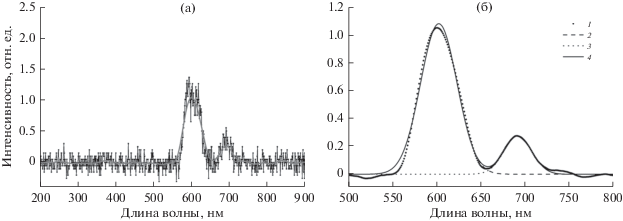
При анализе спектров рентгенофлуоресценции вычитали фоновый спектр (с максимумом при 660 нм), измеренный при выключенном рентгеновском источнике. Спектры рентгенофлуоресценции были проанализированы путем усреднения сигнала по точкам и дальнейшей аппроксимации пиков с помощью функции Гаусса. Было установлено, что спектр рентгенофлуоресценции образца NaGdF4:Eu3+–СТ имеет максимумы при длинах волн 603 и 693 нм (рис. 5).
Рис. 5.
Спектр рентгенофлуоресценции материала NaGdF4:Eu3+–СТ (а): точки – эксперимент; сплошная линия – усреднение экспериментальных данных. Результаты подгонки с помощью функции Гаусса (б): 1 – усреднение экспериментальных данных; 2 – вклад пика при 603 нм; 3 – вклад пика при 693 нм; 4 – результаты подгонки.
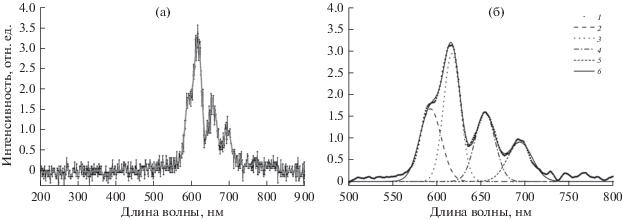
Самый большой выход рентгенофлуоресценции получен для образца NaGdF4:Eu3+–МВ. После подгонки четырех пиков функцией Гаусса было установлено, что максимумы флуоресценции приходятся на длины волн 593, 618, 655 и 694 нм (рис. 6). Стоит отметить, что основной вклад в спектр вносят переходы 5D0 → 7FJ с эмиссией Eu3+ на длинах волн (587, 612, ~700 нм) [6]. Судя по всему, из-за низкой интенсивности рентгеновского источника пики при 587 и 612 нм не удалось разделить для образца NaGdF4:Eu3+–СТ. Для образца NaGdF4:Eu3+–МВ удалось разделить вклады пиков 593, 618, 655 и 694 нм.
Рис. 6.
Спектр рентгенофлуоресценции материала NaGdF4:Eu3+–МВ (а): точки – эксперимент; сплошная линия – усреднение экспериментальных данных. Результаты подгонки с помощью функции Гаусса (б): 1 – усреднение экспериментальных данных; 2 – вклад пика при 593 нм; 3 – вклад пика при 618 нм; 4 – вклад пика при 655 нм; 5 – вклад пика при 694 нм; 6 – результаты подгонки.
ЗАКЛЮЧЕНИЕ
Для серий образцов на основе фторидов гадолиния были получены спектры рентгенофлуоресценции в области 600–700 нм, что позволяет сделать вывод о перспективности подобных материалов для применения в качестве компонента радиосенсибилизаторов для рентгеновской фотодинамической терапии. Полученные данные важны для оптимизации характеристик наноматериалов и для дальнейшей модификации параметров методик синтеза новых материалов для рентгеновской фотодинамической терапии.
Список литературы
Kelly W.K., Halabi S. Oncology Clinical Trials. Springer, 2018. 600 p.
Fan W., Huang P., Chen X. // Chem. Soc. Rev. 2016. V. 45. P. 6488. https://doi.org/10.1039/c6cs00616g
Yi G., Hong S.H., Son J. et al. // Quant. Imaging Med. Surg. 2018. V. 8. P. 433.
Kamkaew A., Chen F., Zhan Y. et al. // ACS Nano. 2016. V. 10. № 4. P. 3918. https://doi.org/10.1021/acsnano.6b01401
Zhang X., Zhu S., Li Y. et al. // Biomed. Eng. Online. 2018. V. 17. P. 45. https://doi.org/10.1186/s12938-018-0480-x
Sudheendra L., Gautom K. D., Li Ch. et al. // Chem. Mater. 2014. V. 26. P. 1881. https://doi.org/10.1021/cm404044n
Sivasubramanian M., Chuang Y.C., Lo L.W. // Molecules. 2019. V. 24. P. 520. https://doi.org/10.3390/molecules24030520
Larue L., Ben Mihoub A., Youssef Z. et al. // Photochem. Photobiol. Sci. 2018. V. 17. P. 1612. https://doi.org/10.1039/c8pp00112j
Pogue B.W., Wilson, B.C. // J. Biomed. Opt. 2018. V. 23. P. 1. https://doi.org/10.1117/1.JBO.23.12.121610
Misawa M., Takahashi J. // Nanomedicine. 2011. V. 7. P. 604. https://doi.org/10.1016/j.nano.2011.01.014
Elmenoufy A.H., Tang Y., Hu J. et al. // Chem. Commun. 2015. V. 51. P. 12247. https://doi.org/10.1039/c5cc04135j
Fan W., Huang P., Chen X. // Chem. Soc. Rev. 2016. V. 45. P. 6488. https://doi.org/10.1039/c6cs00616g
Chen H., Wang G.D., Chuang Y.J. et al. // Nano. Lett. 2015. V. 15. P. 2249. https://doi.org/10.1021/nl504044p
Fan W., Tang W., Lau J. et al. // Adv. Mater. 2019. V. 31. P. 1806381. https://doi.org/10.1002/adma.201806381
Cline B., Delahunty I., Xie J. // WIREs Nanomed. Nanobiotechnol. 2019. V. 11. P. 1541. https://doi.org/10.1002/wnan.1541
Kaščáková S., Giuliani A., Lacerda S. et al. // Nano. Res. 2015. V. 8. P. 2373. https://doi.org/10.1007/s12274-015-0747-5
Chen H.P., Tung F.I., Chen M.H., Liu T.Y. // J. Control. Release. 2016. V. 226. P. 182. https://doi.org/10.1016/j.jconrel.2016.02.025
Chen H., Sun X., Wang G.D. et al. // Mater. Horiz. 2017. V. 4. P. 1092. https://doi.org/10.1039/C7MH00442G
Sudheendra L., Das G.K., Li C. et al. // Proc. SPIE. 2013. V. 8596. Reporters, Markers, Dyes, Nanoparticles, and Molecular Probes for Biomedical Applications V, 85960D. https://doi.org/10.1117/12.2005250
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


