Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 3, стр. 3-13
Влияние двухвалентных ионов на структуру бислоев в везикулах димиристоилфосфатидилхолина
С. А. Куракин a, b, *, Е. В. Ермакова b, А. И. Иваньков b, c, d, С. Г. Смердова e, N. Kučerka b, f, **
a Институт физики, Казанский (Приволжский) федеральный университет
420008 Казань, Россия
b Лаборатория нейтронной физики им. И.М. Франка, Объединенный институт ядерных исследований
141980 Дубна, Россия
c Московский физико-технический институт
141701 Долгопрудный, Россия
d Институт проблем безопасности атомных электростанций национальной академии наук Украины
03028 Киев, Украина
e Казанский национальный исследовательский технологический университет
420015 Казань, Россия
f Фармацевтический факультет, Университет им. Я.А. Коменского в Братиславе
832 32 Братислава, Словакия
* E-mail: ksa18@list.ru
** E-mail: kucerka@nf.jinr.ru
Поступила в редакцию 09.06.2020
После доработки 23.08.2020
Принята к публикации 25.08.2020
Аннотация
Методом малоуглового рассеяния нейтронов (МУРН) исследованы изменения структурных параметров однослойных везикул 1,2-димиристоил-sn-3-фосфатидилхолина (ДМФХ) при варьировании концентрации двухвалентных катионов металлов Ca2+, Mg2+ и Co2+ в диапазоне 0–30 мМ. Получены структурные параметры мембраны (толщина и площадь, приходящаяся на одну молекулу фосфолипида) при разных концентрациях катионов в гель- и жидкокристаллической (ЖК) фазах мембраны. В обеих термодинамических фазах в диапазоне концентрации 0–1 мМ ионов Ca2+ толщина мембраны увеличивается на 1.9 и 2.9 Å; в случае Mg2+ на 1.8 и 2.8 Å в ЖК- и гель-фазах соответственно. В диапазоне 1–30 мМ наблюдается либо слабая тенденция к уменьшению толщины (~1 Å), либо толщина не изменяется. В случае ионов Co2+ все изменения выражены крайне слабо. Расширена модель электростатических взаимодействий, представленная ранее для данных систем, с рассмотрением взаимодействий между фосфолипидами через ионные мостики. С помощью изотермы адсорбции Ленгмюра произведена оценка доли связанных с мембраной ДМФХ ионов Ca2+. Разработанная модель представляет интерес для будущего исследования взаимодействий с различными пептидами, такими как заряженные амилоид-β пептиды и антимикробные пептиды.
ВВЕДЕНИЕ
Биологические мембраны чрезвычайно существенны для жизнедеятельности клетки, поскольку играют важную роль в поддержании ее автономности, а также обладают целым рядом уникальных свойств, связанных с передачей нервных импульсов и транспортом веществ [1, 2]. Такие свойства мембран во многом обусловлены наличием ионов в цитоплазме и окружающей клетку среде. Одно- и двухвалентные ионы металлов содержатся в относительно высоких концентрациях и являются значимыми в регуляции поляризации клеток и потенциалов действия [3]. При этом двухвалентные ионы сильнее взаимодействуют с фосфолипидами по сравнению с одновалентными [4], что приводит к различному влиянию на структуру мембраны. Например, это было показано на бактериальных модельных мембранах, состоящих из липополисахаридов (ЛПС) [5]. Согласно данным нейтронной дифракции, вода проникает через ЛПС, содержащие Ca2+, в меньшей степени, чем в бислои с ионами Na+, дегидратируя головную область липидов, что приводит к более сильному упорядочению цепей в мембране с ионами Ca2+ [5].
Среди всех ионов двухвалентные катионы щелочноземельных металлов, такие как Ca2+ и Mg2+, являются незаменимыми при определенных концентрациях, принимая непосредственное участие в проведении сигналов и минерализации тканей [6, 7]. Ионы переходных металлов (Co2+, Fe2+, Cu2+) необходимы для кроветворения и обмена веществ, в отличие от тяжелых металлов, токсичных для организма (Hg2+, Cd2+, Pb2+) [8].
Известно, что катионы металлов взаимодействуют с мембраной клетки, связываясь с полярной головой образующих бислой фосфолипидов [9–11]. При этом изменяется толщина и структура мембраны, что затрагивает функции и конформации различных белков, интегрированных в нее [12], а сами ионы проявляют специфические особенности к связыванию, характерные для каждого конкретного иона. В общем случае более точно такие специфические взаимодействия ионов с белками, полимерами и в объеме раствора описываются рядами Гофмейстера, ионы в которых расположены в порядке их влияния на свойства растворителя, а также влияния на протекание различных процессов в водной среде. В этих рядах последовательность ионов определяется их зарядом, поляризуемостью, размером и гидратацией. Поскольку ионные радиусы определяются числом электронных оболочек и размерами ядра атома, то ионы с одинаковым зарядом могут иметь совершенно разные эффекты Гофмейстера [3].
Учитывая, что изменения конформаций белков и фосфолипидов при их взаимодействиях с ионами тесно коррелируют с толщиной мембраны, очевидно, что важную роль во многих взаимодействиях играет не только длина хвостов фосфолипидов [13], но и термодинамическая фаза липидных систем. В гель-фазе наблюдается параллельное упорядочение цепей фосфолипидов, что приводит к утолщению мембраны и более плотной упаковке, а также к уменьшению текучести бислоя. Наоборот, липидные системы в ЖК-фазе обладают повышеной динамикой и неупорядоченностью, связанной с менее плотной упаковкой.
В настоящее время многие эксперименты направлены на изучение свойств насыщенных цвиттер-ионных фосфолипидов, однако структурные исследования этих фосфолипидов при их взаимодействиях с такими ионами двухвалентных металлов, как Ca2+, Mg2+ и Co2+, недостаточно полные. Поэтому в настоящей работе мы продолжили предыдущие исследования структурных параметров мембран насыщенных фосфолипидов, развитых в работе [14] на примере системы ДПФХ (1,2-дипальмитоил-sn-3-фосфатидилхолин), содержащей ионы Ca2+, и направили наши эксперименты, выполненные с помощью малоуглового рассеяния нейтронов (МУРН), на изучение везикул фосфолипидов ДМФХ. Кривые МУРН, полученные от образцов однослойных везикул ДМФХ, содержащих в отдельности ионы Ca2+, Mg2+ и Co2+ в диапазоне концентраций 0–30 мМ и находящихся в D2O для получения максимальных условий контраста при рассеянии нейтронов, были проанализированы с помощью двух моделей: приближения Кратки–Порода и модели сферических везикул на всем представленном q-диапазоне. Из аппроксимации экспериментальных данных были получены структурные параметры бислоя: толщина db и площадь AL, соответствующая одной молекуле ДМФХ, как функции концентрации ионов в растворе.
ПРИГОТОВЛЕНИЕ ОБРАЗЦОВ
Для приготовления образцов везикул ДМФХ (Avanti Polar Lipids, Alabama, USA) дегидратированный липид в концентрации 50 мг/мл был добавлен в смесь растворителей хлороформа и метанола, взятыми в объемном соотношении 2 : 1. Далее растворитель выпаривался под потоком аргона или азота для создания липидной пленки на дне ампул. Полное удаление следов растворителя было произведено в вакуумной камере. Из солей исследуемых ионов CaCl2 ⋅ 2Н2О, MgCl2 ⋅ 6Н2О и CoCl2 ⋅ 6Н2О (Sigma-Aldrich, Germany) были приготовлены растворы в D2О (в диапазоне концентраций ионов 0–30 мМ), которыми затем гидратировали липиды в ампуле (1.5 мл). Система была тщательно перемешана в шейкере и (как минимум 10 раз) проведена через температуру основного фазового перехода путем замораживания–оттаивания. После этой процедуры образцы продемонстрировали легкую опалесценцию, типичную для крупных мультислойных липидных везикул в растворе.
Однослойные везикулы ДМФХ были получены при экструдировании мультислойных везикул. Использовались 2 поликарбонатных фильтра с диаметром пор 1000 Å (Avanti Polar Lipids, Alabama, USA) для систем ДМФХ + Ca2+ (Mg2+) и 1 фильтр с порами 500 Å для системы ДМФХ + Co2+ в экструдере фирмы Avanti Polar Lipids (Alabama, USA), оснащенным двумя воздухонепроницаемыми шприцами (Hamilton, Reno, USA). Процесс экструдирования был выполнен механически нечетное число раз (31 проведение системы через фильтры) во избежание попадания в образец крупных везикул. Продавливание мультислойных везикул ДМФХ через фильтры было произведено в ЖК-фазе липида путем нагревания экструдера с образцом до температуры 50°С. После экструдирования для достижения равновесия в системе полностью гидратированные однослойные везикулы были выдержаны в течение суток при комнатной температуре. Все образцы были экструдированы заранее (1–3 дня до проведения эксперимента) во избежание спонтанного формирования мультислойных везикул. Непосредственно перед измерениями образцы были перелиты в двухмиллиметровые кварцевые кюветы (Helma, Germany).
Экструдирование через фильтры меньшего размера более надежно приводит к однослойной структуре везикул, при этом структура бислоя в случае незаряженных липидов не изменяется [15]. Однако в случае присутствия заряда большая кривизна мембраны может привести к изменению ее структуры. Тем не менее, результаты, которые мы получили для везикул, экструдированных через фильтры с диаметром пор 1000 и 500 Å, влияния размера пор на толщину мембраны не выявили, а использование фильтров с меньшим диаметром пор улучшило однослойность везикул, как следует из заметного уменьшения брэгговского пика.
ЭКСПЕРИМЕНТ
Эксперимент был выполнен на спектрометре малоуглового упругого рассеяния нейтронов ЮМО с использованием метода времени пролета [16]. Источник нейтронов – импульсный ядерный реактор ИБР-2М (Лаборатория нейтронной физики им. И.М. Франка Объединенного института ядерных исследований, Дубна) [17].
Пучок тепловых нейтронов с длинами волн от 0.5 до 8 Å, соответствующих распределению Максвелла, был сфокусирован набором из двух коллиматоров диаметром 40 и 14 мм. Рассеянные на образце нейтроны регистрировались двумя кольцевыми детекторами, расположенными на расстоянии 4.5 и 13 м от образцов, что позволило охватить диапазон вектора рассеяния q от 0.006 до 0.5 Å–1. Ванадиевый стандарт использовался для калибровки абсолютной интенсивности рассеяния, буферный раствор – для калибровки фоновой интенсивности. Температура образцов регулировалась термостатом Lauda с термозондом Pt-100 и была установлена на уровне 20 и 30°С для исследования гель- и жидкокристаллической фаз липидных систем ДМФХ, температура основного фазового перехода которых составляет 24°С. Получение кривых МУРН производилось при помощи программного обеспечения SAS [18].
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Для центросимметричных частиц, находящихся в растворе, интенсивность рассеянных нейтронов определяется в виде [19]:
где n – концентрация частиц, q – модуль вектора рассеяния, $~q = \left( {\frac{{4\pi }}{\lambda }} \right)\sin \left( {\frac{\theta }{2}} \right),$ θ – угол рассеяния, B – фоновая интенсивность, $~F\left( q \right)$ – форм-фактор частицы, $S\left( q \right)$ – структурный фактор, описывающий взаимодействие между частицами; в наших (очень разбавленных) системах, при концентрации фосфолипидов <2 мас. % $~S\left( q \right)$ = 1 [20].Полученные экспериментальные зависимости интенсивности I(q) были аналитически аппроксимированы (фитированы) в рамках двух моделей: Кратки–Порода и модели сферических везикул. Интенсивность в приближении Кратки–Порода может быть записана в виде [21]:
(2)
$I\left( q \right) = \frac{A}{{{{q}^{2}}}}{{e}^{{ - {{q}^{2}}R_{t}^{2}}}} + B,\,\,\,\,{{R}_{t}}q < 1,$В сферической модели везикулы можно представить в виде сферы, оболочкой которой является фосфолипидный бислой, причем интенсивность определяется как [22]:
(4)
$\begin{gathered} I\left( q \right) = \frac{\alpha }{{{{V}_{2}}}}\left( {\frac{{3{{V}_{1}}\left( {{{\rho }_{1}} - {{\rho }_{2}}} \right){{j}_{1}}\left( {q{{R}_{1}}} \right)}}{{q{{R}_{1}}}} + } \right. \\ {{\left. { + \,\,\frac{{3{{V}_{2}}\left( {{{\rho }_{2}} - {{\rho }_{1}}} \right){{j}_{1}}\left( {q{{R}_{2}}} \right)}}{{q{{R}_{2}}}}} \right)}^{2}} + B, \\ \end{gathered} $Экспериментально полученные кривые были проанализированы с помощью программного обеспечения SasView [23]. При анализе теоретически рассчитанные кривые для однослойных везикул были свернуты логнормальной функцией распределения везикул по размерам:
(6)
$f\left( {R,{{R}_{m}},\sigma } \right) = \frac{1}{{\sqrt {2\pi } }}\frac{1}{{R\sigma }}\exp \left\{ { - \frac{1}{2}{{{\left( {\frac{{{\text{ln}}R - \mu }}{\sigma }} \right)}}^{2}}} \right\},$Влияние погрешности кривых МУРН на полученные результаты было оценено, следуя подходу ковариационной матрицы. Полученные диагональные члены матрицы, которые представляют относительную погрешность фитированных параметров, умножались на нормированную функцию хи-квадрат для получения погрешности параметров в абсолютных единицах.
РЕЗУЛЬТАТЫ
На рис. 1а точками представлены кривые МУРН для ЖК-фазы фосфолипидов ДМФХ при концентрациях ионов Ca2+ в растворе 0, 1, 2, 10 и 30 мМ. Кривые аналитически аппроксимированы в приближении Кратки–Порода и с помощью модели сферических везикул. Именно нелинейная зависимость построения Кратки–Порода в координатах ln(I(q)q2) от q 2 (рис. 1б) при аппроксимации в диапазоне $q \in \left( {0.~02,~~0.08} \right)$ позволяет определить присутствие в образце мультислойных везикул для не содержащего добавок ДМФХ. Это искажение появляется из-за наличия в кривой брэгговского пика (широкого и слабо выраженного) при q = 0.08–0.1 Å–1 (рис. 1а). Мультислойные везикулы имеют период повторения слоев $d = {{2\pi } \mathord{\left/ {\vphantom {{2\pi } q}} \right. \kern-0em} q}$ ~ 70 Å.
Рис. 1.
Кривые МУРН для образцов ДМФХ в жидкокристаллической фазе при Т = 30°С, экструдированных через фильтры с диаметром пор 1000 Å и содержащих ионы Са2+ в концентрациях 0 (1), 1 (2), 2 (3), 10 (4), 30 мМ (5). Фитирование выполнено с помощью модели сферических везикул (а). Построение Кратки–Порода в координатах ln(I(q)q2) от q2 при тех же концентрациях ионов Са2+ (1) (б).
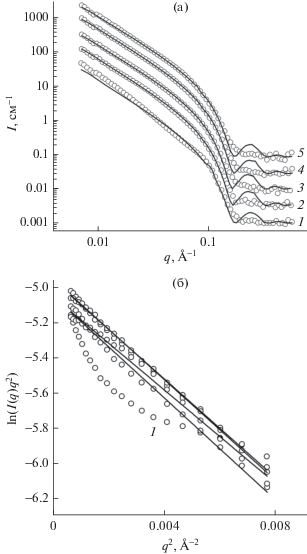
Добавление соли в образец приводит к полному разрушению мультислойных везикул, о чем свидетельствует исчезновение дифракционных пиков на кривых, соответствующих остальным образцам, а также хорошая линейность на построении Кратки–Порода. Поскольку катионы связываются с фосфатной группой (диполь P ––N +), то заряженный бислой электростатически отталкивается от соседнего бислоя в везикуле. Критическая концентрация ионов кальция, при которой происходит разрушение всех мультислойных везикул в такой системе, была оценена значением 0.5 мМ [24] и, следовательно, подтверждена нашими результатами, в которых концентрация ионов превышала критическую. Также отметим, что нами были получены аналогичные кривые МУРН образцов, содержащих Mg2+ и Co2+ (рис. 2 и 3).
Рис. 2.
Кривые МУРН для образцов ДМФХ в жидкокристаллической фазе при Т = 30°С, экструдированных через фильтры с диаметром пор 1000 Å и содержащих ионы Mg2+ в концентрациях 0 мМ (1), 1 (2), 2 (3), 10 (4), 30 мМ (5). Фитирование выполнено с помощью модели сферических везикул (а). Построение Кратки–Порода в координатах ln(I(q)q2) от q2 при тех же концентрациях ионов Mg2+ (1) (б).
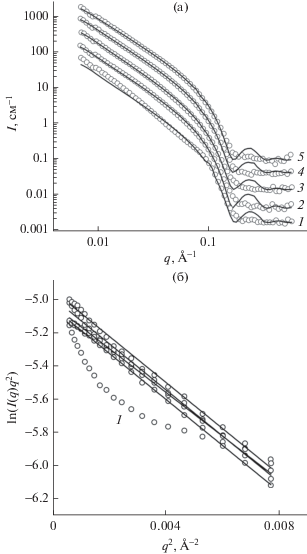
Рис. 3.
Кривые МУРН для образцов ДМФХ в жидкокристаллической фазе при Т = 30°С, экструдированных через фильтры с диаметром пор 500 Å и содержащих ионы Сo2+ в концентрациях 0 (1), 1 (2), 2 (3), 10 (4), 30 мМ (5). Фитирование выполнено с помощью модели сферических везикул (а). Построение Кратки–Порода в координатах ln(I(q)q2) от q2 при тех же концентрациях ионов Сo2+ (б).
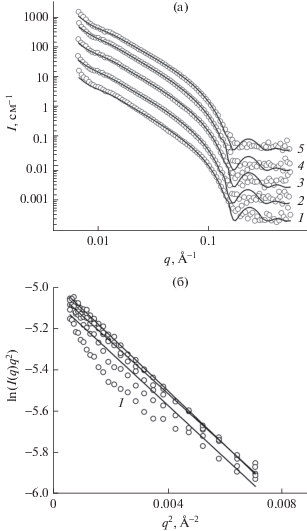
Толщина бислоя db была получена с использованием двух представленных выше моделей (т.е. Кратки–Порода и сферические везикулы). Поскольку тенденции концентрационных зависимостей не отличались, в дальнейшем мы представим результаты только для модели сферических везикул. Площадь AL, приходящаяся на одну молекулу фосфолипида, была рассчитана из полученных значений db по формуле ${{A}_{L}} = {{2{{V}_{L}}} \mathord{\left/ {\vphantom {{2{{V}_{L}}} {{{d}_{{\text{b}}}},}}} \right. \kern-0em} {{{d}_{{\text{b}}}},}}$ где VL – объем, занимаемый одной молекулой фосфолипида. Согласно литературным данным, для ДМФХ при температуре 30°С VL составляет 1101 Å3 [25], для ДМФХ в гель-фазе при 20°С VL = 1041 Å3 [26]. Для ДМФХ без добавок получены следующие значения: в ЖК-фазе db = 36.2 ± 0.7 Å и AL = = 60.8 ± 0.7 Å2 при экструдировании везикул через фильтры с диаметром пор 1000 Å, db = 36.1 ± ± 0.4 Å и AL = 61.0 ± 0.4 Å2 при экструдировании через фильтры 500 Å; в гель-фазе аналогично: db = = 37.8 ± 0.7 Å и AL = 55.1 ± 0.7Å2, db = 38.7 ± 0.8 Å и AL = 53.8 ± 0.8 Å2. Следовательно, полученные различия в значениях толщины и площади на один липид при экструдировании через фильтры с разными диаметрами пор являются несущественными, в особенности для липидных систем ДМФХ в ЖК-фазе. Более того, эти результаты прекрасно совпадают с ранее представленными результатами в работе [27] для мембраны в везикулах ДМФХ без добавок в ЖК-фазе (T = 30°С): db = 36.3 Å и AL = 60.6 Å2.
На рис. 4 представлены графики изменений толщины мембраны ДМФХ, находящейся в ЖК- и гель-фазах, в зависимости от концентрации Ca2+, Mg2+, Co2+. Для Co2+ изменения чрезвычайно слабые. Однако в случае Ca2+ и Mg2+ наблюдаются изменения толщины мембран ДМФХ. В диапазоне концентраций 0–1 мМ ионов Ca2+ и Mg2+ толщина мембраны увеличивается, а затем наблюдается слабая тенденция к уменьшению ее толщины в ЖК-фазе; в гель-фазе уменьшение не происходит (в случае Ca2+), либо оно слабое (в случае Mg2+). Для всех изменений толщины в ЖК-фазе характерны относительно малые значения (в ЖК-фазе ~2 Å; в гель-фазе все изменения ~3 Å).
Рис. 4.
Зависимость изменения толщины мембраны в липидных системах ДМФХ, находящихся в ЖК-фазе (⚪) и гель-фазе (⚫), от концентрации ионов (а) Ca2+; (б) Mg2+; (в) Co2+.
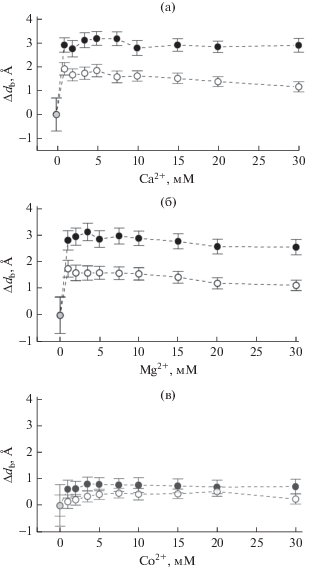
Для мембран, содержащих ионы Ca2+ и Mg2+, в ЖК-фазе наблюдается резкое увеличение толщины бислоя вплоть до максимального значения: db = 38.1 ± 0.3 Å в случае Ca2+ и db = 38.0 ± 0.3 Å для Mg2+. В сравнении с ДМФХ без добавок толщина мембраны увеличивается на значения Δdb = = 1.9 ± 0.9 Å и Δdb = 1.8 ± 1.0 Å для Ca2+ и Mg2+ соответственно. Далее в зависимостях отмечается тенденция к уменьшению db (~0.8 Å для ДМФХ + + Ca2+ и 0.6 Å для ДМФХ + Mg2+) в диапазоне 1–30 мМ. В случае гель-фазы ДМФХ происходит резкое увеличение толщины: с db = 37.8 ± 0.7 Å до db = 40.7 ± 0.3 Å при добавлении в ДМФХ ионов Ca2+ в концентрации 1 мМ, что соответствует изменению на Δdb = 2.9 ± 1.0 Å. В случае Mg2+ также отмечено резкое увеличение: Δdb = 2.8 ± 1.1 Å.
Изменение площади, приходящейся на одну молекулу фосфолипида AL, обратно пропорционально изменению толщины мембраны db. Таким образом, зависимость изменений значений AL от концентрации ионов является зеркальным отражением зависимостей db. При добавлении солей в концентрации 1 мМ AL уменьшается на 3.0 ± 1.3 Å2 и 4.0 ± 1.0 Å2 (Ca2+), 2.8 ± 1.0 Å2 и 4.0 ± 1.1 Å2 (Mg2+) в ЖК- и гель-фазах соответственно. Следовательно, добавки солей (при 1 мМ) приводят к тому, что мембрана оказывается более плотно упакованной по сравнению с ДМФХ, не содержащем ионов. Однако при дальнейшем росте концентрации этих катионов AL начинает увеличиваться (в ЖК-фазе), либо почти не изменяется (в гель-фазе).
ОБСУЖДЕНИЕ
Согласно многочисленным исследованиям, в нейтральной среде P ––N +-диполь фосфолипида расположен вдоль касательной к поверхности мембраны и может свободно вращаться вокруг нормали бислоя, как представлено в работах [14, 28–30] и на рис. 5а. В этих работах, несмотря на [31–33], было показано, что увеличение толщины мембраны может объясняться электрическим полем, возникающим в результате связывания ионов с отрицательным зарядом в голове фосфолипида и ориентирующим P ––N +-диполь вдоль нормали бислоя. При этом известно, что изменение толщины мембраны, например, ДПФХ, происходит как в однослойных везикулах, так и в ориентированных мультислойных мембранах: методами малоуглового рассеяния нейтронов на везикулах обнаружен максимум толщины мембраны (при концентрации ионов Ca2+ ~ 2–3 мМ), что подтверждается экспериментами по нейтронной дифракции на ориентированных мультислойных мембранах в той же системе ДПФХ + + Ca2+ [14, 28]. Это позволяет на представленном диапазоне концентраций утверждать об изменениях толщины мембраны, вызванных именно электростатическими взаимодействиями, а также предположить для наших систем наличие аналогичных процессов, обсужденных в работе [24] лишь в диапазоне концентраций 0–1 мМ ионов Ca2+. При этом существенное влияние кривизны поверхности на толщину мембраны в везикулах исключается.
Рис. 5.
Графическая интерпретация эффекта изменения толщины мембраны ДМФХ: а – молекула ДМФХ (прямыми линиями представлена огрубленная модель молекулы); б – формирование ионного мостика ${\text{PO}}_{4}^{ - }{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{a}}}^{{2 + }}}{\kern 1pt} - {\kern 1pt} {\text{PO}}_{4}^{ - }$ путем электростатического притяжения соседних фосфолипидов к иону; а также изменение пространственной ориентации P ––N +-диполей фосфолипидов; в – наклон фосфолипидов относительно нормали бислоя.
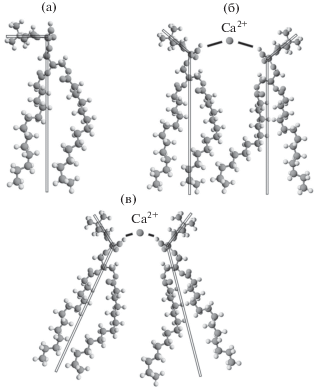
Компьютерным моделированием установлено, что локализация Ca2+ и Mg2+ отмечается у фосфатных и эфирных связей карбоксильных групп ДМФХ [34]. Кроме того, связанные ионы вызывают дегидратацию мембраны, приводящую к образованию более плотной фосфолипидной упаковки, о чем свидетельствует в нашем эксперименте уменьшение площади на один липид (в диапазоне концентраций 0–1 мМ ионов Ca2+). При этом Ca2+ эффективнее дегидратирует мембрану [35], если сравнивать с Mg2+, сильное сродство к гидратации которого затрудняет связывание с фосфолипидами [36].
Вследствие связывания с мембраной ионов электрическое поле реорганизует фосфолипиды в мембране так, что отрицательно заряженные фосфатные группы соседних молекул ориентируются в сторону положительно заряженных фосфолипидов с образованием ионных мостиков (рис. 5б) [33]. Следовательно, достаточно сильное кулоновское взаимодействие в образующихся ионных мостиках ${\text{PO}}_{4}^{ - }{\kern 1pt} - {\kern 1pt} {\text{M}}{{{\text{e}}}^{{2 + }}}{\kern 1pt} - {\kern 1pt} {\text{PO}}_{4}^{ - }$ приводит к уменьшению площади на один липид и последовательному увеличению толщины. При этом формирование ионных мостиков является достаточно быстрым процессом, приводящим к перемещению ионов из раствора в мембрану [37].
В наших образцах дальнейшее увеличение концентрации ионов в растворе, по-видимому, приводит к насыщению изменений структуры мембраны. Это может объясняться отсутствием свободных мест для формирования ионных мостиков. Однако более вероятно, что здесь происходит влияние пространственных ограничений, не позволяющих далее изменять структуру мембраны, т.е. невозможность ее последующего сжатия в латеральном направлении. Тем не менее, тенденция к уменьшению толщины в диапазоне 1–30 мМ, наблюдаемая при увеличении количества ионов в мембране, может возникать из-за избыточного латерального давления в гидрофобной области мембраны, что приводит к наклону молекул фосфолипидов относительно нормали бислоя (рис. 5в). Отметим, что Д. Хастер с коллегами сообщали о влиянии ионов Ca2+ на гидрофобные цепи ДМФХ [31].
В гель-фазе эффект изменения структурных параметров мембраны ДМФХ в диапазоне 1–30 мМ выражен слабо, поскольку мембрана более жесткая, чем в ЖК-фазе. Кроме того, коэффициент самодиффузии молекул ДМФХ в ЖК-фазе на порядок превышает соответствующее значение гель-фазы [38]. Вероятно, это препятствует наклону фосфолипидов относительно нормали. Согласно полученным экспериментальным результатам для ионов Mg2+, которые аналогичны результатам по ионам Ca2+, взаимодействия ДМФХ с Mg2+ могут быть описаны в рамках одной и той же модели. Таким образом, мы распространяем представленную модель взаимодействия на наши системы, содержащие везикулы ДМФХ с ионами Ca2+ и Mg2+.
Для описанной реорганизации фосфолипидных молекул необходимо наличие дальнодействующего электростатического притяжения между комплексами фосфолипид-ион. Электростатическое влияние ионов в растворе с диэлектрической проницаемостью, равной диэлектрической проницаемости головной группы фосфолипидов в латеральном направлении, ${{\varepsilon }_{r}}$ (${{\varepsilon }_{r}}$ = 75 [39]), описывается длиной экранирования Дебая [40]:
(7)
$b = \sqrt {\frac{{{{\varepsilon }_{0}}{{\varepsilon }_{r}}kT}}{{{{e}^{2}}\sum {{{n}_{i}}z_{i}^{2}} }}} ,$Отметим, что длина экранирования Дебая также тесно коррелирует с зарядовой плотностью мембраны, а именно со средним расстоянием между ионами, связанными с фосфолипидами. Количество ионов, связанных с мембраной, может быть оценено изотермой адсорбции Ленгмюра в виде [14]:
(8)
$\frac{{{{X}_{b}}}}{{1 - n{{X}_{b}}}} = K\left( {{{C}_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}} - {{X}_{b}}{{C}_{l}}} \right),$Ионы Co2+ слабо влияют на структурные параметры мембраны ДМФХ. Следовательно, электростатические взаимодействия в бислое, представленные в модели взаимодействия ионов Ca2+ и Mg2+ с фосфолипидами ДМФХ, несколько другие и слабо выражены по сравнению с Ca2+ и Mg2+. Это может напрямую зависеть от разных физических свойств этих ионов, а также объясняться различной гидратацией, силой и местами связывания ионов с головными группами фосфолипидов. Например, в работе [4] были определены константы связывания Ca2+ и Mg2+ с яичным лецитином: K = 40 М–1 и 30 М–1 для Ca2+ и Mg2+ соответственно, что говорит о сильном связывании этих катионов в отличие от Co2+, который связывается относительно слабо (K = 1.2 М–1 при 10 мМ) [44] и практически не затрагивает жесткость мембраны и размер везикул ДМФХ [45].
Кроме того, важно рассмотреть размеры ионов, поскольку меньшие размеры иона способствуют созданию сильных электрических полей, что приводит к бóльшим значениям энергии гидратации [46]. К примеру, ион Ca2+ обладает ионным радиусом 1.00 Å, в то время как Mg2+ – лишь 0.72 Å [33, 47]. Co2+ имеет ионный радиус, близкий к Mg2+, а именно 0.75 Å [48]. В работе [28] было показано, что разное влияние двухвалентных ионов металлов на толщину фосфолипидных мембран также обусловлено и индивидуальными особенностями ионов при их гидратации. В нашем случае известно, что Co2+ имеет 6 молекул в первой гидратной оболочке. В то же время похожим расположением обладают молекулы воды около ионов Mg2+ (от 6 до 7) и Ca2+ (6–8) [33, 47, 49]. Более того, электрическое поле этих ионов распространяется за пределы первой гидратной оболочки, поляризуя молекулы воды во второй оболочке и модифицируя сеть водородных связей. Поэтому расположение молекул воды для этих катионов во второй гидратной оболочке различными методами определяется в следующем виде [47–49]: от 1 до 6 молекул воды для Ca2+, 7 (12) для Mg2+ и 5.7 (9.6) для Co2+.
Из изложенного выше следует, что катионы Co2+ при гидратации по физическим свойствам принципиально не отличаются, например, от ионов Mg2+, и занимают некоторое “промежуточное” положение по своим параметрам между Mg2+ и Ca2+. Однако, вместе с тем важным является тот факт, что кобальт является переходным металлом, имея на внешней оболочке 7 d-электронов. В связи с этим Co2+ в водных растворах формирует высокоспиновые комплексы с упорядоченным октаэдрическим расположением молекул воды в первой гидратной оболочке [50, 51]. Вероятно это приводит к расщеплению вырожденных электронных состояний и появлению новых состояний не только с большей энергией, но и с меньшей, приводящей к увеличению стабильности иона в поле молекул воды, что может затруднять связывание ионов Co2+ с головой фосфолипидов, в частности, с отрицательно заряженными группами PO4 и CO2, которые обладают вакантными высокоэнергетическими орбиталями [18]. Такая специфичность связывания тесно коррелирует с локализацией ионов около отдельных атомных групп головы фосфолипида в мембране, во многом зависящей и от концентрации ионов в растворе.
В заключение отметим, что на основе такого рассмотрения взаимодействий ионов с молекулами воды, а также полученных экспериментальных результатов в этой работе становится очевидна различная специфичность связывания и локализация ионов Ca2+, Mg2+ и Co2+ в головных группах фосфолипидов ДМФХ. При этом подчеркнем, что различия в локализации ионов и вызванные ими изменения толщины мембран могут вместе или по отдельности влиять на конформации и функции различных мембранных белков и пептидов, обладающих зарядом.
ЗАКЛЮЧЕНИЕ
С помощью малоуглового рассеяния нейтронов показано, что катионы Ca2+ и Mg2+ вызывают схожие структурные изменения в мембранах ДМФХ путем конформационных изменений головных групп и формированием ионных мостиков на всeм диапазоне исследуемых концентраций ионов. В диапазоне концентраций 1–30 мМ происходит реорганизация фосфолипидных молекул в мембране с наклоном гидрофобных хвостов. Однако в случае катионов Co2+ все эти изменения выражены крайне слабо, что может объясняться местами связывания Co2+, отличными от Ca2+ и Mg2+. Также показано, что модель электростатического взаимодействия, ранее развитая для систем ДПФХ (ДМФХ) + Ca2+, может быть расширена и на системы ДМФХ + Mg2+.
Установлено, что на структурные изменения мембраны, индуцируемыe катионами Ca2+ и Mg2+, также влияет и термодинамическая фаза липидных систем ДМФХ. В гель-фазе происходят выраженные конформационные изменения головных групп фосфолипидов (изменение толщины на 1/3 больше, чем в ЖК-фазе). С другой стороны, уменьшение толщины мембраны, связанное с наклоном фосфолипидов в бислое в диапазоне 1–30 мМ, проявляется слабее по сравнению с ЖК-фазой.
БЛАГОДАРНОСТЬ
Исследование выполнено при поддержке гранта Российского научного фонда (проект № 19-72-20186).
Список литературы
Pabst G., Kučerka N., Nieh M.-P., Rheinstädter M.C., Katsaras J. // Chemistry and Physics of Lipids. 2010. V. 163. P. 460.https://doi.org/10.1016/j.chemphyslip.2010.03.010
Alberts B., Johnson A., Lewis J., Morgan D., Raff M., Roberts K., Walter P. Molecular Biology of the Cell. 6th edition. Garland Science, 2015. 1465 p.
Lo Nostro P., Ninham B.W. // Chem. Rev. 2012. V. 112. P. 2286.https://doi.org/10.1021/cr200271j
Tatulian S.A. // Eur. J. Biochem. 1987. V. 170. P. 413.https://doi.org/10.1111/j.1432-1033.1987.tb13715.x
Kučerka N., Papp-Szabo E., Nieh M.-P., Harroun T.A., Schooling S.R., Pencer J., Nicholson E.A., Beveridge T.J., Katsaras J. // J. Phys. Chem. B. 2008. V. 112. P. 8057.https://doi.org/10.1021/jp8027963
Beto J.A. // Clinical Nutrition Research. 2015. V. 4. P. 1.https://doi.org/10.7762/cnr.2015.4.1.1
Gröber U., Schmidt J., Kisters K. // Nutrients. 2015. V. 7. P. 8199.https://doi.org/10.3390/nu7095388
Bánfalvi G., Heavy Metals, Trace Elements and Their Cellular Effects, in Cellular Effects of Heavy Metals / Ed. Bánfalvi G. Springer Netherlands, 2011. P. 3. https://doi.org/10.1007/978-94-007-0428-2_1
Petrache H.I., Zemb T., Belloni L., Parsegian V.A. // Proc. Natl. Acad. Sci. U.S.A. 2006. V. 103. P. 7982.https://doi.org/10.1073/pnas.0509967103
Lis L.J., Lis W.T., Parsegian V.A., Rand R.P. // Biochemistry. 1981. V. 20. P. 1771.https://doi.org/10.1021/bi00510a010
Sinn C.G, Antonietti M., Dimova R. // Colloids and Surfaces A: Physicochem. Eng. Aspects. 2006. V. 282. P. 410.https://doi.org/10.1016/j.colsurfa.2005.10.014
Lee A. // Biochimica et Biophysica Acta. 2004. V. 1666. P. 62.https://doi.org/10.1016/j.bbamem.2004.05.012
Kučerka N., Nieh M.-P., Pencer J., Sachs J.N., Katsaras J. // Gen. Physiol. Biophys. 2009. V. 28. P. 117.https://doi.org/10.4149/gpb_2009_02_117
Uhríková D., Kučerka N., Teixeira J., Gordeliy V., Balgavý P. // Chemistry and Physics of Lipids. 2008. V. 155. P. 80.https://doi.org/10.1016/j.chemphyslip.2008.07.010
Kučerka N., Pencer J., Sachs J.N., Nagle J.F., Katsaras J. // Langmuir. 2007. V. 23. P. 1292.https://doi.org/10.1021/la062455t
Kuklin A.I., Soloviev D.V., Rogachev A.V., Utrobin P.K., Kovalev Y.S., Balasoiu M., Ivankov O.I., Sirotin A.P., Murugova T.N., Petukhova T.B., Gorshkova Y.E., Erhan R.V., Kutuzov S.A., Soloviev A.G., Gordelii V.I. // J. Physics: Conference Series. 2011. V. 291. P. 7.https://doi.org/10.1088/1742-6596/291/1/012013
Kuklin A.I., Rogov A.D., Gorshkova Y.E., Utrobin P.K., Kovalev Y.S., Rogachev A.V., Ivankov O.I., Kutuzov S.A., Soloviov D.V., Gordeliy V.I. // Physics of Particles and Nuclei Letters. 2011. V. 8. P. 119.https://doi.org/10.1134/S1547477111020075
Soloviev A.G., Solovjeva T.M., Ivankov O.I., Soloviov D.V., Rogachev A.V., Kuklin A.I. // J. Physics: Conference Series. 2017. V. 848. P. 7.https://doi.org/10.1088/1742-6596/848/1/012020
Feigin L.A., Svergun D.I. Structure Analysis by Small-Angle X-Ray and Neutron Scattering. Springer US, 1987. 335 p. https://doi.org/10.1007/978-1-4757-6624-0
Киселев М.А., Ломбарде Д., Киселев А.М., Лези П., Аксенов В.Л. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2003. № 11. С. 24.
Kučerka N., Kiselev M.A., Balgavý P. // Eur. Biophys. J. 2004. V. 33. P. 328.https://doi.org/10.1007/s00249-003-0349-0
Guinier A., Fournet G. Small-Angle Scattering of X-Rays. John Wiley and Sons, N.Y., 1955. 268 p.
SasView (2020) Sas View for Small Angle Scattering Analysis. https://www.sasview.org/. Cited 25 May 2020.
Горшкова Ю.Е. Структура и взаимодействие липидных мембран в присутствии ионов кальция и полярных молекул по данным малоуглового рассеяния: Дис. … канд. физ.-мат. наук: 01.04.07. Дубна: ОИЯИ, 2017. 139 с.
Nagle J.F., Tristram-Nagle S. // Biochimica et Biophysica Acta. 2000. V. 1469. P. 159.https://doi.org/10.1016/S0304-4157(00)00016-2
Nagle J.F., Wilkinson D.A. // Biophysical Journal. 1978. V. 23. P. 159.https://doi.org/10.1016/S0006-3495(78)85441-1
Kučerka N., Tristram-Nagle S., Nagle J.F. // J. Membrane Biol. 2005. V. 208. P. 193.https://doi.org/10.1007/s00232-005-7006-8
Kučerka N., Dushanov E., Kholmurodov K.T., Katsaras J., Uhríková D. // Langmuir. 2017. V. 33. P. 3134.https://doi.org/10.1021/acs.langmuir.6b03228
Seelig J. // Cell Biology International Reports. 1990. V. 14. P. 353.https://doi.org/10.1016/0309-1651(90)91204-H
Izumitani Y. // J. Colloid Interface Sci. 1994. V. 166. P. 143.https://doi.org/10.1006/jcis.1994.1281
Huster D., Paasche G., Dietrich U., Zschörnig O., Gutberlet T., Gawrisch K., Arnold K. // Biophysical Journal. 1999. V. 77. P. 879.https://doi.org/10.1016/S0006-3495(99)76939-0
Zidovetzki R., Atiya A.W., De Boeck H. // Membrane Biochemistry. 1989. V. 8. P. 177.https://doi.org/10.3109/09687688909025830
Binder H., Zschörnig O. // Chemistry and Physics of Lipids. 2002. V. 115. P. 39.https://doi.org/10.1016/S0009-3084(02)00005-1
Le C.T.M., Houri A., Balage N., Smith B.J., Mechler A. // Frontiers in Materials. 2019. V. 5. P. 1.https://doi.org/10.3389/fmats.2018.00080
Kanti De S., Kanwa N., Ahamed M., Chakraborty A. // Phys. Chem. Chem. Phys. V. 20. P. 14 796.https://doi.org/10.1039/c8cp01774c
Yang J., Calero C., Bonomi M., Martí J. // J. Chem. Theory Comput. 2015. V. 11. P. 4495.https://doi.org/10.1021/acs.jctc.5b00540
Javanainen M., Melcrová A., Magarkar A., Jurkiewicz P., Hof M., Jungwirth P., Martinez-Seara H. // Chem. Commun. 2017. V. 53. P. 5380.https://doi.org/10.1039/c7cc02208e
Scomparin C., Lecuyer S., Ferreira M., Charitat T., Tinland B. // Eur. Phys. J. E. 2009. V. 28. P. 211.https://doi.org/10.1140/epje/i2008-10407-3
Stern H.A., Feller S.E. // J. Chemical Physics. 2003. V. 118. P. 3401.https://doi.org/10.1063/1.1537244
Moore J.M. Physical Chemistry. 4th edition. Prentice-Hall, Englewood Cliffs, NJ, 1972. 859 p.
Satoh K. // Biochimica et Biophysica Acta. 1995. V. 1239. P. 239.https://doi.org/10.1016/0005-2736(95)00154-U
Altenbach C., Seelig J. // Biochemistry. 1984. V. 23. P. 3913.https://doi.org/10.1021/bi00312a019
Chibowski E., Szcześ A. // Adsorption. 2016. V. 22. P. 755.https://doi.org/10.1007/s10450-016-9767-z
McLaughlin A., Grathwohl C., McLaughlin S. // Biochimica et Biophysica Acta. 1978. V. 513. P. 338.https://doi.org/10.1016/0005-2736(78)90203-1
Umbsaar J., Kerek E., Prenner E.J. // Chem. Phys. Lipids. 2018. V. 210. P. 28.https://doi.org/10.1016/j.chemphyslip.2017.11.016
Eriksson E. Principles and Applications of Hydrochemistry. Springer Netherlands, 1985. 188 p.https://doi.org/10.1007/978-94-009-4836-5
David F., Vokhmin V., Ionova G. // J. Molecular Liquids. 2001. V. 90. P. 45.https://doi.org/10.1016/S0167-7322(01)00106-4
Marcus Y. // J. Chem. Soc. Faraday Trans. 1991. V. 87. P. 2995.https://doi.org/10.1039/FT9918702995
Ohtaki H., Radnai T. // Chem. Rev. 1993. V. 93. P. 1157.https://doi.org/10.1021/cr00019a014
Ohtaki H., Yamatera H. Structure and Dynamics of Solutions. Elsevier: Science &Technology, Oxford, United Kingdom, 1992. 350 p.
Bertini I., Luchinat C., Parigi G., Ravera E. NMR of Paramagnetic Molecules: Applications to Metallobiomolecules and Models. 2nd Edition. Elsiever, 2016. 508 p.
Crichton R. Biological Inorganic Chemistry: a New Introduction to Molecular Structure and Function. 3rd edition. Elsevier, 2018. 669 p.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


