Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 8, стр. 51-56
Перспективы использования связующего агента для улучшения адгезии биоактивного покрытия на поверхностях различной природы
Е. А. Богданова a, *, В. М. Скачков a, К. В. Нефедова a
a Институт химии твердого тела Уральского отделения РАН,
Лаборатория химии гетерогенных процессов
620990 Екатеринбург, Россия
* E-mail: chemi4@rambler.ru
Поступила в редакцию 02.11.2020
После доработки 14.01.2021
Принята к публикации 20.01.2021
Аннотация
Проведен цикл работ по нанесению биологически активного покрытия (гидроксиапатит, фторапатит) на матрицы различной природы и пористости (пористые и компактные титан и никель, стекло, керамика). Изучена возможность использования коллоидной суспензии гидроксиапатита и водной суспензии кристаллического апатита в сочетании с желатином качестве биоактивного материала. Подобран качественный и количественный состав материала покрытия, пригодного для нанесения. Методом растровой электронной микроскопии изучена морфология поверхности покрытий. Методом центробежного отрыва определена адгезионная прочность покрытий. Показано, что использование порошка гидроксиапатита/фторапатита в сочетании с желатином в качестве биоактивного покрытия способствует образованию равномерной развитой поверхности не только на пористых, но и на гладких, в том числе стеклянных подложках, позволяет существенно сократить сроки формирования покрытия и значительно повысить его адгезионную прочность.
ВВЕДЕНИЕ
В обзоре [1] показаны перспективы применения гидроксиапатита (ГАП)/фторапатита (ФАП) в качестве материала для костной пластики. Имплантаты из титана и его сплавов относительно давно используются в медицинской практике [2]. В настоящее время актуальным направлением исследований является разработка биологически совместимых имплантатов, сочетающих остеотропность ГАП с механической прочностью и коррозионной стойкостью титана. Но, как известно, при соединении разнородных материалов возникает проблема адгезии. Частично решить эту проблему удается за счет использования пористых материалов [3], что дает свои преимущества. Так, например, при условии сквозной пористости имплантат активно взаимодействует с окружающими тканями, что сокращает время его вживления в организм [4]. Однако применение имплантатов из пористого титана не всегда возможно.
Для нанесения ГАП на твердые поверхности используют различные методы распыления [5, 6]. При выборе метода необходимо учитывать негативное влияние высоких температур на ГАП, так как высокотемпературная обработка (800–1000°С) способствует увеличению степени его кристалличности и переходу в менее растворимую форму по сравнению с минеральной составляющей кости, а дальнейшее повышение температуры ведет к разложению ГАП на трикальций фосфат [6–8]. Отказаться от высоких температур и громоздкой аппаратуры при получении надежных покрытий почти на любой, в том числе гладкой поверхности, а также улучшить свойства биоматериалов на основе ГАП возможно за счет добавления связующего вещества, в частности желатина, частично гидролизованного белка коллагена. Связанный с желатином ГАП является биологически активным материалом, необходимым для роста и обеспечения сохранности костей, применяемым в медицине, в качестве естественного стимулятора образования костной ткани [9].
Целью данной работы было получение конструкционных материалов, представляющих собой металлическую матрицу с нанесенным на нее биоактивным покрытием; оценка возможности использования коллоидной суспензии гидроксиапатита и водной суспензии кристаллического апатита в сочетании с желатином в качестве материала покрытия.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве металлической основы использовались: титан пористый (45%), пластины из титана марки ВТ1-0 (ГОСТ 19 807-91 Титан и сплавы титановые деформируемые марки (Пористый никель (40 и 95%)), пластины из никеля марки Н-3 (ГОСТ 849-2008 Никель первичный); неметаллические материалы: пластина из глинозема (алунд) (ГОСТ 28 390-89 Изделия фарфоровые), стекло (ГОСТ 111-2014 Стекло листовое бесцветное).
В качестве компонентов биоактивного покрытия использовали ∼5–10%-коллоидную суспензию ГАП [10], кристаллические ГАП состава Ca10(PO4)6(OH)2 и ФАП состава Ca10(PO4)6F2, полученные высушиванием на воздухе коллоидных суспензий, синтезированных методом осаждения из растворов [10, 11]. Связующим веществом служил желатин пищевой (ГОСТ 11 293-89).
Исследуемый в работе материал покрытия (суспензия ГАП/ФАП-желатин) получали следующим образом. Пищевой желатин (1 грамм) заливали расчетным количеством дистиллированной воды (20 мл), выдерживали 15 мин для набухания и грели на водяной бане при 60–80°С при перемешивании до полного растворения желатина. Затем в теплый раствор при постоянном перемешивании вводили коллоидный ГАП либо порошок ГАП/ФАП, предварительно измельченный в мельнице до крупности частиц ≤10 мкм, доводя суспензию до нужной консистенции.
Нанесение биоактивного слоя производилось простым однократным смачиванием основы (металлической, керамической и др.) в подготовленной суспензии. Предварительно матрицы обезжиривались этиловым спиртом. Сушку образцов проводили на воздухе при температуре 50–75°С, чтобы предотвратить разложение желатина, протекающее при температурах выше 100°С. В процессе высыхания происходило связывание апатита коллагеном, находящемся в желатине, и на поверхности матрицы формировался ровный, гладкий слой биоактивного покрытия (ГАП/ФАП, пропитанного коллагеном), максимально соответствующего костной ткани.
Для оценки степени влияния связующего компонента на функциональные характеристики материала были проведены сравнительные испытания суспензии ГАП−желатин и ранее разработанного авторами покрытия на основе кристаллической суспензии ГАП [12].
Морфологию поверхности исследуемых образцов исследовали методом растровой электронной микроскопии (РЭМ), при этом использовался сканирующий электронный микроскоп JSM–6390 LA фирмы JEOL (увеличение варьировали от ×5 до 300 000, разрешение составляло 3.0 нм при 30 кВ). Поверхностные характеристики оценивали методом Брунауэра, Эммета и Тейлора (низкотемпературной адсорбции азота с помощью автоматического анализатора площади поверхности и пористости Gemini VII 2390 V1.03 (V1.03t, Micromeritics) при Т = 200°С в течение одного часа. Прочность сцепления биоактивного покрытия с основой определяли методом центробежного отрыва [13] на центрифуге CM-6M, ELMI; центростремительное ускорение составляло 500 м/c2. Адгезионную прочность Р покрытий на матрицах различной природы (титан, никель, керамика, стекло) и пористости рассчитывали в соответствии с формулой:
где m − масса покрытия, кг; ω − угловая скорость вращения в момент разрыва, с–1; r – расстояние от центра масс до оси вращения центрифуги, м; S – площадь контакта покрытия и подложки, м2.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Проведенные исследования позволили определить оптимальное соотношение раствор желатина : апатит = 1 : 0.5–1.2 (содержание ГАП/ФАП ~35–55 масc. %), позволяющее получить однородную пластичную суспензию, пригодную для формирования покрытия. При уменьшении содержания фазы апатита (соотношение раствор желатина: апатит составляет менее 1 : 0.5) суспензия становится чрезмерно разбавленной, что повышает вероятность не полного покрытия поверхности матрицы. При увеличении содержания кристаллической фазы (соотношение раствор желатина : апатит составляет более 1 : 1.2) не удается получить однородную суспензию, поскольку в ней сохраняются несмоченные раствором желатина частицы апатита.
Широкий концентрационный интервал ГАП/ ФАП позволяет использовать суспензию апатит–желатин (при содержании фазы апатита ≤35 масc. %) для получения тонких пленок с размером пор 100–400 мкм (рис. 1а), покрытий на поверхности компактных и пористых материалов (рис. 1б, табл. 1) и для формирования бескаркасных биодеградируемых структур (таблеток, гранул) из с суспензии с повышенной пластичностью (содержание ГАП/ФАП ~50–55 масc. %).
Рис. 1.
Морфология поверхности пленки ГАП–желатин с открытой пористостью (а) и поверхности покрытия ГАП–желатин, нанесенного на пористый титан (45%) однократным смачиванием (б).

Таблица 1.
Результаты обработки поверхности различных материалов водно-желатиновой суспензией порошка ГАП (температура при сушке 50–75°С)
| Материал основы | Характеристики покрытия | |||
|---|---|---|---|---|
| ωГАП,маcс. % | адгезия, МПа | ∆m при высыхании, % | HV, МПа | |
| Титан пористый (45%) | 35 | 1122 | 60.7 | 22 |
| Никель пористый (40%) | 40 | 1089 | 48.2 | 19 |
| Пластина титана | 45 | 606 | 42.9 | 10 |
| Пластина никеля | 45 | 991 | 42.5 | 11 |
| Керамика | 50 | 1323 | 43.2 | 12 |
| Стекло | 55 | 1221 | 42.1 | 14 |
Следует отметить, что при использовании ∼5–10%-коллоидного ГАП в качестве компонента суспензии желатин–ГАП (в любых соотношениях) не удалось получить, пластичный однородный материал, пригодный для формирования покрытия.
Приведенные в табл. 1 данные по обработке матриц различной природы водно-желатиновой суспензией порошка ГАП указывают на хорошую адгезию покрытия вне зависимости от природы и пористости матрицы. Пористость в данном случае определяет количество нанесенного биоматериала, поскольку пористые матрицы “втягивают” внутрь основную часть суспензии. Выравнивание рельефа поверхности за счет заполнения порового пространства биоматериалом и утончения его слоя на ребрах ячеек приводит к увеличению микротвердости покрытия. Микротвердость покрытия на гладких компактных поверхностях возможно увеличить за счет повышения содержания ГАП в составе суспензии (табл. 1). Технологическая простота способа нанесения и возможность сформировать равномерное покрытие толщиной 150–300 мкм (рис. 2а) даже за счет однократной обработки поверхности не только на пористых, но и на гладких компактных подложках выгодно отличает суспензию желатин–ГАП от ранее разработанных материалов покрытий [12, 14] (рис. 2б, табл. 2). Незначительная пористость и дефекты образовавшегося покрытия ГАП–желатин (при необходимости) устраняются повторным нанесением суспензии.
Рис. 2.
Морфология поверхности покрытия, нанесенного на компактную титановую пластину: срез покрытия ГАП–желатин (а) и ГАП-покрытие, нанесенное согласно [14] (б).

Таблица 2.
Результаты нанесения ГАП-покрытия [14] и суспензии ГАП–желатин на титановую пластину
| Материал покрытия | Стадия обработки | mисх, г | mконечн, г | ∆m, г | ∆m, % | Σ∆m, г | Σ∆m, % |
|---|---|---|---|---|---|---|---|
| ГАП-покрытие [14] | 1 | 1.61225 | 1.61415 | 0.00190 | 0.12 | 0.00190 | 0.12 |
| 2 | 1.61415 | 1.61645 | 0.00230 | 0.14 | 0.00420 | 0.26 | |
| 3 | 1.61645 | 1.61715 | 0.00070 | 0.04 | 0.00490 | 0.30 | |
| 4 | 1.61715 | 1.61600 | –0.00115 | 0.07 | 0.00375 | 0.23 | |
| 5 | 1.61600 | 1.61760 | 0.00160 | 0.10 | 0.00535 | 0.33 | |
| ГАП–желатин | 1 | 0.61900 | 0.81220 | 0.19320 | 31.21 | 0.19320 | 31.21 |
| 2 | 0.81220 | 1.56545 | 0.75325 | 92.74 | 0.94645 | 152.90 |
Результаты проведенных сравнительных испытаний суспензии ГАП−желатин и ранее разработанного авторами покрытия на основе кристаллической суспензии ГАП [12], нанесенных на подложки из пористого титана (45%) и пористого никеля (95%), показали, что использование желатина в качестве связующего агента позволяет существенно сократить сроки формирования покрытия (табл. 3). Анализ данных РЭМ (рис. 3) позволяет сделать вывод о том, что при нанесении на подложку суспензии ГАП–желатин благодаря большей пластичности материала вследствие присутствия связующего агента, удается сформировать более однородное и равномерное покрытие по сравнению с ГАП-покрытием [12].
Таблица 3.
Результаты нанесения ГАП-покрытия [12] и суспензии ГАП–желатин на пористые металлические матрицы
| Материал покрытия | № стадии | mисх, г | mконечн, г | ∆m, г | ∆m, % | Σ∆m, г | Σ∆m, % |
|---|---|---|---|---|---|---|---|
| Никель пористый (95%) | |||||||
| ГАП-покрытие [12] | 1 | 0.38645 | 0.76300 | 0.37655 | 97.44 | 0.37655 | 97.44 |
| 2 | 0.76300 | 0.83100 | 0.06800 | 8.91 | 0.44455 | 115.03 | |
| 3 | 0.83100 | 0.86400 | 0.03300 | 3.97 | 0.47755 | 123.57 | |
| 4 | 0.86400 | 0.87180 | 0.00780 | 0.90 | 0.48535 | 125.59 | |
| ГАП–желатин | 1 | 0.39600 | 0.49945 | 0.10345 | 26.12 | 0.10345 | 26.12 |
| 2 | 0.49945 | 0.82945 | 0.33000 | 66.07 | 0.43345 | 109.46 | |
| 3 | 0.82945 | 0.92845 | 0.09900 | 11.94 | 0.53245 | 134.46 | |
| 4 | 0.92845 | 1.48300 | 0.55455 | 59.73 | 1.08700 | 274.49 | |
| Титан пористый (45%) | |||||||
| ГАП-покрытие [12] | 1 | 0.14500 | 0.16760 | 0.02260 | 15.57 | 0.02260 | 15.57 |
| 2 | 0.16760 | 0.17255 | 0.00495 | 2.95 | 0.02755 | 19.00 | |
| 3 | 0.17255 | − | − | − | − | − | |
| 4 | 0.17255 | 0.17500 | 0.00245 | 1.42 | 0.03000 | 20.67 | |
| ГАП–желатин | 1 | 0.53855 | 0.60440 | 0.06585 | 12.28 | 0.06585 | 12.28 |
| 2 | 0.60440 | 0.96060 | 0.35620 | 58.93 | 0.42205 | 78.36 | |
| 3 | 0.96060 | 1.34400 | 0.38340 | 39.91 | 0.80545 | 149.56 | |
| 4 | 1.34400 | 1.99200 | 0.57800 | 43.01 | 1.38345 | 256.88 | |
Рис. 3.
Морфология поверхности пористого никеля: а − исходный Ni (95%); б − Ni (95%) с нанесенным покрытием на основе водной суспензии порошка ГАП [12]; в − Ni (95%) с нанесенным покрытием ГАП–желатин.

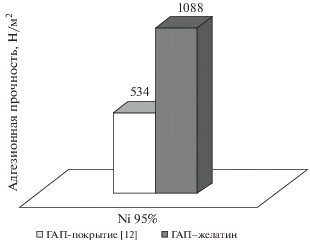
Образование более развитой поверхности при использовании в качестве материала покрытия суспензии, в состав которой входит желатин, также подтверждено методом БЭТ (табл. 4). Результаты сравнительной оценки прочностных характеристик материала свидетельствуют о том, что введение связующего агента в состав покрытия позволяет значительно повысить его адгезионную прочность (рис. 4).
Таблица 4.
Характеристики поверхности пористого титана (45%) с нанесенным ГАП-покрытием [12] и суспензией ГАП–желатин
| Исследуемый образец | Характеристика поверхности | ||
|---|---|---|---|
| Sуд, м2/г | Sпор, м2/г | Vпор, см3/г | |
| Пористый титан (45), исходный | 0.3256 ± 0.0453 | 1.3652 | 0.000783 |
| ГАП-покрытие [12] | 22.6126 ± 0.0252 | − | − |
| ГАП−желатин | 85.3228 ± 0.6884 | 6.4569 | 0.003670 |
Рис. 4.
Адгезионная прочность покрытия на основе водной суспензии порошка ГАП [12] и суспензии ГАП–желатин, нанесенных на пористый никель (95%).
ЗАКЛЮЧЕНИЕ
Проведены исследования по подбору качественного и количественного состава материала покрытия, пригодного для нанесения на матрицы различной природы и пористости. В результате работы были получены композиты на основе пористых титана и никеля, пластин титана и никеля, стекла и керамики с покрытием, сформированным из водно-желатиновой суспензии порошка ГАП (содержание ГАП/ФАП ~35–55 маcс. %).
Показано, что введение связующего агента (желатин) позволяет существенно сократить сроки формирования покрытия, значительно повышает его адгезионную прочность и способствует образованию равномерной развитой поверхности не только на пористых, но и на гладких, в том числе стеклянных подложках.
Регулируя содержание ГАП в суспензии, можно наряду с покрытиями и тонкими пленками, получать бескаркасные биодеградируемые структуры из суспензий с повышенной пластичностью.
Полученные данные позволяют рекомендовать применение суспензии ГАП–желатин для получения покрытия образцов медицинского назначения [15 ] .
Список литературы
Панкратов А.С., Фадеева И.С., Минайчев В.В. и др. // Гены и клетки. 2018. Т. 13. № 3. С. 46.
Гарафутдинова М.А., Астахов М.В., Колобов Ю.Р. и др. // Материаловедение. 2013. № 12. С. 44.
Богданова Е.А., Широкова А.Г., Скачков В.М., Сабирзянов Н.А. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2019. № 3. С. 97. https://doi.org/10.1134/S0207352819030028
Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2006. 204 с.
Лясникова А.В., Дударева О.А., Лясников В.Н. и др. // Стекло и керамика. 2018. № 4. С. 42.
Мамаева А.А., Кенжегулов А.К., Паничкин А.В. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 3. С. 287.
Богданова Е.А., Сабирзянов Н.А. // Материаловедение. 2015. № 1. С. 52.
Добровольская И.П., Царев Н.С., Осмоловская О.М. и др. // Журн. прикладной химии. 2018. Т. 91. № 3. С. 328.
Патент 2 692 578 (РФ). Имплантат для регенерации костной ткани и способ его получения / Московский государственный университет имени М.В. Ломоносова. Архипова А.Ю., Рамонова А.А., Мойсенович М.М., Карачевцева М.А., Котлярова М.С., Мойсенович А.М., Агапов И.И. // Б.И. 2019. № 18. С. 15.
Патент 2406693 (РФ). Способ получения суспензии гидроксиапатита / Институт химии твердого тела УрО РАН. Сабирзянов Н.А., Богданова Е.А., Хонина Т.Г. // Б.И. 2010. № 35. С. 5.
Патент 2 652 193 (РФ). Способ получения суспензии апатита / Институт химии твердого тела УрО РАН. Богданова Е.А., Сабирзянов Н.А., Скачков В.М. // Б.И. 2018. № 12. С. 4.
Патент № 2687737 (РФ). Способ получения биомедицинского материала / Институт химии твердого тела УрО РАН. Богданова Е.А., Скачков В.М., Сабирзянов Н.А., Широкова А.Г. // Б.И. 2019. № 14. С. 10.
Лунев В.М., Немашкало О.В. // ФIП ФИП PSE. 2010. Т. 8. № 1. С. 64.
Патент 2 599 039 (РФ). Способ получения биомедицинского материала / Институт химии твердого тела УрО РАН. Широкова А.Г., Богданова Е.А., Скачков В.М., Борисов С.В., Сабирзянов Н.А. // Б.И. 2016. № 28. С. 7.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


