Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 9, стр. 86-91
Коррозионное поведение сплавов никель–рений в концентрированных кислотах
В. В. Паршутин a, М. В. Герасимов b, *, Н. Л. Богдашкина b
a Институт прикладной физики
MD-2028 Кишинeв, Молдова
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: mvger2018@yandex.ru
Поступила в редакцию 22.01.2021
После доработки 20.02.2021
Принята к публикации 25.02.2021
Аннотация
В работе изучалось коррозионное поведение никеля, рения и их сплавов в концентрированных неокислительной и окислительной кислотах. Предложен механизм коррозионного растворения сплавов никель–рений в концентрированных соляной и азотной кислотах. На основании рентгеновских исследований установлено избирательное растворение никеля с поверхности сплавов никель-рений. Травление идет преимущественно с определeнных граней, особенно по плоскости [111]. Введение рения в никель в количестве 5, 10 и 20 вес. % неоднозначно влияет на скорость коррозии всего сплава: в зависимости от соотношения никеля и рения в сплаве может как уменьшаться, так и увеличиваться скорость коррозии сплава в неокислительной и окислительной кислотах. Сплав с 20%-ным содержанием рения является “граничным” в концентрированной соляной кислоте с точки зрения достижения необходимой концентрации рения на поверхности и уменьшения скорости растворения сплавов. В концентрированной азотной кислоте и царской водке повышение концентрации рения в сплаве выше 10% является нецелесообразным, т. к. скорость коррозии существенно возрастает. Установлена повышенная скорость растворения сплавов в азотной кислоте по сравнению с соляной.
ВВЕДЕНИЕ
Рений известен как жаростойкий металл, температура плавления которого составляет 3186°С против 1455°С для никеля. Рений часто вводят в сплавы для повышения их жаростойкости. Сплавы никель–рений также используются в технике благодаря механическим свойствам [1].
Рений обладает высокой коррозионной стойкостью в ряде агрессивных коррозионно-активных сред, например, кислотах, в том числе концентрированных. Рений стоек также и при анодной поляризации и в отличие от титана может быть использован в качестве покрытия анодов при катодной защите трубопроводов [2].
Рений является достаточно электроположительным металлом (потенциал реакции Re → → Re3+ + 3ē для кислых сред соответствует +0.25 В). По своей термодинамической стабильности рений стоит на девятом месте после Au, Pt, Ir, Pd, Bh, Ag, Hg и Сu. Согласно данной классификации, рений входит в группу металлов промежуточной термодинамической стабильности полублагородных металлов. Данная группа отличается тем, что входящие в нее металлы термодинамически стабильны в кислых и нейтральных средах только в отсутствие кислорода или других окислителей. Рений может также пассивироваться за счет образования на его поверхности оксида ReО2.
Никель является также цветным металлом и обладает высокой коррозионной стойкостью в ряде кислых сред [3], не говоря уже о нейтральных и щелочных [4]. Его часто вводят в виде легирующей добавки в сплавы для повышения их коррозионной стойкости. Согласно диаграмме Пурбе [5], никель в рассматриваемых кислотах должен растворяться по реакции Ni → Ni2+ + 2ē, потенциал которой равен –0.25 В [6].
Рений является более электроположительным металлом в паре рений–никель и при коррозии сплавов никель–рений области, обогащенные рением, должны служить катодом по отношению к никель обогащенным областям. Поверхность должна обогащаться рением в результате избирательного растворения никеля.
Следует отметить, коррозионная стойкость чистого никеля, как правило, уступает таковой для рения. При этом цена рения значительно превосходит стоимость никеля. Сплавы никеля с рением могут представлять практический интерес ввиду снижения их стоимости за счет никеля для условий, где возможно использование данных сплавов в отличие от дорогостоящего рения. С другой стороны, никель повышает пластичность рения и, соответственно облегчает обрабатываемость изделий из сплавов никель–рений.
Практическое использование сплавы никель-рений получили как материал для лопаток газотурбинных двигателей [7, 8]. В ряде случаев может представлять практический интерес коррозионная стойкость сплавов никель–рений в сильнокислых коррозионно-активных средах, например, при переработке отходов, содержащих никель и рений [9].
С другой стороны, сплавы никеля и рения могут быть получены в виде покрытий на поверхности металлов и сплавов [10].
В работах [11, 12] предложено использовать осаждeнные гальваническим способом сплавы никель–рений как катоды для производства водорода. Показана высокая эффективность таких электродов.
В работе рассмотрена коррозионная стойкость сплавов никель–рений, содержащих 5, 10 и 20 вес. % рения, а также чистых никеля и рения в концентрированных соляной и азотной кислотах при комнатной температуре.
В цель работы входило установление взаимосвязь скорости и механизма коррозии сплавов никель–рений с разным содержанием рения (5, 10 и 20%) в сильноагрессивных концентрированных соляной и азотной кислотах.
МЕТОДИКА
Для изготовления сплавов был использован порошковый рений чистотой 99.9%, дополнительно очищенный от легкоплавких и газообразных примесей плавкой в вакуумной дуговой печи [13], а также электролитический никель марки НЭ чистотой 99.9%, переплавленный в вакуумной дуговой печи. Все сплавы были изготовлены методом плавления в электродуговой печи с не расходуемым вольфрамовым электродом на медном водоохлаждаемом поду в атмосфере очищенного гелия при остаточном давлении 200–300 мм рт. ст. Сплавы получены с использованием предварительно выплавленных лигатур. Каждый слиток переплавляли 3–4 раза, достигая равномерного состава по всему сечению. Однородность контролировали микроструктурным анализом и измерением твердости сплавов. Затем слитки отжигали при температуре 1000°С в течение двух часов и прокатывали вхолодную с промежуточными отжигами при той же температуре. Время выдержки составляло 15 мин.
Коррозионные испытания металлов проведены при температуре 25°С путем полного погружения образцов при доступе воздуха. Скорость коррозии рассчитана по изменению веса образцов размерами 10 × 20 × 0.2 мм.
Образцы были предварительно обработаны наждачной бумагой, выдержаны в течение суток в эксикаторе над свежепрокаленным CaCl2, а перед опытом обезжирены в ацетоне и промыты дистиллированной водой. Время выдержки составило 1 ч. Состав поверхностных пленок был определен методом рентгеноструктурного анализа на универсальных дифрактометрах HZG-4B и ДРОН-3М при излучениях CoKα и CuKα.
В статье приведены данные только для деформированных сплавов. Значения скорости коррозии отожженных сплавов будут другими.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как известно, никель образует ряд твердых растворов в интервале концентраций от 0 до 12 ат. % рения. Далее идет двухфазная область примерно от 12 до 90 ат. % рения. То есть сплавы с 5, 10 и 20 вес. % попадают в область твердых растворов. Можно заранее предположить, что существенное влияние на скорость коррозии сплавов будет оказывать селективное растворение, так как вторая фаза отсутствует и система является гомогенной. Возможно снижение скорости коррозии сплавов как из-за обогащения в результате коррозии поверхности более термодинамически стабильным компонентом и как следствие, ее “экранирование”, так и смещение потенциала коррозии в область значительно более положительных значений ввиду облегчения катодного процесса из-за накопления на поверхности “катодного” компонента. В обоих случаях таким компонентом является рений.
Как видно из рис. 1 и 2 в интервале концентраций 10–20 вес. % рения в сплаве имеются перегибы на графиках зависимости скорости коррозии от состава сплава. Так как никаких фаз при данных содержаниях рения в сплавах не образуется, то, вероятно, данные изменения могут быть связаны с существенным повышением содержания рения в сплаве, точнее с его содержанием на поверхности сплава.
Рис. 1.
Зависимость скорости коррозии сплавов никель–рений от состава в концентрированной соляной кислоте.

Рис. 2.
Зависимость скорости коррозии сплавов никель–рений от состава в концентрированной азотной кислоте.
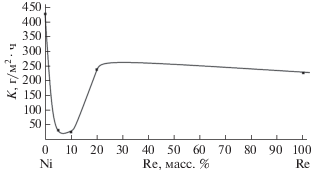
Коррозия сплавов никель–рений в концентрированной соляной кислоте при комнатной температуре в зависимости от состава имеет следующие особенности. Как видно из рис. 1, введение рения в никель в количестве 5 и 10 вес. % несколько понижает скорость коррозии с 9.45 г/м2 ⋅ ч для чистого никеля до 8 г/м2 ⋅ ч для сплавов с 5 и 10% рения. Скорость коррозии сплавов снижается незначительно, примерно на 20% по сравнению с чистым никелем. Для 5 и 10% рения скорость коррозии примерно одинакова, разница находится в пределах ошибки эксперимента. Это может быть обусловлено обогащением поверхности рением в результате избирательного растворения никеля и, как следствие, уменьшением площади поверхности, занятой никелем. По данным Томашова Н.Д. [14], введение всего лишь 0.1% Pd в титан в агрессивных кислотах высокой концентрации приводит в результате селективного растворения к заполнению палладием поверхности на 20%. Подобные процессы могут происходить и на поверхности исследуемых сплавов, например, заполнение 20% поверхности сплавов 5 и 10% никель–рений рением в результате избирательного (селективного) растворения никеля.
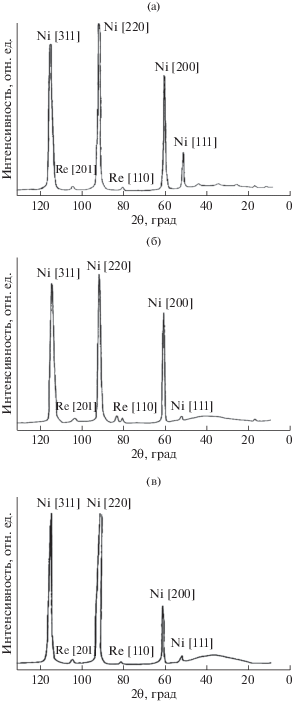
Это подтверждается результатами рентгеноструктурного анализа (рис. 3а, 3б). Так, на рентгенограммах сплава Ni–10Re заметно уменьшение интенсивности рефлексов Ni от плоскостей [311] и [200] по сравнению с нетравленым образцом и очень сильное – от плоскости [111]. Интенсивность рефлексов от плоскости [220] остается на прежнем уровне. Появляются новые рефлексы (на электронограммах также), свидетельствующие о формировании дополнительной фазы, по-видимому, гидроксилхлорида Ni2Cl(OH)3 и оксида ReO3. Появление области высокого диффузионного фона (размытый максимум с d = 2.617 Å свидетельствует об образовании аморфных фаз.
Рис. 3.
Дифрактограммы сплавов Ni–10Re до коррозии (а) и после коррозии в концентрированных HCl (б), HNO3 (в).
При повышении содержания рения до 20% происходит существенное падение скорости коррозии сплава (менее 2 г/м2 ⋅ ч) и приближение ее по значению к скорости коррозии чистого рения в данных условиях (около 1 г/м2 ⋅ ч). При этом скорость растворения сплава с 20% рения падает в пять раз по сравнению с чистым никелем и в четыре раза по сравнению со сплавами 5 и 10%.
Увеличение содержания рения до 20% в сплаве соответствует исходному (до коррозии) увеличению площади рения на поверхности. Если в сплаве с 5% рения изначально на 1 атом рения приходится 60 атомов никеля, то с 10% – 30 атомов, а в 20%-ном сплаве – уже 15. Вероятнее всего, происходит заполнение всей поверхности рением в результате избирательного растворения никеля. Об этом косвенно свидетельствуют близкие значения скоростей коррозии чистого рения и сплава никель–20% рения. Потенциал коррозии по значению должен приближаться к потенциалу коррозию чистого рения в данных условиях. Вполне возможно экранирование почти всей поверхности рением, как более термодинамически стабильным элементом в паре никель–рений, и уменьшении суммарной скорости коррозии сплава. По мнению Томашова Н.Д. и Черновой Г.П., высокая коррозионная стойкость рения обусловлена его высокой термодинамической стабильностью [15].
Данный механизм коррозии может быть подобным таковому для сплавов Ag–Au, Cu–Au, когда вся поверхность обогащается более термодинамически стабильным золотом в результате избирательного растворения менее стойкого компонента, в данном примере меди или серебра [16]. Однако, строго говоря, процесс коррозии в паре никель–рений отличается от растворения двойных сплавов с элементами с разной термодинамической стабильностью.
Отдельно следует отметить, что никель может давать окисленные формы в соляной кислоте. Так, согласно данным рентгеновского анализа, для сплава с 10% рения появляются новые рефлексы (на электронограммах также), свидетельствующие о формировании дополнительной фазы, по-видимому, гидроксилхлорида никеля Ni2Cl(OH)3. Возможно, механизм коррозии сплава с 20%-ным содержанием рения имеет определённую схожесть с коррозией ферритных сталей, покрытых карбидной сеткой в результате селективного растворения, когда потенциал коррозии сталей сильно облагораживался [17]. Вероятно, разницу в скоростях коррозии рения и сплава никель–20% рения дает растворение основы никеля через поверхностный слой, сильно обогащeнный рением.
Соляная кислота, для которой рассмотрен пример коррозии сплавов никель–рений, относится к неокислительным кислотам. В противоположность соляной кислоте азотная является сильной окислительной кислотой. Рассмотрим коррозию сплавов в концентрированной азотной кислоте. Как видно из рис. 2, значения скоростей коррозии как сплавов, так и чистых металлов существенным образом возрастают. Сплавы и чистые металлы (их составляющие) находятся в активной области растворения. На зависимости состав–скорость коррозии имеется минимум при 5–10% рения.
Особенностью азотной кислоты является то, что азот, входящий в состав ${\text{NO}}_{{\text{3}}}^{--},$ имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0.96 В, поэтому азотная кислота является очень сильным окислителем. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N5+. Следовательно, водород в отличие от соляной кислоты никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации).
Сильные окислительные свойства азотной кислоты приводят к возрастанию скорости коррозии никеля и сплавов на два порядка по сравнению с соляной кислотой (рис. 1 и 2). Значения скорости коррозии находятся в пределах от несколько сотен до десятков г/м2 ⋅ ч. Металлы (никель и рений) и их сплавы, вероятно, находятся в активной области растворения. Сначала скорость коррозии падает от 424 г/м2 ⋅ ч для чистого никеля до 33 и 27 г/м2 ⋅ ч для сплавов с 5 и 10% рения соответственно, являющихся твердыми растворами рения в никеле. Затем скорость коррозии резко возрастает до 237г/м2 ⋅ ч для сплава с 20% рения.
Данный минимум при 5 и 10% на зависимости скорость коррозии–состав сплава не может быть связан с обогащением поверхности рением. Так, скорость коррозии чистого рения в данных условиях составляет более 200 г/м2 ⋅ ч. В таких условиях рений является эффективным катодом, на котором могут протекать катодные реакции с образованием и выделением в газовую фазуNO2↑.
Независимо от активности металла реакция взаимодействия с HNO3(конц.) протекает по схеме:
(1)
$\begin{gathered} {\text{Me(Ni, Re, сплав)}} + {\text{HN}}{{{\text{O}}}_{{\text{3}}}}({\text{конц}}{\text{.}}) \to \\ \to {\text{Me(Ni, Re)N}}{{{\text{O}}}_{{\text{3}}}} + {{{\text{Н}}}_{{\text{2}}}}{\text{O}} + {\text{N}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} . \\ \end{gathered} $Скорее всего, потенциал коррозии сплавов с 5 и 10% рения сдвигается в область значительных положительных значений (по сравнению с чистым никелем), где возможно также образование окисленных форм никеля, что и приводит к снижению скорости коррозии сплавов на порядок по сравнению с чистым никелем и в семь раз по сравнению с чистым рением. При этом поверхность обогащается рением. Так, на рентгенограммах сплава Ni–10Re (рис. 3в) обнаружили заметное уменьшение интенсивности рефлексов Ni (по сравнению с нетравленым образцом) от плоскости [200] и очень сильное – от плоскости [111]. Интенсивности рефлексов от плоскостей [311] и [220] остаются без изменений. Появляется область высокого диффузионного фона (интенсивность диффузного пика выше, чем после травления в HCl), свидетельствующая о присутствии аморфных фаз. Размытый максимум имеет d = 2.897 Å. Возможно также влияние на скорость коррозии образующихся на поверхности аморфных фаз.
Скачок скорости коррозии сплава с 20% рения может быть связан со значительным увеличением содержания рения на поверхности сплава и смещением потенциала коррозии сплава к значениям, близким потенциалу коррозии чистого рения. Об этом косвенно свидетельствуют значения скоростей коррозии чистого рения и сплава с 20% рения (226 и 237 г/м2 ⋅ ч соответственно).
Как отмечено выше, в данном сплаве на 1 атом рения приходится 15 атомов никеля, и вполне возможно покрытие всей поверхности рением в результате селективного растворения. Об этом свидетельствуют данные рентгеновского анализа. Как показали рентгенограммы, происходит заметное уменьшение интенсивности рефлексов никеля от плоскостей [200] и [111] по сравнению с нетравленым образцом.
В данном случае проявляется определенное сходство для сплава с 20% рения с коррозией в соляной кислоте. Также происходит обогащение поверхности рением, но в отличие от коррозии в соляной кислоте, где сплав пассивируется, в азотной кислоте данный сплав растворяется активно, о чем свидетельствуют значения скоростей коррозии.
Очень высокая скорость растворения чистого рения в данных условиях (226 г/м2 · ч), вероятно, обусловлена образованием на его поверхности окислов высшей валентности (+7) [18], которые легко растворимы в кислотах. Металлический рений легко растворяется в концентрированной азотной кислоте с образованием рениевой кислоты и большим количеством двуокиси азота:
(2)
${\text{Re}} + 7{\text{HN}}{{{\text{O}}}_{{\text{3}}}} = {\text{HRe}}{{{\text{O}}}_{4}} + {\text{7N}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow + \,\,{\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}.~$Известно [19], что азотная кислота является сильным окислителем и смещает потенциал чистого рения в область значительных положительных величин потенциала, положительнее +1 В [н. в. э.].
Как следует из выше проведённых экспериментов, наиболее эффективными при коррозии в азотной кислоте являются добавки в сплав 5 и 10% рения. Как известно, сначала происходит возрастание скорости коррозии сплавов [15], в результате чего поверхность обогащается рением. Рений как эффективная катодная добавка (после возрастания его содержания на поверхности) способствует смещению потенциала коррозии сплавов к более положительным значениям потенциала, при которых возможно образование защитных соединений никеля. При больших исходных содержаниях рения (20%) сразу реализуются высокие скорости растворения, при которых кинетически невозможно образование защитных соединений никеля. Аналогичные процессы происходят и при легировании титана палладием и рутением в количестве более 5% [15].
Таким образом, на всех зависимостях скорости коррозии сплавов никель–рений от состава сплавов наблюдается перелом в свойствах в интервале от 10 до 20% рения. Вероятно, увеличение содержания “катодной” добавки в каждом конкретном сплаве имеет свой предел, то есть увеличение ее содержания в сплаве выше определённых значений является не эффективным и даже вредным. При этом природа коррозии (механизм коррозии) чистых металлов, никеля и рения в концентрированных кислотах, вероятно, отличается от коррозии их сплавов. Металлы, на основе которых получен сплав, могут вносить индивидуальные свойства в его коррозионное поведение, но при этом механизм коррозионного поведения каждого отдельного сплава будет иметь свои отличия и особенности.
ЗАКЛЮЧЕНИЕ
Скорость коррозии сплавов никель–рений определяется как условиями коррозии, а именно кислотой, окислительной, неокислительной, так и составом сплава, а именно непосредственным содержанием рения.
Введение рения в никель в количестве 5, 10 и 20 вес. % неоднозначно влияет на скорость коррозии всего сплава, и в зависимости от соотношения никеля и рения в сплаве может как уменьшаться, так и увеличиваться скорость коррозии сплава в неокислительной и окислительной кислотах.
Сплав с 20 вес. % или 8 ат. %. рения является “граничным” в концентрированной соляной кислоте с точки зрения достижения необходимой концентрации рения на поверхности и уменьшения скорости растворения сплавов.
В концентрированной азотной кислоте и царской водке повышение содержания рения в сплаве выше 10% является нецелесообразным, так как скорость коррозии существенно возрастает.
Список литературы
Физико-химичесике свойства сплавов рения. Сборник статей / Отв. ред. Е.М. Савицкий, М.А. Тылкина. М.: Наука, 1979. 215 с.
Томашов Н.Д., Матвеева Г.В. // Рений в новой технике. Ч. 2. М.: Наука, 1970. С. 150.
Батраков В.В., Батраков В.П., Пивоварова Л.Н., Соболь В.В. Коррозия конструкционных материалов. М.: Металлургия, 1990. 320 с.
Перельман Ф.М., Зворыкин А.Я. Кобальт и никель. М.: Наука, 1975. 215 с.
Тодт Ф. Коррозия и защита от коррозии. М.: Изд-во Химия, 1966. 847 с.
Сухотин А.М. Справочник по электрохимии. Ленинград: Химия, 1981. 488 с.
Каблов Е.Н., Толораия В.Н., Орехов Н.Г. // Металловедение и термическая обработка металлов. 2002. № 7. С. 7.
Петрушин Е.В., Оспенникова Е.Г., Елютин Е.С. // Авиационные материалы и технологии. 2014. № 5. С. 5.
Патент 2555317. РФ. Способ получения металлических порошков никеля и рения с различным соотношением компонентов при переработке ренийсодержащих жаропрочных никелевых сплавов / МИТХТ им. М.В. Ломоносова. Чернышова О.В., Дробот Д.В., Чернышов В.И. // Б.И. 2015. № 19. С. 1–6.
Крутских В.М., Дровосеков А.Б., Иванов М.В. // Электрохимия. 2016. Т. 52. № 9. С. 980. https://doi.org/10.7868/S042485701609005X
Кузнецов В.В., Гамбург Ю.Д., Крутских В.М., Жуликов В.В., Филатова Е.А., Тригуб А.Л., Белякова О.А. // Электрохимия. 2020. Т. 56. № 10. С. 909. https://doi.org/10.31857/S0424857020100072
Кузнецов В.В., Гамбург Ю.Д., Жуликов В.В., Баталов Р.С., Филатова // Гальванотехника и обработка поверхности. 2018. Т. 26. № 4. С. 4. https://doi.org/10.47188/0869-532620182644
Палант А.А., Трошкина И.Д., Чекмарев А.Н. Металлургия рения. Москва: Наука, 2007. 298 с.
Томашов Н.Д. Титан и коррозионностойкие сплавы на его основе. М.: Металлургия, 1985. 80 с.
Томашов Н.Д., Чернова Г.П. Теория коррозии и коррозионностойкие конструкционные сплавы. М.: Металлургия, 1993. 416 с.
Введенский А.В., Маршаков И.К., Стекольников. Ю.А., Анохина И.В. // Защита металлов. 1985. Т. 21. № 3.С. 346.
Богдашкина Н.Л., Чернова Г.П., Рубцов А.Е., Чалых А.Е.// Защита металлов. 1989. Т. 25. № 5. С. 787.
Борисова Л.В., Ермакова А.Н. Аналитическая химия рения. М.: Наука, 1974. 319 с.
Голубев А.И. Коррозия и защита конструкционных сплавов. М.: Наука, 1966. С. 175.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


