Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2022, № 7, стр. 76-83
Новые полупроводниковые адсорбенты – твердые растворы соединений типа АIIBVI
И. А. Кировская *
Омский государственный технический университет
644050 Омск, Россия
* E-mail: iakirovskaya@omgtu.tech
Поступила в редакцию 17.07.2021
После доработки 18.08.2021
Принята к публикации 18.08.2021
- EDN: OEGVCQ
- DOI: 10.31857/S102809602207010X
Аннотация
На основе сульфидов цинка и кадмия получены новые материалы, аттестованные как твердые растворы замещения с гексагональной структурой вюрцита. Выполнены исследования структуры, объемных и поверхностных свойств (спектроскопических, кислотно-основных и адсорбционных), обогатившие сведения о многокомпонентных алмазоподобных полупроводниках. В результате исследований поверхностных свойств компонентов системы ZnS–CdS определены средняя сила, концентрация активных центров, выявлены их природа, относительный вклад, особенности и механизмы кислотно-основных взаимодействий, согласующихся с адсорбционными. Установлены взаимосвязанные закономерности изменений с составом объемных и поверхностных свойств, использованные для предварительной оценки чувствительности и селективности поверхностей к газам различной электронной природы. Даны практические рекомендации по применению полученных материалов оптимальных составов (с наименьшими значениями pHизо) в изготовлении сенсоров, чувствительных к микропримесям аммиака и других основных газов.
ВВЕДЕНИЕ
Настоящая работа посвящена получению и исследованию физико-химических свойств новых адсорбентов (материалов) – твердых растворов сульфидов цинка и кадмия, представляющих соединения типа АIIBVI. Благодаря уникальным объемным свойствам (электрофизическим, фото- и пьезоэлектрическим, оптическим) [1] такие соединения уже нашли широкое применение в технике: на их основе созданы гетеропереходы, люминесцентные, электролюминесцентные, электронные, оптоэлектронные, нанооптоэлектронные приборы и устройства (светодиоды, лазерные измеряющие элементы, солнечные батареи, инфракрасные окна, полевые транзисторы, оптические сенсоры, наногенераторы, разнообразные фото- и пьезопреобразователи и другие устройства) [2–5].
Постоянно возрастающие темпы развития современной техники, в том числе сенсорной, диктуют необходимость получения и изучения новых материалов. В этом плане перспективны многокомпонентные алмазоподобные полупроводники – твердые растворы бинарных соединений типа АIIBVI. Можно не только прогнозировать, регулировать и тем самым улучшать свойства создаваемых материалов, но и достигать неожиданных свойств (экстремальных эффектов). Их проявление обусловлено внутренними процессами, сопровождающими образование твердых растворов: упорядочением и упрочнением структуры, комбинированным действием составляющих компонентов в роли макро- и микродефектов и возможным получением высоких концентраций примесных центров [6]. Для изучения обозначенных эффектов необходимо как расширение арсенала подобных систем (более “тонкие” диапазоны составов), так и привлечение комплекса современных методов.
Эффективность использования новых материалов (адсорбентов), несомненно, зависит от полноты сведений об их объемных и особенно поверхностных физико-химических свойствах, играющих зачастую определяющую роль в работе полупроводниковых приборов и устройств, в целом ряде технологических процессов. Что касается одной из областей современной техники – сенсорной техники, продуктивным направлением должен быть оригинальный полупроводниковый анализ, важнейшее достоинство которого состоит в легкости миниатюризации его средств на базе современной полупроводниковой технологии в отличие от существующих оптических, хроматографических и других методов. К таким средствам прежде всего относятся истинно полупроводниковые (в отличие от оксидных) сенсоры. Их основное назначение – экспресс-обнаружение и анализ микропримеси вредных компонентов (CO, NO2, SO2, NH3 и других) в различных технологических средах, газовых выбросах автотранспорта, предприятий химического, нефтехимического и других профилей, прилегающих к ним загрязненных зон [1, 7].
До недавнего времени наиболее чувствительными к окислительно-восстановительным средам считали датчики на основе либо оксидов металлов (например, ZnO, NiO, TiO2, SnO2), либо смесей оксидов, либо смесей оксидов с добавками металлов (часто драгоценных) и других сложных системах [8–11]. Однако сложность составов, конструкций, технологий изготовления, необходимость повышения рабочей температуры до 400°С и более, недостаточная ясность принципов работы и при этом невысокая избирательная чувствительность сдерживают их широкое распространение.
Датчики на основе алмазоподобных полупроводников (бинарных и многокомпонентных – их твердых растворов), о которых в частности пойдет речь, при их относительно высокой проводимости, очень малой массе, компактности, простоте конструкции и технологичности изготовления должны обладать способностью обнаруживать большое число различных веществ при низких температурах, вплоть до комнатных [1, 7].
Поскольку работа полупроводниковых датчиков базируется, как правило, на связи электропроводности приповерхностной области пространственного заряда полупроводника с заряжением его поверхности или на изменении частоты колебания подложки – пьезокварцевого резонатора с нанесенным полупроводником в следствие адсорбции среды, их аналитические характеристики в значительной мере определяются состоянием, избирательной чувствительностью поверхности по отношению к различным средам.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Твердые растворы (ZnS)x(CdS)1 – x (x = 4, 22, 38, 80 мол. %) получали по методике, разработанной применительно к системе ZnS–CdS, принимая во внимание ранее использованные методы (например, [12, 13]), возможности метода изотермической диффузии, известные основные объемные свойства исходных бинарных соединений (ZnS, CdS) и прежде всего диаграммы состояния “температура плавления–состав” [1, 14].
Синтез осуществляли в вакуумированных, запаянных кварцевых ампулах при температуре 1173 К по отработанным режиму и программе температурного нагрева [1]. Для оптимизации синтеза навески исходных бинарных соединений (с учетом области их взаимной растворимости) предварительно подвергали измельчению, механохимической активации. О завершении синтеза, образовании, структуре твердых растворов судили по результатам рентгенографических исследований, привлекая данные УФ-, ИК-спектроскопических и электронно-микроскопических исследований, позволивших в целом существенно обогатить информацию о многокомпонентных алмазоподобных полупроводниках.
Полученные твердые растворы представляли собой компактные поликристаллические слитки на дне ампул. Для последующих исследований твердые растворы и исходные бинарные соединения готовили в форме тонкодисперсных порошков (Sуд = 0.91–1.35 м2/г) и наноразмерных пленок (d = 20–100 нм). Пленки получали дискретным термическим напылением в вакууме (Тконд = = 298 К, Р = 1.33 × 10–4 Па) на электродные площадки пьезокварцевых резонаторов, имеющих форму линзы АТ-среза с собственной частотой колебаний 8 МГц, с последующим отжигом в парах исследуемых объектов [15]. Толщину пленок определяли по изменению частоты пьезокварцевого резонатора на основе интерферометрических измерений и исходя из условий напыления [1, 16]. Заданные мольные составы сверяли с элементными, найденными в результате электронно-микроскопических исследований, – они практически совпадали.
Рентгенографические исследования выполняли на дифрактометре D8 Advance фирмы Bruker AXS (Германия) (CuKα-излучение, λ = 0.15406 нм, Т = 293 К) в области больших углов [17, 18], используя позиционно-чувствительный детектор Lynxeye, а также базу данных ICDDIPDF-2 и программу TOPAS3.0 (Bruker) для расшифровки полученных дифрактограмм и уточнения параметров решеток соответственно. УФ-спектроскопические исследования проводили на спектрофотометрах UV-2501 PC фирмы Shimadzu с приставкой диффузного отражения ISR-240A и SPECORD-40 в диапазоне 190–900 нм [19, 20], ИК-спектроскопические – на фурье-спектрометре Инфра-ЛЮМ ФТ-02 с приставкой МНПВО [16, 21], электронно-микроскопические – в растровом электронном микроскопе (РЭМ) JCM-5700, снабженном приставкой для энергодисперсионного анализа JED-2300 [22].
Кислотно-основные свойства поверхностей компонентов системы ZnS–CdS исследовали методами гидролитической адсорбции (определения водородного показателя изоэлектрического состояния поверхности pHизо), неводного кондуктометрического титрования, механохимии [7, 23, 24], адсорбционные – методом пьезокварцевого микровзвешивания (чувствительность 10–11 г/см2 · Гц) [16].
Воспроизводимость и точность экспериментальных данных проверяли в ходе параллельных измерений с использованием методов математической статистики и обработки результатов количественного анализа. Статистическую обработку данных, расчет погрешностей измерений, построение и обработку графических зависимостей осуществляли с использованием компьютерных программ Stat-2, Microsoft Excel и Origin.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты рентгенографических исследований указывают на образование в системе ZnS–CdS (при заданных составах) твердых растворов замещения с гексагональной структурой вюрцита: относительное положение и распределение по интенсивностям основных линий на дифрактограммах бинарных соединений и твердых растворов; сдвиг линий, отвечающих твердым растворам, относительно линий бинарных соединений при постоянном их числе, преимущественное подчинение закону Вегарда (плавный характер) концентрационных зависимостей параметров кристаллических решеток (a, c), межплоскостных расстояний (dhkl) (табл. 1, рис. 1, [25, 26]). Отмечаемое отклонение от закона Вегарда концентрационной зависимости ρr возможно при сложности внутренних процессов, сопровождающих формирование твердых растворов [6].
Таблица 1.
Значения параметров кристаллических решеток (а, с), межплоскостных расстояний (dhkl) и рентгеновской плотности (ρr) компонентов системы ZnS–CdS в зависимости от мольной доли (х) CdS
| х | Тип кристаллической решетки | a, Å | с, Å | dhkl, Å | ρr, г/см3 | ||
|---|---|---|---|---|---|---|---|
| 010 | 110 | 002 | |||||
| 0 | Гексагональная | 3.822 ± 0.001 | 6.263 ± 0.001 | 3.165 | 1.923 | 1.243 | 4.086 |
| 0.20 | Гексагональная | 3.746 ± 0.001 | 6.121 ± 0.001 | 3.234 | 1.897 | 3.323 | 4.772 |
| 0.62 | Гексагональная | 3.933 ± 0.001 | 6.346 ± 0.001 | – | 1.967 | 3.348 | 5.297 |
| 0.78 | Гексагональная | 3.994 ± 0.001 | 6.446 ± 0.001 | 3.268 | 2.014 | 3.223 | 5.002 |
| 0.94 | Гексагональная | 4.049 ± 0.001 | 6.503 ± 0.001 | – | 2.025 | 3.252 | 5.094 |
| 1 | Гексагональная | 4.151 ± 0.001 | 6.711 ± 0.001 | 3.348 | 2.057 | 1.792 | 4.843 |
Рис. 1.
Зависимость от состава параметра кристаллических решеток а (1), рентгеновской плотности ρr (2), ширины запрещенной зоны ∆E (3) компонентов системы ZnS–CdS.

Дополнительно образование твердых растворов замещения в изучаемой системе подтверждают результаты УФ-, ИК-спектроскопических и электронно-микроскопических исследований. С увеличением содержания в системе ZnS наблюдается смещение основного пика в УФ-спектрах и изменение его интенсивности (рис. 2), смещение ИК-полос, отвечающих валентным колебаниям молекулярно-адсорбированных CO2, H2O и структурных гидроксильных групп (рис. 3). Закономерно изменяется также ширина запрещенной зоны (∆E), рассчитанная по УФ-спектрам ([6], рис. 1), среднее число преобладающих частиц (nср), определенное по РЭМ-изображениям (рис. 4).
Рис. 2.
УФ-спектры компонентов системы ZnS–CdS: ZnS (1); (ZnS)0.80(CdS)0.20 (2); (ZnS)0.22(CdS)0.78 (3); CdS (4).

Рис. 3.
ИК-спектры многократного нарушенного полного внутреннего отражения поверхностей компонентов системы ZnS–CdS, экспонированных на воздухе: ZnS (1); (ZnS)0.80(CdS)0.20 (2); CdS (3).

Рис. 4.
РЭМ-изображения, полученные в режиме фазового контраста: а – порошков ZnS; б – твердого раствора (ZnS)0.22(CdS)0.78; в – CdS.

На основе результатов исследований кислотно-основных свойств реальных (экспонированных на воздухе) поверхностей компонентов системы ZnS–CdS с привлечением взаимодополняющих методов были определены средняя сила, концентрация активных центров, установлены их природа, происхождение, механизмы кислотно-основных взаимодействий, закономерности изменений кислотно-основных свойств с составом, коррелирующие с закономерностями изменений объемных физико-химических свойств.
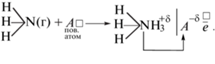
По средней силе кислотных центров поверхности компонентов системы следует отнести к слабокислым: значения pHизо укладываются в интервале 6.4–6.86. Отсюда основание говорить о некотором превалировании кислотных центров Льюиса и ожидаемой повышенной адсорбционной активности по отношению к основным газам. При выяснении природы кислотных центров, их относительного вклада полезными оказались результаты неводного кондуктометрического титрования и механохимических исследований. Кривые неводного кондуктометрического титрования, содержащие три и более пиков (рис. 5), указывают на присутствие на поверхностях компонентов системы ZnS–CdS различных типов кислотных центров, т.е. не только центров Льюиса, но и центров Бренстеда, отвечающих в совокупности за кислотно-основное состояние.
Рис. 5.
Дифференциальные кривые неводного кондуктометрического титрования хранившихся на воздухе компонентов системы ZnS–CdS: ZnS (1); (ZnS)0.80(CdS)0.20 (2); (ZnS)0.22(CdS)0.78 (3); CdS (4).
Согласно ранее высказанным соображениям (например, [1, 6]), в роли кислотных центров должны выступать координационно-ненасыщенные атомы (центры Льюиса), а также адсорбированные молекулы воды, группы ОН– (центры Бренстеда). Этому отвечает как подкисление (уменьшение pH), так и подщелачивание (увеличение pH) среды (H2O) при диспергировании в ней крупнодисперсных порошков ZnS, CdS, (ZnS)x(CdS)1 – x (рис. 6). В начальный отрезок времени (5–10 мин) отмечается подщелачивание при диспергировании ZnS, обладающего более гидратированной поверхностью, и подкисление при диспергировании CdS и твердых растворов с его избытком, обладающих менее гидратированными поверхностями (∆XZnS и ∆XCdS, соответственно, равны 0.9 и 0.8).
Рис. 6.
Кинетические изотермы диспергирования в воде компонентов системы ZnS–CdS: CdS (1); ZnS (2); (ZnS)0.22(CdS)0.78 (3).

Вместе с тем многие факты свидетельствуют о превалирующем вкладе в кислотно-основное состояние поверхностей (особенно при pHизо < 7) центров Льюиса – координационно-ненасыщенных атомов с различной степенью ненасыщенности и, соответственно, различными эффективными зарядами (qэф). К таким фактам следует отнести наличие в ИК-спектрах исходных поверхностей и особенно в условиях адсорбции донорно-акцепторных связей H2O+δ–Me–δ, ${\text{CO}}_{2}^{{ + \delta }}$–Me–δ, образованных с участием координационно-ненасыщенных атомов (рис. 3, [1, 6, 25, 26]), а также наличие в ИК-спектрах водных суспензий компонентов системы полос ионов S2–, ${\text{SO}}_{3}^{{2 - }}$, ${\text{SO}}_{4}^{{2 - }}$ поверхностного происхождения [1, 7]. Здесь наиболее явно “высвечивается” роль поверхностных координационно-ненасыщенных атомов. Именно вследствие взаимодействия воды с координационно-ненасыщенными атомами (S), находящимися на вновь созданных поверхностях, образуются кислоты H2S, H2SO3, H2SO4, которые в процессе механохимического воздействия переходят в среду, отщепляя свои остатки (S2–, ${\text{SO}}_{3}^{{2 - }}$, ${\text{SO}}_{4}^{{2 - }}$). Гидролиз остатка слабой кислоты ${\text{SO}}_{3}^{{2 - }}$ обусловливает подщелачивание среды (рис. 7).
Рис. 7.
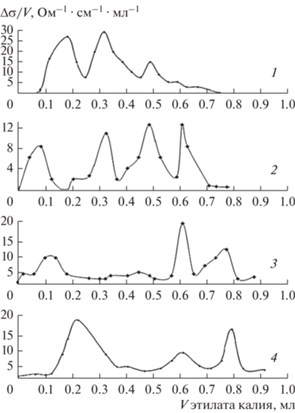
Концентрационные зависимости для компонентов системы ZnS–CdS: pH изоэлектрического состояния поверхностей: pHизо (1); pH водных суспензий (через 20 мин диспергирования) (2); общей концентрации кислотных центров Собщ (3).
На значительную роль координационно-ненасыщенных атомов как активных (кислотных) центров указывают также характер воздействия основного газа (NH3) на pHизо (наблюдается рост) (табл. 2), смещение pHизо в направлении повышения кислотности с увеличением содержания в системе CdS, корреляция между зависимостями pHизо–состав, относительная активность свежеобразованной поверхности–состав, Собщ–состав (рис. 6, 7) (Собщ – общая концентрация кислотных центров, рассчитанная по всем пикам дифференциальных кривых неводного кондуктометрического титрования (рис. 5)). Указанные зависимости носят экстремальный характер при противоположной зависимости Собщ = f(XCdS) (рис. 7). Возникновение экстремумов можно объяснить неодинаковыми конкурентными количественными соотношениями между кислотными центрами Льюиса и Бренстеда [1, 6]. Зеркальное расположение экстремумов дополнительно подтверждает определяющее в целом влияние на кислотность поверхностей координационно-ненасыщенных атомов. Действительно, при двух составах системы (20 и 78 моль. % CdS) снижение относительного вклада координационно-ненасыщенных атомов (возможного за счет сложных внутренних процессов при формировании твердых растворов) незамедлительно обусловливает рост pHизо, т.е. рост вклада центров Бренстеда.
Таблица 2.
Значения рНизо поверхностей компонентов системы ZnS–CdS, подвергнутых обработке в различной среде при Т = 323 К
| Состав | Аргон | NH3 | СО |
|---|---|---|---|
| ZnS | 6.86 | 9.00 | 6.57 |
| ZnS0.22CdS0.78 | 7.30 | 8.55 | 6.70 |
| ZnS0.06CdS0.94 | 7.20 | 8.30 | 6.80 |
| CdS | 6.40 | 10.0 | 6.20 |
Результаты выполненных исследований кислотно-основных свойств поверхностей компонентов системы ZnS–CdS на алмазоподобных полупроводниках (не только на бинарных, но и, что особенно ценно, на многокомпонентных), обогатившие представления о природе, механизме, особенностях кислотно-основного взаимодействия, представляют и практический интерес. Так, согласно результатам определения pHизо исходных поверхностей компонентов изучаемой системы ZnS–CdS (pHизо < 7), а также результатам более ранних параллельных исследований кислотно-основных и адсорбционных свойств алмазоподобных полупроводников [1, 6], в рассматриваемом случае следовало ожидать повышенную адсорбционную активность по отношению к основным газам.
Это предположение подтвердили результаты выполненных по разработанной методике исследований “поведения” pHизо поверхностей компонентов, предварительно обработанных аргоном, при контактах с аммиаком и оксидом углерода (табл. 2). При контактах с NH3 pHизо растет, т.е. кислотность поверхностей ослабевает. При контактах с СО pHизо снижается, т.е. кислотность поверхностей усиливается, хотя и в меньшей степени, чем ослабевает под влиянием NH3 (на твердом растворе с избыточным содержанием CdS ΔpHизо в NH3 в два раза больше ∆pHизо в СО).
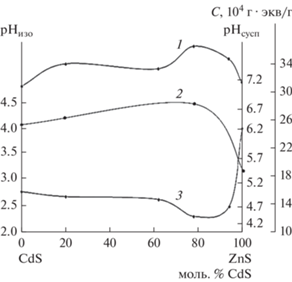
Характер воздействий газов согласуется с химическими свойствами и механизмами их адсорбции (рис. 8, [1, 6]). Молекулы NH3, проявляя себя как основания, образуют донорно-акцепторные комплексы ${\text{NH}}_{3}^{{ + \delta }}$–A–δ за счет смещения электронной пары атомов азота на свободные орбитали поверхностных кислотных центров, в роли которых выступают преимущественно координационно-ненасыщенные атомы А (Zn, Cd) с определенным участием вакансий атомов В (S):
Рис. 8.
Изобары (а), равновесные (б) и кинетические (в) изотермы (Т = 353 К) адсорбции аммиака (1) и СО (2) на поверхности CdS при Pн = 13 Па.
Молекулы СО из-за особенностей электронной структуры могут функционировать как доноры, так и акцепторы электронных пар. Образование в последнем случае дативных и водородных связей
Таким образом, неодинаковый характер (рост и падение) и неодинаковая степень (незначительная в СО) изменений pHизо поверхностей компонентов системы ZnS–CdS при воздействиях NH3 и CO подтверждают высказанные прогнозы об их активности по отношению к газам различной электронной природы и свидетельствуют об их избирательности к одному из двух газов-адсорбатов – к аммиаку.
Изложенное выше позволило рекомендовать изученные полупроводники в качестве материалов – первичных преобразователей высокочувствительных и селективных датчиков, чувствительным к микропримесям NH3. Подобная рекомендация, ранее реализованная применительно к бинарному компоненту CdS, была закреплена патентом [27].
ЗАКЛЮЧЕНИЕ
На основе системы ZnS–CdS получены новые материалы, аттестованные по результатам рентгенографических исследований в сочетании с результатами электронно-микроскопических, оптических исследований как твердые растворы замещения с гексагональной структурой вюрцита.
По УФ-спектрам впервые определена важнейшая характеристика полученных полупроводниковых материалов – ширина запрещенной зоны (∆E).
Изучены поверхностные свойства (кислотно-основные и адсорбционные). Изучение кислотно-основных свойств исходных и подвергнутых воздействиям газов (NH3, CO) поверхностей позволило определить среднюю силу, концентрацию активных центров, выявить их природу, особенности и механизмы кислотно-основных взаимодействий, согласующихся с адсорбционными, что важно не только для подтверждения и углубления предложенных механизмов атомно-молекулярных взаимодействий в алмазоподобных полупроводниках, но и для поиска новых перспективных материалов.
Установлены закономерности изменений объемных и поверхностных свойств с составом системы ZnS–CdS. Многие из них носят экстремальный характер, обусловленный в значительной степени сложностью внутренних процессов, сопровождающих формирование твердых растворов.
Обнаружена и обоснована связь между установленными закономерностями, открывающая возможность прогнозировать уже по объемным свойствам поверхностную активность и селективность новых материалов по отношению к газовым микропримесям окружающей и технологических сред.
По разработанной методике, основанной на определении водородного показателя изоэлектрического состояния (pHизо), оценены чувствительность и селективность поверхностей бинарных и многокомпонентных полупроводников системы ZnS–CdS по отношению к микропримесям типа NH3, CO. Предложены материалы оптимальных составов (преимущественно твердые растворы с наименьшими значениями pHизо).
Список литературы
Кировская И.А. Физико-химические свойства бинарных и многокомпонентных алмазоподобных полупроводников. Новосибирск: Изд-во СО РАН, 2015. 367 с.
Fang X., Zhai T., Gautam U.K. et al. // Progress Mater. Sci. 2011. V. 56. P. 175.
Jeyasubramanian K., Nisanthi M., Benitha V.S., Selvakumar N. // Acta Metall. Sinica (English Lett.) 2015. V. 28. Iss. 1. P. 103.
Sun G.-J., Kheel H., Koand T.-G., Lee Ch. // J. Korean Phys. Soc. 2016. V. 69. P. 390.
Li L., Yang Sh., Han F. et al. // Sensors. 2011. V. 14. Iss. 4. P. 7332.
Кировская И.А. Твердые растворы бинарных и многокомпонентных полупроводниковых систем. Омск: Изд-во ОмГТУ, 2010. 400 с.
Кировская И.А. Поверхностные явления. Омск: Изд-во ОмГТУ, 2001. 175 с.
Мясников И.А. // ЖВХО. 1975. Т. 20. № 1. С. 19.
Hiroyuki Y., Jun T., Koji M. et al. // J. Electrochem. Soc. 1996. V. 43. № 2. P. 36.
Патент № 2 464 554 (RU). Газовый сенсор для индикации диоксида азота / НИЦ “Курчатовский институт”. Гаськов А.М., Румянцева М.Н. // 2012. Бюл. № 29.
Будников Г.К. // Соросовский образовательный журнал. 1998. № 3. С. 75.
Charbonnier M., Murat M. // C. R. Acad. Sci. 1974. V. 278. № 4. P. 259.
Cherin P., Lind E.L., Davis E.A. // J. Electrochem. Soc. 1970. V. 117. № 2. P. 233.
Диаграммы состояния систем на основе полупроводниковых соединений AIIBVI: справочник. Киев: Наукова думка, 1982. 162 с.
Тонкие пленки антимонида индия. Получение, свойства, применение / Ред. Касьян В.А. и др. Кишинев: Штиинца, 1989. 162 с.
Кировская И.А. Адсорбционные процессы. Иркутск: Изд-во Иркут. ун-та, 1995. 300 с.
Горелик С.С., Расторгуев Л.Н., Скаков Ю.А. Рентгенографический и электронно-оптический анализ. М.: Металлургия, 1970. 107 с.
Смыслов Е.Ф. // Заводская лаборатория. Диагностика материалов. 2006. Т. 72. № 5. С. 33.
Левшин Л.В. Оптические методы исследования молекулярных систем. Молекулярная спектроскопия. М.: МГУ, 1994. 320 с.
Косяченко А.А., Склярчук В.М., Склярчук О.В. // Физика и техника полупроводников. 2011. Т. 45. № 10. С. 1323.
Литтл Л. Инфракрасные спектры адсорбированных молекул. М.: Мир, 1969. 514 с.
Гоулдстейн Дж. Растровая электронная микроскопия и рентгеновский микроанализ. Кн. 1. М.: Мир, 1984. 303 с.
Майдановская Л.Г. Каталитические реакции в жидкой фазе. Алма-Ата: Изд-во АН КазССР, 1963. 212 с.
Крешков А.П. Кислотно-основное титрование в неводных растворах. М.: Химия, 1967. 192 с.
Kirovskaya I.A., Mironova E.V., Kosarev B.A. et al. // J. Phys. Chem. 2016. V. 90. № 10. P. 2029.
Кировская И.А, Миронова Е.В., Григан А.А., Леонов В.Е. // Россия молодая. Передовые технологии в промышленность. 2015. № 2. С. 164.
Патент № 2 400 737 (RU). Датчик микропримесей аммиака / Омский гос. тех. ун-т. Кировская И.А., Земцов А.Е., Тимошенко О.Т., Филатова Т.Н. // 2010. Бюл. № 27.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования