Приборы и техника эксперимента, 2020, № 2, стр. 142-148
УСОВЕРШЕНСТВОВАННАЯ СИСТЕМА ДЛЯ ФЛЮОРЕСЦЕНТНОГО АНАЛИЗА IN VIVO В МЕДИЦИНЕ
И. А. Разницына a, А. П. Тарасов a, b, Д. А. Рогаткин a
a Московский областной научно-исследовательский клинический институт имени М.Ф. Владимирского
129110 Москва, ул. Щепкина, 61/2, Россия
b Институт радиотехники и электроники им. В.А. Котельникова РАН
125009 Москва, ул. Моховая, 11, корп. 7, Россия
Поступила в редакцию 29.09.2019
После доработки 11.10.2019
Принята к публикации 16.10.2019
Аннотация
Описаны конструкции отдельных элементов усовершенствованной системы для лазерной флюоресцентной спектроскопии in vivo. Предложенные технические решения, в частности: включение в систему источника белого света, особые конструкции оптоволоконного зонда и блока фильтров – позволяют исключить ряд недостатков существующих систем. В описанной системе спектр диффузного отражения исследуемой области определяется автоматически после детектирования спектров флюоресценции. Равенство диагностических объемов достигается не только путем автоматического переключения режимов, но и использованием большого числа осветительных волокон, расположенных вокруг приемного волокна, для равномерного освещения области интереса. Показана конструкция блока фильтра, позволяющего корректировать передаточную функцию прибора путем регулирования степени перекрытия светового пучка фильтром. Мы полагаем, что включение данных элементов в системы лазерной флюоресцентной спектроскопии позволит уточнить данный метод, унифицировать параметры аналогичных устройств и в перспективе – настраивать все приборы идентичным образом.
ВВЕДЕНИЕ
Методы неинвазивного флюоресцентного анализа используются в различных областях медицины [1]. В основе метода лазерной флюоресцентной спектроскопии (л.ф.с.) in vivo лежит детектирование спектров вторичного излучения, вышедшего с поверхности исследуемого объекта в результате воздействия на него узкополосным излучением в видимом или ближнем у.ф.-диапазонах. Регистрируемый вторичный спектр интенсивности флюоресценции экзогенных или эндогенных флюорофоров в биоткани несет информацию о ее биохимическом составе [2].
Наиболее известной областью применения л.ф.с. в медицине является фотодинамическая терапия (ф.д.т.) опухоли. Эта процедура предполагает введение препаратов, повышающих чувствительность тканей к свету (фотосенсибилизаторов), которые избирательно накапливаются в области патологии. Для определения границ образования, а также для контроля динамики накопления и выведения фотосенсибилизаторов оценивают флюоресценцию области патологии и здоровых тканей [3].
Работа диагностических систем для л.ф.с. in vivo осуществляется следующим образом. От узкополосного источника при помощи осветительных волокон оптоволоконного зонда к поверхности объекта доставляется излучение для возбуждения флюоресценции. Вторичное излучение, в частности диффузно отраженное и флюоресцентное, по приемному волокну зонда доставляется к спектрометру. При этом регистрируемый сигнал флюоресценции примерно в тысячу раз слабее, чем диффузно отраженный сигнал. Поэтому для детектирования и визуализации флюоресцентной части спектра диффузно отраженная часть ослабляется спектральным фильтром, расположенным перед спектрометром, в β ≈ 1000 раз.
Известны устройства, реализующие метод л.ф.с. для диагностики и анализа флюоресценции опухолей в ходе ф.д.т. К ним относится, например, система ЛЭСА-01-Биоспек, описанная в [4]. При помощи данного комплекса в режиме реального времени можно наблюдать спектры флюоресценции, а специальное программное обеспечение позволяет оценить их различные параметры (высоты максимумов, площади отдельных областей и др.). Также среди отечественных приборов известен диагностический комплекс для измерения in vivo медико-биологических параметров кожи и слизистых оболочек компании ООО ЛАЗМА [5] с аналогичным функционалом.
При использовании этих устройств, как и их зарубежных аналогов, дальнейший количественный анализ спектров флюоресценции вызывает ряд затруднений. В частности, попытки скорректировать зарегистрированные спектры флюоресценции с учетом влияния приборных характеристик и различий оптических свойств биотканей приводят к возникновению различных алгоритмов нормировки и появлению неунифицированных показателей, например, индекса тканевого содержания, коэффициента флюоресцентной контрастности и т.д. [2, 6, 7].
При расчетах данных величин предполагается, что поглощающие свойства биоткани на длинах волн возбуждения и флюоресценции одинаковы, что не всегда верно. Кроме того, для разработки количественных диагностических критериев состояния биоткани важно осуществить переход от измеренных физических величин к медико-биологическим показателям, выраженным, например, в уровнях накопления или в относительных концентрациях флюорофоров. Таким образом, основным недостатком описанных выше устройств является отсутствие как обоснованного алгоритма перехода от измеренных физических величин (спектров) к медико-биологическим количественным характеристикам ткани, так и необходимых для этого аппаратных и программных средств.
Существуют системы, которые позволяют проводить дополнительные математические операции и корректировать спектры флюоресценции с использованием тех или иных приближений. Для этого в конструкцию измерительного устройства включают источник белого света и, помимо спектра флюоресценции, снимают спектр диффузного отражения, характеризующий оптические свойства биоткани в зависимости от длины волны [8, 9]. В данных приборах геометрия оптоволоконного зонда предполагает наличие дополнительных волокон для широкополосного источника.
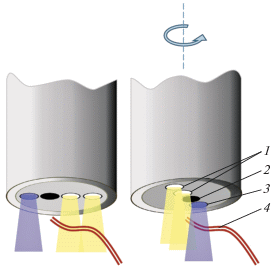
Чаще всего эти волокна расположены в ряд, что обусловлено применяемыми расчетными алгоритмами. В этом случае диагностические объемы для исследования флюоресценции и диффузного отражения не одинаковы (рис. 1). Попадание мелкого сосуда в одну из исследуемых областей приведет к неверным расчетам, особенно в зеленой части спектра, где основным поглощающим веществом является гемоглобин. Соответственно различие диагностических объемов для двух измерений, как и поворот дистального конца оптоволоконного зонда вокруг своей оси, могут привести к ошибкам при дальнейших расчетах (см. рис. 1).
Рис. 1.
Конфигурация волокна в устройстве, описанном в [8], и иллюстрация возможных источников ошибок, связанных с неравенством диагностических объемов и поворотом оптоволокна вокруг своей оси. 1 – волокна, доставляющие широкополосное излучение к поверхности объекта; 2 – приемное волокно; 3 – волокно для доставки лазерного излучения; 4 – кровеносный сосуд.
Важным условием активного внедрения л.ф.с. in vivo в клинику является метрологическое обеспечение приборов для достижения единства результатов и требуемой точности измерений. Ранее нами было проведено исследование, в котором оценивались погрешности измерений, выполненных на разных приборах одного производителя [10]. Было показано, что для метода л.ф.с. разброс регистрируемых значений, даже на приборах одной фирмы, может превышать 25%.
Сегодня, проводя измерения на различных приборах, можно получить совершенно разные данные ввиду того, что нет общепринятых стандартов и единых мер для калибровки и настройки приборов. Например, значения коэффициентов флюоресцентной контрастности, которые часто используются в исследованиях [7, 8], рассчитываются по формуле
(1)
${{K}_{f}} = 1 + \frac{{I({{\lambda }_{f}}) - I({{\lambda }_{e}})}}{{I({{\lambda }_{f}}) + I({{\lambda }_{e}})}},$Исходя из этого, можно отметить необходимость проведения не только стандартных калибровочных процедур, но и коррекции передаточной функции прибора, обеспечивая тем самым влияние на соотношения максимумов диффузного отражения и флюоресценции, что требует дополнительных технических решений.
В данной работе предложен новый вариант устройства для лазерной флюоресцентной спектроскопии in vivo в медицине, конструктивные особенности которого позволяют исключить вышеописанные недостатки аналогов.
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Ввиду того что разные биоткани могут иметь различное кровенаполнение, интенсивность флюоресценции I(λf) может не быть прямо пропорциональной концентрации флюоресцирующих веществ. В общем случае зависимость I(λf) от концентрации флюорофоров Cf имеет сложный характер [11]. Влияние кровенаполнения на результаты флюоресцентного анализа наиболее существенно в зеленом диапазоне длин волн, так как здесь наблюдается активное поглощение света гемоглобином. Потому сравнение I(λf) в зеленой части спектра областей даже одной локализации не всегда корректно.
Ранее нами была решена задача распространения света в мутной среде с равномерно распределенным флюорофором [11] на основе модифицированной модели Кубелки–Мунка и решения А.А. Кохановского [12]. Выражение для потока флюоресценции Jf, Вт, на поверхности объекта выглядит следующим образом:
(2)
${{J}_{f}} = {{{\Phi }}_{0}}{{A}_{f}}({{\lambda }_{e}})\varphi ({{\lambda }_{e}},{{\lambda }_{f}})\frac{{(1 + {{r}_{{\infty {{\lambda }_{e}}}}})(1 + {{r}_{{\infty {{\lambda }_{f}}}}})}}{{2(\alpha ({{\lambda }_{e}}) + \alpha ({{\lambda }_{f}}))}}.$Величины r∞λ, β1(λ) и β2(λ) сложным образом зависят от концентрации Cf флюорофора, выраженной в относительных единицах (0 ≤ Cf ≤ 1) [11]. Следовательно, для определения относительных концентраций флюорофора в тканях измерения спектров флюоресценции недостаточно, необходимо знать коэффициенты диффузного отражения на длинах волн возбуждения λe и флюоресценции λf. В общем случае данные коэффициенты нельзя принять равными ввиду различий оптических свойств среды на разных длинах волн. Потому использование величины пика обратного рассеяния для какой-либо нормировки (в том числе, в (1)) не совсем корректно. Для возможности измерения r∞λ на любой из интересующих длин волн видимого диапазона необходимо включить в систему широкополосный источник.
ОПИСАНИЕ УСТРОЙСТВА
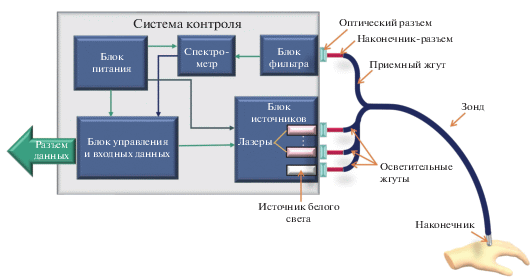
Для устранения описанных недостатков было разработано новое устройство для л.ф.с. in vivo “Мультиком”. Оно, как и устройства-аналоги, содержит оптический зонд, на дистальном конце которого находится жесткий наконечник, непосредственно контактирующий с поверхностью биологической ткани (рис. 2). На проксимальном конце расположены наконечники-разъемы для соединения зонда с системой контроля.
Система контроля включает в себя блок источников первичного излучения, блок фильтра, спектрометр, блок управления и входных данных, управляющий всеми источниками первичного излучения и спектрометром, а также блок питания. Система контроля имеет также ряд оптических разъемов для подсоединения зонда через наконечники-разъемы. Блок управления и входных данных подключается к стандартному персональному компьютеру со специализированным программным обеспечением.
Работа устройства осуществляется следующим образом. Блок управления и входных данных формирует, принимает и обрабатывает две основные управляющие команды: “наблюдение” и “измерение”. По команде “наблюдение” включается выбранный лазерный источник в непрерывном режиме, после чего спектрометр в непрерывном режиме регистрирует спектр вторичного излучения. По команде “измерение” в памяти устройства сохраняется последний зарегистрированный спектр, лазерный источник выключается, и на короткое время включается импульсный источник белого света. Спектрометр регистрирует диффузно отраженное излучение, после чего все измеренные спектры передаются в блок управления и входных данных для последующей обработки.
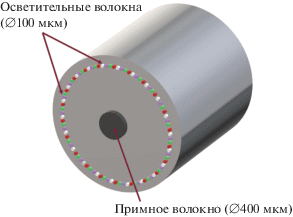
В отличие от устройств-аналогов, оптоволоконный зонд представленной системы включает в себя группу осветительных волокон (более 30) диаметром 100 мкм и одно приемное волокно диаметром 400 мкм, по которому вторичное излучение от биологической ткани доставляется к блоку фильтра. Блок источников излучения содержит несколько лазеров для возбуждения флюоресценции и источник белого света. В описываемом приборе использованы источники на длинах волн 365, 405, 515 и 632 нм и стандартный источник на основе ксеноновой лампы.
Осветительные волокна зонда на проксимальном конце собраны в отдельные жгуты, каждый из которых через оптический разъем подсоединен к источнику. Таким образом, к каждому источнику присоединяется несколько осветительных волокон. Отдельный жгут, содержащий одно приемное волокно, также присоединяется к блоку фильтров. На дистальном конце осветительные волокна располагаются по кругу вокруг приемного волокна, равномерно освещая исследуемую область (рис. 3).
Рис. 3.
Расположение осветительных и приемного волокон в оптоволоконном зонде и характерные размеры волокна прототипа устройства. Диаметр наконечника зонда 3 мм.
Использование в данном устройстве ксеноновой лампы-вспышки, которая включается по команде пользователя, а также круговой геометрии освещения значительно уменьшают систематическую погрешность измерений. Это связано с тем, что для данного прибора процесс регистрации данных максимально автоматизирован, нет необходимости ожидания выхода на режим источника белого света и ручного переключения источников. Кроме того, использование ксеноновой лампы-вспышки позволяет варьировать амплитуду принимаемого сигнала путем изменения числа вспышек.
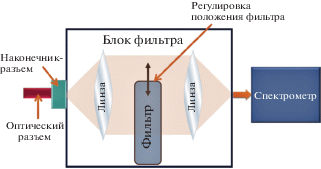
Для коррекции передаточной функции блок фильтров выполнен в виде коллимирующей системы из двух собирающих линз, ослабляющего оптического фильтра, помещенного между линзами, и передвижного устройства, перемещающего оптический фильтр перпендикулярно главной оптической оси линз (рис. 4).
Фокусирующие линзы оптического фильтра формируют между собой пучок большого диаметра (примерно 1–2 см). Оптический фильтр, помещенный в широкий пучок между линзами, ослабляет излучение на длине волны возбуждения флюоресценции в заданное число раз (β ≈ 1000), при этом остальная часть спектра ослабляется незначительно (примерно на 10% в зависимости от фильтра). Путем варьирования площади перекрытия пучка и фильтра посредством передвижного устройства можно изменять соотношение пиков обратного рассеяния и флюоресценции в спектре. Передвижное устройство представляет собой систему регулировочных винтов, позволяющих передвигать фильтр в широком параллельном пучке между линзами коллиматора. Данная конструкция позволит идентичным образом настраивать все приборы.
ОСОБЕННОСТИ АНАЛИЗА ДАННЫХ
Как правило, зарегистрированные спектры диффузного отражения без дополнительной обработки анализировать сложно, так как их вид в основном определяется спектральными характеристиками самого источника излучения. Поэтому для дальнейшего анализа используют нормировку на спектры диффузного отражения, полученные от материалов с известными показателями. В оптике в качестве такого материала часто используют фторопласт ФТ-4 ввиду того, что данный материал имеет высокую степень однородности, не флюоресцирует и активно рассеивает излучение во всем видимом диапазоне спектра. На рис. 5 показаны спектры флюоресценции и диффузного отражения, снятые при помощи нового диагностического комплекса, а также рассчитанные коэффициенты диффузного отражения.
Рис. 5.
Пример спектров сальника крысы: а – зарегистрированный спектр флюоресценции, длина волны возбуждения λe = 365 нм; б – зарегистрированный спектр диффузного отражения; в – рассчитанные коэффициенты диффузного отражения.
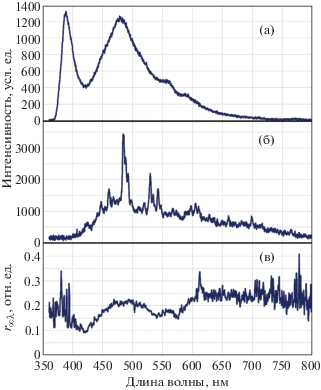
На рис. 5а представлен характерный спектр вторичного излучения биоткани, полученный при воздействии на ее поверхность лазерным излучением с длиной волны λe = 365 нм. Спектр имеет ярко выраженный пик диффузного отражения на длине волны возбуждения, уменьшенный фильтром, и пик флюоресценции с максимумом на длине волны 470 нм. Без дополнительного анализа можно ошибочно заключить, что в спектре также присутствуют два небольших пика на длинах волн около 560 и 590 нм. Однако дальнейший анализ коэффициентов диффузного отражения (см. рис. 5в) показывает, что эти максимумы в спектре флюоресценции связаны с резким изменением поглощения на данных длинах волн. Провал, наблюдаемый на графике (см. рис. 5в) в зеленом диапазоне длин волн соответствует спектру поглощения оксигемоглобина. Таким образом, дополнительный анализ спектра коэффициентов диффузного отражения необходим для устранения возможных неточностей и ошибок при интерпретации данных. Кроме того, данный спектр можно использовать как самостоятельные результаты, по которым можно оценить степень кровенаполнения биотканей.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ УСТРОЙСТВА
Следует отметить, что основные характеристики описанного выше устройства определяются характеристиками выбранных компонентов под определенные задачи. К примеру, в системе “Мультиком”, предназначенной для исследований эндогенной флюоресценции кожи и слизистых в видимом и ближнем и.к.-диапазонах, используется спектрометр с рабочим диапазоном 350–800 нм. Импульсный ксеноновый источник AvaLight-XE (Avantes, Inc., USA) с энергией импульса 39 мкДж (оптическая мощность в одном волокне диаметром 200 мкм – 20 мкВт) имеет максимальную частоту повторения импульсов 100 Гц. Число вспышек источника белого света для исследования свойств тканей подбирается исходя из максимальной амплитуды сигнала, которая может быть детектирована спектрометром.
Для макета устройства с использованием технологии ручной сборки был изготовлен оптоволоконный зонд (ООО “НТЦ волоконно-оптических устройств”, РФ) с сорока осветительными и одним приемным волокнами (см. рис. 3) [13]. Экспериментально было установлено, что при использовании зонда с 19-ю освещающими волокнами диаметром 100 мкм и одним приемным волокном диаметром 400 мкм для источника белого света достаточно пяти вспышек при исследовании кожи и мягких тканей и одной вспышки – для измерения спектра диффузного отражения светорассеивающей меры (фторопласта).
Аналогичным образом подбирались величины максимумов обратного рассеяния и флюоресценции в регистрируемом спектре (см. рис. 5а), которые варьировались изменением непосредственно мощности лазерного излучения и используемым фильтром. Представленный прибор “Мультиком” калибровался, исходя из задачи воспроизведения спектров, полученных на комплексе ЛАКК-М (ООО “ЛАЗМА”, РФ). Для калибровки использовались фторопластовые меры с флюорофором, описанные в [14]. Мощность излучения на выходе оптического волокна была установлена: для лазера с длиной волны 405 нм (7 освещающих волокон) – 4.8 мВт; 515 нм (7 освещающих волокон) – 5.8 мВт; 635 нм (7 освещающих волокон) – 3.3 мВт.
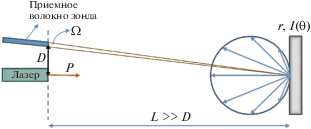
Для анализа чувствительности прибора был проведен эксперимент, схема которого представлена на рис. 6.
Излучение от лазерного источника, мощность P которого измерялась при помощи универсального фотодатчика PD300 (OPHIR Ltd., Израиль), падало перпендикулярно на поверхность светорассеивающего материала с заданным коэффициентом диффузного рассеяния r и известной зависимостью интенсивности рассеянного излучения от угла рассеяния I(θ). В качестве такого материала была взята мера диффузного отражения Spectralon (Labsphere Ltd., New Hampshire, USA), которая близка к идеальной ламбертовской поверхности с коэффициентом диффузного отражения r = 0.75 во всем интересующем нас диапазоне длин волн.
Приемное волокно располагалось на расстоянии D < 5 см, расстояние L от лазерного источника до меры должно быть много больше D и бралось более 1 м. Таким образом, вторичный источник в такой геометрии измерения можно считать точечным, расположение приемного волокна – перпендикулярным по отношению к поверхности меры, а телесный угол Ω, образованный приемным волокном, – малым. Мощность излучения, попавшего в приемное волокно, можно оценить по формуле
где d – диаметр приемного волокна.Расстояние L и фильтр (см. рис. 6) подбирались таким образом, чтоб сигнал, приходящий на устройство, был минимальным, но при этом отличимым от шума. Было определено, что пороговое значение мощности излучения, которое может быть зарегистрировано устройством, имеет порядок 10–12 Вт без учета потерь в волокне, которые могут составлять 5–10%.
ЗАКЛЮЧЕНИЕ
В данной работе описано устройство для лазерной флюоресцентной спектроскопии, конструкционные особенности элементов которого способны существенно повысить точность метода и предоставить дополнительную информацию клиницисту. Специальная конструкция блока фильтров позволяет подбирать передаточную функцию прибора для воспроизведения результатов исследований, полученных при помощи приборов других производителей. Конструкция оптоволоконного зонда позволяет исключить ошибки, связанные с несовпадением диагностических объемов при использовании нескольких источников излучения, а также с поворотом зонда вокруг своей оси. Мы полагаем, что после разработки мер для нормировки передаточных функций на основе представленного комплекса будет возможна разработка диагностических методик и алгоритмов обработки, универсальных для приборов всего класса.
Список литературы
Тучин В.В. Лазеры и волоконная оптика в биомедицинских исследованиях. Саратов: Изд-во Саратовского университета, 2010. С. 66–67.
Рогаткин Д.А. // Медицинская физика. 2014. № 4. С. 78.
Lovell J.F., Liu T.W., Chen J., Zheng G. // Chemical reviews. 2010. № 110 (5). P. 2839. https://doi.org/10.1021/cr900236h
Линьков Г.К., Березин А.Н., Лощёнов В.Б. // Российский биотерапевтический журнал. 2005. Т. 4. № 4. С. 114.
Лощенов В.Б., Волкова А.И., Прохоров А.М., Стратонников А.А. // Российский химический журнал. 1998. Т. XLII. № 5. С. 50.
Guseva I., Rogatkin D., Kulikova P., Kulikov D. // Proc. of the 9th Int. Joint Conference on Biomedical Engineering Systems and Technologies (BIOSTEC 2016). BIODEVICES. Portugal, SCITEPRESS, 2016. V. 1. P. 139. https://doi.org/10.5220/0005659301390144
Дунаев А.В., Дрёмин В.В., Жеребцов Е.А., Гордон П.С., Соколовский С.Г., Рафаилов Э.У. // Биотехносфера. 2013. № 2 (26). С. 38.
Kim A., Khurana M., Moriyama Y., Wilson B.C. // Journal of biomedical optics. 2010. V. 15. № 6. P. 067006. https://doi.org/10.1117/1.3523616
Lim L., Nichols B.S., Rajaram N., Tunnell J.W. // Journal of biomedical optics. 2011. V. 16. № 1. P. 011012. https://doi.org/10.1117/1.3525288
Rogatkin D.A., Prisnyakova O.A., Moiseeva L.G., Cherkasov A.C. // Measurement Techniques. 1998. V. 41. № 7. P. 670. https://doi.org/10.1007/BF02504894
Rogatkin D., Guseva I., Lapaeva L. // Journal of Fluorescence. 2015. V. 25(4). P. 917. https://doi.org/10.1007/s10895-015-1572-7
Kokhanovsky A.A. // Journal of the Optical Society of America. 2010. V. A 27. P. 1896. https://doi.org/10.1364/JOSAA.26.001896
Даниелян Г.Л., Шилов И.П., Кочмарев Л.Ю., Иванов А.В., Замятин А.А., Маковецкий А.А., Кузнецов О.О. // Медицинская физика. 2014. № 1. С. 51.
Rogatkin D., Guseva I., Lapaeva L. // Journal of fluorescence. 2015. T. 25. № 4. C. 917.
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента