Приборы и техника эксперимента, 2020, № 6, стр. 64-70
СПЕКТРОФОТОМЕРИЯ ВОД В УЛЬТРАФИОЛЕТОВОМ И ВИДИМОМ ДИАПАЗОНЕ КАК ЭЛЕМЕНТ ЭКОАНАЛИТИКИ ВОДНЫХ РЕСУРСОВ
Н. Л. Алукер a, *, M. E. Herrmann b, **, Я. М. Суздальцева c, ***
a Кемеровский государственный университет
650000 Кемерово, ул. Красная, 6, Россия
b Department of Meteorology and Atmospheric Science, The Pennsylvania State University
PA, USA
c Институт экологии человека Федерального исследовательского центра
“Институт углехимии и химического материаловедения СО РАН”
650065 Кемерово, просп. Ленинградский, 10, Россия
* E-mail: naluker@gmail.com
** E-mail: maria.herrmann@psu.edu
*** E-mail: y-komarova@mail.ru
Поступила в редакцию 17.04.2020
После доработки 01.05.2020
Принята к публикации 04.05.2020
Аннотация
Обосновано использование электронных спектров поглощения природных и питьевых вод в ультрафиолетовой (у.ф.) области спектра для первичной оценки качества исходных проб воды. Это позволяет в ряде случаев определять на количественном уровне содержание некоторых истинно растворенных примесей или хромофорных групп в воде. Прямая спектрофотомерия в у.ф.-области исходных водных проб предлагается в качестве дешевого и экспрессного метода для текущего мониторинга в экоаналитике водных ресурсов.
1. ВВЕДЕНИЕ
Вода представляет собой универсальный растворитель, необходимый для протекания жизненно важных биохимических реакций. Большинство солей хорошо растворяются в воде, образуя истинные растворы. Ряд веществ при взаимодействии с водой подвергаются гидролизу, т.е. происходит разложение и вещества, и воды с образованием новых соединений [1, 2].
Растворенные неорганические и органические вещества присутствуют во всех без исключения типах природных вод.
В подавляющем большинстве случаев солевой состав вод определяется катионами Ca2+, Mg2+, Na+, K+ и анионами Cl–, ${\text{SO}}_{4}^{{2 - }}$, ${\text{NO}}_{3}^{ - }$ и ${\text{HCO}}_{3}^{ - }$. Щелочность вод в основном определяется наличием гидрокарбонатов и карбонатов, сухой остаток – суммой массовой концентрации анионов (гидрокарбонатов и карбонатов, хлоридов и сульфатов) и катионов (кальция, магния, натрия и калия) [1, 2], а общая жесткость воды – содержанием растворимых солей кальция и магния [1, 2]. Мутность воды обусловлена присутствием в ней взвешенных частиц минерального и органического происхождения [1, 2]. Состав органических веществ довольно сложен и может быть представлен всеми классами органических соединений, что затрудняет идентификацию химического состава воды.
Для оценки качества питьевых вод, являющихся основным продуктом питания и источником ряда необходимых элементов, поступающих в организм человека, во всем мире применяются немногим отличающиеся, но, в принципе, очень близкие нормативы. Анализ воды проводится аккредитованными лабораториями, имеющими права проведения анализа по определенной номенклатуре показателей, которых, в принципе, более 100 [3]. Это газы, неорганические примеси катионной и анионной природы, органические соединения, микроорганизмы, радионуклиды, что делает полный анализ воды чрезвычайно дорогостоящим и трудоемким процессом. В связи с этим зачастую проводится анализ по сокращенной номенклатуре, включающей в себя простейшие комплексные показатели, зачастую не характеризующие достаточно адекватно качество воды [4].
Актуальность внедрения методов, позволяющих анализировать воды разного происхождения и примесного состава, не требующих сложного аппаратурного обеспечения и нетрудоемких, не вызывает сомнения. К таким методам можно отнести оптические методы исследования, позволяющие, в принципе, не только определить присутствующую примесь, но зачастую и степень ее окисления (валентность), отслеживая химические превращения по изменению спектров. Однако прямые спектральные измерения, широко применяемые в научных исследованиях, практически не реализуются в лабораториях, контролирующих качество вод, несмотря на то что практически все современные лаборатории снабжены спектрофотометрами и люминесцентными спектрометрами, которые применяются при реализации методов мокрой “химии” (превращение исходного продукта специальными реактивами в “аналит” с выраженными характерными свойствами с его последующим анализом) [5].
В данной работе спектрофотометрический метод исследования применяется для первичного анализа исходных неизмененных проб воды, что позволяет оценить качество вод по их спектру поглощения в ультрафиолетовой (у.ф.) и видимой области и на количественном уровне определить содержание в воде ряда истинно растворенных примесей или хромофорных групп.
В работе обосновано применение метода для оценки качества природных и питьевых вод.
2. ВОЗМОЖНОСТИ СПЕКТРОФОТОМЕТРИИ В У.Ф.- И ВИДИМОЙ ОБЛАСТИ СПЕКТРА ДЛЯ АНАЛИЗА КАЧЕСТВА ИСХОДНЫХ ПРОБ ВОДЫ
Чистая вода в у.ф.- и видимой области спектра прозрачна. Слабое поглощение воды в коротковолновой у.ф.-области может быть обусловлено собственным поглощением воды (167 нм, 1480 л/(моль · см)) за счет электронного перехода n → σ* и поглощением OН– (187 нм, 50 000 л/(моль · см)) [6]. Коротковолновое поглощение дистиллированной воды может быть обусловлено также содержащимися в ней на уровне сотен миллиграмм на литр хлоридами, сульфатами, гидрокарбонатами и нитратами металлов. В ближней инфракрасной (и.к.) области у воды наблюдаются полосы с максимумом 980 нм и более коротковолновые слабые полосы. Эти полосы являются проявлением обертонов гармоник основных частот и.к.-колебаний и их интерференцией.
При отсутствии в воде микроорганизмов и примесей в диапазоне 205–720 нм свежая дистиллированная вода является прозрачной на уровне коэффициента поглощения ≤0.01 см–1.
Однако в природе чистой воды, состоящей только из молекул Н2О, не существует. Она всегда содержит растворенные в ней вещества, кроме того, в воде могут присутствовать малые коллоидные частицы и кластеры металлов. Поглощение вод в у.ф.-области может быть хорошим индикатором наличия в ней растворенных соединений, а бесструктурное повышение поглощения в видимой области – показателем наличия взвешенных (нерастворенных) частиц.
Способность к поглощению зависит от электронного строения молекул, и обычно ее связывают с наличием в молекуле хромофорных групп. При загрязнении воды определенными хромофорами в спектрах оптического поглощения будут наблюдаться определенные полосы поглощения. Ряд растворенных соединений, например азота в виде нитратов и нитритов металлов, хорошо поглощают свет и надежно проявляются в спектрах поглощения вод [7]. При больших концентрациях в видимой части спектра может проявляться поглощение, обусловленное ионами (комплексами) металлов.
Наличие взвешенных частиц (газовых пузырьков) микронного размера в воде будет приводить к увеличению поглощения (рассеяния) по всей области изучаемого спектра. Более мелкие (коллоидные) частицы могут обусловливать рассеяние, спадающее от у.ф.- в длинноволновую область, накладывающееся на поглощение.
Исходя из возможностей метода, такие показатели, как мутность, цветность и прозрачность воды, априори можно определять по поглощению, так как это сугубо оптические показатели, которые можно нормировать по коэффициенту поглощения и рассеивания. Более того, по виду спектра поглощения для рассеивающих сред можно определить размер рассеивающих частиц. Таким образом, анализ измеренного спектра поглощения в широком диапазоне длин волн позволяет сделать ряд важных выводов о качестве воды.
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1. Аппаратура
Исследование спектров поглощения проводилось на спектрофотометре SHIMADZY UV-1700, работающем в диапазоне длин волн 190–1100 нм. Модель имеет двулучевую оптику, оптическая ширина щели может принимать значения: 0.1, 0.2, 0.5, 1, 2 и 5 нм. Оптическая плотность A измеряется в диапазоне 0–4 с точностью 0.001. При измерениях использовались кварцевые кюветы разных толщин и рассчитывался коэффициент поглощения в обратных сантиметрах. При обработке из спектров растворов вычитался спектр поглощения дистиллированной воды. В качестве источников сканирующего излучения в у.ф.-области спектра использовались дейтериевые, а в видимой области – галогеновые лампы.
3.2. Оценка пределов обнаружения растворенных в воде примесей методом прямой спектрофотомерии проб
В связи с тем что в большинстве небольших населенных пунктов питьевую воду чаще всего получают из персональных скважин, централизованный контроль этой воды не осуществляется. Оценка ее безопасности для населения непомерно дорога, поэтому поиск простых и дешевых методов экспрессной оценки качества используемой воды, несомненно, актуален. Значимость этой проблемы возрастает в связи с истощением ресурсов, а также с нарастающим антропогенным загрязнением окружающей среды, приводящим к ухудшению качества подземных и поверхностных вод [1, 2].
На основании теоретических предпосылок и предварительных исследований можно предложить метод прямой спектрофотомерии проб воды в у.ф.- и видимой области в качестве первичного метода анализа качества воды, потребляемой населением для питьевых и бытовых целей.
Установить структуру молекул или ионов, содержащихся в воде, основываясь на изучении только спектров поглощения, удается далеко не всегда [7]. Зачастую для дополнительного изучения физико-химических свойств сложных молекулярных систем применяются люминесцентные методы анализа, обладающие чувствительностью, во много раз превышающей чувствительность спектрофотометрических методов [8]. Однако спектр поглощения воды в случае значительного его отличия от характерного для воды со средними показателями загрязнения может являться сигналом для проведения более подробного анализа.
Для большинства катионов металлов (без пробоподготовки) поглощение в воде может наблюдаться в области 300–1000 нм с коэффициентами молярной экстинкции, не превышающими 10 л/(моль · см), поэтому прямое спектрофотометрическое определение их концентрации на уровне предельно допустимой концентрации (п.д.к.) не представляется возможным. Из металлических примесей только шестивалентный хром и семивалентный марганец могут быть определены в воде на уровне п.д.к. по спектру поглощения их характерных хромофорных групп.
Иная ситуация с определением анионов или анионных групп, которые являются оптически активными в у.ф.-области и обладают высокими коэффициентами молярной экстинкции, что позволяет регистрировать их с высокой степенью надежности и хорошей чувствительностью.
Практически все анионы при содержании их в воде на уровне, не превышающем п.д.к., проявляются в спектре поглощения, и содержание некоторых из них можно определить прямым измерением поглощения анализируемых проб воды в у.ф.-области.
Оценим пределы обнаружения растворенных в воде анионов с использованием модельных систем на основе приготовленных в лабораторных условиях растворов с изменяющимися анионными группами. В качестве основного катиона был выбран калий, так как его присутствие не влияет на спектр поглощения в рассматриваемой области спектра.
Наиболее хорошо в у.ф.-области из анионов поглощают свет йодид-ионы, бромид-ионы, нитрат-ионы, нитрит-ионы. Их определение возможно на уровне концентрации десятки микрограмм на литр при существенно разных п.д.к.: для йода и брома это сотни микрограмм на литр, а для нитратов и нитритов – миллиграммы на литр. Предельно допустимая концентрация, естественно, отражает распространенность данных анионов в водах. Таким образом, именно нитрат-ион, имеющий наиболее высокое значение п.д.к. (45 мг/л) и низкий предел обнаружения, наиболее вероятно будет определять поглощение вод в у.ф.-области [7].
Сульфаты имеют полосу поглощения с максимумом в области 215 нм с коэффициентом молярной экстинкции порядка 2300 л/(моль · см).
Хлориды, гидрокарбонаты и дигидрофосфаты надежно определить прямым спектрофотометрическим методом нельзя, так как максимумы их полос поглощения не находятся в анализируемой области спектра, а коэффициенты молярной экстинкции в десятки раз ниже нитратов и сульфатов. Данные анионные группы при содержании на допустимых уровнях повышают поглощение воды в области ≤190 нм, слабо влияя на спектр поглощения ≥210 нм.
Ряд катионов с переменной валентностью, таких как шестивалентный хром, образуя анионные хромофорные группы с максимумами поглощения на длинах волн 270, 370 нм, могут в сантиметровой толщине слоя определяться на уровне двух п.д.к., и, следовательно, их определение на уровне п.д.к. технически возможно при увеличении толщины слоя. Семивалентный марганец надежно определяется на уровне п.д.к. по характерному структурируемому поглощению в диапазоне длин волн 525–545 нм. Фенол, имея поглощение при 211 и 270 нм, может быть определен на уровне фенольного индекса 0.25 мг/л.
Поглощение, схожее с характерным поглощением фенола в области 270 нм по форме полосы, но с небольшим сдвигом в длинноволновую область, может наблюдаться для аминокислот, особенно тирозина и триптофана, которые входят в состав практически каждой белковой молекулы. Однако учет положения максимумов (сдвиг в длинноволновую область) и соотношений интенсивностей полос поглощения, характерных для этих аминокислот, не приведут к завышению концентрации фенола, определяемой по у.ф.-спектру поглощения. И фенол, и аминокислоты (тирозин и триптофан) лучше диагностируются по их спектрам фотолюминесценции при возбуждении в области полос поглощения.
Спектры поглощения бензинов обладают определенной информативностью, однако определить загрязнение воды нефтепродуктами на уровне п.д.к. невозможно без привлечения люминесцентных исследований, имеющих большую чувствительность.
Таким образом, спектрофотометрия в у.ф.- и видимой области может стать простым и экспрессным методом первичного анализа качества воды, не требующим подготовки проб, экстракции или введения дополнительных химических реактивов в отобранные анализируемые пробы. В ряде случаев метод позволяет провести количественную оценку следующих растворенных в воде примесей:
• йодид-ионов, начиная с 50 мкг/л при п.д.к. 125 мкг/л;
• бромид-ионов, начиная с 30 мкг/л при п.д.к. 200 мкг/л;
• нитрат-ионов, начиная с 40 мкг/л при п.д.к. 45 мг/л;
• нитрит-ионов, начиная с 30 мкг/л при п.д.к. 3 мг/л;
• хрома (6) – на уровне 0.1 мг/л при п.д.к. 0.05 мг/л;
• марганца (7) – на уровне 0.1 мг/л при п.д.к. 0.1 мг/л;
• фенола – на уровне 0.2 мг/л при п.д.к. 0.25 мг/л.
Во всех проведенных нами экспериментах не применялось ни дополнительной подготовки проб, ни введения катализаторов, скорость выполнения анализа была существенно выше существующих методов анализа водных проб.
3.3. Моделирование спектров поглощения проб вод с допустимыми показателями загрязнения
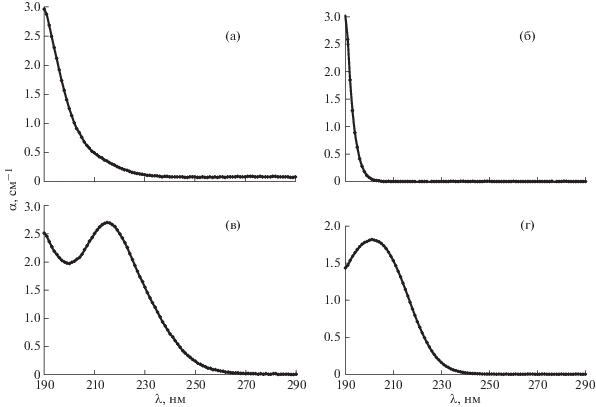
На основании проведенных исследований на модельных системах и данных о характерных содержаниях примесей в водах разного генезиса мы смоделировали спектры поглощения дистиллированной воды c допустимым содержанием анионов для преимущественно карбонатных, сульфатных, хлоридных и нитратных вод (рис. 1).
Рис. 1.
Общий вид спектров поглощения вод с преимущественными типами анионов: а – карбонатные воды, концентрация ${\text{CO}}_{3}^{{2 - }}$ 100 мг/л; б – хлоридные воды, концентрация Cl– 100 мг/л; в – сульфатные воды, концентрация ${\text{SO}}_{4}^{{2 - }}$ 50 мг/л; г – нитратные воды, концентрация ${\text{NO}}_{3}^{ - }$ 12 мг/л.
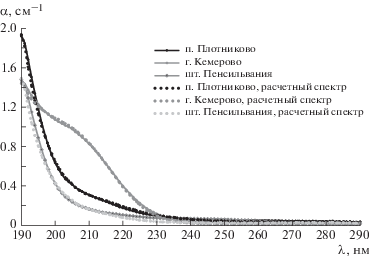
На рис. 2 приведен как рассчитанный на основании стандартных содержаний анионов, так и реально измеренный спектр поглощения дистиллированной воды.
3.4. Поглощение реальных проб природных и питьевых вод
На рис. 3 приведены спектры поглощения вод, используемых населением в качестве питьевых. Основное поглощение в области 202 нм обусловлено нитрат-ионом [7], а в области ~190 нм – хлоридами и гидрокарбонатами.
Рис. 3.
Спектры поглощения питьевых вод, отобранных в населенных пунктах Кемеровской области: а – в п. Березовский (скважины № 1 и № 2), здесь же сравнительные спектры поглощения ${\text{NO}}_{3}^{ - }$ для определения концентраций нитрат-иона в скважинах; б – в п. Ариничево (водопровод), концентрация ${\text{NO}}_{3}^{ - }$ 270 мг/л; в – спектры поглощения водопроводных вод в п.г.т. Промышленная, п. Плотниково и г. Кемерово; г – в п. Бархатово из различных источников.
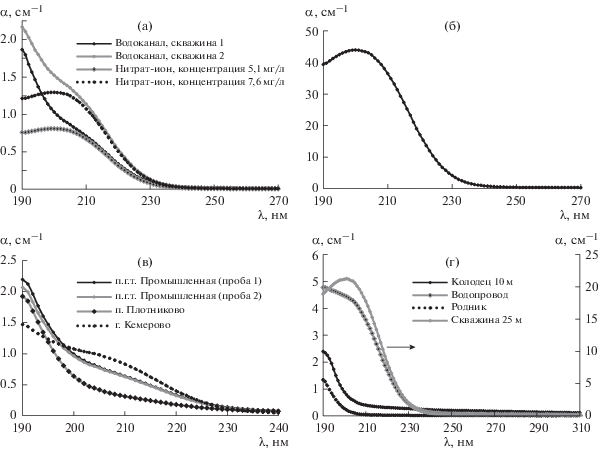
Поглощение при длине волны 202 нм колеблется для разных проб воды в диапазоне от 0.5 до 45 см–1, т.е. в изменяется 90 раз, достигая значения 270 мг/л по ${\text{NO}}_{3}^{ - }$ (шестикратное превышение п.д.к.). При этом вода абсолютно прозрачна на вид и не имеет запаха.
В централизованно подготовленной питьевой воде нитраты также наблюдаются в спектре поглощения на уровне 5–7 мг/л (на рис. 3а в скважине 1 на уровне 5.7 мг/л; в скважине 2 – 7.6 мг/л). В п. Бархатово более высокие концентрации нитрат-иона обнаружены в воде из 25-метровой скважины, а в родниковой воде и воде из колодца глубиной 10 м нитратов немного (см. рис. 3г).
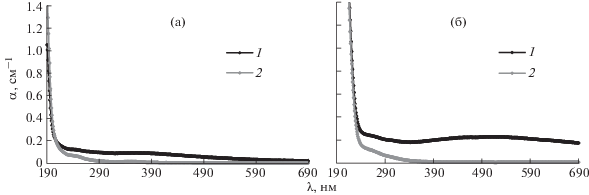
На рис. 4 приведены спектры поглощения вод из частной скважины (шт. Пенсильвания, США) до очистки, показавшие превышение по железу и марганцу, и после их очистки, а также спектры поглощения вод из Кемеровской области до и после отстаивания.
Рис. 4.
Спектры поглощения вод, загрязненных железом и марганцем выше уровня п.д.к.: а – из скважины в шт. Пенсильвания, США до (1) и после очистки системой фильтров (2); б – в Кемеровской области до (3) и после отстаивания (4).
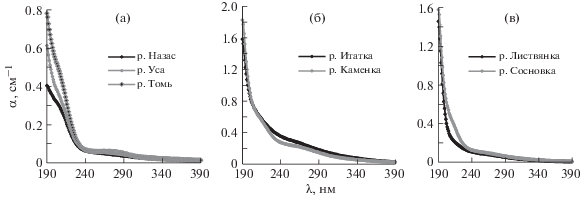
На рис. 5 приведен ряд спектров поглощения поверхностных вод (воды, отобранные в реках в окрестностях г. Междуреченска, п. Итатского и п. Бархатово Кемеровской области). Наилучшие характеристики поглощения имеет вода из р. Назас (рис. 5а). Эта река сопоставима по размерам с реками в окрестностях п. Итатского и п. Бархатово, протекающими по более антропогенно загрязненным территориям (рис. 5б и 5в). Воды таких крупных рек, как Томь и Уса, в своих верховьях также имеют характеристики лучше, чем питьевые водопроводные воды (рис. 5а).
Рис. 5.
Спектры поглощения поверхностных вод Кемеровской области, отобранных в окрестностях г. Междуреченска (а); п. Итатского (б); п. Бархатово (в).
На рис. 6 приведены расчетные и реально измеренные спектры питьевых вод.
Программная обработка реально измеренных спектров на основании модельных спектров с преимущественными типами анионов позволяет оценить концентрации растворенных в воде анионных групп. Лучшие совпадения реальных и расчетных спектров получены при следующих концентрациях: Cl– – 16.7 мг/л, ${\text{CO}}_{3}^{{2 - }}$ – 45.5 мг/л, ${\text{SO}}_{4}^{{2 - }}$ – 1.67 мг/л (п. Плотниково); Cl– – 10 мг/л, ${\text{CO}}_{3}^{{2 - }}$ – 14.3 мг/л, ${\text{NO}}_{3}^{ - }$ – 6 мг/л (г. Кемерово); Cl– – 16.7 мг/л, ${\text{CO}}_{3}^{{2 - }}$ – 33 мг/л (шт. Пенсильвания).
4. ЗАКЛЮЧЕНИЕ
В работе обоснован вывод о возможности проведения первичной оценки исходных проб воды (без пробоподготовки) спектрофотометрическим методом и проведена количественная оценка содержания ряда анионных примесей, растворенных в воде. Следует отметить, что спектрофотометрический метод позволяет проводить оценку именно истинно растворенных в воде примесей и, зачастую, их присутствия в разных формах окисления.
Загрязнение нитратами подземных вод, являющееся в настоящее время одной из серьезных экологических проблем, легко выявляется по спектру поглощения воды. Это позволяет рекомендовать метод для текущего мониторинга как элемент экоаналитики водных ресурсов. В настоящее время ни одна из действующих методик исследования вод не связана с прямым исследованием спектров поглощения воды в у.ф.-области, позволяющим определять растворенные в воде примеси без дополнительных процедур подготовки проб или введения химических реагентов.
Список литературы
СанПиН 2.1.4.1175-02. Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников. Москва. 2003.
СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения (с изменениями на 2 апреля 2018 года). 2001.
Грудинкина Н.П. // Оптика и спектроскопия. 1956. Т. 1. Вып. 5. С. 658.
Шмидт В. Оптическая спектроскопия для химиков и биологов. М.: Техносфера, 2007.
Танасюк Д.А., Ермаков В.И. // Успехи в химии и химической технологии. 2013. Т. 27. № 6. С. 55.
Клюбин В.В., Клюбина К.А., Маковецкая К.Н. // Журнал физической химии. 2017. Т. 91. № 6. С. 973. https://doi.org/10.7868/S0044453717060140
ГОСТ 18826-73. Вода питьевая. Методы определения содержания нитратов.
ГОСТ 4192-82. Вода питьевая. Методы определения минеральных азотсодержащих веществ.
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента