Приборы и техника эксперимента, 2021, № 2, стр. 128-131
УСТАНОВКА ДЛЯ ЛАЗЕРНЫХ ВОЛОКОННЫХ ПЕРФОРАЦИЙ БИОМАТЕРИАЛОВ
Н. В. Минаев a, В. И. Юсупов a, *
a Институт фотонных технологий ФНИЦ “Кристаллография и фотоника” РАН
108840 Москва, Троицк, ул. Пионерская, 2, Россия
* E-mail: iouss@yandex.ru
Поступила в редакцию 18.08.2020
После доработки 26.08.2020
Принята к публикации 28.08.2020
Аннотация
Установка предназначена для проведения перфораций биологических материалов с помощью волоконных лазеров. Перфорации проводятся при различных параметрах лазерных воздействий (непрерывное и импульсное излучение, длина волны, мощность) и заданной силе прижима оптического волокна к поверхности биоткани. Для регистрации быстропротекающих процессов используется скоростная видеосъемка и акустические измерения. При перфорации ткани контролируются температура разогрева торца волокна, его положение и скорость перемещения. Система разработана для совершенствования лазерных пункционных технологий, подбора оптимальных параметров лазерного воздействия и разработки новой медицинской робототехники.
1. ВВЕДЕНИЕ
С появлением достаточно компактных и мощных лазеров, излучение которых передается по оптическому волокну, получили развитие пункционные лазерные медицинские операции, основанные на перфорации различных тканей [1], т.е. формировании лазерного канала (отверстия) в биоткани путем осевого продвижения оптического волокна при нагреве его торца и близлежащих к нему водосодержащих тканей лазерным излучением. Такое каналирование проводится, например, при лечении межпозвонковых дисков в случае радикулитов, для пункционной лазерной деструкции чувствительного корешка тройничного нерва, при лазерной остеоперфорации (перфорации стенки кости) при лечении остеомиелита [2, 3].
Лазерные медицинские перфорации проводятся при различных параметрах лазерных воздействий (непрерывное и импульсное излучение, длина волны, мощность), с использованием разных оптических волокон и при заданных силах прижима оптоволокна к поверхности биоткани. Все эти параметры влияют на скорость выполнения процедуры, эффективность, отдаленные последствия и безопасность той или иной медицинской технологии. Поэтому для подбора оптимальных параметров воздействия, совершенствования лазерных медицинских технологий и разработки новой медицинской робототехники необходимо систематическое изучение процессов, происходящих при лазерных перфорациях. Именно для этих целей создана установка, описанная ниже.
2. КОНСТРУКЦИЯ УСТАНОВКИ
Принципиальная схема установки для лазерных волоконных перфораций биоматериалов представлена на рис. 1. Одним из основных элементов системы является набор волоконных лазеров умеренной мощности с длинами волн 0.97, 1.47, 1.56, 1.94 мкм и др., которые широко применяются в современных медицинских технологиях. Излучение от лазера по оптическому волокну через оптический разветвитель 1 подводится с помощью держателя волокна 2 к поверхности биоматериала 3. Образец биоматериала закрепляется на подставке на дне прозрачной кюветы 4 из поликарбоната, заполненной рабочей жидкостью (обычно водой или водным раствором).
Рис. 1.
Принципиальная схема установки для лазерных волоконных перфораций. 1 – оптический разветвитель; 2 – держатель волокна; 3 – биоматериал; 4 – кювета с водой; 5 – широкополосный гидрофон; 6 – игольчатый гидрофон с предусилителем; 7 – запоминающий осциллограф; 8 – спектрометр; 9 – подвижная платформа; 10 – датчик перемещений; 11 – скоростная камера; 12 – фронтальная подсветка; 13 − персональный компьютер.
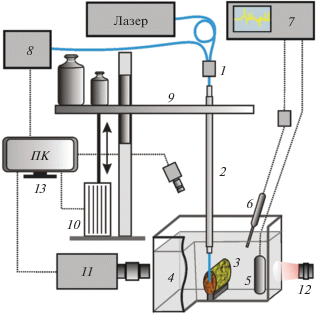
Другим важным элементом системы является установленная на вертикальной стойке платформа 9, которая по миниатюрной линейной направляющей MGN-9 (HIWIN, Тайвань) может свободно перемещаться в вертикальном направлении. На платформе жестко закреплен держатель волокна 2. Снизу к платформе подходит шток потенциометрического датчика линейных перемещений (10) ЛТР-50 (Sensor Systems Solutions, РФ), выход которого соединен через преобразователь сигнала с осциллографом или компьютером. Датчик позволяет определять положение торца волокна в биоткани с точностью 10 мкм в диапазоне перемещений 50 мм. Сверху на платформу могут устанавливаться калиброванные гири для обеспечения необходимой силы прижима оптического волокна к биоткани.
Для контроля динамических процессов в жидкости используется оптоакустический метод [4, 5]. В свободном объеме кюветы с рабочей жидкостью размещают широкополосный гидрофон (5) 8103 (B&K, Denmark) с полосой частот 0.1 Гц–500 кГц. Для регистрации быстропротекающих процессов под необходимым углом к месту контакта оптоволокна с биоматериалом устанавливают игольчатый гидрофон 6 (Precision Acoustics, UK) диаметром 1 мм с шириной полосы 10 кГц–50 МГц. Регистрацию полученных акустических данных осуществляют с помощью цифрового четырехканального запоминающего осциллографа (7) GOS 72304 (GW Instek, Тайвань) с полосой дискретизации 300 МГц.
Оптическое излучение от дополнительного оптического канала разветвителя 1 через оптоволокно поступает на спектрометр 8 (Ocean Optics, США) или на скоростной фотодиод OD-08AF/С (Авеста, РФ). С их помощью регистрируется спектр или мощность сигнала, отраженного от рабочего торца оптического волокна. Амплитуда этого сигнала связана с показателем преломления среды на границе торца волокна, что позволяет контролировать плотность среды. Спектральные характеристики позволяют оценивать температуру вблизи торца волокна.
Для оптической регистрации процессов, развивающихся вблизи торца волокна при формировании лазерных каналов, используется высокоскоростная камера (11) Fastcam SA-3 (“Photron”, Япония) с фронтальной подсветкой 12 от набора источников белого света либо от излучения непрерывного или импульсного лазера. Это позволяет снимать серию кадров со скоростью до 105 кадров/с либо одиночные кадры с необходимой задержкой относительно лазерного импульса, синхронизируя запись с помощью компьютера. Для дополнительной оптической регистрации с другого ракурса используется камера XCAM 1080 PHD (“ToupTek”, Китай) с микроскопическим объективом.
Отдельные элементы, такие как кювета, видеокамеры и осветители, размещены на подвижках с микрометрическими винтами.
3. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
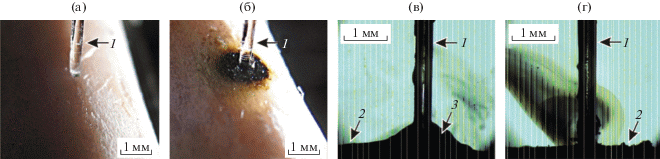
Описанная установка позволяет экспериментально исследовать процессы, происходящие при лазерных волоконных перфорациях различных биотканей. На рис. 2 приведены фотографии и кадры скоростной съемки, полученные во время лазерной перфорации поверхности кости с помощью оптического волокна диаметром 400 мкм. Исследовалось влияние воды вблизи торца волокна на скорость формирования канала.
Рис. 2.
Фотографии до (а) и после (б) лазерной перфорации поверхности кости и кадры скоростной съемки в процессе лазерного воздействия в присутствии капли воды (в) и без воды (г). 1 – оптическое волокно; 2 – поверхность кости; 3 – капля воды. Длина волны λ = 1.56 мкм, мощность 5 Вт, нагрузка на волокно 500 г.
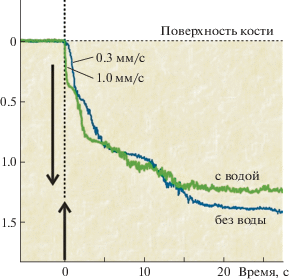
На рис. 3 приведены графики, иллюстрирующие изменение во времени глубины проникновения торца оптического волокна в кость при лазерной перфорации поверхности кости в присутствии воды и без воды. Видно, что наличие капли воды привело к значительному (в три раза) увеличению скорости перфорации верхних слоев кости.
Рис. 3.
Изменение во времени глубины проникновения торца оптического волокна в кость при лазерной перфорации поверхности кости в присутствии воды и без воды. Длина волны λ = 1.56 мкм, мощность 5 Вт, нагрузка на волокно 500 г. Нижняя стрелка показывает момент включения лазерного излучения.
Оптическая регистрация процессов, происходящих при лазерной перфорации водосодержащих биотканей, является очень информативной. На рис. 4 представлены последовательные кадры видеосъемки процесса воздействия лазерного излучения на образец хрящевой ткани. Видно, что вблизи торца происходит постепенная карбонизация ткани, сопровождающаяся актами горения (2 на рис. 4). Проведенный эксперимент показывает, что максимальные значения температуры в биоткани достигаются не на торце волокна, а на удалении ~1 мм от него.
Рис. 4.
Последовательные кадры видеосъемки при воздействии лазерным излучением на хрящевую ткань. 1 – торец оптического волокна; 2 – горение ткани. Длина волны λ = 1.56 мкм, мощность 3 Вт.

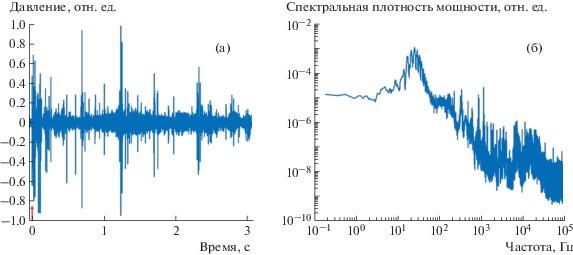
Другую возможность установки иллюстрирует рис. 5, на котором показаны акустический сигнал и его спектр, полученные при лазерном формировании канала в кровенасыщенном образце биоматериала. Видно, что сигнал имеет вид коротких, интенсивных и спектрально широких акустических колебаний ударного типа. Это указывает на то, что при продвижении волокна в глубь образца вблизи торца волокна происходят акты взрывного кипения воды [6].
4. ЗАКЛЮЧЕНИЕ
Представленная экспериментальная установка позволяет проводить исследования процессов, происходящих при лазерных волоконных перфорациях биотканей. Помимо применения информативных методов оптики и оптоакустики, установка обеспечивает перемещение волокна в биоткани с заданным нажимом с возможностью контроля положения торца оптоволокна с точностью до 10 мкм. Это является ее основным преимуществом по сравнению с описанной в [7] установкой, также позволяющей изучать процессы вблизи неподвижного торца лазерного оптоволокна.
Список литературы
Минаев В.П. // Альманах клинической медицины. 2008. Т. 17. № 2. С. 116.
Сандлер Б.И., Суляндзига Л.Н., Чудновский В.М., Юсупов В.И., Косарева О.В., Тимошенко В.С. Перспективы лечения дискогенных компрессионных форм пояснично-крестцовых радикулитов с помощью пункционных неэндоскопических лазерных операций. Владивосток: Дальнаука, 2004. ISBN 5-8044-0443-1.
Привалов В.А., Крочек И.В., Абушкин И.А., Шумилин И.И., Лаппа А.В. // Вестник экспериментальной и клинической хирургии. 2009. Т. 2. № 1. С. 19.
Карабутов А.А., Пеливанов И.М., Подымова Н.Б., Скипетров С.Е. // Квантовая электроника. 1999. Т. 29. № 3. С. 215. https://doi.org/10.1070/QE1999v029n12ABEH001630
Юсупов В.И., Коновалов А.Н., Ульянов В.А., Баграташвили В.Н. // Акустический журнал. 2016. Т. 62. № 5. С. 531. https://doi.org/10.7868/S0320791916050191
Чудновский В.М., Юсупов В.И., Дыдыкин А.В., Невожай В.И., Кисилёв А.Ю., Жуков С.А., Баграташ-вили В.Н. // Квантовая электроника. 2017. Т. 47. № 4. С. 361. https://doi.org/10.1070/QEL16298
Минаев Н.В., Юсупов В.И., Цыпина С.И., Минаев В.П. // ПТЭ. 2019. № 2. С. 157. https://doi.org/10.1134/S0032816219020137
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента