Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 77-85
Роль фитогормонов в регуляции устойчивости семян пшеницы, ржи и тритикале к действию повышенных температур при прорастании
Л. В. Чумикина 1, *, Л. И. Арабова 1, В. В. Колпакова 2, А. Ф. Топунов 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Всероссийский научно-исследовательский институт крахмалопродуктов
140051 Московская обл., п., Красково, Россия
* E-mail: chumikina@mail.ru
Поступила в редакцию 20.02.2018
После доработки 19.07.2018
Принята к публикации 25.07.2018
Аннотация
Изучена динамика изменения содержания фитогормонов – абсцизовой и индолил-3-уксусной кислот на ранних этапах прорастания семян пшеницы, ржи и тритикале (гибрид ржи и пшеницы) при нормальной температуре (22°С) и коротком тепловом шоке (40°С). В сухих зародышах пшеницы и тритикале присутствовали как свободные, так и конъюгированные индолил-3-уксусная и абсцизовая кислоты, но преобладали конъюгаты. Действие повышенных температур на зародыши в разные периоды набухания и прорастания индуцировало быстрые изменения уровня гормонов. Обнаружены изменения в соотношении этих кислот в зародышах пшеницы и тритикале при тепловом шоке, которые могут быть связаны с саморегуляцией и переходом гормонов в неактивное состояние. Установлена зависимость ростовых процессов от соотношения индолил-3-уксусная кислота/абсцизовая кислота при коротком тепловом шоке. Показано, что процессы, предшествующие проклевыванию и активному росту проростка, отличались по температурной чувствительности.
Прорастание является одним из ключевых моментов в жизни растения. Набухающие семена должны переходить к реализации новой генетической программы и обеспечить синтез необходимых для этого клеточных белков и их мРНК. Дегидратация семян на определенной стадии созревания является переключателем клеточного метаболизма, как в зародыше, так и в запасающих тканях. Она вызывает перепрограммирование клеточной активности и белкового синтеза путем супрессии синтеза белков, необходимых для созревания и индукции синтеза белков, типичных для прорастания, обеспечивая, тем самым, переход от эмбриогенеза к прорастанию. С началом прорастания происходит гидратация семени, увеличение скорости дыхания, активация многих ферментов, интенсивное деление клеток и их растяжение. Наблюдается наложение одного этапа на другой, но первым всегда является поглощение воды. Увеличение гидратации связано с растяжением и делением клеток в точках роста, так же, как и с освобождением гормонов, стимулирующих синтез ферментов и их активность.
Семена должны быть приспособлены к тому, чтобы противостоять неблагоприятным воздействиям окружающей среды и сохранять способность к прорастанию в широком диапазоне внешних условий. Одним из важнейших факторов, влияющих на скорость прорастания, является температура, оказывающая влияние и на продуктивность, и на качество семян при созревании. Механизмы негативного действия повышенных температур на прорастание в настоящее время до конца не ясны и требуют дальнейших исследований. Биохимия реакции семян на тепловой стресс включает многочисленные сложнорегулируемые процессы. Важную роль в этом играют фитогормоны, участвующие в регуляции многих физиолого-биохимических процессов, в том числе и ответа на неблагоприятные воздействия. В этих условиях в тканях растений, как правило, снижается содержание гормонов стимулирующего типа и возрастает концентрация гормонов – ингибиторов роста [1, 2].
Контроль за прорастанием осуществляется в результате конкурирующего взаимодействия между потенциалом роста зародыша и предельно допустимой силой окружающих его тканей (например, семенной кожуры). Некоторые растительные гормоны вовлекаются в этот контроль. Выделяют особую роль фитогормона ингибиторного характера – абсцизовой кислоты (АБК), которая является положительным регулятором индукции покоя и негативным – прорастания семян [3]. Особое внимание уделяется корреляции между способностью семян к прорастанию и уровнем эндогенной АБК, а также выяснению ее роли в регуляции процессов транскрипции и трансляции мРНК, необходимой для прорастания. Ингибирующий эффект АБК на процесс прорастания может быть временным и обратимым и сохраняется, пока ее содержание не понизится до уровня, не оказывающего ингибирующего действия. Такое понижение уровня АБК в семенах может происходить за счет ее метаболизма или десорбции в подготовительный период к прорастанию. Так как АБК в определенных концентрациях является сильным ингибитором прорастания и индуцирует покой у семян многих растений, необходимо знать уровень ее эндогенного содержания.
В ответ на действие различных неблагоприятных факторов: засуха, затопление, засоление и действие патогенов, в тканях растений может происходить накопление АБК. Увеличение концентрации АБК в проростках многих растений вызывают как низкие, так и высокие температуры, при этом только в первые 10 мин такое увеличение может быть связано с ее высвобождением из связанных форм. Действие АБК на растения при высоких температурах может происходить не только через индукцию синтеза белка, но и через иные механизмы. Например, АБК способна повышать теплоустойчивость растений, влияя на свойства мембран [4]. Быстрое изменение ее содержания при неблагоприятных условиях, в том числе при тепловом шоке, дает сигнал для включения механизмов адаптации к таким условиям.
Другим важным фитогормоном является индолил-3-уксусная кислота (ИУК), относящаяся к гормонам стимулирующего типа – ауксинам, веществам индольной природы. ИУК присутствует практически во всех тканях растения, а в значительных количествах обнаружена в семенах, молодых почках, листьях и цветках. ИУК играет ключевую роль в регуляции таких процессов, как рост и развитие растений, образование васкулярных тканей и пыльцы [5, 6]. Ауксин сам по себе не нужен для прорастания семян, однако ИУК необходима для роста молодых проростков [7]. Она также способна влиять на прорастание семян, действуя на активность ряда ферментов. Так, в прорастающих семенах гороха ИУК регулирует активность глиоксилазы I, приводя к высокой скорости клеточного деления и развития [7]. Ауксины участвуют в адаптивных процессах, происходящих в растении под влиянием теплового шока. Главным источником этого гормона для проростков является ИУК, накопленная в семядолях.
По мнению ряда авторов, ауксин может влиять на прорастание семян только в присутствии АБК [8, 9], однако механизм такого взаимодействия пока не известен. Существует метаболическая связь между ИУК и фитогормонами стресса – этиленом и АБК: ауксин, активируя синтез этилена, может быть триггером аккумуляции АБК [10]. Показано, что ауксин, как и АБК, играет решающую роль в индукции покоя семян и поэтому может действовать как ключевой протектор этого процесса [11].
Свободная ИУК является биологически активным соединением. При этом большая часть ауксинов находится в виде конъюгатов – запасной или транспортной формы [12], из которой ИУК высвобождается при гидролизе. Главный источник свободной ИУК для молодых проростков – конъюгаты, запасенные в семенах при созревании. В работе [13] показано, что свободная ИУК почти исчезала при созревании семян бобовых, а амидо-подобная ИУК увеличивалась и становилась главной ее формой. Соотношение конъюгированная/свободная ИУК уменьшается при развитии семени, поскольку в процессе клеточного деления и клеточной элонгации конъюгированная ИУК гидролизуется до свободной формы, а на поздней стадии созревания запасается в конъюгированном состоянии. В злаках основная доля ИУК находится в эндосперме, откуда она при набухании постепенно поступает в зародыш. При высокотемпературном стрессе в молодых метелках риса происходило уменьшение содержания ИУК и увеличение содержания АБК [14].
Ранее [15–17] нами были получены данные о влиянии температуры на процессы набухания и прорастания семян пшеницы, ржи и тритикале, а также мобилизации в них запасных белков. Особенно интересно было изучить уровень фитогормонов в зародыше, поскольку именно в нем происходит остановка и возобновление роста.
Цель работы – установить взаимосвязь между изменением уровней АБК и ИУК и характером ростовых процессов, происходящих на различных этапах набухания и раннего прорастания семян и при подготовке зародыша к возобновлению ростовой активности при нормальной и повышенной температуре (40°С).
МЕТОДИКА
Объекты исследования и условия проращивания. Объектом исследования служили семена гибрида ржи и пшеницы (тритикале, Triticosecale Wittm. & A. Camus. сорт “Немчиновская 56”), ржи (Secale cereale L. сорт "Валдай”) и мягкой озимой пшеницы (Triticum aestivum L. сорт “Ангелина”), любезно предоставленные Московским НИИ сельского хозяйства “Немчиновка” (МосНИИСХ, Россия). Семена были собраны в 2014 г., первоначально хранились при комнатной температуре, затем в течение года после сбора урожая при 5°С.
В экспериментах использовали воздушно-сухие семена, которые поверхностно стерилизовали слабым раствором перманганата калия в течение 2 мин при интенсивном перемешивании с последующим ополаскиванием бидистиллятом и обсушиванием фильтровальной бумагой. Отбирали равные по величине неповрежденные семена и проращивали в стерильных чашках Петри на фильтровальной бумаге, пропитанной бидистиллятом при 22°С или при тепловом шоке 40°С (ТШ 40°С) в термостате в темноте. Первую партию семян подвергали ТШ 40°С с первых ч набухания. Вторую партию после набухания в воде в течение 8 ч при 22°С – ТШ 40°С в течение 4 ч перед началом лаг–фазы (12 ч). Третью партию после 20 ч набухания на воде при 22°С – ТШ 40°С в течение 4 ч перед началом роста (конец лаг–фазы). Четвертую партию после 44 ч набухания на воде при 22°С при интенсивном росте корня и начале роста стебля – ТШ 40°С в течение 4 ч. Для определения содержания фитогормонов сразу после шока вручную отделяли зародыши и хранили при –70°С. Контролем служили семена, набухавшие 4, 12, 24 и 48 ч при 22°С. Для изучения ростовой активности семена после шока быстро переносили на 22°С и наблюдали за ростом проростков до 8 сут.
Определение содержания фитогормонов. Навеску (2 г) замороженных при –70°С зародышей заливали холодным 80%-ным этанолом (1 : 10) и измельчали в ступке. Экстракт выдерживали 20 ч при 5°С, затем перемешивали в течение 1 мин, и осадок отделяли центрифугированием при 6000 об/мин в течение 20 мин. Спирт из супернатанта испаряли при 40°С. Полученную водную фазу фильтровали, доводили бидистиллятом до 10 мл и подкисляли 0.2 н. HCl до pH 3.0. ИУК и АБК из подкисленного экстракта извлекали диэтиловым эфиром. Эфирную экстракцию повторяли дважды. Объединенную эфирную фракцию упаривали досуха и помещали на ночь на –20°С для последующего анализа свободных форм АБК и ИУК.
Водный остаток подщелачивали 1 н. KOH до pH 12 и выдерживали в термостате 1 ч при 70°С, затем осадок отделяли центрифугированием при 6000 об./мин в течение 10 мин. Надосадочную жидкость подкисляли 0.2 н. HCl до pH 3.0 и дважды фракционировали диэтиловым эфиром. Объединенную эфирную фракцию упаривали досуха, хранили при –20°С в течение ночи, а затем использовали для анализа связанных форм АБК и ИУК.
Для определения АБК и ИУК использовали метод высокоэффективной жидкостной хроматографии (ВЭЖХ) по внешнему стандарту на жидкостном хроматографе Аквилон Стайер со спектрофотометрическим детектором UVV 104 и c колонкой Ultrasphere ODS (C18) с обращенной фазой (размер 4.6 × 250 мм). Жидкая фаза: ацетонитрил–бидистиллят–уксусная кислота (25 : 74.9 : 0.1), скорость протока 1 мл/мин, выход фракций детектировали по оптическому поглощению при длине волны 254 нм. Использовали реактивы (“Aldrich”, Германия). В качестве контроля принимали содержание АБК и ИУК в зародышах, не подвергавшихся тепловому шоку.
Опыты проводили в трех биологических и трех аналитических повторностях. Для статистической обработки результатов использовали программы Microsoft Office Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Динамика изменения содержания ИУК в зародышах. Была изучена динамика накопления ИУК в зародышах пшеницы, тритикале и ржи в процессе набухания и раннего прорастания. На рис. 1 представлены результаты определения содержания ИУК в зародышах исследуемых культур после набухания при 22°С в периоды гидратации (4 ч), начала лаг–фазы (12 ч), конца лаг–фазы (24 ч) и начала роста проростка (48 ч). Видно, что в сухих зародышах всех культур присутствовала ИУК, синтезированная при созревании семян, при этом ее содержание было максимальным в сухих зародышах ржи. Известно, что у сортов ржи, устойчивых к прорастанию в колосе, повышено содержание ауксинов [18]. Так, в фазе молочной спелости ауксиновая активность у устойчивых сортов более чем в 2 раза выше, чем у неустойчивых, при этом различия сохраняются на поздних этапах созревания.
Рис. 1.
Изменение содержания индолил-3-уксусной кислоты в зародышах пшеницы (1), тритикале (2) и ржи (3), набухавших при 22°С (а) и 4 ч при 40°С (б).
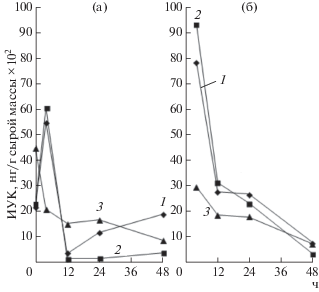
Уровень общей ИУК в зародышах пшеницы и тритикале на стадии гидратации (4 ч набухания) составлял 5.45 и 6.03 мкг/г сырой массы соответственно. К началу лаг–фазы (12 ч набухания) содержание ИУК резко снижалось, а к началу роста зародышевого корешка (48 ч) незначительно возрастало. Как было показано в работе [19], на этой стадии могло происходить высвобождение ИУК из конъюгированной формы или начинаться синтез новой ИУК. У набухающих зародышей ржи содержание ИУК плавно снижалось до конца исследуемого периода.
Изучение динамики изменения содержания ИУК в зародышах при коротком тепловом шоке (40°С) в разные периоды набухания семян (гидратация, начало лаг–фазы, конец лаг–фазы и прорастание) показало, что резкое повышение температуры с 22 до 40°С индуцировало быстрые изменения в гормональной системе, при этом количество фитогормонов у различных культур различалось. При коротком тепловом шоке на всех стадиях набухания семян содержание общей ИУК оказалось значительно выше, чем в контроле (рис. 1), а его максимум приходился на 4 ч набухания при 40°С. Увеличение содержания ИУК по сравнению с контролем у зародышей тритикале и пшеницы составило 30–35%, и в дальнейшем наблюдалось резкое ее падение до начала лаг–фазы (12 ч). Концентрация ауксина практически не изменялась до конца лаг–периода, то есть до проклевывания зародышевого корешка. Следует отметить, что лаг-фаза относится к очень важному этапу прорастания, когда продолжает увеличиваться скорость таких процессов, как образование проводящей ткани, и новых митохондрий, синтез новых ферментов и связывание ферментов с мембранами. ИУК в этот период высвобождалась из конъюгатов и/или синтезировалась de novo. К началу роста проростка содержание ауксина возвращалось к контрольным значениям. Для семян ржи при ТШ наблюдали плавное снижение содержания ИУК на всех фазах набухания и прорастания (до 48 ч) (рис. 1б). Таким образом, полученные результаты свидетельствовали о быстрой ответной реакции ИУК на тепловой шок, которая проявляется в изменении содержания ее различных форм.
В сухих зародышах пшеницы и тритикале присутствовала как свободная, так и конъюгированная ИУК, но преобладали конъюгаты (табл. 1), что совпадало с данными, полученными на семенах фасоли, бобов [19] и сосны [20]. При созревании этих семян почти полностью исчезала свободная ИУК, а конъюгированная становилась главной формой.
Таблица 1.
Изменение содержания свободной и связанной форм ИУК в зародышах пшеницы и тритикале во время набухания при 22 и 40°С
| Пшеница | ||||
|---|---|---|---|---|
| Время набухания, ч | ИУК своб., нг/г сырой массы | ИУК связ., нг/г сырой массы | ||
| 22°С | 40°С | 22°С | 40°С | |
| 0 | 23 ± 1 | – | 2134 ± 107 | – |
| 4 | 103 ± 5 | 680 ± 34 | 5343 ± 267 | 7168 ± 358 |
| 12 | 150 ± 8 | 670 ± 33 | 205 ± 10 | 2124 ± 106 |
| 24 | 240 ± 12 | 724 ± 36 | 933 ± 47 | 1976 ± 99 |
| 48 | 418 ± 21 | 101 ± 5 | 1463 ± 73 | 706 ± 35 |
| Тритикале | ||||
| 0 | 24 ± 1 | – | 2276 ± 114 | – |
| 4 | 140 ± 7 | 155 ± 8 | 5890 ± 295 | 9170 ± 459 |
| 12 | 20 ± 1 | 170 ± 9 | 130 ± 7 | 2985 ± 149 |
| 24 | 45 ± 2 | 190 ± 10 | 120 ± 6 | 2160 ± 108 |
| 48 | 30 ± 2 | 0 | 360 ± 18 | 370 ± 19 |
Уровень свободной ИУК в условиях гипертермии (4 ч при 40°С) увеличивался в зародышах пшеницы и тритикале от начала гидратации до начала проклевывания (24 ч) (табл. 1). У зародышей пшеницы наблюдалось 2 максимума уровня свободной ИУК: первый – при ТШ (4 ч при 40°С) был выше контроля в 6.6 раза, второй (20 ч при 22°С + 4 ч при 40°С ) оказался выше первого на 6.5%. Для тритикале амплитуда колебаний содержания свободной ИУК была значительно меньше: наблюдался только один максимум (20 ч при 22°С + 4 ч при 40°С), который был больше контроля в 4.2 раза. Можно предположить, что реакция ауксинового обмена у зародышей пшеницы в большей степени термозависима по сравнению с тритикале. При тепловом шоке (4 ч при 40°С) после 44 ч при 22°С содержание свободной ИУК у обоих культур опускалось ниже контроля. Быстрые изменения содержания ИУК у изученных культур показали, что реакции ауксинового обмена у них термозависимы, причем динамика ответа ауксиновой системы на воздействие повышенных температур была нелинейной.
Из результатов, представленных в табл. 1, видно, что количественные изменения свободной и связанной ИУК у подвергнутых тепловому шоку семян были противоположными на всех фазах. Увеличение уровня свободной ИУК сопровождалось снижением уровня связанной кислоты, что могло быть результатом высвобождения ИУК из конъюгированной формы или усиления биосинтеза этого гормона на протяжении всей лаг–фазы. В литературе имеются указания на важную роль перехода свободная–связанная ИУК в экспресс-регуляции уровня активной формы гормонов [21]. Перераспределение свободной и связанной ИУК в зародышах происходило в течение всего исследуемого периода, что могло быть связано с формированием быстрого ответа гормонов на гипертермию. Таким образом, реакция растения в ответ на тепловой шок развивалась очень быстро и проявлялась, в первую очередь, в изменении содержания различных форм ИУК. Механизмы выхода ИУК из конъюгатов в настоящее время не выяснены. Можно предположить, что при ТШ изменяются свойства клеточных мембран, внутриклеточный рН или содержание других фитогормонов.
Имеются данные о повышении уровня ИУК при тепловом стрессе, а также о быстром и кратковременном (10–15 мин) “всплеске” ее концентрации [22]. В то же время отмечалось слабое влияние гипертермии на содержание ИУК и даже снижение ее уровня. Это было показано на ряде растений, в частности, на проростках огурца [23], которые, по-видимому, более устойчивы к тепловому шоку.
Динамика изменения содержания АБК в зародышах. Изучение динамики изменения содержания АБК в зародышах на начальных этапах прорастания при 22°С показало, что ее уровень изменялся в период от 0 до 48 ч (рис. 2а), при этом характер изменений был сходен с ИУК. Содержание АБК в сухих семенах (0 ч) у исследуемых культур было различным, но у всех она присутствовала в низкой концентрации, не ингибирующей рост (рис. 2а). В некоторых работах [24] этот факт объясняли тем, что в зародышах семян при их развитии максимум содержания АБК приходился на период прекращения клеточного роста, а к фазе полной зрелости уровень этого гормона в зародышах резко снижался. Это подтверждает важную роль АБК в процессах вхождения семени в состояние покоя, поддержания его в нем и выхода из него. Наименьшее содержание АБК было обнаружено в сухом зерне пшеницы, а наибольшее – в зерне ржи (рис. 2а), при этом в тритикале оно занимало промежуточное положение. АБК в сухих зародышах присутствовало, как в свободном, так и в связанном состояниях (рис. 3).
Рис. 2.
Изменение содержания абсцизовой кислоты в зародышах пшеницы (1), тритикале (2) и ржи (3), набухавших при 22°С (а) и 4 ч 40°С (б).
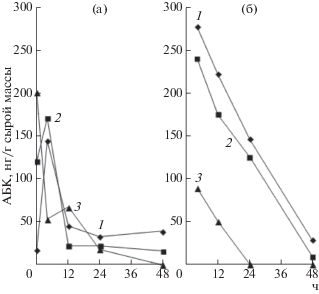
Рис. 3.
Изменение содержания свободной (1 и 3) и связанной форм (2 и 4) абсцизовой кислоты в зародышах пшеницы (а) и тритикале (б), набухавших при 22°С и 4 ч при 40°С.
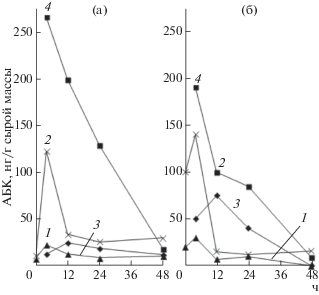
При 22°С максимальное содержание АБК (в основном в связанной форме) в зародышах пшеницы и тритикале достигалось к 4 ч набухания, а на последующих стадиях оно снижалось и оставалось на низком уровне до конца исследуемого периода (рис. 3). Повышение уровня свободной АБК не сопровождалось уменьшением количества связанной формы, которая увеличивалась параллельно с увеличением свободной формы АБК (рис. 3). Таким образом, накопление активной формы АБК в процессе прорастания происходило не вследствие изменений в системе свободная/связанная форма гормона, а за счет его синтеза de novo. В зародышах ржи содержание АБК, как и ИУК, уменьшалось постепенно (рис. 2а). Следует отметить, что низкое содержание АБК необходимо для нормального роста зародышевого корешка.
Экспонирование зерна при 40°С в разные периоды набухания и прорастания индуцировало быстрые изменения уровня как свободной, так и связанной форм АБК (рис. 3). Если набухание в первые 4 ч происходило в условиях гипертермии (40°С), то содержание общей АБК в зародышах пшеницы возрастало почти в 2 раза по сравнению с контролем, а в зародышах тритикале и ржи – в 1.5 раза. В этих условиях в зародышах исследуемых культур присутствовали обе формы АБК, но у пшеницы она находилась преимущественно в связанном состоянии, а в зародышах тритикале доля свободной АБК увеличивалась в 1.5–2 раза по сравнению с контролем (рис. 3).
При тепловом стрессе (8 ч при 22°С + 4 ч при 40°С) и (20 ч при 22°С + 4 ч при 40°С) в зародышах тритикале и пшеницы содержание общей и связанной форм АБК резко снижалось, и обнаруживались существенные различия в динамике изменения содержания свободной формы. Свободная АБК в зародышах пшеницы находилась на очень низком уровне, а в зародышах тритикале она достигала максимума при тепловом шоке (8 ч при 22°С + 4 ч при 40°С) и увеличивалась по сравнению с контролем примерно в 7 раз (рис. 3). К началу роста зародышевого корешка содержание обеих форм АБК было минимальным.
Баланс фитогормонов. Понятие фитогормонального баланса включает динамику изменения их состава и соотношения в онтогенезе. Соотношение эндогенных фитогормонов находится в динамическом равновесии, характерной особенностью которого является чрезвычайная чувствительность к внешним воздействиям. Это обеспечивает переключение клеток с программ нормального развития (ростовой и онтогенетической) на адаптивные, происходящее уже в начальный период действия теплового стресса. Ранее такие исследования в основном проводились на вегетативных органах растений, и имелись лишь единичные работы о роли АБК и ИУК в поддержании устойчивости семян к действию теплового шока на стадиях набухания и проклевывания.
Поскольку в данной работе было обнаружено изменение содержания обоих исследованных гормонов, было оценено изменение соотношения ИУК/АБК в зародышах пшеницы и тритикале. В начале набухания (4 ч при 22°С) это соотношение было близким у обоих культур и находилось в пределах 35.5–37.8 (табл. 2). Затем в процессе прорастания это соотношение уменьшалось и практически не изменялось до начала проклевывания (24 ч набухания). В начале роста зародышевого корешка (48 ч) соотношение ИУК/АБК резко возрастало, при этом наблюдалось увеличение содержания ИУК – гормона роста.
Таблица 2.
Соотношение ИУК/АБК в зародышах пшеницы и тритикале во время набухания при 22 и 40°С
| Время набухания, ч | Пшеница | Тритикале | ||
|---|---|---|---|---|
| 22°С | 40°С | 22°С | 40°С | |
| 0 | 26.29 | – | 30.17 | – |
| 4 | 37.82 | 28.88 | 35.47 | 38.85 |
| 12 | 7.9 | 13.38 | 14.98 | 18.03 |
| 24 | 14.35 | 18.36 | 13.29 | 16.92 |
| 48 | 48.1 | 32.68 | 60.02 | 41.11 |
При коротком ТШ колебания соотношения ИУК/АБК для зародышей пшеницы и тритикале по форме соответствовали контролю, но отличались по амплитуде (табл. 2). Соотношение эндогенных фитогормонов постоянно изменялось и динамично поддерживалось вследствие их синтеза, распада и транспорта. Даже кратковременное действие повышенной температуры вызывало перестройку всей гормональной системы. Первоначально ТШ индуцировал выброс ИУК из пула ее конъюгатов, который выполнял роль стрессового сигнала, затем уровень ИУК снижался.
Можно предположить, что колебания соотношения ИУК/АБК связаны с процессом накопления фитогормона или переходом его из неактивного в активное состояние и обратно. Баланс фитогормонов в условиях теплового шока является одним из важных факторов, влияющих на адаптацию растения к неблагоприятным условиям.
Ростовые процессы. Ранние этапы прорастания зерновых культур, завершающиеся началом роста осевых органов, это переход из состояния вынужденного покоя к активному метаболизму. Семена должны быть защищены от экологических стрессов, в том числе и от теплового воздействия, которые они могут испытывать при прорастании. Проявлением такой защиты у растений является ингибирование роста. На гормональном уровне это проявляется в накоплении АБК, которое смещает гормональное равновесие в сторону гормонов–ингибиторов, что приводит к торможению роста, хотя при этом не всегда наблюдается уменьшение содержания ИУК. При возврате к нормальной температуре воспроизводятся метаболические реакции, связанные с прорастанием, и восстанавливаются темпы роста проростков, а соотношение ИУК/АБК увеличивается.
Была изучена зависимость ростовых процессов от соотношения ИУК/АБК при нормальной температуре и коротком тепловом стрессе. При набухании семян пшеницы и тритикале в первые 4 ч при 40°С концентрация ИУК и АБК увеличивалась, а соотношение гормонов в зародышах мало изменялось. При возврате к нормальной температуре семена оказались способны быстро прорастать, для чего им требовалось столько же времени, сколько и семенам, исходно набухавшим при 22°С. Можно предположить, что при набухании при 40°С в первые 4 ч не тормозились некоторые процессы, необходимые для прорастания.
При набухании семян тритикале и пшеницы в начале лаг–фазы (8 ч при 22°С + 4 ч при 40°С) соотношение ИУК/АБК уменьшалось, поскольку концентрация ИУК в зародышах пшеницы и тритикале увеличивалась эффективнее, чем концентрация АБК, что позволяло семенам не погибнуть. При этом наблюдалась задержка процесса проклевывания и дальнейшего роста пророста при переносе семян после шока на 22°С. Через 3 сут после шока проростки отставали от контроля по высоте стебля на 20–25%. Через 8 сут проростки пшеницы и тритикале практически догнали контроль. Все это свидетельствовало о чувствительности семян к действию повышенных температур в период, предшествующий проклевыванию.
В конце лаг–фазы (первые 20 ч семена набухали при 22°С, а затем 4 ч при 40°С) концентрация ИУК и АБК увеличивалась одинаково, а соотношение ИУК/АБК оставалось на относительно низком уровне, что снижало эффективность адаптационного процесса при переносе семян на 22°С. Восстановление темпов роста происходило медленно, что свидетельствовало о чувствительности семян к действию повышенных температур в период, предшествующий видимому прорастанию. Даже через 5 сут проростки пшеницы и тритикале отставали от контроля на 50%, а через 8 сут проростки пшеницы догнали контрольные, а проростки тритикале отставали от контроля примерно на 15%.
В период роста проростка при коротком ТШ (40 ч при 22°С + 4 ч при 40°С) соотношение ИУК/АБК значительно увеличивалось, и при переносе семян на 22°С после шока ростовая активность у семян тритикале и пшеницы быстро восстанавливалась.
Соотношение ИУК/АБК при тепловом шоке на двух стадиях лаг-фазы (12 и 24 ч) было намного ниже, чем в период физического набухания семян (4 ч) и фазы активного роста проростка (48 ч), при этом происходило торможение проклевывания и задержка роста проростка. В фазах 4 ч набухания и 48 ч при тепловом шоке соотношение ИУК/АБК оказалось высоким и задержки роста не наблюдалось. Можно сделать вывод, что стадии проклевывания и дальнейшего роста проростка различались по термочувствительности. В настоящее время активно изучается влияние стрессовых факторов на растения. Это направление становится важной областью исследований, ее преподают как отдельную дисциплину или как самостоятельный раздел биохимии и физиологии растений. К одним из важнейших стресовых факторов, действующих на растения, относится температура, а ранние этапы развития, в том числе прорастание семян, являются одними из самых чувствительных к такому воздействию. Обсуждается и роль фитогормонов в ответе растения на действие неблагоприятных температур [25].
В предыдущих работах [15–17] было показано, что наибольший процент прорастания у пшеницы наблюдался при 20°С, у ржи – при 15°С, а у тритикале – при 30°С. Однако эти значения не были оптимальными для дальнейшего развития проростков, так как формирование корневой системы и стебля при этих температурах замедлялось. Оптимальной для прорастания пшеницы и тритикале оказалась температура 22°С, а ржи – 18–19°С. Отличие семян тритикале от пшеницы и ржи по данному параметру связано с тем, что у тритикале процессы, подготавливающие начало роста клеток растяжением, более термоустойчивы, чем процессы, обеспечивающие последующий рост осевых органов за счет растяжения, деления и дифференцировки клеток корня и стебля.
Для большинства семян набухание представляет трехфазный процесс [25], в котором лаг–фаза имеет первостепенную значимость для инициации появления корня. Предполагают, что именно на лаг–фазу могут влиять такие неоптимальные условия прорастания, как водный и температурный стрессы и возраст [25]. На зародышах яблонь было показано, что эти фазы различаются по ответу на действие окружающей среды [26], а на семенах арбуза – высокая температура может вызвать потерю энергии. Это, в свою очередь, уменьшает процент проклевывания семян, при этом содержание АБК хорошо коррелирует с низким потенциалом проклевывания [27]. Семена и зародыши сортов пшеницы, отличающиеся в состоянии покоя, сильно различаются и по индексу прорастания при высокой температуре, а ингибирование прорастания абсцизовой кислотой зависит от ее концентрации [28].
В растении одновременно функционирует не только гормональная, но и другие регуляторные системы. Именно слаженность их работы способствует устойчивости к неблагоприятным воздействиям. В предыдущей работе [15] нами было показано, что метаболическое развитие зародышей в период, предшествующий началу их роста, сопровождался активным протеолизом собственных белковых отложений. Небольшое повышение температуры вызывало изменения мобилизации запасных веществ в семени. При длительном действии теплового шока (40°С) прорастание всех зерновых культур полностью угнеталось [15–17]. Клетки зародыша были неспособны преодолевать неблагоприятные последствия теплового стресса и восстанавливать нормальный клеточный метаболизм, необходимый для успешного прорастания. При этом в составе белков зародыша зерна всех трех культур не происходило изменений. Тормозящее действие высокотемпературного набухания на потребление запасных отложений в зародышах происходит вследствие ингибирования активности ферментов, участвующих в деградации белков, нарушения их транспорта внутри клетки к местам белковых отложений или ингибирования синтеза этих ферментов. Это может быть одной из причин низкого прорастания семян при высоких температурах.
Тепловой шок не только изменяет гормональный баланс, но и вызывает синтез белков теплового шока. К настоящему времени уже хорошо изучены изменения экспрессии генов в ответ на повышение температуры, приводящие к индукции синтеза белков теплового шока (БТШ). В последние годы выделено несколько семейств БТШ, устанавливаются их защитные функции в растении. Проведенные ранее исследования по изучению синтеза БТШ на семенах гороха [29, 30] показали, что осевые органы способны отвечать на короткий тепловой шок синтезом полного их набора с первых ч набухания. Можно предположить, что способность клеток осевых органов зародыша поддерживать на высоком уровне синтез нормальных клеточных белков с одновременным синтезом полного набора БТШ в ответ на тепловой шок адаптирует метаболизм к неблагоприятным внешним условиям, повышает термоустойчивость и обеспечивает надежное завершение прорастания. Тепловой шок индуцирует изменение устойчивости клеток зародыша и изменяет мобилизацию запасных отложений в процессе набухания и прорастания, приводя к синтезу БТШ.
Необходимо подчеркнуть, что процесс прорастания является моделью для изучения формирования устойчивости растения в критический онтогенетический период развития с целью изменения параметров метаболизма для формирования долгосрочной программы адаптационного ответа растения на действие экологически неблагоприятных факторов. Изучение влияния теплового шока на различные регуляторные системы при раннем прорастании семян необходимо для характеристики этого процесса и для выяснения механизмов приспособления растений к условиям окружающей среды. Исследование процесса прорастания важно также для понимания причин изменения качества семян при хранении, разработки критериев его оценки, и повышения продуктивности земледелия.
Список литературы
Косаковская И.В. Стрессовые белки растений. Киев: Фитосоциоцентр, 2008. 154 с.
Popko J., Hänsch R., Mendel R., Polle A., Teichmann T. // Plant Biol. 2010. V. 12. № 2. P. 242–258.
Nambara E., Okamoto M., Tatematsu K., Yano R., Seo M. // Seed Science Research. 2010. V. 20. № 2. P. 55–67.
Косаковская И.В., Майдебура Е.В. // Физиология и биохимия культурных растений. 1989. Т. 21. № 4. С. 315–332.
He Y.K., Xue W.X., Sun Y.D., Yu X.H., Liu P.L. // Cell Res. 2000. V. 10. № 2. P. 151–602.
Reed J.W. // Trends Plant Sci. 2001. V. 6. № 9. P. 420–425.
Hentrich M., Boettcher C., Duchting P. // Plant J. 2013. V. 74. № 4. P. 626–637.
Liu P.P., Montgomery T.A., Fahlgren N., Kasschau K.D., Nonogaki H., Carrington J.C. // Plant J. 2007. V. 52. № 1. P. 133–146.
Liu X., Yue Y., Li B., Nie Y., Li W., Wu W.H., Ma L. // Science. 2007. V. 315. № 5819. P. 1712–1716.
Hansen H., Grossmann K. // Plant Physiol. 2000. V. 124. № 3. P. 1437–1448.
Shu K., Liu X.D., Xie Q., He Z.H. // Mol. Plant. 2016. V. 9. № 1. P. 34–45.
Cohen J.D., Bandurski R.S. // Ann. Rev. Plant Physiol. 1982. V. 33. P. 403–430.
Bialek K., Michalczuk L., Cohen J.D. // Plant Physiol. 1992. V. 100. № 1. P. 509–517.
Wu C., Cui K., Wang W, Li Q, Fahad S, Hu Q, Huang J, Nie L, Peng S. // Sci. Rep. 2016. V. 6. Article ID e34978. doi 10.1038/srep34978
Чумикина Л.В., Арабова Л.И., Колпакова В.В. // Вестник Российской академии сельскохозяйственных наук. 2002. № 2. С. 30–35.
Чумикина Л.В., Арабова Л.И., Топунов А.Ф. // Известия ВУЗов. Пищевая технология. 2009. № 1. С. 9–13.
Арабова Л.И., Чумикина Л.В., Топунов А.Ф. // Вестник Мичуринского государственного аграрного университета. 2011. № 2. Ч. 2. С. 82–88.
Хорева В.И. // Бюллетень ВИР. 1978. № 78. С. 18–21.
Bialek K., Cohen J.D. // Plant Physiol. 1989. V. 91. № 1. P. 398–400.
Ljung K., Ostin A., Lioussanne L., Sandberg G. // Plant Physiol. 2001. V. 125. № 1. P. 464–475.
Кудоярова Г.Р., Веселов С.Ю., Усманов И.Ю. // Журн. общей биологии. 1999. № 6. С. 649–658.
Веселов А.П., Лобов В.П., Олюнина Л.Н. // Физиология растений. 1998. Т. 45. № 5. С. 709–715.
Таланова В.В., Кудоярова Г.Р., Титов А.Ф. // Ф-изиология и биохимия культурных растений. 1990. Т. 22. № 2. С. 153–157.
Romagosa I. // J. Exp. Bot. 2001. V. 52. № 360. P. 1499–1506.
Bewley J.D., Black M. Seeds: Physiology of Development and Germination. / N.Y., London: Plenum Press, 1994. 445 p.
Perino C., Côme D. // Seed Sci. Technol. 1991. V. 19. № 1. P. 1–14.
Demir I., Van De Venter H.A. // Exp. Agric. 2000. V. 36. P. 453–458.
Walker-Simmons M. // Plant Cell Environ. 1988. V. 11. № 8. P. 769–775.
Гумилевская Н.А. Чумикина Л.В., Арабова Л.И., Зимин М.В., Шатилов В.Р. // Физиология растений. 1996. Т. 43. № 2. С. 247–255.
Гумилевская Н.А., Арабова Л.И., Чумикина Л.В., Шатилов В.Р. // Физиология растений. 1997. Т. 44. № 5. С. 690–698.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


