Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 86-92
Ингибирование автоокисления полиненасыщенных жирных кислот эфирными маслами гвоздики и орегано
Т. А. Мишарина 1, 2, *, М. Б. Теренина 1, Н. И. Крикунова 1, М. Г. Семёнова 1
1 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
2 Российский экономический университет им. Г.В. Плеханова
117997 Москва, Россия
* E-mail: tmish@rambler.ru
Поступила в редакцию 20.03.2018
После доработки 02.07.2018
Принята к публикации 25.07.2018
Аннотация
Изучено ингибирование эфирными маслами гвоздики, орегано и их смесью автоокисления метиловых эфиров полиненасыщенных жирных кислот, выделенных из рыбьего жира. Для оценки антиоксидантной эффективности определяли их содержание после 1–6 мес. автоокисления методом капиллярной газовой хроматографии. Показано, что эфирные масла гвоздики и орегано и их смесь эффективно ингибировали автоокисление полиненасыщенных жирных кислот. Степень этого ингибирования зависела от структуры жирных кислот и состава их смеси, а также от содержания эфирных масел и длительности автоокисления. Показано, что с увеличением числа двойных связей в молекуле ненасыщенных кислот снижалась устойчивость их эфиров к окислению. В контроле после 3 мес. автоокисления сохранялось 97% мононенасыщенных кислот, а докозагексаеновой – только 9%. Одинаково эффективно ингибировали окисление 2 и 4% эфирного масла гвоздики, при этом после 3 мес. сохранялось 86–91% эфиров кислот с 5 и 6 двойными связями. Эфирное масло орегано оказалось менее эффективным антиоксидантом по сравнению с маслом гвоздики. Так, после 3 мес. автоокисления в его присутствии сохранялось до 79% метилэйкозапентаеноата и 73% метилдокозагексаеноата. После 6 мес. автоокисления в присутствии 4% масла гвоздики содержание метилэйкозапентаеноата и докозагексаеноата составляло 67 и 54%, а при 1% – только 11 и 7% соответственно. Ингибирующее действие 4% масла орегано и 2% гвоздики оказалось практически одинаковым, а в присутствии 1% этих масел наблюдали близкое содержание всех не окисленных кислот. Смесь эфирных масел гвоздики и орегано проявляла аддитивное антиоксидантное действие на эфиры арахидоновой и эйкозапентаеновой кислот и синергетическое – на эфир докозагексаеновой кислоты.
Эссенциальные полиненасыщенные жирные кислоты (ПНЖК) являются предшественниками простагландинов и лейкотриенов, крайне важных для формирования иммунного ответа [1]. Они активно изучаются биологией и медициной, так как способны оказывать существенное влияние на здоровье благодаря их противовоспалительным, кардиопротекторным и противораковым свойствам [2–4]. ПНЖК с числом двойных связей больше 3 окисляются намного быстрее, чем моно- и диненасыщенные кислоты. Для снижения степени окисления используют инкапсулирование жиров, богатых этими кислотами (рыбий жир), и часто добавляют различные антиоксиданты.
Оценка способности некоторых индивидуальных эфирных масел (ЭМ) ингибировать автоокисление метиловых эфиров полиненасыщенных жирных кислот (МЭЖК), выделенных из коммерческого масла семян льна, показала, что наиболее эффективными антиоксидантами оказались ЭМ гвоздики, листьев корицы и орегано [5, 6]. При содержании ЭМ к массе МЭЖК равным 4% в течение 4 мес. автоокисления сохранялось до 85% метиллинолеата и до 82% метиллиноленоата, при этом в контроле, не содержавшем ЭМ, оставалось не окисленными только 21 и 8% этих МЭЖК соответственно. Установлено, что ЭМ орегано проявляло высокую антиоксидантную (АО) активность по отношению к арахидоновой, эйкозапентаеновой и докозагексаеновой кислотам, выделенным из мозга мышей [7]. Такая эффективность ингибирования автоокисления жирных кислот (ЖК) обеспечивалась за счет присутствия в ЭМ фенолов – эвгенола, карвакрола и тимола [6–9].
В таких сложных системах, как пищевые продукты, наиболее эффективны мультифункциональные антиоксиданты или смеси антиоксидантов, действующих по различным механизмам и способных оказывать синергетическое влияние друг на друга. Смеси различных ЭМ используются в качестве натуральных ароматизаторов для придания пищевым продуктам различного вкуса и аромата, а также для снижения уровня микробиологического загрязнения продуктов и степени окисления липидов. Эти достоинства ароматизаторов из натуральных пряностей и продуктов их переработки – экстрактов и ЭМ, особенно важны в производстве продуктов быстрого приготовления и снеков. Однако взаимное влияние различных ЭМ на их антиоксидантные свойства изучено не достаточно.
Цель работы – изучить взаимное влияние ЭМ гвоздики и орегано, потенциальных компонентов вкусо-ароматических добавок, на их способность ингибировать автоокисление МЭЖК, выделенных из рыбьего жира.
МЕТОДИКА
Изучали свежие эфирные масла (“Plant Lipids Ltd.”, Индия), полученные из бутонов гвоздичного дерева (Eugenia caryophyllata Thumb.) и высушенных листьев и цветов орегано (Origanum majorana L.). В работе использовали аптечный рыбий жир (“Рускапс”, Россия), содержащий до 60% ПНЖК. Метиловые эфиры получали метанолизом 1 г рыбьего жира по методике, приведенной в работе [10]. Полученный гексановый экстракт анализировали газовой хроматографией (ГХ). Содержание МЭЖК в экстракте, определенное ГХ анализом, доводили гексаном до 5 мг/мл. Полученный раствор МЭЖК разделяли на аликвоты по 5 мл и помещали в пробирки объемом 10 мл, три из которых использовали в качестве контрольных. В 3 аликвоты добавляли 2, 4 и 8 мкл гексанового раствора (125 мкл/мл) ЭМ гвоздики, что соответствовало 1, 2 и 4% масла по отношению к суммарному содержанию в ней МЭЖК. Три аналогичных раствора были приготовлены с ЭМ орегано. В оставшуюся аликвоту добавляли растворы ЭМ гвоздики и орегано (по 4 мкл, то есть 2% каждого ЭМ к сумме МЭЖК). Полученные смеси выдерживали на свету при комнатной температуре, а каждые 7 сут их открывали и встряхивали в течение 30 мин. После 1, 2, 3, 4, 5 и 6 мес. определяли содержание МЭЖК методом ГХ. Все растворы приготавливали в двух экземплярах, а контроли – в трех.
ГХ анализ проводили на хроматографе “Кристалл 2000 М” (ЗАО СКБ “Хроматэк”, Россия) с пламенно-ионизационным детектором и кварцевой капиллярной колонкой DB-1 (50 м × 0.32 мм) с толщиной слоя фазы 0.25 мкм (“Supelco”, США). Температуру колонки программировали от 120 до 270°С со скоростью 4°С/мин, температура детектора и инжектора составляла 250°С. Содержание каждого МЭЖК определяли как отношение площади его пика к площади пика эфира пальмитиновой кислоты (16 : 0), который не окислялся, и поэтому использовался в качестве внутреннего стандарта. Таким способом было определено относительное содержание каждого МЭЖК в исходном гексановом экстракте, который использовался в качестве образца сравнения, а также в контрольных и опытных пробах, содержавших ЭМ после автоокисления в течение каждого месяца в период полугода. Степень ингибирования автоокисления МЭЖК рассчитывали как отношение содержания каждого из них в пробах с внесенными ЭМ к содержанию МЭЖК в исходном гексановом экстракте и выражали в %.
Математическую обработку результатов осуществляли с помощью программ Microsoft Excel 2007 и Sigma Plot 10. Стандартное отклонение средних величин 3-х измерений не превышало 5% (относительных).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение АО свойств различных веществ и их смесей показало, что они зависят от многих факторов, включая их структуру, концентрацию, температуру окружающей среды, тип и состав окисляемого субстрата, физическое состояние системы и наличие в ней дополнительных анти- и прооксидантов и синергистов [11–13]. К важнейшим параметрам процесса ингибирования окисления относится концентрация антиоксиданта, которая должна быть оптимальной, так как многие из них могут оказывать прооксидантное действие при высокой концентрации. Изучение АО свойств 16 различных ЭМ в системе, состоявшей из гексанового раствора МЭЖК, выделенных из льняного масла, показало, что наиболее эффективными антиоксидантами являлись ЭМ гвоздики, листьев корицы и орегано при их содержании 4% к сумме МЭЖК [5, 6].
В работе были определены изменения в процессе автоокисления содержания МЭЖК, выделенных из рыбьего жира, обогащенного ПНЖК. Изучение поведения МЭЖК в контрольных и опытных образцах, содержавших как три различных концентрации индивидуальных ЭМ гвоздики и орегано, так и их смесь, позволило сравнить АО свойства этих ЭМ, определить влияние их концентрации на ингибирование автоокисления и обнаружить возможные синергетические эффекты.
ЭМ были охарактеризованы ГХ, установлен их состав и содержание в них компонентов. Полученные данные приведены в табл. 1. Основными соединениями, отвечающими за АО свойства ЭМ, являлись замещенные фенолы - эвгенол, тимол и карвакрол. Их суммарное содержание в индивидуальных маслах орегано и гвоздики и в смеси было близким и составляло около 70%. К важным компонентам ЭМ, обладающим АО свойствами, относились также γ-терпинен и β-кариофиллен [14–16]. В ЭМ орегано оказалось наиболее высоким содержание монотерпена γ-терпинена (8.7%), а в ЭМ гвоздики – сесквитерпена, β-кариофиллена (10%). В смеси ЭМ содержание этих компонентов составляло 4.5 и 6.0% соответственно (табл. 1).
Таблица 1.
Содержание основных компонентов (%) в изученных эфирных маслах гвоздики и орегано и их смеси
| Соединение | Содержание ЭМ, % | ||
|---|---|---|---|
| гвоздика | орегано | смесь ЭМ | |
| α-Туйен | – | 0.39 | 0.20 |
| α-Пинен | 0.16 | 2.06 | 1.10 |
| Камфен | – | 0.58 | 0.29 |
| Сабинен | – | 0.50 | 0.25 |
| β-Пинен | – | 1.55 | 0.74 |
| α-Терпинен | – | 0.92 | 0.45 |
| p-Цимен | – | 13.00 | 6.4 |
| 1,8-Цинеол | 3.06 | 0.22 | 1.62 |
| γ-Терпинен | 0.10 | 8.73 | 4.50 |
| Линалоол | 0.45 | 2.38 | 1.45 |
| Изоборнеол | – | 0.32 | 0.15 |
| Борнилацетат | 0.45 | 0.20 | |
| Тимол | – | 4.23 | 2.12 |
| Карвакрол | – | 63.28 | 31.64 |
| Эвгенол | 73.08 | – | 36.50 |
| Метилэвгенол | 0.54 | – | 0.27 |
| β-Кариофиллен | 10.39 | 1.64 | 6.00 |
| α-Бергамотен | 3.07 | – | 1.53 |
| Эвгенилацетат | 5.30 | – | 2.65 |
Гексановый экстракт рыбьего жира также анализировали ГХ. Состав и процентное содержание МЭЖК в нем приведены в табл. 2. Как видно в табл. 2, в состав смеси МЭЖК входили 3 насыщенных кислоты, 4 мононенасыщенных, среди которых основной по содержанию была олеиновая кислота, и 6 полиненасыщенных кислот с 2–6 двойными связями. В изученном препарате рыбьего жира содержание ПНЖК составляло около 56%, при этом на эйкозапентаеновую кислоту приходилось 27.6% и на докозагексаеновую – 20.0% (табл. 2). Доля кислоты с 3 двойными связями (18:3ω6) составляла 2.3%, а суммарное содержание двух кислот с 4 двойными связями (20:4ω6 и 22:4ω6) – 5%.
Таблица 2.
Состав метиловых эфиров жирных кислот, выделенных из рыбьего жира
| № | Название кислоты | Обозначение кислоты | Содержание, % |
|---|---|---|---|
| Насыщенные кислоты | |||
| 1 | Миристиновая | 14:0 | 5.10 |
| 2 | Пальмитиновая | 16:0 | 12.42 |
| 3 | Стеариновая | 18:0 | 3.88 |
| Суммарное содержание, % | 21.30 | ||
| Мононенасыщенные кислоты | |||
| 4 | 7-Ундеценовая | 16:1ω9 | 7.30 |
| 5 | Олеиновая | 18:1ω9 | 8.14 |
| 6 | 11-Октадеценовая | 18:1ω7 | 3.87 |
| 7 | 11-Эйкозеновая | 20:1ω9 | 1.86 |
| 8 | 13-Докозеновая | 22:1ω9 | 1.32 |
| Суммарное содержание, % | 22.43 | ||
| Полиненасыщенные кислоты | |||
| 9 | Линолевая | 18:2ω6 | 1.07 |
| 10 | 6,9,12- Октадекатриеновая | 18:3ω6 | 2.34 |
| 11 | Арахидоновая | 20:4ω6 | 1.67 |
| 12 | 7,10,13,16- Докозатетраеновая | 22:4ω6 | 3.40 |
| 13 | 5,8,11,14,17- Эйкозапентаеновая | 20:5ω3 | 27.63 |
| 14 | 4,7,10,13,16- Докозагексаеновая | 22:6ω3 | 20.00 |
| Суммарное содержание, % | 56.11 | ||
Содержание индивидуального МЭЖК определяли как отношение площади пика эфира кислоты к площади пика метилпальмитата С16:0, который не окислялся, и поэтому использовался в качестве внутреннего стандарта. Так было установлено их относительное содержание в гексановом экстракте МЭЖК рыбьего жира, который служил для сравнения, в контролях и пробах, содержавших ЭМ после 1, 2, 3, 4, 5 и 6 мес. автоокисления.
Степень ингибирования автоокисления МЭЖК рассчитывали как отношение содержания индивидуальной МЭЖК в пробах с ЭМ к ее содержанию в исходном свежеприговленном растворе МЭЖК и выражали в %. Чем больше оставалось неокисленного МЭЖК, тем эффективнее действовало ЭМ в качестве антиоксиданта.
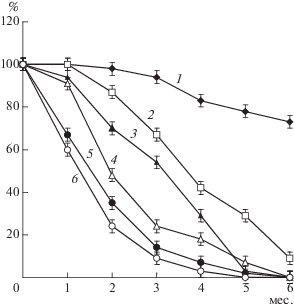
На рис. 1 приведены кинетические кривые автоокисления шести ненасыщенных ЖК в контроле. Оказалось, что метиловые эфиры мононенасыщенных кислот (олеиновой кислоты, рис. 1, кривая 1) устойчивы к автоокислению. После 3 мес. в системе сохранялось 97% метилолеата, а после 6 мес. – 73%. Такую же устойчивость к автоокислению проявили и другие эфиры мононенасыщенных кислот. Менее устойчивым оказался эфир линолевой кислоты, после 3 мес. автоокисления его оставалось 67%, после 6 мес – только 9%. После 3.5 мес. автоокисления оставалось 50% метиллинолеата (рис. 1, кривая 2). Метиловый эфир 6,9,12-октадекатриеновой кислоты окислялся примерно на 10% быстрее, чем метиллинолеат (рис. 1, кривая 3), но обе кинетических кривых имели близкие скорости окисления в период 1–4 мес. После 5 мес. автоокисления в смеси МЭЖК оставалось только 3% метил-6,9,12-октадекатриеноата, а после 6 мес. – он полностью окислялся.
Рис. 1.
Кинетика автоокисления метиловых эфиров жирных кислот 18:1ω9 (1), 18:2ω6 (2), 18:3ω6 (3), 20:4ω6 (4), 20:5ω3 (5) и 22:6ω3 (6), выделенных из рыбьего жира в отсутствие антиоксидантов (контроль).
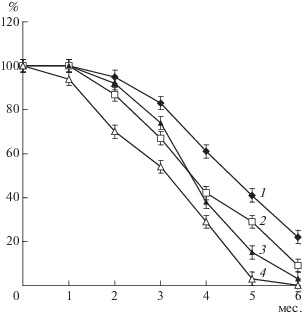
Сравнение кинетики автоокисления метиллинолеата из изученного ранее льняного масла [5, 6] и рыбьего жира показало, что состав ЖК в смеси МЭЖК влиял на скорость окисления одних и тех же МЭЖК. На рис. 2 приведены кинетические кривые автоокисления для эфиров кислот с 18 атомами углерода и двумя или тремя двойными связями из льняного масла (кривые 1 и 3) и из рыбьего жира (кривые 2 и 4). Видно, что метиллинолеат из льняного масла, содержащего в своем составе только 3 ненасыщенных кислоты (олеиновую, линолевую и линоленовую), окислялся в меньшей степени, чем метиллинолеат из рыбьего жира, в составе которого присутствовали значительные количества полиненасыщенных кислот, включая кислоты с 4–6 двойными связями. Такое же влияние на окисление метиллиноленоата (18:3ω3) из льняного масла (рис. 2, кривая 2) и метил-6,9,12-октадекатриеноата (18:3ω6) из рыбьего жира (рис. 2, кривая 4) оказывал состав МЭЖК. Эфир триеновой кислоты в составе МЭЖК из рыбьего жира окислялся в большей степени, чем из льняного масла. Однако следует отметить, что оба эфира различались положением системы двойных связей в молекулах кислот, что также могло влиять на их автоокисление.
Рис. 2.
Кинетика автоокисления метиллинолеата (1) и метиллиноленоата (3) из льняного масла и метиллинолеата (2) и метил 6,9,12-октадекатриеноата (4) из рыбьего жира.
В изученном контроле после 6 мес. полностью окислялись эфиры всех кислот с 4, 5 и 6 двойными связями (рис. 1, кривые 4–6). В течение 1–2 мес. окисления сохранялось только 50% этих МЭЖК. Кинетические кривые имели вид, характерный для такого процесса автоокисления, когда в окислении участвовали, помимо кислорода и свободных радикалов из воздуха, радикальные продукты окисления МЭЖК.
ЭМ гвоздики, орегано и их смесь оказывали значительное влияние на окисление ПНЖК. В табл. 3 приведены результаты определения содержания МЭЖК в контролях без масел и экстрактах с ЭМ гвоздики и орегано и их смеси после 3 и 6 мес. автоокисления. ЭМ добавляли в гексановые растворы МЭЖК в трех концентрациях: 4, 2 или 1% по отношению к сумме МЭЖК, а смесь ЭМ в соотношении 1 : 1 добавляли в количестве 4%. Как видно в табл. 3, степень ингибирования автоокисления зависела от структуры МЭЖК, содержания ЭМ и длительности автоокисления. Как и следовало ожидать, с увеличением числа двойных связей в молекуле МЭЖК, его устойчивость к окислению снижалась. В контроле после 3 мес. сохранялось 97% мононенасыщенных кислот, а докозагексадиеновой – только 9%. Добавление 4 и 2% ЭМ гвоздики существенно ингибировало окисление МЭЖК. Следует отметить, что снижение содержания ЭМ в системе в 2 раза оказывало незначительное влияние на степень ингибирования окисления. Даже ПНЖК с 5 и 6 двойными связями сохранялись на 86–91% (табл. 3). При снижении содержания ЭМ гвоздики с 2 до 1% сохранялось 93–100% эфиров олеиновой и линолевой кислот, но значительно (на 20–32%) уменьшалось содержание эфиров полиненасыщенных кислот. Так, эфиры эйкозапентаеновой и докозагексаеновой кислот сохранялись только на 60 и 54% соответственно.
Таблица 3.
Содержание (отн. %) полиненасыщенных МЭЖК рыбьего жира без и с добавками 4, 2 и 1% эфирных масел гвоздики и орегано при автоокислении в течение 3 и 6 мес. по сравнению с исходным гексановым экстрактом
| МЭЖК | Контроль | ЭМ гвоздики, % | ЭМ орегано, % | ЭМ гвоз-дики и орега-но 1 : 1, 4% | ||||
|---|---|---|---|---|---|---|---|---|
| 4 | 2 | 1 | 4 | 2 | 1 | |||
| 3 мес. | ||||||||
| 18:1ω9 | 97 ± 2 | 100 ± 1 | 100 ± 2 | 100 ± 2 | 99 ± 1 | 100 ± 0 | 97 ± 2 | 98 ± 1 |
| 18:2ω6 | 67 ± 3 | 100 ± 2 | 100 ± 1 | 93 ± 1 | 95 ± 3 | 90 ± 2 | 87 ± 1 | 97 ± 2 |
| 18:3ω6 | 54 ± 2 | 100 ± 1 | 89 ± 2 | 84 ± 2 | 91 ± 2 | 75 ± 2 | 58 ± 1 | 87 ± 3 |
| 20:4ω6 | 25 ± 1 | 94 ± 1 | 90 ± 2 | 72 ± 1 | 76 ± 1 | 75 ± 1 | 42 ± 2 | 88 ± 2 |
| 22:4ω6 | 15 ± 2 | 92 ± 2 | 90 ± 1 | 61 ± 3 | 76 ± 2 | 73 ± 2 | 44 ± 2 | 73 ± 3 |
| 20:5ω3 | 14 ± 3 | 91 ± 3 | 87 ± 2 | 60 ± 1 | 79 ± 3 | 76 ± 3 | 46 ± 1 | 82 ± 1 |
| 22:6ω3 | 9 ± 1 | 88 ± 2 | 86 ± 3 | 54 ± 2 | 73 ± 2 | 72 ± 2 | 38 ± 2 | 73 ± 2 |
| 6 мес. | ||||||||
| 18:1ω9 | 73 ± 2 | 94 ± 2 | 92 ± 2 | 92 ± 1 | 90 ± 3 | 90 ± 1 | 89 ± 1 | 98 ± 1 |
| 18:2ω6 | 9+ 2 | 94 ± 3 | 84 ± 2 | 57 ± 2 | 81 ± 2 | 67 ± 2 | 55 ± 2 | 92 ± 2 |
| 18:3ω6 | 0 | 84 ± 2 | 69 ± 3 | 13 ± 1 | 55 ± 1 | 39 ± 1 | 13 ± 3 | 72 ± 2 |
| 20:4ω6 | 0 | 77 ± 1 | 63 ± 1 | 12 ± 2 | 60 ± 1 | 32 ± 2 | 9 ± 1 | 78 ± 2 |
| 22:4ω6 | 0 | 59 ± 2 | 46 ± 2 | 10 ± 3 | 40 ± 2 | 26 ± 3 | 8 ± 2 | 72 ± 2 |
| 20:5ω3 | 0 | 63 ± 1 | 48 ± 1 | 11 ± 2 | 47 ± 1 | 18 ± 2 | 7 ± 1 | 66 ± 3 |
| 22:6ω3 | 0 | 54 ± 2 | 37 ± 1 | 7 ± 1 | 37 ± 2 | 12 ± 1 | 4 ± 2 | 57 ± 2 |
ЭМ орегано оказалось менее эффективным антиоксидантом по сравнению с ЭМ гвоздики. После 3 мес. автоокисления при содержании 4 или 2% ЭМ орегано сохранялось 76–79% метилэйкозапентаеноата и 72–73% метилдокозагексаеноата, а при его содержании 1% – 46 и 38% этих эфиров.
Более сильное влияние содержание ЭМ оказывало на ингибирование окисления МЭЖК после 6 мес. автоокисления (табл. 3). Так, при снижении концентрации ЭМ гвоздики от 4 до 1% содержание эфира 6,9,12-октадекатриеновой кислоты уменьшалось с 84 до 13%, арахидоновой – с 77 до 12%, эйкозапентаеновой с 67 до 11%, а докозагексаеновой – с 54 до 7%. Наиболее значительное снижение ингибирующего действия ЭМ гвоздики было отмечено при уменьшении его количества от 2 до 1% (табл. 3). В гексановых экстрактах, содержавших 4% ЭМ орегано, его ингибирующее действие оказалось практически таким же, как в экстрактах с 2% ЭМ гвоздики. Однако экстракты, содержавшие 1% ЭМ гвоздики и орегано, характеризовались близким количеством всех не окисленных МЭЖК (табл. 3). Следует отметить, что в контроле после 6 мес. все кислоты с 3–6 двойными связями оказались полностью окислеными. В то же время ЭМ гвоздики и орегано даже при концентрации 1% сохраняли столько ПНЖК, сколько их оставалось в контроле после 3 мес. автоокисления.
Для выявления возможных синергетических эффектов в раствор МЭЖК было добавлено 4% (по отношению к сумме МЭЖК) смеси ЭМ гвоздики и орегано (соотношение 1:1). Как видно в табл. 3, после 3 мес. автоокисления в присутствии смеси ЭМ степень окисления ЖК оказалась практически такой же, как и в присутствии 2 и 4% индивидуальных ЭМ гвоздики или орегано. Синергетическое действие ЭМ можно было обнаружить только для тех экстрактов, в которых степень ингибирования автоокисления ПНЖК составляла менее 50%. Такие значения были получены для некоторых ЖК после 6 мес. автоокисления (табл. 3). Следует отметить, что в этом случае для ПНЖК с числом двойных связей 4–6 ингибирующее действие смеси ЭМ было эффективнее, чем в присутствии 2 и даже 4% индивидуальных ЭМ гвоздики и орегано. Так, смесь ЭМ ингибировала окисление метилэйкозатетраеноата (22:4ω6) на 72%, а при содержании 4% ЭМ гвоздики – на 59 и 4% ЭМ орегано – на 40%. Однако суммарная эффективность торможения автоокисления метилэйкозатетраеноата в экстрактах, содержавших 2% ЭМ гвоздики и орегано или их смеси, составляла 72%, то есть масла оказывали скорее аддитивное действие чем синергетическое. Аналогичные эффекты были обнаружены и при автоокислении эфиров арахидоновой и эйкозапентаеновой кислот. Однако суммарный эффект окисления эфира докозагексаеновой кислоты (22:6ω3) в присутствии 2% обеих индивидуальных ЭМ составлял 49%, а смеси – 57%, то есть в этом случае существовало синергетическое действие (табл. 3).
Обнаруженный эффект имел важное значение при составлении композиций ЭМ для получения пищевых ароматизаторов, обладающих дополнительно антиоксидантной активностью. ЭМ гвоздики обладает сильным специфическим ароматом, который мог негативно влиять на общий аромат пищевой добавки и самого продукта. Составление смесей ЭМ с более низким содержанием ЭМ гвоздики и с различными направлениями в аромате позволит разнообразить ассортимент ароматизаторов без потери их АО свойств.
Изученные ЭМ обладали и другими видами биологической активности. Так, орегано и близкие по составу летучих веществ тимьян и чабер и их эфирные масла, активно использующиеся в кулинарии, обладают приятным интенсивным ароматом, а также антибактериальной и противовоспалительной активностью [11, 12]. Изучение in vivo биологической активности ЭМ чабера и орегано показало, что они, являясь биоантиоксидантами, оказывали позитивное влияние на антиоксидантный и иммунный статус мышей и формировали устойчивость к окислительному стрессу [13–15]. Они обладали также геропротекторным действием. Регулярный прием этих масел увеличивал на 18–20% продолжительность жизни мышей. При регулярном приеме малых доз ЭМ в мозге стареющих мышей сохранялось высокое содержание полиненасыщенных жирных кислот, тогда как в контрольной группе уровень этих кислот с увеличением возраста снижался [14].
Таким образом, в работе показано, что ЭМ гвоздики и орегано и их смесь эффективно ингибировали автоокисление ПНЖК. Его степень зависела от их структуры, состава их смеси, содержания ЭМ и от длительности автоокисления. С увеличением числа двойных связей в молекуле ЖК снижалась устойчивость их эфиров к окислению. ЭМ гвоздики (2 или 4%) одинаково эффективно ингибировали окисление и сохраняли эфиры кислот с 5 и 6 двойными связями. ЭМ орегано было менее эффективным антиоксидантом по сравнению с ЭМ гвоздики, но после 3 мес. автоокисления оно сохраняло до 73–79% эфиров эйкозапентаеной и докозагексаеновой кислот. Ингибирующее действие 4% ЭМ орегано оказалось практически таким же, как 2% ЭМ гвоздики. В присутствии 1% ЭМ гвоздики или орегано содержание всех не окисленных кислот было близким. Показано, что смесь ЭМ гвоздики и орегано оказывала аддитивное антиоксидантное действие на эфиры арахидоновой и эйкозапентаеновой кислот и синергетическое действие – на эфир докозагексаеновой кислоты.
Список литературы
Shahidi F., Zhong Y. // Chem. Soc. Rev. 2010. V. 39. № 12. P. 4067–4079.
Halliwell B., Gutteridge J.M.C., Cross C.E. // J. Clin. Lab. Med. 1992. V. 119. № 3. P. 598–620.
Omega-3 Fatty Acids: Chemistry, Nutrition and Health Effects. ACS Symposium Series 788. / Eds. Shahidi F., Finley J. Washington, DC: American Chemical Society, 2001. 458 p.
Shahidi F., Miraliakbari H. Nutraceutical and Specialty Lipids and Their Co-products. / Ed. F. Shahidi. Boca Raton. FL.: LLC.Taylor and Francis Group, 2006. P. 227–250.
Мишарина Т.А., Алинкина Е.С.,Теренина М.Б., Крикунова Н.И., Киселева В.И., Медведева И.Б., Семенова М.Г. // Прикл. биохимия и микробиология. 2015. Т. 51. № 4. С. 417–423.
Мишарина Т.А., Алинкина Е.С., Воробьева А.К., Теренина М.Б., Крикунова Н.И. // Прикл. биохимия и микробиология. 2016. Т. 52. № 3. С. 339–345.
Теренина М.Б., МишаринаТ.А., Крикунова Н.И., Алинкина Е.С., Фаткулина Л.Д., Воробьева А.К. // Прикл. биохимия и микробиология . 2011. Т. 47. № 4. С. 490–494.
Lambert R.J.W., P.N. Skandamis, P. Coote, Nyc-has G.-J.E. // J. Appl. Microbiol. 2001. V. 91. № 3. P. 453–462.
Алинкина Е.С., Мишарина Т.А., Фаткуллина Л.Д. // Прикл. биохимия и микробиология. 2013. Т. 49. № 1. С. 82–87.
Miller A.L. // Alt. Med. Rev. 1996. V. 1. № 1. P. 103–110.
Koroch A.R., Juliani H.R., Zygadlo J.A. Flavour and Fragrances. Chemistry, Bioprocessing and Sustainability / Ed. R.G. Berger. N.Y.: Springer, 2007. P. 43–116.
Charles D.J. Antioxidant Properties of Spices, Herbs and Other Sources. N.Y.: Springer, 2013. 610 p.
Miguel M.G. // Flavour Fragr. J. 2010. V. 25. № 2. P. 291–312.
Мишарина Т.А. // Прикл. биохимия и микробиология. 2001. Т. 37. № 6. С. 724–730.
Foti M.C., Ingold K.U. // J. Agric. Food Chem. 2003. V. 51. № 9. P. 2758–2765.
Мишарина Т.А., Теренина М.Б., Крикунова Н.И. // Прикл. биохимия и микробиология. 2009. Т. 45. № 6. С. 710–716.
Бурлакова Е.Б., Мишарина Т.А., Фаткуллина Л.Д., Теренина М.Б., Крикунова Н.И., Ерохин В.Н., Воробьева А.К. // Доклады РАН. 2011. Т. 437. № 3. С. 409–412.
Бурлакова Е.Б., Мишарина Т.А., Воробьева А.К., Алинкина Е.С., Фаткуллина Л.Д., Теренина М.Б., Крикунова Н.И. // Доклады РАН. 2012. Т. 444. № 6. С. 676–679.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


