Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 69-76
Изучение локализации низкомолекулярных стресс-индуцируемых белков, защищающих фотосинтетический аппарат от фотодеструкции
Л. С. Шарапова 1, Д. В. Акулинкина 1, Ю. В. Болычевцева 1, И. В. Еланская 2, **, Н. П. Юрина 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119991 Москва, Россия
** E-mail: ivelanskaya@mail.ru
* E-mail: nyurina@inbi.ras.ru
Поступила в редакцию 16.04.2018
После доработки 06.07.2018
Принята к публикации 25.07.2018
Аннотация
Изучали ассоциацию низкомолекулярных светоиндуцируемых стрессовых белков HliA/HliB с хлорофилл-белковыми комплексами тилакоидных мембран цианобактерии Synechocystis sp. PCC 6803. С помощью двумерного электрофореза в ПААГ, масс-спектрометрии и вестерн блоттинга показано, что белки HliA/HliB ассоциированы с мономерами и тримерами фотосистемы I и комплексом фотосистемы II, что предполагает их универсальную роль в защите фотосинтетического аппарата от избыточного света. Для изучения функций белков Hli и их влияния на фотохимическую активность фотосистемы I сравнивали клетки, не содержащие HliA/HliB, c клетками цианобактерий, у которых эти белки были идентифицированы. Показано, что фотохимическая активность пигмент-белковых комплексов фотосистемы I по поглощению кислорода с метилвиологеном в отсутствие стрессовых белков HliA/HliB в 3–4 раза ниже, чем в присутствии Hli белков. Высказано предположение, что белки Hli важны для реакции поглощения кислорода в фотосистеме I с искусственным донором и акцептором, что указывало на их роль в поддержании ее оптимальной активности.
В процессе фотосинтеза при оптимальной интенсивности света энергия поглощенных квантов практически полностью преобразуется в энергию химических связей. При избыточном освещении световая энергия может расходоваться на переход молекул хлорофиллов из основного синглетного состояния в триплетное. Триплетно-возбужденные молекулы хлорофилла способны передавать энергию на О2, в результате чего образуется синглетный кислород и его производные, которые являются сильными окислителями и вызывают деструкцию фотосинтетического аппарата [1–3]. Таким образом, избыточное освещение может вызывать окислительный стресс у фотосинтетических организмов. Чтобы минимизировать образование активных форм кислорода они выработали несколько способов защиты своего фотосинтетического аппарата, из которых наиболее быстрым является нефотохимическое тушение флуоресценции [1, 3]. Более медленный механизм защиты включает синтез светоиндуцируемых низкомолекулярных тилакоидных белков, содержащих одну трансмембранную спираль (One-helix proteins). Эти консервативные белки обнаружены у всех изученных фотосинтезирующих эукариот (оксигенных фототрофов) [4, 5]. Показано, что они играют существенную роль в сборке и стабилизации фотосинтетических пигмент-белковых комплексов тилакоидных мембран и, особенно, в реакционных центрах [6].
Цианобактерии относятся к прекрасным модельным организмам для изучения процессов фотосинтеза. У цианобактерий, считающихся эволюционными предшественниками хлоропластов, эти белки называются high light-inducible proteins (Hlips) или small Cab-like proteins (SCP) [5]. У Synechocystis sp. РСС 6803 (в дальнейшем Synechocystis) идентифицированы пять белков Hli, четыре из которых представляют собой низкомолекулярные белки HliA/HliB, HliC/HliD, а пятый – С-концевой фрагмент феррохелатазы [7–10]. Hli-белки содержат одну трансмембранную спираль, последовательность которой обладает высокой степенью гомологии с последовательностями первой и третьей трансмембранными областями белка светособирающего комплекса высших растений [7]. HliA-D являются низкомолекулярными белками (6–10 кДа), которые могут связывать хлорофилл и каротиноиды. Предполагают, что Hli-белки цианобактерий участвуют в нефотохимической диссипации избыточно поглощенной световой энергии [11] и в регуляции биосинтеза хлорофилла [15, 16], а также выполняют функции переносчиков молекул хлорофилла при сборке/репарации фотосистемы II (ФСII) [12–14]. Hli-белки, по-видимому, могут быть вспомогательным фактором интеграции хлорофилла с хлорофилл-связывающими белками [4, 17, 18 ]. Таким образом, низкомолекулярные светоиндуцируемые белки играют важную роль в защите фотосинтетического аппарата от фотодеструкции, и рассматриваются как одна из важных защитных систем клетки. Однако основная функция Hli-белков и их локализация в хлорофилл-белковых комплексах тилакоидных мембран до настоящего времени остаются недостаточно изученными. Изучение их участия в защите фотосинтетического аппарата от светового стресса при ассоциации с хлорофилл-белковыми комплексами фотосистем представляет большой интерес.
Цель работы − выявить ассоциацию HliA/HliB-белков с хлорофилл-белковыми комплексами клеток Synechocystis sp. дикого типа и мутанта, лишенного ФСII и изучить их влияние на фотохимическую активность ФСI.
МЕТОДИКА
Объект исследования. Объектом исследования служили клетки дикого типа цианобактерии Synechocystis sp. РСС 6803 и мутанта ΔФСII (∆psbDI/∆psbC/∆psbDII), лишенного этой фотосистемы [19]. Цианобактерии выращивали в жидкой среде BG-11 при 30°С в условиях постоянного освещения флуоресцентными лампами дневного света и аэрации с помощью магнитной мешалки до середины логарифмической фазы роста. Клетки дикого типа выращивали при умеренной интенсивности света (40 мкмоль фотонов/м2 · с), а клетки мутанта без ФСII – при низкой интенсивности света (5 мкмоль фотонов/м2 · с) с добавлением 5 мМ глюкозы и антибиотиков хлорамфеникола и спектиномицина 20 мкг/мл. Для создания условий светового стресса клетки дикого типа и мутантов без ФСII, выращенные в указанных выше условиях, освещали в течение 1 ч светом высокой интенсивности (150 мкмоль фотонов/м2 · с). Меньшая интенсивность освещения использовалась для предотвращения фотодеструкции и гибели клеток, особенно в случае мутанта без ФСII. При сравнительном изучении клеток дикого типа и мутанта без ФСII клетки дикого типа были предварительно адаптированы к условиям выращивания мутанта.
Выделение тилакоидных мембран и фракционирование хлорофилл-белковых комплексов. Выделение тилакоидных мембран проводили по методу, описанному в работе [20]. Для экстракции нативных комплексов фотосистем из тилакоидной мембраны использовали мягкий неионный детергент n-додецил-β-D-мальтозид (β-DM), который добавляли в соотношении детергент: хлорофилл 15 : 1. После инкубации в течение 30 мин при 4°C лизат центрифугировали при 18 000 g в течение 10 мин.
Определение содержания хлорофилла и активности комплекса фотосистемы I в тилакоидных мембранах. Содержание хлорофилла в определяли в этаноловом экстракте [21]. Активность комплекса фотосистемы I (ФСI) определяли по способности к фотоокислению P700 (первичного донора электрона реакционного центра ФСI) при освещении действующим светом при 730 нм как фотоиндуцированное изменение поглощения при 810 нм (против 870 нм). Измерения проводили с помощью флуориметра DUAL-PAM-101 с приставкой ED-Р700 DW-101 (“Walz, Effelrich”, Германия) [22].
Определение фотохимической активности комплекса ФСI по поглощению О2 в системе искусственных донора и акцептора с помощью электрода Кларка. Фотохимическую активность ФСI оценивали по поглощению кислорода тилакоидными мембранами в результате транспорта электрона от донорной пары 2,6-дихлорфенолиндофенол (ДХФИФ)/аскорбат натрия) через ФСI к метилвиологену (МВ), который после фотовосстановления окислялся кислородом воздуха. Для измерений использовали тилакоидные мембраны, выделенные из клеток дикого типа и мутанта без ФСII, выращенные при низком освещении (5 мкмоль фотонов/м2 · с). Клетки мутанта без ФСII подвергали световому стрессу (150 мкмоль фотонов/м2 · с) в течение 1 ч. Тилакоидные мембраны суспендировали в 50 мМ трициновом буфере, рН 8.3, содержащем 100 мМ NaCl, 5 мМ MgCl2, 1 мМ KCN, 40 мкМ ДХФИФ, 2 мМ аскорбиновой кислоты и 0.5 мкМ 3-(3,4-дихлорфенил)-1,1-диметилмочевину (диурон), и измеряли скорость фотохимического восстановления О2 в присутствии или без МВ (100 мкМ). Ингибитор ФСII – диурон был необходим для того, чтобы подавить ее активность в условиях искусственной донорно-акцепторной системы. В ячейку вносили такое количество тилакоидных мембран, чтобы концентрация хлорофилла составила 20 мкг/мл, а затем освещали белым светом 800 мкмоль фотонов/м2 · с. Скорость электронного транспорта выражали в мкмоль О2/мг хлорофилла ч.
Фракционирование пигмент-белковых и белковых комплексов тилакоидных мембран. Фракционирование проводили с помощью нативного неокрашенного электрофореза в ПААГ (Clear Native PAGE; СN-PAGE). К лизату тилакоидных мембран Synechocystis sp. добавляли в соотношении лизат : буфер 9 : 1 200 мМ бистрис буфера, рН 7.0, содержащего 75%-ную сахарозу и 1 М 6-аминокапроновую кислоту. Использовали градиентный ПААГ от 4 до 12%. Электрофорез в первом направлении проводили в течение 4–5 ч на приборе (“Hoefer”, США) при напряжении 200 В. После окончания электрофореза полосы фотографировали, затем 1 полоску использовали для электрофореза во втором направлении по методу Леммли с Na-ДДС. Электрофорез белков проводили в 12.5%-ном ПААГ в течение 2 ч в трис-глициновом буфере, pH 7.5, содержащем 25 мМ трис, 250 мМ глицина и 0.1%-ный ДДС-Na, при постоянной силе тока 120 мА.
Вестерн-блоттинг. Перенос белков с геля на нитроцеллюлозную мембрану осуществляли в камере для блоттинга в буфере для переноса (25 мМ трис, 250 мМ глицин, 20%-ный этанол и 0.02%-ный Na-ДДС, pH 7.5) в течение 1 ч при 200 мА. Затем мембрану с перенесенными белками помещали на 1 ч при 4°С в (блокирующий) 50 мМ трис/HCl буфер, pH 7.5, содержащий 200 мМ NaCl, 0.1%-ный твин 20 (TBST) и 5%-ное сухое обезжиренное молоко, и затем добавляли первичные поликлональные антитела кролика к HliA/HliB (1 : 4000) (“Abcam”, США). Мембрану инкубировали с антителами при постоянном перемешивании в течение ночи при 4°С. В качестве вторичных антител использовали антикроличий IgG козла, конъюгированный с пероксидазой хрена (1 : 10 000) (“AgriSera”, Швеция). Каждый этап сопровождали многократным промыванием мембран буфером TBST. Иммунные комплексы на мембране выявляли с помощью флуоресцентной системы детекции ECL (“GE Healthcare”, Великобритания), сигналы регистрировали на рентгеновскую пленку (“Retina”, Германия). Пленку сканировали, данные обрабатывали с помощью программы Image J (http://rsbweb.nih.gov/ij/).
Идентификация белков с помощью масс-спектрометрии MALDI-TOF. Триптический гидролиз белка проводили в полиакриламидном геле, окрашенном Кумасси бриллиантовым голубым. Для удаления красителя кусок геля размером 3–4 мм3 дважды промывали 100 мкл 40%-ного раствора ацетонитрила в 0.1 М NH4HCO3 в течение 20 мин при 37°С. Затем для дегидратации геля добавляли 100 мкл ацетонитрила, который удаляли и высушивали кусок геля. К высушенному гелю добавляли 3.5 мкл раствора (15 мкг/мл) модифицированного трипсина (“Promega”, США) в 0.05 М NH4HCO3. Гидролиз проводили в течение 3 ч при 37°С, затем к раствору добавляли 5.25 мкл 0.5%‑ной трифторуксусной кислоты (ТФУ) в 50%-ном водном растворе ацетонитрила и тщательно перемешивали. Гидролизат подвергали MALDI-масс-спектрометрии. Для масс-спектрометрии на мишени смешивали 1.5 мкл гидролизата и 0.5 мкл раствора (10 мг/мл) 2,5-диоксибензойной кислоты (“Aldrich”, США) в 20%-ном водном ацетонитриле, содержащем 0.5%-ную ТФУ. Полученную смесь высушивали на воздухе. Идентификацию белков осуществляли при помощи программы Mascot (www.matrixscience.com). Масс-спектры были обработаны с помощью программного пакета FlexAnalysis 3,3 (“Bruker Daltonics”, Германия). Оборудование и программное обеспечение для масс-спектрометрии использовали на базе Центра коллективного пользования “Промышленные биотехнологии” ФИЦ Биотехнологии РАН.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ассоциация белков HliA/HliB с хлорофилл-белковыми комплексами тилакоидных мембран. Для изучения локализации Hli белков анализировали хлорофилл-белковые и белковые комплексы в лизатах тилакоиднных мембран с помощью двумерного электрофореза (2D). В первом направлении комплексы фракционировали в нативном ПААГ (рис. 1а), а во втором – денатурирующем с ДДС-Na (рис. 1б). После фракционирования во втором направлении и окрашивания белков использовали масс спектрометрию для идентификации окрашенных белковых компонентов.
Рис. 1.
Двумерная электрофореграмма хлорофилл-белковых комплексов тилакоидных мебран клеток дикого типа Synechocystis sp. б − 1–16 – белковые компоненты, идентифицированные масс-спектрометрией MALDI-TOF, а – электрофореграмма белковых компонентов в ПААГ в нативных условиях: ФСI(3) – тример комплекса ФСI; ФСI(1) –мономер комплекса ФСI, ФСII(2) – димер комплекса ФСII, ФСII(1) – мономер комплекса ФСII, НАДФH-ОР – НАДФH- окидоредуктаза, цит. b6/f – цитохром b6/f и СБ – свободные белки; в – вестерн-блот-анализ белков HliA/HliB после действия светового стресса.
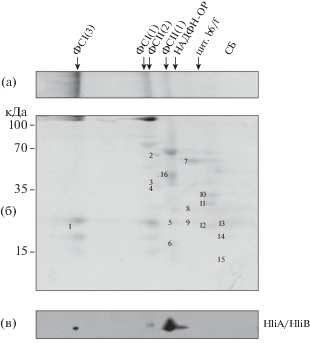
На основании идентификации белков (на рис. 1 отмечены цифрами) были выявлены хлорофилл-белковые и белковые комплексы, обозначенные на рис. 1. Как показано на рис. 1а, 1б, после фракционирования лизата тилакоидных мембран клеток дикого типа в нативных условиях удалось обнаружить и идентифицировать тримеры и мономеры комплекса ФСI, димеры и мономеры комплекса ФСII, цитохромный комплекс, АТФ-азный комплекс и комплекс НАДФН-оксидоредуктазы, а также зону свободных белков, отделившихся от комплексов в процессе выделения и фракционирования. Сходное распределение хлорофилл-белковых комплексов было установлено для Synechocystis [12].
С помощью иммуноблотинга были идентифицированы белки HliA/HliB в хлорофилл-белковых комплексах (рис. 1в). Установлено, что они ассоциированы с тримерами ФСI, комплексами ФСII и мономерами ФСI, причем их большая часть связана с комплексом ФСII. Иногда белки HliA/HliB обнаруживались также в зоне свободных белков.
Ранее были получены однозначные данные об ассоциации HliA/HliB с комплексом ФСII. Так, белок HliA был обнаружен в мономерах и димерах комплекса ФСII и ассоциирован непосредственно с субъединицей СР47 [23]. Предполагают, что белки HliA/HliB участвуют в стабилизации хлорофилла для его повторного использования при репарации поврежденного комплекса ФСII и биогенезе вновь синтезированных комплексов [23–26].
Относительно локализации HliA/HliB в ФСI были получены разноречивые данные. Так, было показано, что эти белки не связаны с ФСI Synechocystis [24]. Было обнаружено, что они ассоциированы как с тримерами, так и с мономерами ФСI клеток дикого типа, выращенных в нормальных условиях и подвергнутых световому стрессу. Полученные в данной работе результаты согласовывались с ранее опубликованными данными о наличии белков Hli в тримерах ФСI клеток дикого типа в стрессовых условиях [18, 27]. В работе [18] белки Hli не были обнаружены во фракции, содержащей мономеры ФСI и комплекс ФСII, что, возможно, обусловлено их фотодеструкцией при использовании сильного светового стресса (освещение 200–400 мкмоль фотонов/м2 · с в течение 12 ч). Предполагают, что Hli белки взаимодействуют с ФСI в процессе переноса молекул хлорофилла от тримера ФCI к комплексу ФСII. Действительно, показано, что тримеры ФСI Synechocystis акцептируют большую часть вновь синтезированных молекул хлорофилла, которые затем распределяются между другими хлорофилл-связывающими белками [28]. Таким образом, в данной работе обнаружена ассоциация белков HliA/HliB с тримерами и мономером комплекса ФСI.
Для подтверждения обнаруженной ассоциации HliA/HliB с ФСI был использован мутант ΔФСII, не содержащий ФСII, который позволил бы исключить возможность связывания белков Hli с ФСII, также связывающей эти белки. У мутанта ΔФСII были выявлены все комплексы, содержащиеся в тилакоидных мембранах клеток дикого типа, за исключением комплекса ФСII (рис. 2). С помощью иммуноблоттинга удалось установить, что белки HliA/HliB ассоциированы только с мономерами ФСI. Отмечен также сигнал в области тримеров ФСI. Таким образом, с помощью мутанта ΔФСII Synechocystis sp. показана ассоциация белков HliA/HliB с мономерами ФСI в клетках цианобактерий. Эти результаты согласовывались с полученными в работе, проведенной на клетках высших растений, в которой было показано, что эволюционный гомолог Hlip – односпиральный белок Ohp Arabidopsis thaliana также связан с мономером ФСI [29].
Рис. 2.
Двумерная электрофореграмма белковых комплексов тилакоидных мебран клеток мутанта Synechocystis sp. ΔФСII. б – 1–21 – белковые компоненты, идентифицированные масс-спектрометрией MALDI-TOF; а – электрофореграмма компонентов хлорофилл-белковых комплексов тилакоидных мембран в ПААГ в нативных условиях : ФСI(3) – тример комплекса ФСI, ФСI(1) –мономер ФСI, АТФсинт – АТФ-синтаза, НАДФH-ОР – НАДФH – окидоредуктаза, цит. b6/f – цитохром b6/f и СБ – свободные белки; в – вестерн-блот-анализ белков HliA/HliB после действия светового стресса.

Разноречивость данных литературы может быть обусловлена тем, что время обновления белков ФСI существенно превышало это время у ФСII. Вследствие этого содержание светоиндуцированных стрессовых белков HliA/HliB, участвующих в реутилизации хлорофилла и ассоциированных с ФСI, оказывалось ниже, чем в ФСII. Можно также предположить, что их содержание ниже чувствительности методов, используемых в работах. Отличия могут быть вызваны и различными условиями культивирования клеток. Связь белков Hli с мономерами и тримерами ФСI не кажется удивительной, поскольку они, по-видимому, могут выполнять функции запасания и сохранения хлорофилла, а также переносить хлорофилл при нарушениях ФСI и синтезе новообразованных комплексов ФСI, как это предполагается для ФСII. Можно также предположить, что белки Hli участвуют в системе координированной доставки пигментов и вновь синтезированных апобелков при биогенезе фотосинтетических комплексов ФСI и ФСII, уменьшая риск накопления фототоксичных свободных молекул хлорофиллов.
Мутанты без ФСII могут расти только в фотогетеротрофных условиях (5 мкмоль фотонов/м2 ⋅ с в присутствии глюкозы). В связи с этим необходимо было проверить влияние гетеротрофного питания на световую индукцию и ассоциацию белков HliA/HliB с пигмент-белковыми комплексами клеток дикого типа. Для этого клетки дикого типа были выращены в тех же условиях, что и мутант ΔФСII. Однако белки HliA/HliB не удалось в них обнаружить при выращивании в фотогетеротрофных условиях (рис. 3б, 1). Не исключено, что их содержание ниже порога определения. Однако после действия светового стресса белки HliA/HliB удалось идентифицировать в клетках дикого типа [20]. По-видимому, гены этих белков в клетках экспрессируются только под действием светового стресса [5]. Таким образом, фотогетеротрофные условия выращивания не влияли на ассоциацию белков HliA/HliB с хлорофилл-белковыми комплексами. Сходные с приведенными результатами данные о присутствии белков HliA/HliB в клетках, выращенных при низкой интенсивности света, были получены в работе [24].
Рис. 3.
Электрофореграмма (а) белков тилакоидных мембран клеток дикого типа (1) и мутанта Synechocystis sp. до (2) и после светового стресса (3, 150 мкмоль/м2 с) в ПААГ c ДДС-Na после окрашивания Кумасси R-250; вестерн-блот-анализ (б) белковых комплексов тилакоидных мебран клеток дикого типа (1) и мутанта (2), выращенных в фотогетеротрофных условиях, после действия светового стресса в течение 1 ч (3).

Как показано на рис. 3, у мутанта ΔФСII белки HliA/HliB экспрессировались даже при низком освещении (5 мкмоль фотонов/м2 · с), что отличало их от клеток дикого типа, у которых в этих условиях белки HliA/HliB не обнаруживались. Полученные данные свидетельствовали о том, что мутант в большей степени подвержен световому стрессу, и экспрессия стрессовых белков HliA/HliB у него индуцировалась даже в условиях низкой освещенности. Предполагают также, что у мутантов, лишенных фотосистем, эти белки синтезируются конститутивно [7].
Фотохимическая активность ФСI в клетках дикого типа и мутанта, лишенного ФСII, различающихся по содержанию белков HliA/HliB. Для оценки влияния мембранных белков HliA/HliB на фотохимическую активность ФСI изучали скорость электронного транспорта через ФСI в мембранах клеток дикого типа и мутанта ΔФСII. Фотохимическую активность ФСI сравнивали в тилакоидных мембранах клеток дикого типа, у которых не идентифицированы белки HliA/HliB, с помощью вестерн-блот анализа, и мутанта, лишенного ФСII, но содержащего их (рис. 3). Клетки дикого типа и мутанта выращивали при низкой освещенности в присутствии глюкозы.
При измерении МВ-зависимого поглощения кислорода скорость электронного транспорта через ФСI в клетках мутанта ΔФСII оказалась значительно выше, чем в клетках дикого типа, выращенных в одинаковых условиях (рис. 4). Фотохимическая активность комплекса ФСI в мембранах мутанта ΔФСII, содержащих белки HliA/HliB, была выше в 3–4 раза, чем в мембранах клеток дикого типа, не содержащих белки HliA/HliB.
Рис. 4.
Фотохимическая активность ФСI (мкмоль О2/ч ⋅ мг хлорофилла) тилакоидных мембран клеток Synechocystis sp. дикого типа (ДТ) и мутанта ΔФСII в отсутствие (1) и в присутствии (2) метилвиологена. ΔФСII + осв – клетки ΔФСII дополнительно освещенные светом высокой интенсивности (150 мкмоль фотонов/м2 · с в течение 1 ч.)
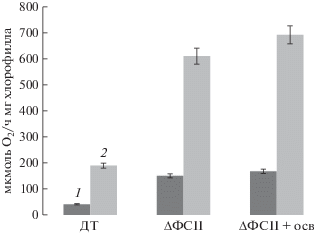
Было проведено сравнение активности ФСI в тилакоидных мембранах мутанта ΔФСII, выросшего при низкой освещенности, и в мембранах того же мутанта после действия светового стресса (освещение 150 мкмоль фотонов/м2 · с, в течение 1 ч). Оказалось, что в условиях светового стресса содержание белков HliA/HliB у мутанта ΔФСII возрастало на ~20% (рис. 3б, 3). Обнаружено также, что у мутанта ΔФСII, выросшего при низкой освещенности, скорость электронного транспорта увеличивалась на 15–17% после светового стресса (рис. 4), что коррелировало с увеличением содержания белков HliA/HliB в этих условиях (рис. 3б, 3). Эта корреляция свидетельствовала в пользу предположения о необходимости белков Hli для оптимальной фотохимической активности ФСI. Результаты по низкой скорости фотохимического поглощения кислорода ФСI в мембранах клеток дикого типа, практически их не содержащих (рис. 3б, 1), согласовывались с опубликованными ранее данными по низкой скорости электронного транспорта через ФСI в тилакоидных мембранах мутантов Synechocystis sp., лишенных белков Hli [18]. Высокая фотохимическая активность ФСI в мембранах мутанта ΔФСII по сравнению с активностью в клетках дикого типа могла быть связана с присутствием белков HliA/HliB, но могла и отражать различное соотношение тримерных и мономерных комплексов ФСI в мембранах клеток дикого типа и мутанта ΔФСII. В мембранах клеток дикого типа, выращенного при низкой освещенности, оказалось выше содержание тримерных комплексов ФСI, а у мутанта ΔФСII – мономерных [20]. Однако показано, что скорость поглощения кислорода тримерами и мономерами ФСI в искусственной донороно-акцепторной системе одинакова [31]. Обнаруженное различие фотохимической активности ФСI в мембранах клеток дикого типа и мутанта ΔФСII скорее связано с различным содержанием белков HliA/HliB.
Для того чтобы понять, какой участок переноса электрона может отвечать за увеличение фотохимической активности ФСI в присутствии белков Hli, были изучены фотоиндуцированные изменения поглощения реакционного центра П700 в мембранах клеток дикого типа и мутанта ΔФСII, выращенных при низкой интенсивности света (5 мкмоль фотонов/м2 ⋅ с). При измерении на флуориметре DUAL-PAM-101 фотоиндуцированных изменений поглощения П700 было обнаружено, что скорость восстановления П700 аскорбатом натрия после выключения света у мутанта заметно выше, чем у дикого типа. Время 50%-ного темнового восстановления П700 составляло 17.5 ± 3.5 с для клеток дикого типа и 10.5 ± 0.5 с для мутанта. Эти данные косвенно подтверждали предположение о большей доступности П700 для доноров и (или) акцепторов в комплексах ФСI мутанта ΔФСII по сравнению с П700 комплексов ФСI клеток дикого типа. Не исключено, что наличие мембранных (светоиндуцированных) белков HliA/HliB, ассоциированных с комплексами ФСI мутанта ΔФСII, могут вызывать изменения организации этих пигмент-белковых комплексов, приводящие к увеличению доступности П700 для доноров и (или) акцепторов электронов, в результате чего может возрастать фотохимическая активность ФС1.
Таким образом, сравнение фотосинтетической активности ФСI в клетках, содержащих и не содержащих белки HliA/HliB, показало важную роль этих белков в поддержании оптимальной фотохимической активности ФСI. Полученные в работе данные об ассоциации стрессовых светоиндуцируемых белков с мономерами и тримерами ФСI и комплексом ФСII свидетельствуют об универсальной роли этих белков в защите фотосинтетического аппарата от избыточного света. Изучение локализации стрессовых светоиндуцируемых белков имеет не только самостоятельный научный интерес, но и позволяет расширить представления о защитных функциях светоиндуцируемых Hli-белков. Эти данные могут быть использованы для изучения регуляции процессов фотосинтеза, определяющих продуктивность сельскохозяйственных растений.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-04-01626А), программы Президиума РАН № I.18 “Молекулярная и клеточная биология и постгеномные технологии” и госзадания ФИЦ Биотехнологии РАН № 01201351375.
Авторы выражают благодарность проф. В.Ф.Д. Вермаасу (Университет Аризоны, США) за предоставление мутанта цианобактерий.
Список литературы
Карапетян Н.В. // Биохимия. 2007. Т. 72. № 10. С. 1385−1395. (Karapetyan N.V. // Biochemistry (Mosc). 2007. V. 72. № 10. P. 1127-1135).
Niyogi K.K. // Annu. Rev. Plant Physiol. Plant Mol. B-iol.1999. V. 50. P. 333‒359.
Kirilovsky D., Kerfeld C.A. // Biochim. Biophys. Acta. 2012. V. 1817. № 1. P. 158‒166.
Tibiletti T., Hernández-Prieto M.A, Matthijs H.C.P., Niyogi K.K., Funk C. // Biochim. Biophys. Acta. 2016. V. 1857. № 4. P. 396–407.
Tibiletti T., Rehman A.U., Vass I. // Photosynth. Res. 2018. V. 135. № 1–3. P. 103–114.
Beck J., Lohscheider J.N., Albert S., Andersson U., Mendgen K.W., Rojas-Stütz M.C., Adamska I., Funck D. // Frontiers Plant Sci. 2017. V. 8. https://doi.org/10.3389/ fpls.2017.00007.
Funk C., Vermaas W.F.J. // Biochemistry. 1999. V. 38. № 29. P. 9397–9404.
Sobotka R., McLean S., Zuberova M., Hunter C.N., Tichy M. // J. Bacteriol. 2008. V. 190. № 6. P. 2086–2095.
Sobotka R., Tichy M., Wilde A., Hunter C.N. // Plant Physiol.2011. V. 155. № 4. P. 1735–1747.
Storm P., Tibiletti T., Hall M., Funk C. // PLoS One. 2013. V. 8.e55569.
Havaux M., Guedeney G., He Q., Grossman A.R. // Biochim. Biophys. Acta. 2003. V. 1557. № 1–3. P. 21–33.
Knoppová J., Sobotka R., Tichy M., Yu J., Konik P., Halada P., Nixon P.J., Komenda // Plant Cell. 2014. V. 26. № 3. P. 1200–1212.
Hernández-Prieto M.A., Tibiletti T., Abasova L., Kirilovsky D., Vass I., Funk C. // Biochim. Biophys. Acta. 2011. V. 1807. № 9. P. 1043–1151.
Yao D.C., Brune D.C., Vavilin D., Vermaas W.F. // J. Biol. Chem. 2012. V. 287. № 1. P. 682–692.
Xu H., Vavilin D., Funk C., Vermaas W.F.J. // Plant Mol. Biol. 2002. V. 49. № 2. P. 149–160.
Xu H., Vavilin D., Funk C., Vermaas W.F.J. // J. Biol. Chem. 2004. V. 279. № 27. P. 27971–27979.
Юрина Н.П., Мокерова Д.В., Одинцова М.С. // Физиол. растений. 2013. Т. 60. № 5. С. 611–624. (Yurina N.P., Mokerova D.V., Odintsova M.S. // Russian Journal of Plant Physiology. 2013. V. 60. № 5. P. 577–588).
Wang Q., Jantaro S., Lu B., Majeed W., Bailey M., He Q. // Plant Physiol. 2008. V. 147. № 3. P. 1239–1250.
Shen G., Boussiba S., Vermaas W.F.J. // Plant Cell. 1993. V. 5. № 12. P. 1853–1863.
Акулинкина Д.В., Болычевцева Ю.В., Еланская И.В., Карапетян Н.В., Юрина Н.П. // Биохимия. 2015. Т. 80. № 10. С. 1522‒1531. (Akulinkina D.V., Bolychevtseva Y.V., Elanskaya I.V., Karapetyan N.V., Yurina N.P. // Biochemistry (Mosc). 2015. V. 80. № 10. P. 1254–1261).
Lichtenthaler H.K. // Methods Enzymol. 1987. V. 148. P. 350–382.
Schreiber U., Klughammer C., Neubauer C. // Z. Naturforsch. 1988. V. 43. P. 686–698.
Promnares K., Komenda J., Bumba L., Nebesarova J., Vacha F., Tichy M. // J. Biol. Chem. 2006. V. 281. № 43. P. 32705–32713.
Yao D.C., Kieselbach T., Komenda J., Promnares K., Hernandez-Prieto M.A., Tichy M., Vermaas W.F.J., Funk C. // J. Biol. Chem. 2007. V. 282. № 1. P. 267–276.
Kufryk G., Hernandez-Prieto M.A., Kieselbach T., Miranda H., Vermaas W.F.J., Funk C. // Photosynth Res. 2008. V. 95. № 2–3. P. 135–145.
Shi L.X., Hall M., Funk C., Schöder W.P. // Biochim. Biophys. Acta. 2012. V. 1817. № 1. P. 13–25.
Daddy S., Zhang J., Jantara S., He C., He Q., Wang Q. // Sci. Rep. 2015. V. 5. 9480. doi 10.1038/srep09480
Kopecna J., Komenda J., L. Bucinska L., Sobotka R. // Plant Physiol. 2012. V. 160. № 4. P. 2239–2250.
Andersson U., Heddad M., Adamska I. // Plant Physiol. 2003. V. 132. № 2. P. 811–820.
Rakhimberdieva M.G., Boichenko V.A., Karapetyan N.V., Stadnichuk I.N. // Biochemistry. 2001. V. 40. № 51. P. 15780–15788.
El-Mohsnawy E., Kopczak M.J., Schlodder E., Nowac-zyk M., Meyer H.E., Warscheid B., Karapetyan N.V., Rögner M. // Biochemistry. 2010. V.49. № 23. P. 4740–4751.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


