Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 266-274
Получение штамма Aspergillus nidulans lac№ 4 (argB–) и его применение для трансформации прогестерона
О. С. Савинова 1, *, А. М. Чулкин 1, Т. С. Савинова 2, Е. А. Вавилова 1, Д. В. Васина 1, П. Н. Сольев 3, Т. В. Фёдорова 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Россия
3 Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, Россия
* E-mail: savinova_os@rambler.ru
Поступила в редакцию 10.11.2019
После доработки 20.12.2019
Принята к публикации 23.12.2019
Аннотация
Получен штамм Aspergillus nidulans lac№ 4 (argB–) – продуцент рекомбинантной лакказы А базидиомицета Trametes hirsuta 072. Проведена биокаталитическая трансформация прогестерона (ПГ) новым штаммом. Основные продукты биотрансформации: 11α-гидрокси-ПГ, 11α-ацетокси-ПГ и 6β,11α-дигидрокси-ПГ. Изучена кинетика сорбции ПГ и основных продуктов его биотрансформации из трансформационной среды с использованием сорбента Macronet MN-200. Показана эффективность применения метода твердофазной экстракции стероидов без предварительного отделения мицелия.
Стероидные лекарственные препараты занимают одно из важных мест в терапии большого числа заболеваний (воспалительных, аллергических, гинекологических, онкологических и др.) [1, 2]. Работы по поиску методов трансформации природных стероидных соединений с целью получения новых лекарственных препаратов, а также разработки новых экологически чистых технологий, ведутся учеными на протяжении нескольких десятилетий, однако остаются актуальными и в настоящее время. Одним из наиболее важных и перспективных методов является биотрансформация с применением ферментных систем различных микроорганизмов, в том числе мицелиальных грибов [3]. Применение целых клеток микроорганизма в качестве биокатализатора более предпочтительно, так как исключает необходимость выделения, очистки и стабилизации чистых ферментов [4].
Проблема регионаправленного и стереоселективного микробиологического гидроксилирования относится к числу важнейших в химии стероидов [3]. В настоящее время для проведения таких трансформаций штаммы выбираются в результате скрининга.
Одним из часто используемых модельных соединений для изучения направленности гидроксилирования стероидов ряда прегнана микроорганизмами является прогестерон (ПГ). ПГ – половой гормон, синтезируемый желтым телом яичника, корой надпочечников, семенными пузырьками и плацентой. 11(α/β)-Гидроксилирование стероидов, особенно ПГ, является важным процессом при производстве кортикостероидов. Однако введение кислородной функции в С11 положение химическими методами синтеза трудно осуществимо. 11α-Гидроксипрогестерон (11α-гидрокси-ПГ), как и его 11β-эпимер, обладает ингибирующей активностью в отношении фермента 11β-гидроксистероиддегидрогеназы, который окисляет 11-гидроксигруппу в 11-кетогруппу, участвуя таким образом в регуляции электролитного баланса [5].
Биотрансформация ПГ с образованием 11α-гидрокси-ПГ наиболее изучена с применением грибов Aspergillus ochraceus [6]. Наличие 11α-монооксигеназной активности и способность трансформировать ПГ с образованием 11α-гидрокси-производного обнаружена также у некоторых штаммов вида Aspergillus nidulans [7–9]. Несмотря на то, что грибы A. nidulans широко применяются в качестве модельного организма в молекулярной биологии и биотехнологии, их способность к трансформации стероидов мало изучена.
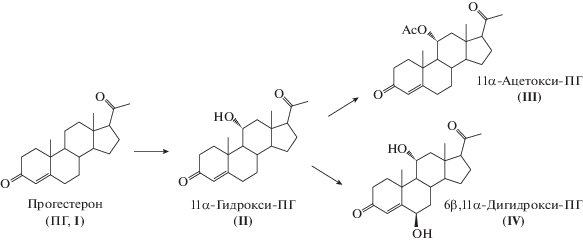
Ранее было обнаружено, что штамм дикого типа A. nidulans ВКПМ F-1069 способен гидроксилировать ПГ с образованием 11α-гидрокси-ПГ и 6β,11α-дигидрокси-ПГ, а также ацетилировать 11α-гидрокси-ПГ (рис. 1) [10].
Известно, что наличие генетических мутаций в штамме может влиять на его стероид-трансформирующую способность (степень превращения исходного субстрата) и регионаправленность гидроксилирования. Так, в работах [11, 12] было показано, что введение плазмиды pUT 720, несущей устойчивость к блеомицину и содержащей ген Sh ble, экспрессируемый под контролем сигналов экспрессии gpd и trpC A. nidulans, изменяло направление гидроксилирования молекулы ПГ грибом Cochliobolus lunatus с С11β- на С15α-положение.
В работе [13] показана возможность гидроксилирования некоторых стероидов в органических средах базидиальными лакказами (ЕС 1.10.3.2) [14].
Цель работы − получение нового штамма A. nidulans lac№ 4 (argB–), способного продуцировать рекомбинантную лакказу А базидиомицета Trametes hirsuta 072, оценка влияния генетических изменений в штамме на гидроксилирующую и ацетилирующую способность, а также изучение возможности использования метода твердофазной экстракции (ТФЭ) стероидов из культуральной среды без предварительного отделения мицелия.
МЕТОДИКА
Штаммы. В работе были использованы следующие штаммы микроорганизмов: штамм аскомицета A. nidulans 031 (argB–; pyrG–) (син. A. nidulans (Eidam) G. Winter; AN031; FP-308.1) из коллекции “The CBS-KNAW culture collection”, CBS 129193 (Нидерланды); – ауксотроф штамма A. nidulans ВКПМ F-1069 дикого типа (син. FGSC A4; ATCC 3863, 12996, 26451; CBS 112.46; NRRL 194), несущий мутации argB2 и pyrG89 [15]. Для конструирования плазмиды и бактериальной экспрессии использовали штамм Escherichia coli XL-10 Gold (“Stratagene”, США).
Реактивы. Прогестерон (I, ПГ, CAS № 57-83-0, С21Н30О2. M.м. 314.46; “Steraloids Inc.”, США) использовали в качестве исходного субстрата и стандарта. 11α-Гидроксипрогестерон (II, 11α-гидрокси-ПГ, CAS No. 80-75-1, C21H30O3, M.м. 330.46; “Steraloids Inc.”, США) и 11α-ацетоксипрогестерон (III, 11α-ацетокси-ПГ, CAS № 2268-98-6, C23H32O4, M.м. 372.5; “Steraloids Inc.”, США) использовали в качестве стандартов. В качестве сорбента использовали Macronet MN-200 (“Purolite Ltd.”, США).
Неорганические соли − фирмы “Fluka” (Germany) и “Amresco” (США), дрожжевой экстракт и агар – “Difco Becton Dickinson”, США и “Sparks”, США), диметилсульфоксид 99.0%-ный (ДМСО) – “Serva”, США.
Культивирование. Штаммы A. nidulans культивировали поверхностным способом в течение 7–10 сут при 37°С [10] в термостате на агаризованной минимальной питательной среде (ММ) следующего состава (г/л): NaNO3 – 0.53, D-глюкоза – 10.0, уридин – 1.1, урацил – 1.2, аргинин – 0.21 (при культивировании трансформантов уридин и урацил не добавляли), раствор минеральных солей, описанный в работе [10], – 20 мл/л.
В качестве посевного материала для глубинного культивирования использовали водную суспензию конидий (4 × 107 конидий/100 мл). При глубинном культивировании трансформантов A. nidulans для оценки активности лакказы использовали жидкую среду ММ с концентрацией глюкозы 20 г/л. Культивирование проводили на орбитальной качалке Brunswick Innova № 44 (“Eppendorf, inc.”, США) в колбах на 750 мл при 240–250 об./мин и 37°C.
Для культивирования грибов с последующей трансформацией ПГ была использована среда CM [16] следующего состава (г/л): глюкоза – 40; MgSO4 ∙ 7Н2О – 1.0; КН2РО4 – 0.74; пептон – 1.0; дрожжевой экстракт – 1.0; L-аспарагин – 0.7 с добавлением уридина, урацила и аргинина в зависимости от использованного штамма, как описано выше.
Конструирование плазмиды pGPD-lac1-A.n. Из плазмиды pBGlac [17] с помощью рестрикции по сайтам AdeI-PaeI был вырезан фрагмент, содержаший ген lacA Trametes hirsuta (GeneBank:KP027478); из плазмиды pPCGPDPr с помощью рестрикции по сайтам KpnI-PscI был вырезан фрагмент, содержащий последовательность сильного конститутивного промотора глицеральдегид-3-фосфатдегидрогеназы (gpdA), из плазмиды pPCGNX [17] по сайтам NcoI-PaeI был вырезан фрагмент сигнального пептида β-галактозидазы (BgaS) Penicillium canescens. Полученные фрагменты лигировали в плазмидный вектор pBlueskript II KS (+) (“Stratagene”, США), разрезанный по сайтам KpnI-AdeI. Полученную лигазную смесь (5 мкл) использовали для трансформации компетентных клеток штамма E. coli XL10 Gold. Правильность сборки плазмидной конструкции проверяли с помощью рестрикционного анализа препаратов плазмидной ДНК по сайтам AdeI-PaeI и KpnI-PaeI. Правильность состыковки по сайтам PaeI/NcoI проверяли секвенированием (“Евроген”, Россия) с помощью олигонуклеотидного праймера: PCGpd_prom_seq СССTCTTCCATCCTCCTCCT.
Трансформация A. nidulans плазмидой и отбор клонов. Плазмида pGPD-lac1-A.n. была введена в геном A. nidulans 031 (argB2-, pyrG89-) ко-трансформацией [18] совместно с плазмидой pJR15 [19], несущей ген pyrG A.nidulans, c отбором на селективной среде ММ, содержащей 0.2 мМ 2,2'-азино-бис-(3-этилбензтиазолин-6-сульфоновой кислоты) диаммониевой соли (АБТС) и 0.1 мМ CuSO4.
Определение активности лакказы. Активность лакказы в культуральной жидкости (КЖ) определяли спектрофотометрическим методом на спектрофотометре PerkinElmer Lambda 35 (США), как описано в работе [20], с использованием раствора АБТС в качестве хромогенного субстрата. Измерения проводили в 0.1 М натрий-ацетатном буфере, рН 4.5. За 1 условную единицу активности принимали увеличение оптической плотности в 1 мл реакционной смеси за 1 мин.
Биотрансформация прогестерона штаммами A. nidulans. Водную суспензию конидий готовили смывом с поверхности колоний и по 4 × 107 конидий вносили в качалочные колбы емкостью 750 мл со 100 мл среды СМ. Затем в среду вносили ПГ в виде раствора в ДМСО в концентрации 1.0 г/л, при этом концентрация растворителя составляла 4% (об.). Культуру выращивали на качалке при 37°С в течение 4 сут. Трансформацию проводили в тех же условиях в течение 66 ч для изучения влияния мутаций и наличия плазмиды и 216 ч для оценки возможности применения метода ТФЭ для извлечения продуктов трансформации без отделения мицелия.
Жидкофазная экстракция (ЖФЭ). Извлечение продуктов трансформации ПГ из культуральной среды проводили через 66 ч от начала биотрансформации. Мицелий отфильтровывали на воронке Бюхнера через полотняный фильтр, промывали дихлорметаном (ДХМ) на фильтре. Фильтрат экстрагировали трижды порциями ДХМ равного объема. Стероиды, адсорбированные на мицелии, извлекали ре-мацерацией (трижды), используя метанол и выдерживая без перемешивания в течение 4 ч. Метанол упаривали под вакуумом, стероиды из водного остатка экстрагировали ДХМ трижды. Объединенные экстракты фильтрата и мицелия промывали водой, осветляли активированным углем и упаривали в вакууме.
Содержание стероидов в остатке оценивали методом количественной ТСХ на пластинах Silica gel 60 F254 TLC plates (“Merck”, Германия). Хроматографировали дважды в этилацетате (ЭА), продукты визуализировали в УФ-свете (254 нм). Содержание стероидов оценивали с применением программы ImageMaster 2D Platinum v.7 (“GE Healthcare”, Швеция). Пластины опрыскивали 1%-ным раствором ванилина в 10%-ном водном растворе HClO4, а затем проявляли, нагревая при температуре 100–120°C.
Выделение индивидуальных соединений I–IV проводили описанным ранее методом [10]. Хроматографическую чистоту подтверждали с помощью ТСХ и ЯМР-спектроскопии.
Изучение кинетики сорбции стероидов. Измерение кинетики сорбции стероидов из водной среды проводили с использованием сорбента Macronet MN-200 в статических условиях. Использовали модельные растворы/суспензии стероидов. Для каждого испытуемого соединения использовали 15 конических колб eмкостью 250–300 мл, содержащих по 100 мл дистиллированной воды. В каждую колбу вносили по каплям при перемешивании по 100 мг стероида в растворе ДМСО, поддерживая температуру 35–40°С. Конечная концентрация стероида составляла 1.0 г/л, а ДМСО – 4% (об.). Содержимое колб охлаждали при перемешивании до комнатной температуры (26 ± 2°С) и в каждую колбу помещали капроновый фильтр-пакет с сорбентом Macronet MN-200. Соотношение фаз сорбент : вода составляло 1 : 10 г/об. Фильтр-пакеты готовили из технической капроновой ткани для фильтрации белого цвета и заполняли сухим сорбентом (по 10 г). После приготовления фильтр-пакеты с сорбентом выдерживали в 95%-ном этиловом спирте в течение не менее 3 сут. Перед использованием помещали на 1 ч в стерильную дистиллированную воду.
Процесс сорбции проводили при перемешивании (60–70 об./мин) и температуре 28°С. Через 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 24, 48, 72, 96 и 120 ч из каждой колбы извлекали фильтр-пакет с сорбентом, дважды промывали его 20 мл воды от возможных остатков раствора (и/или кристаллов) стероида, водную промывку присоединяли к основной водной фазе. Пакет с сорбентом помещали в колбу на 200–250 мл и добавляли 50 мл ацетона для десорбции стероидного соединения.
Стероид из оставшейся водной фазы экстрагировали этилацетатом трижды по 100 мл. Экстракт упаривали досуха. В остатке определяли содержание стероида с помощью количественной ТСХ.
Твердофазная экстракция (ТФЭ). Извлечение продуктов трансформации ПГ из трансформационной среды проводили через 216 ч от начала биотрансформации. В каждую колбу помещали фильтр-пакет с сорбентом. Перемешивали при температуре 28°С на качалке (60–70 об./мин) в течение 24 ч. Затем пакет меняли на другой и продолжали перемешивание еще 48 ч в этих же условиях (операцию повторяли дважды). По окончании сорбции пакеты промывали 20 мл воды каждый. Для контроля полноты сорбции мицелий отфильтровывали, добавляли метанол и выдерживали в условиях ре-мацерации, а фильтрат КЖ обрабатывали этилацетатом в условиях примера ЖФЭ.
Десорбция. Десорбцию проводили в динамическом режиме, используя аппарат Сокслета с объёмом рабочей зоны экстрактора 100 мл, куда помещали 3 фильтр-пакета с сорбентом. В круглодонную колбу на 250 мл наливали 150 мл ацетона и подключали к аппарату. Процесс проводили при перемешивании. Ацетон нагревали до кипения, экстракцию проводили в течение 4 ч. Затем экстрагировали повторно новой порцией ацетона в течение 1 ч для контроля завершения экстракции. Ацетоновый экстракт упаривали до удаления растворителя. Водный остаток (~30–40 мл) обрабатывали этилацетатом трижды по 45 мл, растворитель упаривали досуха. Контроль полноты десорбции осуществляли методом ТСХ. Полная десорбция завершалась за 4 ч.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияния мутации argB2 и pyrG89, а также плазмиды с геном lacA, на процесс биотрансформации ПГ изучали с использованием известного штамма A. nidulans 031 (argB–; pyrG–) [15] и нового штамма A. nidulans lac№ 4 (argB–).
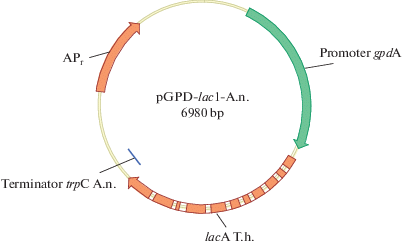
Получение штамма A. nidulans lac№ 4 (argB–). Лакказы – медьсодержащие оксидазы, окисляющие ряд фенольных и нефенольных соединений с сопутствующим восстановлением кислорода до молекулы воды без образования пероксида водорода [14]. Для получения продуцента рекомбинантной LacA в штамме A. nidulans была создана плазмида pGPD-lac1-A.n (рис. 2) с геном lacA (GeneBank: KP027478) базидиомицета T. hirsuta 072, кодирующим LacA (без сигнального пептида лакказы), под контролем сильного конститутивного промотора глицеральдегид-3-фосфатдегидрогеназы (gpdA) с сигнальным пептидом β-галактозидазы P. canescens.
Рис. 2.
Карта плазмиды pGPD-lac1-A. n., содержащей ген lacA, кодирующий лакказу А гриба T. hirsuta 072.
Полученную плазмиду трансформировали в штамм A. nidulans 031 (argB2–, pyrG89–). Преимуществом штамма являлось то, что его геном секвенирован [21] и гены, кодирующие лакказы sensu stricto, не были обнаружены. Кроме того, для штамма была разработана эффективная методика трансформации и отбора целевых клонов, в которой в качестве маркерных генов использовали гены argB и pyrG, комплиментирующие мутации argB2 и pyrG89 соответственно. В настоящей работе трансформация проводилась совместно с плазмидой pJR15 [19], несущей комплиментирующий ген pyrG A.nidulans c отбором на селективной среде без добавления уридина и урацила.
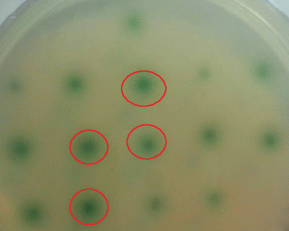
Тестирование трансформантов на способность продуцировать лакказу. Первичное тестирование полученных трансформантов на способность продуцировать лакказу осуществлялось путем их пересева на агаризованную питательную среду ММ, содержащую АБТС в качестве хромогенного субстрата [18, 22, 23]. Колонии, вокруг которых появлялись окрашенные зоны наибольшего размера (30 шт.), были выбраны в качестве потенциальных продуцентов лакказы (рис. 3).
Рис. 3.
Первичный отбор трансформантов A. nidulans – продуцентов рекомбинантной LacА на среде с АБТС.
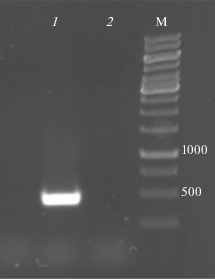
Отобранные трансформанты, перспективные для дальнейшего исследования, потенциально продуцирующие лакказу, культивировали в жидкой питательной среде ММ. Было показано, что максимальная активность рекомбинантной лакказы А в КЖ по субстрату АБТС составляла 2.0 усл. ед./мл у трансформанта A. nidulans lac№ 4 (argB–) и была сопоставима с активностью рекомбинантной лакказы Trametes versicolor, ранее полученной в A. niger (2.7 усл. ед./мл [24]), и активностью рекомбинантной лакказы T. villosa, полученной в A. oryzae (3.0 усл. ед./мл [22]). Наличие плазмиды с геном lacA у штамма A. nidulans lac№ 4 (argB–) подтверждали с помощью ПЦР с геномной ДНК, выделенной из мицелия (рис. 4).
Рис. 4.
Электрофорез ПЦР-фрагмента с геномной ДНК: 1 – A. nidulans lac№ 4 (argB–), 2 – A. nidulans 031 (argB2–, pyrG89–), М – маркеры, bp.
Культурально-морфологические особенности штамма A. nidulans lac№ 4 (argB–). На агаризованной среде штамм образует круглые колонии диаметром 30–35 мм через 7 сут роста, поверхность колоний ровная, выпуклая, пушистая, текстура средней плотности. Край колоний плотный, ровный. Цвет колоний в зоне спороношения зеленовато-белый, обратная сторона палево-коричневая, эксудат отсутствует. Культура характеризуется умеренным спороношением, споры зеленого цвета.
Биотрансформация ПГ. Влияние изменений в генетическом аппарате штамма на его способность к трансформации стероидов оценивали, сравнивая с результатами трансформации ПГ исходным штаммом дикого типа A. nidulans ВКПМ F-1069 [10] и мутантным штаммом A. nidulans 031 (argB–; pyrG–). Трансформацию ПГ штаммами проводили в течение 66 ч в одинаковых условиях, параллельно культивируя штаммы без ПГ в качестве контроля. Каждый эксперимент выполняли в трех повторностях.
Результаты биотрансформации ПГ штаммами A. nidulans приведены в табл. 1.
Таблица 1.
Конверсия ПГ штаммами A. nidulans на среде СМ и относительная селективность образования продуктов трансформации (мол. %) на 66 ч трансформации*
| Стероиды | A. nidulans ВКПМ F-1069 | A. nidulans 031 (argB–; pyrG–) | A. nidulans lac№4 (argB–) |
|---|---|---|---|
| Конверсия ПГ (I), % | 85.39 | 80.52 | 94.37 |
| 11α-Гидрокси-ПГ(II) | 17.05 | 13.8 | 26.51 |
| 11α-Ацетокси-ПГ (III) | 29.53 | 47.4 | 41.87 |
| 6β,11α-Дигидрокси-ПГ (IV) | 53.42 | 38.8 | 31.62 |
Как видно из табл. 1, степень превращения (конверсия) ПГ новым штаммом за 66 ч трансформации была значительно выше, чем у A. nidulans ВКПМ F-1069 и A. nidulans 031 (argB–; pyrG–) – на 10.5 и 17.2% соответственно.
ТФЭ. В работах [10, 25] для извлечения продуктов трансформации ПГ из трансформационной среды с мицелием, использовали метод ЖФЭ. В настоящей работе изучена возможность использования метода ТФЭ для выделения продуктов трансформации ПГ из культуральной среды без предварительного разрушения или отделения мицелия. В качестве сорбента был использован Macronet MN-200 – неионогенный макропористый полистирол, сшитый дивинилбензолом, один из перспективных полимеров для применения в биотехнологических процессах. Важным является также то, что сорбент легко регенерируется, полностью отдавая поглощенные вещества при обработке органическим растворителем [26, 27]. Предварительно было проведено изучение кинетики сорбции ПГ и мажорных продуктов его биотрансформации этим сорбентом из водной среды.
Кинетика сорбции стероидов из водной среды. Для определения оптимального времени контакта сорбента с трансформационной средой изучали кинетику сорбции ПГ (I) и продуктов его трансформации (11α-гидрокси-ПГ (II), 11α-ацетокси-ПГ(III) и 6β,11α-дигидрокси-ПГ (IV)) из модельных растворов (или суспензий). Следует отметить, что, если соединения II и IV, вносимые в воду в виде раствора в ДМСО, образовывали растворы, то при добавлении в воду растворов I и III в ДМСО наблюдалось образование мелкокристаллической суспензии, что, вероятно, было обусловлено ограниченной растворимостью этих соединений в воде. Известно, что растворимость ПГ в дистиллированной воде при комнатной температуре составляет 16.8 мкг/мл [28].
После помещения фильтр-пакета с сорбентом в модельный раствор (суспензию) содержимое колбы перемешивали, что обеспечивало диффузию раствора стероида через капроновый фильтр внутрь пакета и обратно жидкости без стероида. Внутри пакета протекал процесс сорбции стероида из раствора. Вне пакета происходило постепенное растворение кристаллов стероида. Скорость перемешивания 60–70 об./мин была минимально необходимой для обеспечения диффузии и процесса сорбции без механического истирания гранул сорбента.
Капроновый фильтр-пакет защищал сорбент от налипания на гранулы полимера кристаллов стероидного соединения, не препятствуя при этом сорбции растворенного стероида из жидкой фазы. Определение количества остаточного стероида в колбе проводили по истечении условленного времени. На основании экспериментальных данных были построены кинетические кривые сорбции соединений I, II, III и IV (рис. 5).
Рис. 5.
Кинетические кривые адсорбции ПГ и мажорных продуктов на Macronet MN-200. 1 – ПГ, 2 – 11α-гидрокси-ПГ, 3 – 11α-ацетокси-ПГ, 4 – 6β,11α-дигидрокси-ПГ.
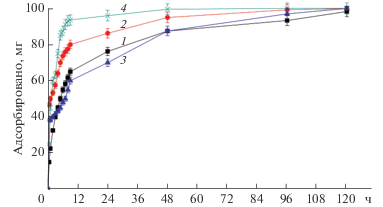
Как видно из рис. 5, сорбция соединений II и IV из растворов протекала значительно быстрее, чем для соединений I и III из их суспензий. Полная сорбция соединения IV проходила за 48 ч, а соединения II за 96 ч. Сорбция соединения III завершалась через 120 ч. При этом через 120 ч сорбционного процесса содержание I в водной фазе составило 0.75 мг, то есть менее 1% от внесенного для трансформации. Особенностью процессов адсорбции в случае соединений I и III является более медленное достижение сорбционного равновесия, так как в этих случаях скорость процесса переноса вещества зависит от скорости перехода вещества из твердой фазы в раствор, диффузии растворенного вещества в растворе через капроновый фильтр и удаления его из раствора в результате адсорбции на полимере.
Полученные результаты позволили заключить, что оптимальная продолжительность контакта сорбента с КЖ составляла 120 ч.
Извлечение стероидов из трансформационной среды. Ранее [10] было показано, что в аналогичных условиях трансформации ПГ штаммом A. nidulans ВКПМ F-1069 образование максимального количества продукта IV достигалось через 96 ч и не изменялось в дальнейшем. Процесс энзиматического ацетилирования 11α-гидроксильной группы соединения II, напротив, продолжался и после того, как 6β-гидроксилирование прекращалось. При этом полная конверсия исходного субстрата I, а также интермедиата II, происходила за 216 ч трансформации. Для изучения возможности использования метода ТФЭ для извлечения продуктов биоконверсии ПГ штаммом A.nidulans lac№ 4 (argB–) трансформацию проводили в течение 216 ч.
По окончании биотрансформации ПГ грибом A. nidulans lac№ 4 (argB–) извлечение продуктов из трансформационной среды проводили в тех же качалочных колбах без отделения мицелия, помещая фильтр-пакет с сорбентом в колбу. Полноту сорбции оценивали хроматографически, отбирая пробы из трансформационной среды каждые 4–6 ч. Периодически пакет с сорбентом заменяли. Применение капронового фильтр-пакета защищало сорбент от загрязнения частицами ростовой среды и налипания на гранулы полимера мицелия, не препятствуя при этом сорбции растворенных стероидов из жидкой фазы. Для контроля полноты сорбции мицелий отделяли фильтрованием от жидкой фазы. Проводили ре-мацерацию мицелия метанолом, а фильтрат обрабатывали этилацетатом в условиях ЖФЭ. По данным ТСХ анализа в фильтрате и мицелии ПГ и продукты его трансформации отсутствовали.
По окончании сорбции проводили десорбцию стероидов с сорбента в фильтр-пакетах. Как правило, десорбцию стероидов с носителя проводят смешивающимися (алифатическими спиртами, ацетоном и др.) или не смешивающимися с водой растворителями (ароматическими углеводородами, эфирами уксусной кислоты, хлороформом, дихлорметаном и др.), а также их смесями [29, 30].
Десорбцию стероидов проводили в динамическом режиме ацетоном в аппарате Сокслета. Контроль полноты десорбции осуществляли методом ТСХ, анализируя содержимое экстрактов. Полная десорбция завершалась за 4 ч. При этом содержание продуктов в экстракте было следующим (мол. %): 11α-гидрокси-ПГ – 1.43; 11α-ацетокси-ПГ – 49.91; 6β,11α-дигидрокси-ПГ – 22.49. На основании анализа полученных результатов был сделан вывод, что за 216 ч трансформации достигалась практически полная конверсия исходного субстрата ПГ, а относительная селективность образования мажорных продуктов трансформации составляла (мол. %): 11α-гидрокси-ПГ – 1.94; 11α-ацетокси-ПГ – 67.6; 6β,11α-дигидрокси-ПГ – 30.46.
Ранее сообщалось о применении сорбционного способа для извлечения некоторых стероидов рядов прегнана и андростана из КЖ. Так, в патенте [31] описан способ использования сильнокислотного набухающего катионита для извлечения эпи-гидрокортизона и гидрокортизона из их КЖ после трансформации кортексолона (вещество “S” Рейхштейна) с концентрацией 0.5 и 0.6 г/л соответственно. При этом сорбцию проводили из культуральной среды после отделения мицелия. Синтетические неполярные макросетчатые полимерные сорбенты, синтезированные на основе дивинилбензола, нашли применение в ферментативном получении 3,17-дикетоандростанов, например, андрост-4-ен-3,17-диона, из стеринов [32] благодаря их способности селективно сорбировать 3,17-дикетоандростаны. Применение макросетчатого сорбента для извлечения продуктов трансформации ПГ из трансформационной среды без отделения мицелия описано нами впервые.
Полученные результаты показали, что наличие мутации у штамма Aspergillus nidulans lac№ 4 (argB–) − продуцента гетерологичной лакказы А, не влияло на качественный состав мажорных продуктов трансформации ПГ, но приводило к изменению их количественного содержания. Следует отметить, что продукты II и III являются важными предшественниками в производстве высокоактивных стероидных соединений, в частности, адренокортикоидов [33]. Они также могут применяться как самостоятельные препараты с гестагенной и антиандрогенной активностью [34–36], причем 11α-гидрокси-ПГ (II) известен как регулятор кровяного давления [37] и обладает нейропротекторной активностью [38]. Соединение 6β,11α-дигидрокси-ПГ (IV) может быть превращено в 11α-гидрокси-ПГ (II) известным способом [39].
Таким образом, штамм A. nidulans lac№ 4 (argB–) оказался более эффективным биокатализатором для трансформации ПГ в 11α-ацетокси-ПГ (III) и 11α-гидрокси-ПГ (II). Штамм можно рассматривать как перспективный объект для изучения его стероидтраснформирующей активности с использованием других модельных стероидов, например, кортексолона (вещество “S” Рейхштейна) и андроста-4-ен-3,17-диона.
Работа выполнена при частичной поддержке грантом Российского фонда фундаментальных исследований № 18-34-00653 мол_а.
Список литературы
Машковский М.Д. Лекарственные средства. Пособие для врачей. M.: Новая волна, 2005. P. 579–580.
Fernandes P., Cruz A., Angelova B., Pinheiro H.M., Cabral J.M.S. // Enz. Microb. Technol. 2003. V. 32. № 6. P. 688–705. https://doi.org/10.1016/S0141-0229(03)00029-2
Donova M.V., Egorova O.V. // Appl. Microbiol. Biotechnol. 2012. V. 94. № 6. P. 1423–1447.
Lam K.S. Biocatalysis for the Pharmaceutical Industry: Discovery, Development, and Manufacturing. / Ed. J.A. Tao, G-Q Lin, A. Liese, N.Y.: Wiley, 2010. P. 213–227.
Souness G.W., Latif S.A., Laurenzo J.L., Morris D.J. // Endocrinology. 1995. V. 136. № 4. P. 1809–1812. https://doi.org/10.1210/endo.136.4.7895695
Dutta T.K., Samanta T.B. // Curr. Microbiol. 1999. V. 39. № 6. P. 309–312. https://doi.org/10.1007/s002849900464
Henry M.J., Sisler H.D. // Pestic. Biochem. Physiol. 1984. V. 22. № 3. P. 262–275. https://doi.org/10.1016/0048-3575(84)90019-1
El-Refai A.H., Ghanem K.M. // Egyptian J. Microbiol. (EJM) 1987. V. 22. № 2. P. 327–338.
El-Refai A.H., Ghanem K.M. // Egyptian J. Microbiol. (EJM) 1989. V. 23. № 1. P. 1–11.
Savinova O.S., Solyev P.N., Vasina D.V., Tyazhelova T.V., Fedorova T.V., Savinova T.S. // Steroids. 2019. V. 149. Article 108421. https://doi.org/10.1016/j.steroids.2019.05.013
Dermastia M., Rozman D., Komel R. // FEMS Microbiology Letters 1991. V. 77. № 2–3. P. 145–150.
Rozman D., Komel R. // Curr Genet. 1992. V. 22. № 2. P. 123–127. https://doi.org/10.1007/BF00351471
Khomutov S.M., Shutov A.A., Chernikh A.M., Myasoedova N.M., Golovleva L.A., Donova M.V. // J. Mol. Catal. B: Enzym. 2016. V. 123. P. 47–52.
Baldrian P. // FEMS Microbiol. Rev. 2006. V. 30. № 2. P. 215–242. https://doi.org/10.1111/j.1574-4976.2005.00010.x
Christensen U., Gruben B.S., Madrid S., Mulder H., Nikolaev I., de Vries R.P. // Appl. Environ. Microbiol. 2011. V. 77. № 19. P. 7084–7087.
Čapek A., Tadra M., Tůma J. // Folia Microbiologica. 1964. V. 9. № 6. P. 380–382
Абянова A.Р., Чулкин A.M., Вавилова E.A., Федорова T.В., Логинов Д.С., Королева O.В., Беневоленский С.В. // Прикл. биохимия и микробиология. 2010. Т. 46. № 3. С. 342–347.
Aleksenko A.Y., Makarova N.A., Nikolaev I.V., Clutterbuck A.J. // Curr. Genet. 1995. V. 28. № 5. P. 474–477. https://doi.org/10.1007/BF00310818
Oakley B.R., Rinehart J.E., Mitchell B.L., Oakley C.E., Carmona C., Gray G.L., May G.S. // Gene. 1987. V. 61. № 3. P. 385–399.
Savinova O.S., Moiseenko K.V., Vavilova E.A., Tyazhelova T.V., Vasina D.V. // Biochimie. 2017. V. 142. P. 183–190.
Galagan J.E., Calvo S.E., Cuomo C., Ma L.J., Wortman J.R., Batzoglou S. et al. // Nature. 2005. V.438. № 7071. P. 1105–1115.
Yaver D.S., Xu F., Golightly E.J., Brown K.M., Brown S.H., Rey M.W., Schneider P., Halkier T., Mondorf K., Dalboge H. // Appl. Environ. Microbiol. 1996. V. 62. № 3. P. 834–841.
Berka R.M., Schneider P., Golightly E.J., Brown S.H., Madden M., Brown K.M., Halkier T., Mondorf K., Xu F. // Appl. Environ. Microbiol. 1997. V. 63. № 8. P. 3151–3157.
Bohlin C., Jönsson L.J., Roth R., van Zyl W.H. // Appl. Biochem. Biotechnol. 2006. V. 129. P. 195–214.
Савинова О.С., Васина Д.В., Сольев П.Н., Федорова Т.В., Тяжелова Т.В., Савинова Т.С. // Актуальная биотехнология. 2018. Т. 3. № 26. С. 258.
https://www.purolite.com/product-pdf/MN200.pdf
Tsyurupa M.P., Davankov V.A. // React. Funct. Polym. 2002. V. 53. № 2–3. P. 193–203. https://doi.org/10.1016/S1381-5148(02)00173-6
Haskins A.L. // Proc. Society for Experimental Biology and Medicine. 1949. V. 70. № 2. P. 228–229.
Парбузина И.Л., Маслина T.И., Калинкина З.В., Романчук M.A. // Хим.-фарм. журн. 1973. Т. 7. № 12. С. 34–38.
Пaтeнт PФ. № 2049792. 1995.
Патент США. № 3356695. 1967.
Пaтeнт PФ. 2003. № 2205224.
Zohri A.A. // Folia Microbiol (Praha). 2000. V. 45. № 5. P. 391–396.
Патент Германии. 1979. № 2757024.
Пaтeнт PФ. 2011. № 2432952.
Savechenkov P.Y., Chiara D.C., Desai R., Stern A.T., Zhou X., Ziemba A.M., Szabo A.L., Zhang Y., Cohen J.B., Forman S.A., Miller K.W., Bruzik K.S. // Eur. J. Med. Chem. 2017 V. 136. P. 334–347. https://doi.org/10.1016/j.ejmech.2017.04.043
Habibi Z., Yousefi M., Ghanian S., Mohammadi M., Ghasemi S. // Steroids. 2012. V. 77. P. № 13. 1446–1449. https://doi.org/10.1016/j.ejmech.2017.04.043
Yamaguchi T., Lee J.-H., Lim A-R., Yu E.-J., Oh T.-J. // Steroids. 2019. V. 145. P. 32–38. https://doi.org/10.1016/j.steroids.2019.02.008
Патент США 1957. № 2787624.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология