Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 283-291
Влияние спектрального состава освещения на выход биомассы, флуоресценцию хлорофилла фотосистемы 2 и общее содержание эфирных масел у Ocimum basilicum
В. С. Зотов 1, Ю. В. Болычевцева 1, *, С. А. Хапчаева 1, И. В. Терехова 1, В. В. Шубин 1, Н. П. Юрина 1, Ю. Н. Кульчин 2
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт автоматики и процессов управления Дальневосточного отделения РАН
690041 Владивосток, Россия
* E-mail: bolychev@inbi.ras.ru
Поступила в редакцию 02.11.2019
После доработки 19.12.2019
Принята к публикации 23.12.2019
Аннотация
Изучено действие света различного спектрального состава (белый-ББ, белый-красный-БК, белый – синий-БС и белый-красный-синий-БКС) на сырую массу, высоту растений, суммарную площадь поверхности листьев, параметры переменной флуоресценции фотосистемы 2 (ФС2) и содержание суммарной фракции эфирных масел у 30- и 50-суточных растений базилика, сорта “Аромат корицы”. 30-суточные растения базилика, адаптированные к свету БС, характеризовались наибольшим содержанием хлорофилла, наиболее высоким значением коэффициента фотохимического тушения флуоресценции ФС2, но наименьшей сырой массой и суммарной поверхностью листьев по сравнению растениями, выращенными на свету другого спектрального состава. Более длительная адаптация (50 сут) базилика к освещению разного спектрального состава, но при этом одинаковой интенсивности, приводила к выравниванию растений по содержания хлорофилла и высоте. Обнаружена положительная корреляция изменений коэффициента фотохимического тушения флуоресценции ФС2 и сырой массы у 50-суточных растений. Наибольшее количество суммарной фракции эфирных масел установлено у 50-суточных растений, выращенных на свету с высокой долей красного излучения (БК и БКС), имеющих генеративные побеги с бутонами.
Рост народонаселения, изменения климата, возрастающие потребности в натуральной сельскохозяйственной продукции способствуют развитию различных искусственных систем для выращивания растений, таких как тепличные, гидропонные системы или системы вертикального сельского хозяйства [1–4]. Эти системы требуют использования недорогих и компактных источников света, каковыми являются светодиоды. Светильники, созданные на основе светодиодов, характеризуются малыми размерами, длительным временем жизни, низким потреблением электроэнергии и способностью перекрывать весь видимый диапазон оптического спектра [5]. В ряде работ показана целесообразность использования светодиодов в качестве источника, как основного, так и дополнительного освещения [4–6]. Использование светодиодов открывает новые перспективы оптимизации условий освещения для культивирования растений в искусственных системах. Для развития этих технологий необходимы знания о разнообразных биохимических, биофизических и физиологических ответах на качество света и связанных с ними сигнальных и метаболических путях. Свет, в первую очередь, воздействует на фотосинтетический аппарат растений. Для оценки состояния фотосинтетического аппарата широко используется флуоресценция хлорофилла ФС2 [7, 8]. Измерение флуоресценции хлорофилла является быстрым, не инвазивным, не деструктивным методом скрининга состояния растений.
Известно, что спектральный состав света влияет как на фотосинтетические характеристики, так и морфогенез растений [2, 9]. Исследования, проведенные на разных видах растений и сортах одного вида, показали, что примерно одинаковый спектральный состав освещения может вызывать неодинаковые изменения фотосинтетических и морфологических параметров не только у разных видов растений, но и сортов одного вида [2, 3], поэтому необходимы более широкие исследования видо- и сортоспецифических ответов растений на различный спектральный состав освещения. Кроме того, мало изучено влияние спектрального состава света на содержание соединений вторичного метаболизма – эфирных масел.
В связи с этим в качестве модельного объекта был выбран базилик (Ocimum basilicum), который используют в медицине и пищевой промышленности благодаря эфирным маслам, содержащим производные фенолов и монотерпенов [10]. В настоящей работе были исследованы фотосинтетические и морфологические параметры базилика, выращенного при белом освещении (4000 К) с дополнением света синих (пик – 460 нм) и (или) красных (пик – 660 нм) светодиодов.
Цель работы – изучение воздействия различных соотношений дополнительного красного и синего излучения к основному белому свету на общее содержание эфирных масел, флуоресценцию хлорофилла ФС2 и морфологические параметры, отражающие рост и развитие растений базилика раннеспелого сорта “Аромат корицы” (сырая масса, высота, суммарная площадь поверхности листьев), а также подбор оптимального режима статического светодиодного освещения для достижения максимальных сортовых показателей зеленой биомассы и/или общего содержания эфирного масла в растениях.
МЕТОДИКА
Растения и условия выращивания. Вегетационный опыт на растениях базилика (Ocimum basilicum), сорта “Аромат корицы” (Агрофирма “АЭЛИТА”, Россия) проводили в сосудах на 0.5 л с почвой (грунт универсальный, ООО “Фаско+”, Россия) в трех повторностях в условиях фитотрона (“Альгоконсорциум”, Россия) с поддержанием температурного режима (день – 27°С, ночь – 23°С), фотопериода (14-часовой световой день) и заданными спектральными характеристиками освещения светодиодами: с доминантой в синей зоне спектра (БС), зеленой (ББ) и красной (БК и БКС) (табл. 1). Цикл вегетации равнялся 30 и 50 сут. Плотность фотосинтетически активной радиации (излучение в диапазоне 400–720 нм – ФАР) определяли при помощи поверенного спектрофотометра ТКА-Спектр (ФАР) (“ТКА”, Россия). В табл. 1 представлено распределение интенсивности фотосинтетически активной радиации (ФАР) при различных условиях освещения.
Таблица 1.
Интенсивность излучения (мкмоль м–2 с–1), примененная при различных условиях освещения базилика. Показано распределение интенсивности фотонного потока по спектральным диапазонам фотосинтетически активной радиации (ФАР) и инфракрасного излучения (ИК)
| Условия освещения растений |
Интенсивность излучения, мкмоль м–2сек–1 | ||||
|---|---|---|---|---|---|
| ФАР (400–720 нм) | ИК (700–800 нм) | ||||
| суммарная интенсивность | синий (400–500 нм) | зеленый (500–600 нм) | красный (600–700 нм) | ||
| ББ | 115.3 (100%) | 23.3 (20.2%) | 52.8 (45.8%) | 39.2 (34.0%) | 3.6 |
| БК | 117.3 (100%) | 11.7 (10.0%) | 27.6 (23.5%) | 78 (66.5%) | 2.8 |
| БС | 115.4 (100%) | 67 (58.1%) | 27.6 (23.9%) | 20.8 (18.0%) | 1.7 |
| БКС | 125.5 (100%) | 29.5 (23.5%) | 23 (18.3%) | 73 (58.2%) | 2.3 |
Для исследования параметров флуоресценции и содержания хлорофилла использовали листья 3 яруса у 30- и 50-суточных растений базилика. Измерения фотосинтетических параметров проводили в 2–3 повторностях для каждого из трех растений, выращенных при одинаковом освещении. На всех рисунках приведены средние арифметические значения параметров. Статистическую обработку проводили в программе ORIGIN 6.0 с критическим уровнем значимости p ≤ 0.05. Уточнения даны в подписях к рисункам.
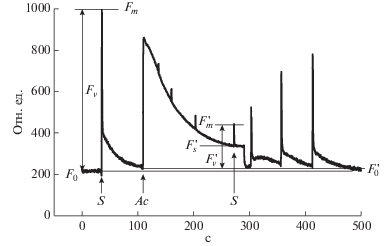
Индукция и релаксация флуоресценции ФС2. Индукцию и релаксацию флуоресценции ФС2 листьев базилика регистрировали при помощи флуорометра РАМ-101 (“Walz”, Германия) [11]. При измерении индукции флуоресценции в качестве источника действующего света (680 нм, 420 мкмоль м–2 с–1, 3 мин) использовали галогеновую лампу KL 1500 (“Schott”, Германия) с интерференционным фильтром BPF-680 (“Фотооптик”, Россия) и тепловым фильтром (“Balzers”, Лихтенштейн). Для измерения максимального выхода флуоресценции ФС2 (FM) использовали насыщающий белый свет (1 с, 3000 мкмоль м–2 с–1). На рис. 1 представлена характерная кривая индукции и релаксации флуоресценции базилика, выращенного при освещении БС светом.
Рис. 1.
Характерная кривая индукции и релаксации флуоресценции (отн. ед.) листа 30-суточного базилика, адаптированного к БС-свету. Fv/Fm – максимальная квантовая эффективность ФС2 (после темноты); ($F_{m}^{'}$ – Fs)/($F_{m}^{'}$ – $F_{0}^{'}$) – коэффициент фотохимического тушения (Fq'/$F_{{v}}^{'}$), нелинейно связан с долей центров ФС2, которые открыты (QA окислен); (Fv – $F_{{v}}^{'}$)/Fv – коэффициент нефотохимического тушения (NPQ). Стрелками указано время включения насыщающего (S – 1с) и действующего (Ac – 3 мин) света.
Концентрация хлорофилла. Концентрацию хлорофилла определяли в 80%-ных ацетоновых экстрактах листьев растений по методу Лихтенталера [12].
Площадь листьев определяли весовым методом.
Определение содержания эфирного масла методом газожидкостной хроматографии. Для оценки содержания компонентов эфирного масла базилика в трех повторностях отбирали равные количества усредненной биомассы листьев целого растения, отдельно для 30- и 50-суточных культур. Образцы экстрагировали смесью метанол : бензол : гексан в равных объемах при соотношении образец : экстракционная смесь 1 : 2 (вес : об.). Экстракцию проводили не менее 12 ч при температуре 4°С. Затем жидкую часть отфильтровывали и добавляли равный объем дистиллированной воды. После полного разделения фаз, верхнюю фазу отбирали и исследовали методом газожидкостной хроматографии. Исследования проводили на хроматографе Shimadzu GC 2010 Plus с квадрупольным масс детектором GCMS-QP2010 Ultra (Япония). Режим хроматографа: газ-носитель – гелий, линейная скорость потока 36.5 см/с, деление потока 1 : 10. Температурный режим: термостат 600°С, изотерма 2 мин, далее 5°С/мин до 12°С, 10°С/мин до 150°С и 30°С/мин до 300°С, затем изотермальный 2 мин. Температура инжектора 180°С, интерфейса 205°С, детектора 200°С. Диапазон регистрации масс от 29 до 400 m/z. Идентификацию пиков проводили с использованием библиотеки масс спектров NIST 11.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Проведено сравнительное исследование морфологических характеристик (высота растений, суммарная площадь поверхности листьев, сырая масса), содержания хлорофилла, показателей флуоресценции ФС2 (Fv/Fm, Fq'/$F_{V}^{'}$и NPQ) и содержания суммарной фракции эфирных масел у растений базилика сорта “Аромат корицы”, выращенных в течение 30 и 50 сут при светодиодном освещении различного спектрального состава.
Содержание хлорофиллов а и b и отношение хлорофиллов а/b у 30- и 50-суточных растений базилика. Наибольшее содержание хлорофилла а и высокое значение отношения а/b обнаружено у 30-суточных растений базилика, освещаемых светом с максимальной долей излучения в синей области спектра (БС) – 58% (рис. 2а).
Рис. 2
Содержание хлорофилла (мкг/г сырой массы) и отношение хлорофиллов а/b (отн. ед.) у 30-суточных (а) и 50-суточных (б) растений базилика, выращенных при освещении ББ, БК, БС или БКС светом: 1 – хлорофилл а, 2 – хлорофилл b, 3 – а/b. Доверительные интервалы (p ≤ 0.05) представляют стандартное отклонение от среднего арифметического (± sd) для n = 6.
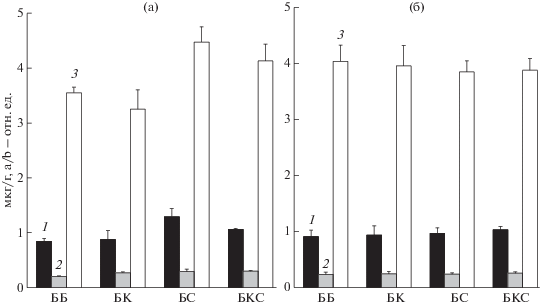
Хлорофилл b у высших растений связан с большим светособирающим а/b комплексом, ассоциированным с ФС2, тогда как фотосистема 1 (ФС1) содержит хлорофилл а [13, 14], поэтому можно предположить, что в фотосинтетических мембранах 30-суточных растений базилика стехиометрическое соотношение фотосистем смещено в пользу ФС1.
Растения, выращенные при освещении светом с более низкой долей излучения в синей области спектра (ББ – 20.3%, БК – 11.7%, БКС – 23.5%), содержали меньшее количество хлорофилла и характеризовались более низким отношением хлорофиллов а/b (рис. 2а). Для 50-суточных растений базилика было характерно примерно одинаковое содержание хлорофилла (рис. 2б) при всех вариантах освещения. Поскольку все варианты спектрально различающегося освещения были выровнены по интенсивности фотосинтетически активного излучения (см. Методику), то длительная адаптация растений к одинаковой интенсивности освещения, по-видимому, привела к выравниванию содержания хлорофилла и соотношения хлорофиллов а/b у 50-суточных растений, что могло отражать и выравнивание растений по соотношению фотосистем.
Параметры флуоресценции хлорофилла ФС2 у 30- и 50-суточных растений базилика. Для относительной оценки состояния фотосинтетического аппарата использовали такие параметры флуоресценции хлорофилла ФС2 как максимальную квантовую эффективность реакционных центров ФС2 (Fv/Fm), коэффициент фотохимического тушения флуоресценции ФС2 (${{F_{q}^{'}} \mathord{\left/ {\vphantom {{F_{q}^{'}} {F_{{v}}^{'}}}} \right. \kern-0em} {F_{{v}}^{'}}}$ – отражает долю открытых реакционных центров ФС2, когда QA окислен, и возможен перенос электронов далее по электронтранспортной цепи фотосинтеза) и коэффициент нефотохимического тушения – NPQ. Нефотохимическое тушение флуоресценции ФС2 является многокомпонентым процессом, но в листьях, не подверженных стрессовым воздействиям, такое тушение связывают в основном с закислением внутритилакоидного пространства при переносе электронов по электронтранспортной цепи при освещении [8], поэтому был использован также и этот параметр для оценки состояния фотосинтетического аппарата. Судя по тому, что значения Fv/Fm при всех вариантах освещения 30-суточных растений приближались к 0.8 (рис. 3а), в таких условиях выращивания растений отсутствовали значительные стрессовые факторы [15].
Рис. 3.
Параметры флуоресценции ФС2 30- (а) и 50-суточных (б) растений (отн. ед.), выращенных при освещении разного спектрального состава: 1 – максимальная квантовая эффективность реакционных центров ФС2 (Fv/Fm), 2 – коэффициент фотохимического тушения флуоресценции ФС2 (Fq'/$F_{{v}}^{'}$), 3 – коэффициент нефотохимического тушения (NPQ). Доверительные интервалы (p ≤ 0.05) представляют стандартное отклонение (± sd) для n = 9.
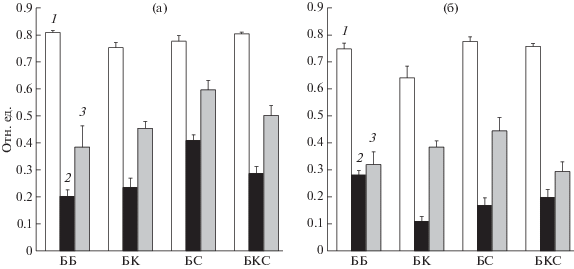
Близкие значения Fv/Fm для всех вариантов 30-суточного базилика (рис. 3а), а также наибольшее содержание хлорофилла а и высокое отношение хлорофиллов а/b в растениях, выращенных в режиме БС освещения (рис. 2а), позволили предположить, что под действием синего света дополнительные молекулы хлорофилла а включались, главным образом, в ФС1, которая практически не содержит хлорофилл b [13, 14]. Поскольку, кроме спектральных различий освещения, все остальные условия (интенсивность освещения, содержание О2, СО2, температура, влажность) были одинаковы, можно предположить, что коэффициент фотохимического тушения ${{F_{q}^{'}} \mathord{\left/ {\vphantom {{F_{q}^{'}} {F_{{v}}^{'}}}} \right. \kern-0em} {F_{{v}}^{'}}}$ мог адекватно коррелировать с относительной скоростью ассимиляции СО2. При относительно одинаковой максимальной квантовой эффективности реакционных центров ФС2, коэффициенты фотохимического и нефотохимического тушения флуоресценции ФС2 были наибольшими у растений базилика, выращенных при БС освещении (рис. 3а). Таким образом, у растений базилика, выращенных при таком освещении, более высокие коэффициенты фотохимического и нефотохимического тушения флуоресценции ФС2 в сочетании с большим относительным содержанием ФС1, о чем судили по более высокому содержанию хлорофилла а и отношению хл а/b (рис. 2а), возможно, отражают повышенную активность всего фотосинтетического аппарата.
Результаты настоящей работы согласуются с полученными ранее данными на других растениях. Так, было показано, что растения перца, выращенные под люминесцентными лампами синего света, накапливали больше суммарного хлорофилла (мг/дм–2 площади листа) и характеризовались большей скоростью ассимиляции СО2 по сравнению с растениями, выращенными под люминесцентными лампами красного, зеленого или белого света [1]. В проростках огурцов суммарное содержание хлорофилла в расчете на единицу площади листа, скорость ассимиляции СО2 и устьичная проводимость также возрастали при добавлении синего излучения к основному освещению, использованному при выращивании растений [3]. Эти данные объяснялись тем, что на синем свету число клеток и хлоропластов в 1 см2 листа было значительно больше, чем на красном или зеленом свету [16]. Удельная масса листьев (масса в расчете на единицу площади) огурца также возрастала при добавлении синего излучения к основному освещению [3].
Относительная фотохимическая активность фотосинтетического аппарата у 50-суточных растений базилика снижалась при комбинированном освещении (БК, БС и БКС), но только при освещении белым светом увеличился коэффициент фотохимического тушения и несколько снизился NPQ (рис. 3б).
Полученные результаты могли быть следствием длительной адаптации растений к освещению разного спектрального состава. У растений, освещаемых БКС светом, значения параметров флуоресценции хлорофилла ФС2, хотя и оказались близкими к таковым у растений, выращенных на белом свету, но все же были несколько ниже (рис. 3б), что, вероятно, связано с избытком излучения в красной области спектра (БКС – 58.2% и ББ – 34.0%). Возможно, что и недостаток излучения в зеленой области спектра (БКС – 18.3% по сравнению с белым – 45.8%) мог косвенно повлиять на фотохимические характеристики ФС2, так как у растений предполагается существование нескольких фоторегуляторных систем, активируемых излучением в зеленой (500–600 нм) области спектра [17]. Более низкий коэффициент фотохимического тушения и более высокий NPQ у растений, освещаемых БК светом, по сравнению с параметрами адаптированных к белому свету растений, отражают меньшую эффективность утилизации поглощенной хлорофиллами световой энергии. Это могло происходить из-за дисбаланса активации фотосистем при освещении светом, несбалансированного спектрального состава (избытка “красных” фотонов – 66.5%, и низкой доли “синих” фотонов – 11.7%), о чем можно судить по более низкому квантовому выходу ФС2 (Fv/Fm). Более низкое значение параметра Fv/Fm может отражать инактивацию некоторой части центров ФС2 из-за фотоингибирования, то есть поглощенная световая энергия не расходуется в фотохимических процессах и не высвечивается в виде флуоресценции, но диссипирует в виде тепла [8]. Кроме того, длительная адаптация к БК освещению с низкой долей “синих” фотонов могла приводить к снижению устьичной проводимости, числа клеток и хлоропластов на единицу площади листа [1, 3]. 50-суточные растения, выращенные при освещении БС светом, обнаруживали более низкие значения коэффициента фотохимического тушения и высокое значение NPQ, по сравнению с растениями, адаптированными к белому свету, что может отражать низкую долю “красных” фотонов (600–700 нм) видимого излучения (18%), поглощаемых основными светособирающими пигментами растений – хлорофиллами а и b.
Таким образом, изменение параметров флуоресценции ФС2 после 50-суточной адаптации растений базилика к свету одинаковой интенсивности и различного спектрального состава, по-видимому, в основном не связано с изменением стехиометрии фотосистем, о чем судили по отсутствию значительных изменений в содержании и соотношении хлорофиллов а/b (рис. 2б). Наблюдаемые изменения скорее отражают комплексную адаптацию фотосинтетического аппарата к свету различного спектрального состава (изменение устьичной проводимости, структуры хлоропластов, настройки скорости переноса электронов по электронтраспортной цепи фотосинтеза и скорости темновых реакций и т.д.).
Морфологические параметры 30- и 50-суточных растений базилика. Несмотря на более высокую фотосинтетическую активность, 30-суточный базилик, выращенный с дополнительным освещением синими светодиодами (рис. 3а), характеризовался более низкими значениями морфологических параметров (сырой массой, высотой растений и суммарной площадью листьев), тогда как наибольшие значения этих морфологических параметров обнаруживали растения, выращенные при БК освещении (рис. 4а).
Рис. 4.
Морфологические параметры 30- (а) и 50-суточных (б) растений базилика, выращенных при освещении светом разного спектрального состава: 1 – сырая масса (г), 2 – суммарная площадь поверхности листьев (см–2 × 10), 3 – высота (см × 10) растений. Доверительные интервалы (p ≤ 0.05) представляют стандартное отклонение (± sd) для n = 3.
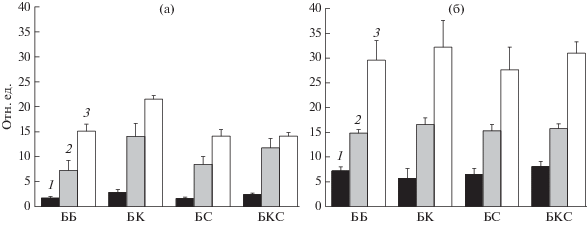
Эти данные свидетельствуют о том, что более высокий уровень фотосинтеза, наблюдаемый на синем свету, не мог компенсировать дефицит площади листьев и сырой массы растений. Ранее отмечалось, что синий свет вызывал торможение роста стебля и площади поверхности листьев у растений перца [1] и проростков огурца [3]. Эти изменения объяснялись тем, что на синем свету в листьях образуется значительно большее количество ингибиторов роста (абсцизовой кислоты, оксикоричных кислот и др.) по сравнению с растениями, выращенными на красном и на зеленом свету, что приводило к формированию укороченных стеблей и более толстых листьев [1]. Вероятно, описанные выше морфофизиологические изменения растений вызваны каскадом реакций, который запускается криптохромами – фоторецепторами, активируемыми синим светом [17, 18]. Растения, адаптированные в течение 30 сут к комбинированному БК свету, накапливали большую сырую массу, были выше и отличались большей суммарной площадью поверхности листьев (рис.4а), что может объясняться большей активацией системы фитохромов при освещении с большей долей (БК – 66%) красного излучения [1, 3], по сравнению с другими (ББ – 34.0%, БКС – 58.2% и БС – 18%) вариантами освещения.
При всех вариантах освещения 50-суточные растения базилика показали увеличение сырой массы, высоты растений и суммарной площади поверхности листьев по сравнению с 30-суточными (рис. 4б). При этом значения морфологических показателей у 50-суточных дневных растений, адаптированных к свету разного спектрального состава (рис. 4б), заметно выровнялись, по сравнению с таковыми 30-суточных (рис. 4а). Большую сырую зеленую массу набрали растения, выращенные на БКС и белом свету, что, вероятно, связано с воздействием красного света (см. Методику) через систему фитохромов на накопление сырой массы растений [1, 2]. Большая сырая масса у растений, выращенных на БКС и белом свету, коррелировала с большими значениями коэффициента фотохимического тушения и относительно невысокими значениями коэффициента NPQ (рис. 4б, 3б). Наименьшей сырой массой характеризовались растения, выращенные при БК освещении, для которых было характерно самое низкое значение коэффициента фотохимического тушения и высокий NPQ (рис. 4б, 3б). По-видимому, при длительной 50- суточной адаптации растений к БК освещению дисбаланс между большой долей красного излучения (66.5%) и низкой долей синего излучения (11.7%) мог приводить не только к дисбалансу функционирования фотосистем (рис. 3б). Возможно, длительная 50-дневная адаптация к низкой доле “синих” фотонов приводила к таким морфофизиологическим изменениям, как снижение числа хлоропластов в расчете на единицу площади листа, удельной массы листа и др. [1, 3], которые нивелировали эффекты от активации фитохромной системы красным излучением, хотя такую активацию можно было наблюдать у 30-дневных растений при этом же освещении (наибольшие сырая масса, суммарная площадь поверхности листьев и высота, рис. 4а). Более низкая сырая масса у растений, выращенных при БС освещении, по сравнению с массой растений, адаптированных к БКС и ББ свету, может объясняться недостатком красного излучения (18%) в спектре освещения растений, что связано с нарушением активации фитохромов, а также с избытком “синих” фотонов (58.1%), которые активируют фоторецепторы синего света, в результате чего запускается каскад реакций, увеличивающий количество ингибиторов роста растения [1]. Обнаруженная положительная корреляция изменений коэффициента фотохимического тушения флуоресценции ФС2 и сырой массы при 50-дневной адаптации базилика к освещению различного спектрального состава (рис. 3б и 4б) указывала на то, что измеренные в настоящей работе параметры флуоресценции ФС2 адекватно отражали эффективность функционирования фотосинтетического аппарата при освещении различного спектрального состава.
Известно, что спектральный состав света может влиять на содержание эфирных масел (включая фенольные соединения) в растениях и, в частности, в базилике [2, 4]. Однако изучение содержания эфирных масел у растений, находящихся на разных фенологических стадиях в условиях адаптации к стационарному освещению разного спектрального состава, не проводилось. В связи с этим исследовали влияние освещения различного спектрального состава на общее содержание суммарной фракции эфирного масла в растениях базилика.
Суммарное содержание эфирных масел в 30- и 50-суточных растениях базилика сорта “Аромат корицы”, выращенных при освещении светом разного спектрального состава. У 30-суточных растений базилика наибольшее содержание суммарной фракции эфирных масел было при адаптации растений к белому свету (рис. 5а). Ранее было показано, что при освещении базилика в течение 28 дней светодиодами различного спектрального состава, наибольшим содержанием суммарных фенольных соединений (входят в состав эфирных масел базилика [2, 10]) характеризовались растения, адаптированные к “сине-зеленому” свету (суммарно 59%) с 5%-ной долей дальнего красного излучения [2]. В настоящей работе в составе белого светодиодного освещения также была высокая доля сине-зеленого (суммарно 66%) излучения, а интенсивность дальнего красного излучения составляла 3.6 мкмоль м–2 с–1 (см. Методику). Таким образом, полученные результаты согласуются с полученными ранее данными на других сортах базилика. В результате дальнейшей адаптации (20 дней) базилика “Аромат корицы” к свету различного спектрального состава у растений при БК и БКС освещении появлялись генеративные побеги и бутоны. По-видимому, высокая доля красного излучения (при данном фотопериоде, см. Методику) через систему фитохромов способствовала зацветанию растений [19–21]. Некоторые зарубежные и отечественные авторы отмечали активацию биосинтеза соединений вторичного метаболизма (в том числе и летучих соединений) при цветении растений [21–23]. В нашем случае именно у растений с бутонами возросло содержание суммарной фракции эфирных масел как в расчете на г сырой массы, так и в пересчете на целое растение (рис. 5б).
Рис. 5.
Суммарное содержание эфирных масел у 30- (а) и 50-суточных (б) растений базилика, выращенных при освещении светом разного спектрального состава: 1 – содержание суммарной фракции эфирных масел (мкг/г); 2 – содержание суммарной фракции эфирных масел (мкг) на одно растение. Цифры (б) показывают отношение доли красного излучения к доле синего. Доверительные интервалы (p ≤ 0.05) представляют стандартное отклонение (± sd) для n = 3.
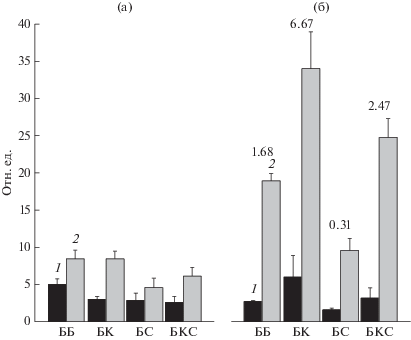
Таким образом, для накопления эфирных масел в не цветущих растениях базилика сорта “Аромат корицы” наиболее подходящим оказалось белое светодиодное освещение с высокой долей сине-зеленого и наибольшей (в нашем эксперименте) долей дальнего красного излучения. Однако свет с высокой долей красного излучения способствовал более быстрому образованию генеративных побегов и бутонов, что, вероятно, и приводило к 4-кратному увеличению содержания суммарной фракции эфирных масел в пересчете на одно растение. Результаты согласуются с представлениями о том, что красный свет воздействует на накопление соединений вторичного метаболизма в растениях через систему фитохромов [4]. По данным ряда авторов ответы растений на различный спектральный состав света зависят от вида растения и даже сорта растений одного вида [2, 3], поэтому для получения большего экономического эффекта требуются более широкие и детальные сравнительные исследования морфофизиологических ответов разных сортов базилика на стационарное светодиодное освещение разного спектрального состава.
Результаты исследований получены с использованием научного оборудования ЦКП “Промышленные биотехнологии” ФГУ “Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук”.
Работа выполнена при финансовой поддержке гранта Министерства науки и высшего образования Российской Федерации (соглашение № 075-15-2019-1696, уникальный идентификатор проекта RFMEFI60419X0229) по теме: “Разработка технологий управляемой вегетации целевых культур в условиях динамического освещения”.
Список литературы
Протасова Н.Н. // Физиология растений. 1987. Т. 34. № 4. С. 812–822.
Bantis F., Ouzounis Th., Radoglou K. // Scientia Horticulturae, 2016. V. 198. P. 277–283.
Hernandez R., Kubota C. // Environmental and Experimental Botany. 2016. V. 121. P. 66–74.
Darko E., Heydarizadeh P., Schoefs B., Sabzalian M.R. // Phil. Trans. R. Soc. B. 2014. V. 369. P. 1–7.
Massa D.G., Kim Hyeon-H., Wheeler R.M. // Hortscience. 2008. V. 43. № 7. P. 1952–1956.
Samuolienė G., Brazaitytė A., Sirtautas R., Novičkovas A., Duchovskis P. // J. Food, Agriculture Environment. 2011. V. 9. № 3–4. P. 271–274.
Ruban A.V., Lavaud J., Rousseau B., Guglielmi G., Horton P., Etienne A.-L. // Photosynth. Research. 2004. V. 82. P. 165–175.
Baker N.R. // Annu. Rev. Plant Biol. 2008. V. 59. P. 89–113.
Протасова Н.Н., Кефели В.И. // Фотосинтез и рост высших растений, их взаимосвязь и корреляции. Физиология фотосинтеза. М.: Наука, 1982. С. 251–255.
Lewinsohn E., Ziv-Raz I., Dudai N., Tadmor Y., Lastochkin E., Larkov O., Chaimovitsh D., Ravid U., Putievsky E., Pichersky E., Shoham Y. // Plant Science. 2000. V. 160. P. 27–35.
Schreiber U., Schliwa U., and Bilger W. // Photosynth. Res. 1986. V. 10. P. 51–62.
Lichtenthaler H.K. // Methods Enzymol. 1987. V. 148. P. 350–382.
Anderson J.M. // FEBS Lett. 1980. V. 117. № 1. P. 327–331.
Mullet J.E., Burke J.J., Arntzen Ch.J. // Plant Physiol. 1980. V. 65. P. 814–822.
Björkman O., Demmig B. // Planta. 1987. V. 170. P. 489–504.
Карначук Р.А., Протасова Н.Н., Добровольский М.В., Ревина Т.А., Ничипорович А.А. // Физиология растений. 1987. V. 34. № 1. С. 51–59.
Гловацкая И.Ф. // Физиология растений. 2005. V. 52. № 6. С. 822–829.
Ahmad M., Grancher N., Heil M., Black R.C., Giovani B., Galland P., Lardemer D. // Plant Physiol. 2002. V. 129. P. 774–785.
Johnson E., Bradley M., Harberd N.P., Whitelam C.C. // Plant Physiol. 1994. V. 105. P. 141–149.
Bagnall D.J., King R.W., Whitelam C.C., Boylan M.T., Wagner D., Quail P.H. // Plant Physiol. 1995. V. 108. P. 1495–1503.
Zhou Yu, Singh B. R. // Plant Growth Regulation. 2002. V. 38. P. 165–171.
Dudareva N., Pichersky E., Gershenzon J. // Plant Physiol. 2004. V. 135. P. 1893–1902.
Ильченко Г.Н., Березкин Н.Г. // Вестник АГУ. 2013. 125. № 4. С. 52–56.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


