Радиационная биология. Радиоэкология, 2019, T. 59, № 1, стр. 103-112
МИНЕРАЛЬНАЯ ПЛОТНОСТЬ КОСТНОЙ ТКАНИ КАК ФАКТОР ДЕПОНИРОВАНИЯ 90Sr: ДАННЫЕ ЭКСПЕРИМЕНТА
В. И. Стариченко *
Институт экологии растений и животных УрО РАН
Екатеринбург, Россия
* E-mail: starichenko@ipae.uran.ru
Поступила в редакцию 11.04.2018
Аннотация
Исследование кинетики остеотропных радионуклидов (в частности 90Sr) в зависимости от функционального состояния костной ткани связано с существующей угрозой радиационных инцидентов и все большим использованием медицинских радионуклидных препаратов для лечебных и диагностических целей. Остеотропные радионуклиды, накапливаясь в скелете и оставаясь в нем на продолжительный срок, являются источниками хронического внутреннего облучения. Величина их инкорпорации (результирующая процессов накопления и выведения) зависит от множества эндо- и экзогенных факторов. Важнейшим эндогенным фактором является минеральная плотность кости (МПК) – одна из основных ее характеристик. В данной работе изучена зависимость величины накопления 90Sr от МПК после однократного введения радионуклида. Исследование проведено в лабораторном эксперименте на половозрелых разновозрастных линейных мышах CBA, развивающихся в стандартных условиях вивария и под влиянием факторов, модифицирующих ростовые процессы в организме. Показана обратная корреляция (r = –0.77, p < 0.0001) между накоплением 90Sr и степенью минерализации скелета. Проведено сравнение с данными, ранее полученными нами в природной среде на двух видах мышевидных грызунов, обитающих в зоне Восточно-Уральского радиоактивного следа в условиях хронического поступления 90Sr.
Актуальность проблемы исследования механизмов кинетики остеотропных радионуклидов (90Sr, 224,226,228Ra, 238,239Pu, 241Am и других) и выявление факторов, от которых зависят особенности их метаболизма, связаны с неснижающейся угрозой радиационных инцидентов и аварий, при которых радионуклиды поступают в организм больших групп населения и сельскохозяйственных животных [1–3], а также с широким применением радиофармпрепаратов для целей диагностики и лечения. Накапливаясь в скелете под слоями вновь образующейся кости, остеотропные радионуклиды задерживаются в нем на длительный срок и становятся источником хронического облучения близлежащих тканей и всего организма, которое может вызвать хроническую лучевую болезнь, канцерогенез и уменьшение продолжительности жизни [3–6].
Существование значительных индивидуальных различий кинетики остеотропных радионуклидов характерно даже для однородных по полу и возрасту выборок. В частности, в лабораторном эксперименте среди интактных животных встречаются особи, существенно различающиеся по метаболическим характеристикам [7, 8]. Использование же средних величин для отдельного индивида может привести к существенной ошибке в оценке кинетики радионуклида [3, 9, 10] и соответственно дозы внутреннего облучения. Например, индивидуальная изменчивость депонирования в ряде случаев приводит к различиям в эффекте внутреннего облучения более чем на порядок величин [11].
Изучение в лабораторных экспериментах показало, что кинетика остеотропных веществ в организме позвоночных зависит от морфофизиологических факторов (МФФ) самого организма [12–14]. МФФ представляют собой функциональную систему, состоящую из морфологических структур, физиологических процессов, физико-химических и биохимических реакций, которые определяют накопление в костной ткани и выведение из нее остеотропных веществ. Параметры МФФ закономерно изменяются в процессе роста и развития организма. Как эндогенные, так и экзогенные влияния на обмен веществ в скелете опосредуются через систему МФФ.
Минеральная насыщенность (плотность) кости (МПК) является одним из МФФ. Молодая недообызвествленная кость более проницаема для радионуклидов, которые затем фиксируются в минеральной фракции. Влияние минеральной насыщенности кости на депонирование остеотропных веществ известно давно [15–18]. Есть указания на пониженную аккумуляцию 90Sr при увеличении степени минерализации скелета животных из зон, загрязненных радионуклидами [19]. Нами также показана отрицательная корреляция этих характеристик у животных, обитающих на территории Восточно-Уральского радиоактивного следа (ВУРСа), образовавшегося в результате аварии на химкомбинате “Маяк” в 1957 г. [7]. Однако для понимания особенностей формирования дозовых нагрузок на скелет и целостный организм в условиях хронического поступления 90Sr требуется более детальное изучение обнаруженной взаимосвязи. Это связано с тем, что изменение МПК, трансформируя задержку 90Sr, оказывает влияние на поглощенную тканевую дозу. Такое исследование возможно провести в строго контролируемых условиях лабораторного эксперимента.
Одним из наиболее важных физиологических факторов, модифицирующих кинетику обмена радионуклидов и биологические эффекты, вызванные инкорпорированными радионуклидами, является возраст [4, 12, 20–27 и др.], с которым связано изменение гормонального фона, регулирующего скорость накопления и выведения костных минералов. Кроме того, процессы роста скелета с рождения до взрослого состояния сопровождаются повышением уровня минерализации скелета (у человека с определенного возраста начинается уменьшение), определяющего прочность костей [17, 18, 28–32], однако необходимо исследование, позволяющее оценить количественную связь метаболических и морфофизиологических параметров скелета индивидов разных возрастов. В литературе исследование динамики минеральной плотности костной ткани мышевидных грызунов под влиянием возраста или экзогенных воздействий представлено недостаточно полно [33–37].
Поскольку кинетика остеотропных радионуклидов в значительной степени определяется кинетикой естественных костных минералов (кальций, фосфор), то все факторы, влияющие на минеральный обмен млекопитающих (количество минералов и белков в диете, изменение гормонального фона и т.п.), будут влиять на кинетику остеотропных радионуклидов.
Цель работы – изучить влияние эндо- и экзогенных факторов на индивидуальное накопление остеотропного 90Sr, связанное с МПК. Поскольку МПК закономерно определяется ростом и развитием организма, в конкретные задачи исследования входила оценка взаимосвязи накопления 90Sr и МПК у лабораторных инбредных мышей разных возрастов, развитие скелета которых проходило на фоне модифицирующих факторов.
МАТЕРИАЛЫ И МЕТОДИКА
Исследование проведено на инбредных мышах линии CBA (n = 444), разведенных в виварии ИЭРиЖ УрО РАН. С целью модификации процессов роста для некоторых групп использована несбалансированная диета (овсяная монодиета) самок с момента рождения у них потомства. Нами ранее показано [14], что овсяная монодиета у линейных мышей, начатая с момента рождения (вначале – опосредованно – через молоко матери), приводит к замедлению ростовых процессов (в том числе, скелета). Это связано с недостатком пластических веществ, необходимых для естественного развития детенышей. Белки овса дефицитны по многим аминокислотам (метионин, гистидин, триптофан и лизин) [38]. Кроме того, овсяная монодиета снижает всасывание кальция в кишечнике и увеличивает выведение кальция из скелета. Эти недостатки практически полностью компенсируются материнским организмом во время беременности, и, в значительно меньшей степени, во время лактации. Однако при последующем развитии происходит замедление роста и минерализации скелета детенышей.
Во избежание несовместимого с жизнью и здоровьем дефицита кальция и витаминов в рацион всех экспериментальных животных включали минеральную подкормку кусковым мелом (ad libitum) и свежую зелень (в том числе при содержании животных на измененной диете). Эти добавки, однако, не компенсировали полностью дефицит белка и минералов в рационе.
Самки и их потомство сразу после родов были разделены на две группы – “контроль” и “монодиета”. Контрольных (интактных) животных содержали на стандартном рационе вивария, животных группы “монодиета” – на овсяной монодиете (в течение всего периода молочного вскармливания и до конца эксперимента). В месячном возрасте самки были отсажены от детенышей.
В возрасте 8 нед части потомства из групп “монодиета” и “контроль” однократно внутрибрюшинно был введен 90Sr (3.2 кБк на животное), остальным – в 12 нед (животные 1-го и 2-го возраста соответственно). Использовано индикаторное количество радионуклида, которое в 200–300 раз меньше количества, вызывающего острые токсические эффекты, а дозы облучения, создаваемые им, не приводят к нарушению процессов жизнедеятельности организма [23, 39, 40]. Через 3 нед (в возрасте 11 и 15 нед соответственно) животные были подвергнуты эфирной эвтаназии. Инъекцию 90Sr и эвтаназию животных осуществляли под эфирным наркозом [41, 42]. Таким образом, всего было сформировано четыре экспериментальные группы: “контроль”–1 и –2, “монодиета”–1 и –2; индексы 1 или 2 указывают на возраст животных.
С целью выявления начального срока формирования различий (между контролем и опытом) в накоплении 90Sr были сформированы подгруппы, включающие по пять животных из каждой группы 1-го возраста (“контроль”–1.1 и “монодиета”–1.1). Эти животные были подвергнуты эвтаназии через 1 сут после введения радионуклида.
Исследовали накопление 90Sr в бедренной кости, так как принято считать, что у лабораторных грызунов она репререзентативно отражает процессы, протекающие в целостном скелете [12, 43]. Костную ткань (в анализ брали обе кости) озоляли до постоянной массы при температуре 600 °С в течение 5 ч, затем с помощью мокрого озоления готовили пробы для радиометрии [44].
Радиометрию проб осуществляли на приборе бета-счета VAG–120 (VEB RFT Messelektronik, Германия). Для расчета удельной активности образцов (% от введенного на г сырой кости) градуировку прибора производили по серии калийных эталонов [44]. Для простоты изложения под активностью 90Sr подразумевали активность, обусловленную 90Sr + 90Y.
Минеральная плотность костной ткани – это количество минералов в расчете на единицу объема или площади кости. В наших исследованиях показателем МПК считали коэффициент озоления, т.е. количество минералов (золы) в расчете на единицу массы сырой кости.
Статистическая обработка данных выполнена с помощью пакета программ Microsoft Excel 2002 и Statistica 6.0 (StatSoft Inc.). Для описания данных использовали среднее значение и стандартную ошибку среднего. Значимость различий между выборками оценивали с помощью t-критерия Стьюдента и U-теста Манна–Уитни. Для анализа связи между удельной активностью 90Sr и МПК использовали линейный коэффициент корреляции Пирсона. Статистический вывод осуществляли на 5% уровне значимости (p < 0.05).
РЕЗУЛЬТАТЫ
Массовые характеристики, величина коэффициента озоления и результаты радиометрического анализа костной ткани экспериментальных животных, подвергнутых эвтаназии через 3 нед после введения 90Sr, представлены в табл. 1.
Таблица 1.
Удельная активность 90Sr в костной ткани, массовые показатели животных и коэффициент озоления костей через 3 нед после введения радионуклида (M ± m)
| Возраст, нед | Группа | Пол | n | Масса тела, г | Масса бедренных костей1), г | Коэффициент озоления | 90Sr, % от исх/г |
|---|---|---|---|---|---|---|---|
| 11 | Контроль-1 | Самцы | 94 | 18.8 ± 0.1* | 0.1031 ± 0.001* | 0.29 ± 0.002 | 27.9 ± 0.7* |
| Самки | 72 | 16.0 ± 0.1 | 0.0969 ± 0.001 | 0.30 ± 0.002 | 31.0 ± 0.8 | ||
| Среднее по группе | 166 | 17.6 ± 0.2 | 0.1004 ± 0.001 | 0.30 ± 0.001 | 29.2 ± 0.5 | ||
| Монодиета-1 | Самцы | 62 | 11.8 ± 0.3 | 0.0733 ± 0.001 | 0.22 ± 0.003 | 51.2 ± 1.1 | |
| Самки | 71 | 11.6 ± 0.2 | 0.0722 ± 0.001 | 0.23 ± 0.003 | 49.3 ± 1.0 | ||
| Среднее по группе | 133 | 11.7 ± 0.2** | 0.0727 ± 0.001** | 0.23 ± 0.002** | 50.2 ± 0.7** | ||
| 15 | Контроль-2 | Самцы | 51 | 22.8 ± 0.3* | 0.1206 ± 0.001 | 0.33 ± 0.002 | 18.9 ± 0.3* |
| Самки | 31 | 19.8 ± 0.2 | 0.1178 ± 0.001 | 0.34 ± 0.003 | 22.0 ± 0.5 | ||
| Среднее по группе | 82 | 21.7 ± 0.3 | 0.1196 ± 0.001 | 0.33 ± 0.002 | 20.1 ± 0.3 | ||
| Монодиета-2 | Самцы | 19 | 15.0 ± 0.4* | 0.0894 ± 0.002 | 0.24 ± 0.004 | 36.5 ± 2.2 | |
| Самки | 34 | 13.0 ± 0.4 | 0.0837 ± 0.002 | 0.25 ± 0.006 | 41.3 ± 1.8 | ||
| Среднее по группе | 53 | 13.7 ± 0.3** | 0.0858 ± 0.002** | 0.25 ± 0.004** | 39.2 ± 1.4** |
Для массовых характеристик и коэффициента озоления четко прослеживается возрастная тенденция их увеличения: у животных в возрасте 11 нед все они значимо (p < 0.01) меньше тех же показателей 15-недельных животных. Это свидетельствует о продолжающемся росте экспериментальных животных и о повышении минеральной плотности их костей.
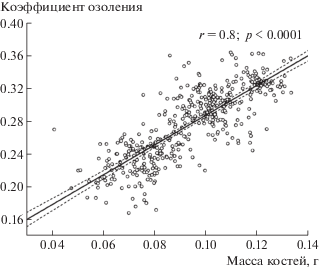
На протяжении всего эксперимента животные, содержавшиеся на овсяной диете, были гораздо мельче контрольных (без выраженных диспропорций в размерах тела). Их характеристики значимо ниже соответствующих контрольных. Причем изменения массы тела и бедренных костей пропорциональны друг другу, а увеличение зольности костей пропорционально изменению их массы (рис. 1).
Рис. 1.
Величина коэффициента озоления в зависимости от массы костей. Пунктиром обозначены границы 95%-ного доверительного интервала для линии регрессии.
Отметим также различие поведенческих и физиологических реакций животных групп “монодиета” и “контроль”. Например, у контрольных животных уже в возрасте 11 нед наблюдали случаи спаривания и последующей беременности самок (родивших и беременных самок выбраковывали из эксперимента, их число было около 5%) и отсутствие такового у животных, содержавшихся на овсяной монодиете, как первой, так и второй возрастной групп. Кроме того, при неполноценном рационе питания отсадка самок в месячном возрасте потомства приводила к гибели части детенышей от истощения (около 3–4%), так как они оказались не готовы к переходу на самостоятельное питание. Приведенные факты свидетельствуют не только о нарушении ростовых процессов, но и о задержке развития и гормональных сдвигах в организме опытных животных.
Как в контроле, так и в опыте наблюдается значимое снижение уровня депонирования 90Sr с возрастом. При этом аккумуляция 90Sr у животных опытных групп значимо (p < 0.01) выше.
Влияние пола животных на массовые показатели и аккумуляцию 90Sr выявлено не во всех экспериментальных группах. Половой диморфизм характеристик массы у большинства видов позвоночных хорошо известен. На метаболические показатели половая принадлежность животных влияет в меньшей степени. Например, для 90Sr половые различия значимы в обеих контрольных, но отсутствуют в опытных группах. Половые различия для коэффициента озоления не обнаружены.
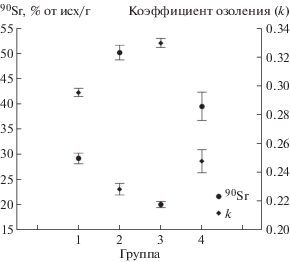
Сравнение уровня аккумуляции 90Sr и величины коэффициента озоления, который является индикатором МПК, представлено на рис. 2. Видно, что величина накопления 90Sr и коэффициент озоления зеркально соотносятся друг с другом. Бόльшей величине депонирования 90Sr соответствует меньшая степень минеральной насыщенности кости.
Рис. 2.
Сравнительное изменение удельной активности 90Sr и коэффициента озоления костной ткани у мышей экспериментальных групп: 1, 3 – контроль; 2, 4 – монодиета (возраст 11 и 15 нед соответственно). Показан средний ±95%-ный доверительный интервал.
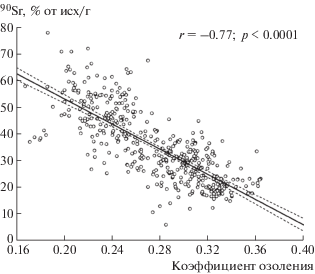
Зависимость депонирования 90Sr от зольности костей представлена на рис. 3. Выявлена отрицательная корреляция (r = –0.77, p < 0.0001) между величиной накопления 90Sr и коэффициентом озоления.
Рис. 3.
Удельная активность 90Sr в зависимости от коэффициента озоления кости. Пунктиром обозначены границы 95%-ного доверительного интервала для линии регрессии.
В табл. 2 представлены исследуемые показатели 8-недельных экспериментальных животных через 1 сут после введения 90Sr. Различия между опытной и контрольной группой для всех показателей значимы на уровне p < 0.01 (по U-тесту Манна–Уитни).
Таблица 2.
Удельная активность 90Sr в костной ткани, массовые показатели животных и коэффициент озоления костей через 1 сут после введения радионуклида (M ± m)1
| Группа | n | Масса тела, г | Масса бедренных костей, г | Коэффициент озоления | 90Sr, % от исх/г |
|---|---|---|---|---|---|
| Контроль-1.1 | 5 | 16.2 ± 1.0 | 0.0852 ± 0.004 | 0.30 ± 0.007 | 54.7 ± 3.6 |
| Монодиета-1.1 | 5 | 10.7 ± 0.8 | 0.0586 ± 0.003 | 0.23 ± 0.003 | 93.7 ± 7.8 |
1 Данные через 3 нед после введения 90Sr представлены в табл. 1.
ОБСУЖДЕНИЕ
Массовые характеристики. Изменение массовых показателей в экспериментальных группах совпадает с полученными нами ранее данными: животные, длительное время содержавшиеся на овсяной монодиете, резко отстают от сверстников, развивающихся на фоне стандартной диеты или монодиеты, имевшей место в другие периоды пре- и постнатального развития [14]. Влияние возраста выражается в росте животных и увеличении массы тела и скелета. Эффект фактора “пол” проявляется в распространенном в природе явлении полового диморфизма массовых характеристик (в частности, массы тела).
МПК. Увеличение зольности костей животных всех экспериментальных групп отражает возрастную закономерность. Различия между одновозрастными группами связаны с использованной диетой.
Интерес представляет сравнение 2-й опытной группы с 1-м контролем: опытные животные в возрасте 15 нед по всем изученным показателям еще не достигли уровня 11 нед контрольных животных. Например, масса тела – 13.7 ± 0.3 и 17.6 ± ± 0.2 г; масса бедренных костей – 0.0858 ± 0.002 и 0.1004 ± 0.001 г; коэффициент озоления – 0.25 ± 0.004 и 0.30 ± 0.001 соответственно. Эти данные были расценены нами как несоответствие физиологического и хронологического возрастов костной ткани животных опытных групп. Т.е. диета, состоящая в течение длительного времени из овса, замедляет не только темп роста тела, но и дифференциацию морфологических структур скелета и свидетельствует о необходимости учета в физиологических исследованиях всех экзогенных факторов. В литературе имеются указания на снижение темпов созревания скелета как на неспецифическую реакцию костной системы на различные патологические состояния или длительное содержание животных на измененных диетах, при которых наблюдается недостаточное поступление в организм веществ, необходимых для нормального образования костной ткани, прежде всего кальция, витаминов и белков, что тормозит ростовые процессы и изменяет химический состав костей [45–47].
Накопление 90Sr. Межгрупповые различия в накоплении 90Sr связаны с различием возрастов на момент инъекции и воздействием на протяжении длительного времени экзогенного фактора – овсяной монодиеты. Аккумуляция 90Sr значимо выше у животных опытных групп, что соответствует данным других авторов об изменении поведения остеотропных радионуклидов под влиянием эндо- и экзогенных факторов, например, при изменении диеты и гормонального статуса организма (см. обзор [14]).
Отсутствие половых различий в накоплении 90Sr соответствует давно утвердившемуся в радиобиологии мнению об относительно небольшом вкладе половых особенностей в накопление большинства остеотропных радионуклидов [14, 24, 48–50]. Исключение составляют период беременности и лактации, когда в организме самок происходят изменения в минеральном обмене [19, 23, 27, 51, 52], а также период быстрого роста, когда формируется масса скелета. Темп накопления вещества и его количество в это время различаются у самцов и самок за счет полового диморфизма в размерах скелета (тела) [27, 52].
Связь МПК и накопления 90Sr. За 1 мес. (временной разрыв между 1-м и 2-м возрастом) коэффициент озоления у всех животных увеличился на 8–10% (что указывает на соответствующее увеличение минерализации кости), уровень накопления 90Sr за этот срок снизился на 20–30%. Различия между одновозрастными контрольными и опытными, находившимися на овсяной монодиете животными, по этим показателям еще больше: по коэффициенту озоления различия составили 20–25%, по регистрируемой удельной активности – 70–95%.
У животных 1-го возраста через 1 сут после введения 90Sr (табл. 2) процент удержанного 90Sr почти в 2 раза больше, чем у животных этой же группы через 3 нед. (табл. 1): в контрольной группе – 54.7 ± 3.6 и 29.2 ± 0.5%, в группе “монодиета” – 93.7 ± 7.8 и 50.2 ± 0.7% соответственно. Это связано со значительным биологическим выведением радионуклида в начальные сроки после введения. Значительную величину разброса данных радиометрии через 1 сут после введения можно объяснить небольшим количеством животных в группах. Однако различия по всем параметрам между животными групп “контроль”–1.1 и “монодиета”–1.1 значимы (p < 0.01).
Соотношение уровня накопления 90Sr у животных групп “контроль”–1 и “монодиета”–1 равно 1.7 как через 1 сут, так и через 3 нед, прошедшие после введения радионуклида (93.7/54.7 = = 1.7 и 50.2/29.2 = 1.7 соответственно). У животных 2-го возраста это соотношение равно = 1.9 (39.2/20.1), однако различия с 1-м возрастом недостоверны. Это означает, что различия в депонировании 90Sr между контрольными и опытными животными формируются в 1-е сутки после введения радионуклида, и коэффициент озоления (величину МПК) можно считать фактором депонирования 90Sr.
Полученные данные находятся в хорошем соответствии с физиологией костной ткани. Молодая кость пронизана густой сетью кровеносных сосудов, она содержит больше воды и органических веществ, чем старая. В то же время отношение количества минералов в старой и вновь образующейся кости редко превышает 1.5 : 1, что способствует повышенной диффузии в молодой кости. При этом отношение уровня аккумуляции остеотропных радионуклидов, накапливающихся в этих структурах, может составлять 1 : 10 или даже 1 : 20 [16]. С возрастом замедляются рост кости и связанная с ним перестройка, что приводит к увеличению доли старой, полностью минерализованной и неактивной костной ткани. Существенное различие в депонировании радионуклидов в зрелой (старой) и молодой (вновь образующейся) костной ткани и ее обусловленность степенью минерализиции обсуждаются еще с 60-х годов прошлого века [15–18]. Роль МПК наглядно демонстрирует диффузное отложение остеотропных радионуклидов, в частности 90Sr, в эмбриональной слабо минерализованной, благоприятной для диффузии кости, в то время как в зрелой кости с высокой минеральной плотностью радионуклид откладывается преимущественно на костных поверхностях [12]. Доля радионуклида на поверхностях кости, из которых происходит его выведение, у зрелых животных значительно выше, чем у молодых особей с более диффузным характером отложения. Поэтому даже при равной доле элиминации костного вещества поверхностей у молодых животных скелетное удержание выше [12, 15, 16, 54–56]. Радиометрические данные подтверждают это положение: у опытных животных с меньшей зольностью костей удельная активность 90Sr больше, чем у контрольных.
Даже в наблюдениях [30], где у взрослых людей с полностью минерализованной костной тканью, проживающих в радиоактивной среде, не обнаружена связь между МПК и активностью 90Sr в кости, указывается на возрастно-зависимое увеличение МПК и уровней накопления 90Sr в период роста организма, что согласуется с приведенными данными.
Ранее на крысах линии Вистар нами было выявлено снижение скорости периостального костеобразования на уровне середины диафиза бедренной кости с 8.5 ± 0.5 до 2.3 ± 0.3 мкм/сут в течение первых 4 мес жизни [14]. В связи с этим представляет интерес изучение обусловленности костного метаболизма интенсивностью аппозиционного роста и костной перестройки в нормальных и модифицированных условиях развития скелета, в том числе после отмены модифицирующего воздействия.
Закономерности, выявленные нами в данном лабораторном эксперименте, нашли свое подтверждение при исследовании природных естественных популяций грызунов [57]. При исследовании аккумуляции 90Sr в костной ткани двух видов мышевидных грызунов: мышь полевая (Apodemus agrarius Pall., 1771) и малая лесная мышь (Sylvaemus uralensis Pall., 1811), обитающих в зоне ВУРСа с плотностью загрязнения 90Sr 0.074–3.7 и 3.7–18.5 МБк/м2 (2–100 и 100–500 Ки/км2 – периферия и эпицентр соответственно) выявлена обратная зависимость удельной активности 90Sr и МПК. Корреляционная связь удельной активности 90Sr и МПК составляет в эпицентре –0.42–(–0.44) (p ≤ 0.0001); на периферии – –0.21 (p = 0.0024). Более низкая обусловленность аккумуляции 90Sr МПК на периферии ВУРСа связана с тем, что здесь идет более интенсивное, чем по оси следа, перемешивание животных с мигрантами из сопредельной контрольной зоны [58]. То есть эффект эндогенного фактора – МПК – статистически значим на фоне существенных флюктуаций 90Sr в среде (мозаичности загрязнения территории).
Следует отметить, что слабоминерализованная кость присуща ряду системных заболеваний скелета, которые характеризуются уменьшением доли костной ткани в объеме костных органов, накоплением в костях неминерализованного или слабо минерализованного остеоида, усиленной васкуляризацией пораженных участков, снижением прочности костей и возрастанием риска их переломов от минимальной травмы или без таковой [59, 60]. При этом меняются площадь костных поверхностей и их “качество” (степень минерализации), чем в значительной степени объясняется повышенное накопление диагностических радиофармацевтических препаратов [61, 62]. Например, у больных остеомиелитом в острой стадии их накопление в очаге поражения в 6–10 раз больше, чем в неповрежденном участке симметричной кости [63], аккумуляция 85Sr в костной ткани у лиц с несовершенным остеогенезом более чем в 3 раза выше, чем в норме [64]. Следует отметить, что современные методы денситометрии для человека позволяют учитывать фактор минеральной плотности в задержке остеотропных радиофармпрепаратов.
ВЫВОДЫ
1. Показано, что длительная несбалансированная диета (овсяная монодиета) способствует более интенсивному накоплению 90Sr за счет замедления темпа роста тела (скелета) и запаздыванию дифференциации морфологических структур скелета.
2. Выявлена отрицательная корреляция (r = = –0.77, p < 0.0001) между накоплением в кости 90Sr и МПК.
3. Установлено, что явление аккумуляции 90Sr в зависимости от МПК, показанное в данной работе в лабораторных экспериментах, обнаружено у двух видов мышевидных грызунов на территории ВУРСа в условиях хронического поступления 90Sr. То есть выявленная закономерность характерна и для млекопитающих из радиоактивной среды. Это подтверждает достоверность экспериментально изученных механизмов радиоактивного загрязнения животных, недоступных для непосредственного наблюдения в природной среде.
4. Отмечено, что влияние функционального состояния костной ткани, в частности МПК, на кинетику остеотропных радионуклидов может иметь прикладное значение и быть использовано в случаях сомнительного диагноза при радиодиагностике патологий скелета и для расчета поглощенной тканевой дозы от радиофармпрепаратов, используемых для терапии костных раков и других целей.
Список литературы
Последствия техногенного радиационного воздействия и проблемы реабилитации Уральского региона / Под общ. ред. С.К. Шойгу. М.: Комтехпринт, 2002. 287 с.
Alexakhin R.M., Buldakov L.A., Gubanov V.A. et al. Large radiation accidents: Consequences and protective countermeasures. M.: IzdAT Publisher, 2004. 556 p.
ICRP. Publication 103. 2007. Recommendations of the International Commission on Radiological Protection // ICRP Ann. 2007. V. 37 (2–4).
ICRP. Publication 67. Age-dependent dose to members of the public from intake of radionuclides. Pt. 2: Ingestion dose coefficients. Oxford: Pergamon Press, 1993. 167 p.
Аклеев А.В. Хронический лучевой синдром у жителей прибрежных сел реки Теча. Челябинск: Книга, 2012. 464 с.
Калистратова В.С., Беляев И.К., Жорова Е.С. и др. Радиобиология инкорпорированных радионуклидов / Под ред. В.С. Калистратовой. Изд. 2-е, перераб. М: ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России, 2016. 556 с.
Стариченко В.И. Роль морфофизиологических характеристик скелета в депонировании 90Sr: сравнительное изучение / Актуальные проблемы экологической физиологии, биохимии и генетики животных: Мат. II Междунар. науч. конф. / Мордов. гос. ун-т им. Н.П. Огарева. Саранск: Мордовия–ЭКСПО, 2009. С. 136–138.
Стариченко В.И. Метаболизм остеотропных токсических веществ: наследственная детерминация // Экол. генетика. 2010. Т. VIII. № 3. С. 27–37.
Likhtarev I.A., Dobroskok I.A., Ilyin L.A. et al. A study of certain characteristics of strontium metabolism in a homogeneous group of human subjects // Health Phys. 1975. V. 28. № 1. P. 49–60.
Thomas R.G., Healy J.W., McInroy J.F. Plutonium partitioning among internal organs // Health Phys. 1984. V. 46. № 4. P. 839–844.
Любашевский Н.М., Стариченко В.И., Григоркина Е.Б. Материалы к прогнозированию индивидуальной дозовой нагрузки при хроническом облучении остеотропными радионуклидами // I Всесоюз. радиобиол. съезд, Москва, 21–27 авг. 1989 г.: Тез. докл. Т. IV. Пущино, 1989. С. 965–967.
Любашевский Н.М. Метаболизм радиоизотопов в скелете позвоночных. М.: Наука, 1980. 255 с.
Любашевский Н.М., Попов Б.В., Мокроносов А.А. и др. Биологические основы межвидовых экстраполяций параметров скелетного метаболизма / Пограничные проблемы экологии: Сб. науч. тр. Свердловск: УНЦ АН СССР, 1986. С. 84–102.
Стариченко В.И., Любашевский Н.М., Попов Б.В. Индивидуальная изменчивость метаболизма остеотропных токсических веществ. Екатеринбург: Наука, 1993. 168 с.
Ньюман У., Ньюман М. Минеральный обмен кости. М.: Иностр. лит-ра, 1961. 270 с.
Энгстрем Э., Бьёрнерстед П., Клемендсон К., Нельсон Э. Кость и радиоактивный стронций: Пер. с англ. М.: Медгиз, 1962. 128 с.
Публикация МКРЗ 23. Человек: Медико-биологические данные: Докл. рабочей группы Комитета II МКРЗ по условному человеку. М.: Медицина, 1977. 496 с.
Публикация МКРЗ 89. Основные анатомические и физиологические данные для использования в радиационной безопасности: Референтные значения. М.: Медкнига, 2007. 318 с.
Ильенко А.И., Крапивко Т.П. Экология животных в радиационном биогеоценозе. М.: Наука, 1989. 224 с.
Метаболизм стронция: сборник статей: Пер. с англ. / Под ред. В.А. Книжникова, А.А. Моисеева. М.: Атомиздат, 1971. 344 с.
Osanov D.P., Panova V.P., Arefieva S.S. Evaluation of age influence on accumulation and elimination rate of radioactive strontium // Health Phys. 1971. V. 21. № 2. P. 205–210.
Age-Related Factors in Radionuclide Metabolism and Dosimetry // Radiation Protection Programme and the Commissariat à l’Energie Atomique, Institut de Protection et de Sûreté Nucléaire, Fontenay-aux-Roses, France / Eds G.B. Gerber, H. Métivier, H. Smith. 1987.
Баженов В.А., Булдаков Л.А., Василенко И.Я. и др. Вредные химические вещества. Радиоактивные вещества: Справочное издание. Л.: Химия, 1990. 464 с.
Шведов В.Л., Аклеев А.В. Радиобиология стронция-90. Челябинск: УНПЦ РМ, 2001. 298 с.
Калистратова В.С., Заликин Г.А., Нисимов П.Г. и др. Биокинетика радионуклидов как функция возраста экспериментальных животных // Радиац. биология. Радиоэкология. 1996. Т. 36. Вып. 3. С. 421–426.
Vakili A., Jalilian A.R., Moghadam A.K. et al. Evaluation and comparison of human absorbed dose of (90) Y-DOTA-Cetuximab in various age groups based on distribution data in rats // J. Med. Phys. 2012. V. 37. № 4. P. 226–234.
Shagina N.B., Tolstykh E.I., Degteva M.O. et al. Age and gender specific biokinetic model for strontium in humans // J. Radiol. Prot. 2015. V. 35. № 1. P. 87–127.
Беневоленская Л.И., Насонов Е.Л. Патогенез остеопороза: Руководство по остеопорозу / Под ред. Л.И. Беневоленской. М.: БИНОМ. Лаборатория знаний, 2003. С. 77–104.
Оганов В.С. Костная система, невесомость и остеопороз. М.: Слово, 2003. 260 с.
Толстых Е.И. Половозрастные особенности минерализации скелета у жителей радиоактивно загрязненных территорий Уральского региона: Автореф. дис. … д-ра биол. наук. Челябинск: Челяб. госуд. пед. ун-т, 2006.
ICRP. Publication 70. Basic anatomical and physiolo-gical data for use in radiological protection: the skeleton. Oxford: Pergamon Press, 1995. 81 p.
Osteogenesis Imperfecta: A Translational Approach to Brittle Bone Disease / Eds J.R. Shapiro, J. Kassim, P. Sponseller. Academic Press, 2013. 578 p.
Jee W.S.S., Yao W. Overview: animal models of osteopenia and osteoporosis // J. Musculoskel. Neuron Interact. 2001. V. 1. № 3. P. 193–207.
Sims N.A., Clément-Lacroix P., Minet D. et al. A functional androgen receptor is not sufficient to allow estradiol to protect bone after gonadectomy in estradiol receptor–deficient mice // J. Clin. Invest. 2003. V. 111. № 9. P. 1319–1327.
Lean J.M., Davies J.T., Fuller K. et al. A crucial role for thiol antioxidants in estrogen-deficiency bone loss // J. Clin. Invest. 2003. V. 112. № 6. P. 915–923.
Bigham-Sadegh A., Oryan A. Selection of animal mo-dels for pre-clinical strategies in evaluating the fracture healing, bone graft substitutes and bone tissue regene-ration and engineering // Connect Tissue Res. 2015. V. 56. № 3. P. 175–194.
Guo Y., Sun N., Duan X. et al. Estrogen Deficiency Leads to Further Bone Loss in the Mandible of CKD Mice [Electronic resource] // PLoS ONE. 2016. V. 11. № 2. URL: https://doi.org/10.1371/journal.pone.0148804
Петрухин И.В., Петрухин Н.И. Кормление домашних и декоративных животных: Cправ. кн. М.: Нива России, 1992. 336 с.
Журавлев В.Ф. Токсикология радиоактивных веществ. М.: Энергоатомиздат, 1990. 336 с.
Ильин Б.Н., Борисова В.В., Ветух В.А. Отдаленные биологические эффекты комбинированного действия радионуклидов различной тропности. М.: Энергоатомиздат, 1991. 160 с.
Smith J.A., van den Broek F.A.R., Cantor Martorell J. et al. Principles and practice in ethical review of animal experiments across Europe: Summary of the report of a FELASA Working Group on Ethical Evaluation of Animal Experiments // Lab. Animals. 2007. V. 41. № 2. P. 143–160.
Caring for animals aiming for better science: Directive 2010/63/EU on Protection of Animals used for Scientific Purposes / European Commission, 2010.
Indritz A.N., Hegarty P.V.J. Problems in the choice of a representative bone for mineral analysis: evidence from five bones of rats at two stages of development // J. Anat. 1980. V. 131. № 2. P. 317–320.
Стариченко В.И., Любашевский Н.М. Индивидуальные особенности аккумуляции 90Sr в организме двух видов серых полевок, обитающих на территории Восточно-Уральского радиоактивного следа // Радиац. биология. Радиоэкология. 1998. Т. 38. Вып. 3. С. 375–383.
Котова С.М., Карлова Н.А., Максимцева И.М., Жорина О.М. Снижение темпов созревания скелета – неспецифическая реакция костной системы на различные патологические состояния // Гений ортопедии. 2002. № 1. С. 163.
Диетология / Под ред. А.Ю. Барановского. 4-е изд. СПб.: Питер, 2012. 1024 с.
Nutrient Requirements of Laboratory Animals: Fourth Revised Edition. Washington D.C.: National Academy Press, 1995. 192 p.
Stover B.J. Metabolism of radioactive isotopes which deposit mainly in the skeleton // Health Phys. 1959. V. 1. № 4. P. 373–378.
Книжников В.А. Кальций и фтор. Радиационно-гигиенические аспекты. М.: Атомиздат, 1975. 199 с.
Толстых Е.И., Перемыслова Л.М., Шагина Н.Б. и др. Особенности накопления и выведения 90Sr у жителей Уральского региона в период 1957–1988 гг. // Радиац. биология. Радиоэкология. 2005. Т. 45. № 4. С. 464–473.
ICRP. Publication 88. Doses to the Embryo and Fetus from Intakes of Radionuclides by the Mother // ICRP Ann. 2001. V. 31 (1–3).
Shagina N.B., Tolstykh E.I., Fell T.P. et al. Strontium biokinetic model for the lactating woman and transfer to breast milk: application to Techa River studies // J. Radiol. Prot. 2015. V. 35. P. 677–694.
Tolstykh E.I., Kozheurov V.P., Vyushkova O.V., Degteva M.O. Analysis of strontium metabolism in humans on the basis of the Techa river data // Radiat. Environ. Biophys. 1997. V. 36. P. 25–29.
Любашевский Н.М., Шарыгин Л.М., Степина В.И. Нативные поверхности и сорбционная способность зрелой и формирующейся костной ткани // Метаболизм радиоизотопов в животном организме. Свердловск, 1974. С. 12–18.
Расин И.М., Пантелеев Л.И., Сарапульцев И.А. и др. Закономерности формирования минеральной части скелета у млекопитающих // Журн. общей биологии. 1981. Т. 42. № 1. С. 118–121.
Cabrera W.E., Schrooten I., De Broe M.E., D’Haese P.C. Strontium and bone // J. Bone Miner. Res. 1999. V. 14. № 5. P. 661–668.
Стариченко В.И. Аккумуляция 90Sr у грызунов из зоны Восточно-Уральского радиоактивного следа: влияние минеральной плотности кости // Радиац. биология. Радиоэкология. 2018. Т. 58. № 2. С. 205–213.
Стариченко В.И., Любашевский Н.М., Модоров М.В., Чибиряк М.В. 90Sr в скелете как метка миграционной активности мышевидных грызунов в зоне Воcточно-Уральского радиоактивного следа // Экология. 2014. № 3. С. 230–240.
Slemenda C.W., Turner C.H., Peacock M. et al. The genetics of proximal femur geometry, distribution of bone mass and bone mineral density // Osteoporos. Int. 1996. V. 6. № 2. P. 178–182.
Rosen C.J., Beamer W.G., Donahue L.R. Defining the genetics of osteoporosis: using the mouse to understand man // Osteoporos. Int. 2001. V. 12. № 10. P. 803–810.
Касаткин Ю.Н., Поцыбина В.В., Левчук Д.И. Остеосцинтиграфия при системных поражениях опорно-двигательного аппарата: параметры нормы, проблемы визуализации и анализа // Радиология – практика. 2003. № 3. С. 31–37.
Love C., Din A.S., Tomas M.B. et al. Radionuclide bone imaging: an illustrative review // RadioGraphics. 2003. V. 23. № 2. P. 341–358.
Линденбратен Л.Д., Лясс Ф.М. Медицинская радиология. 3-е изд., перераб. и доп. М.: Медицина, 1986. 368 с.
Лихтарев И.А., Краснощекова Г.П., Доброскок А.И., Синицкий Ю.Ф. Сообщение III. Биофизическая интерпретация особенностей обмена стронция у лиц с нормальным и нарушенным развитием скелета // Мед. радиология. 1972. Т. 17. № 1. С. 80–86.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


