Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 305-310
ВЛИЯНИЕ ДЕЙТЕРИЯ НА ЭКСПРЕССИЮ ИНДУЦИБЕЛЬНЫХ ГЕНОВ У Escherichia coli
С. К. Абилев 1, 2, *, Е. В. Игонина 1, С. В. Смирнова 1, А. В. Рубанович 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: abilev@vigg.ru
Поступила в редакцию 23.07.2018
Аннотация
Впервые показано, что предварительное дейтерирование бактерий Esherichia coli оксидом дейтерия (D2O) в концентрациях от 2.5 до 10% в среде приводит к усилению экспрессии гена recA, индуцированной H2O2 в концентрациях 2.2–8.8 ммоль/л. Для сравнительного изучения индукции recA-гена в дейтерированных и недейтерированных (контрольных) культурах использовали биосенсор на основе штамма E. coli K12 MG1655 (pRecA–lux), люминесцирующий в результате активации промотора гена recA в ответ на повреждения ДНК, вызванные Н2О2. Концентрации D2O 5.0 и 7.5% были наиболее эффективными. Для объяснения выявленного феномена была изучена экспрессия гена каталазы в дейтерированных и недейтерированных культурах биосенсора E. coli K12 MG1655 (pKatA–lux). Люминесценция этого биосенсора происходит результате активации промотора гена katA в ответ на увеличение концентрации Н2О2 в клетке. Выявлено, что D2O снижает уровень экспрессии гена katA, что может привести к накоплению Н2О2, и соответственно возрастанию уровня повреждений ДНК, регистрируемого по увеличению экспрессии гена recA.
Дейтерий (D), тяжелый изотоп водорода – протия (Н), был открыт в 1932 г. [1]. Дейтерий находится в природе в незначительных количествах и составляет 0.0156% от общего количества водорода в природе. Наиболее распространенным его соединением является оксид дейтерия (D2O), который в 1933 г. был получен в концентрированном виде и получил название “тяжелая вода”. В ядерных ректорах D2O используется как замедлитель нейтронов. Способность D2O регулировать ядерные реакции привела к появлению промышленного производства этого соединения. D2O в физике элементарных частиц используется для детектирования нейтрино, в химии и биологии – в качестве изотопного индикатора [2, 3]. Распространение в природе соединений, меченных дейтерием, позволяет проводить разнообразные экологические, геоморфологические, палеонтологические и другие исследования, в том числе связанные с проблемой происхождения Вселенной и Земли [4].
Изучение влияния D2O на самые разные живые организмы началось сразу после получения этого соединения в значительных количествах. К настоящему времени накоплен большой объем информации по данному вопросу. Ранние исследования показали, что D2O в больших концентрациях у живых организмов замедляет метаболизм, вызывает снижение уровней синтеза белков и нуклеиновых кислот, ингибирует митоз в стадии профазы, что приводит к нарушению процесса клеточного деления и морфологическим изменениям, понижает скорости ферментативных реакций [3, 5, 6]. Клетки животных способны выдерживать водные растворы с концентрацией D2O до 30%, растений – 50%, микроводорослей – 70%, а клетки простейших и бактерий – 95% [5, 7]. Биологическая адаптация микроорганизмов к D2O открывает большие возможности для получения меченого дейтерием биологического материала для диагностических и биомедицинских целей [7–9].
В экспериментах in vitro и in vivo D2O подавлял рост как культивируемых in vitro, так и перевиваемых in vivo опухолевых клеток [10–13]. При комбинированном воздействии D2O усиливал действие цитостатика гемцитабина (2',2'-дифтор-2'-дезоксицитидин) на опухолевые клеточные линии поджелудочной железы человека [14], 5-фторурацила и блеомицина на инокулированные подкожно мышам клетки плоскоклеточной карциномы человека [15].
Несмотря на многочисленные работы по изучению токсического действия D2O на уровне целого организма и влияния его на физиологические и биохимические процессы в клетке, исследования его влияния на генетические механизмы немногочисленны. Ранее было показано, что предварительное дейтерирование культуры мышиных лейкемических клеток L5178Y в течение 3 ч D2O в концентрации 45% в среде усиливает мутагенное действие γ-лучей в низких дозах или тритийсодержащей воды (β-лучей) при мощностях доз от 0.025 до 0.4 Гр/ч, регистрируемое по индукции мутаций устойчивости к 6-тиоганину [16]. Нами впервые было показано, что предварительное культивирование клеток E. сoli в среде с концентрацией D2O не более 10% усиливает SOS-ответ, индуцированный 4-нитрохинолин-1-оксидом, N-нитрозо-N-метилмочевиной (НММ) и митомицином С [17], а также экспрессию гена alkA, индуцированную алкилирующими соединениями метилметансульфонатом и нитрозометилмочевиной [18]. Это является свидетельством того, что в случае индукции генотоксичными агентами повреждений ДНК дейтерирование усиливает экспрессию генов, относящихся к системам SOS-репарации ДНК и адаптивного ответа.
В настоящей работе изучали влияние предварительного культивирования клеток E. сoli в среде с D2O на индуцированный перекисью водорода экспрессию генов recA, входящего в SOS-регулон, а также гена каталазы katG, разрушающей перекись. Н2О2, являясь нейтральной молекулой, в результате ферментативных процессов в клетке с участием металлов переменной валентности, может образовать высокореакционный гидроксильный радикал [19]. Это позволяет использовать его в качестве имитатора ионизирующего излучения.
МАТЕРИАЛЫ И МЕТОДИКА
В работе использованы генетически модифицированные штаммы E. coli, содержащие плазмиды, несущие оперон luxCDABE почвенной фотобактерии Photorhabdus luminescens, поставленный под контроль промоторов генов recA и каталазы (katG): E. coli MG1655 (pRecA-lux) и E. coli MG1655 (pKatG-lux). Оперон luxCDABE отвечает за работу люцифераз и обеспечивает биолюминесценцию, используемую в данном тесте в качестве репортерной функции. Штаммы любезно предоставлены Г.Б. Завильгельским и А.В. Мануховым (НИЦ “Курчатовский институт” – ГосНИИгенетика, Москва). Генотипы штаммов и конструкции рекомбинантных плазмид приведены в работе [20].
Культуры клеток E. coli выращивали на полноценной среде Луриа–Бертани (LB). Как в жидкую, так и твердую среды добавляли антибиотик ампициллин (100,0 мкг/мл). Культивирование бактерий в жидкой питательной среде проводили при 37°С до ранней или средней логарифмической фазы. Ночную культуру разбавляли свежей средой до плотности 0.01–0.1 единица Мак-Фарланда (концентрация 3 × 106–3 × 107 кл./мл). Измерения проводили при помощи денситометра DEN-1B (“Biosan”). Затем суспензию подращивали в течение 2 ч при 37°С при 200 об./мин до ранней логарифмической фазы. Аликвоты этой культуры (по 180 мкл) переносили в стерильные ячейки (находящиеся в стрипах планшета) и добавляли в них, в зависимости от варианта эксперимента, по 20 мкл Н2О2. В контрольные ячейки добавляли 20 мкл дистиллированной воды.
Через 60 и 90 мин после завершения описанных процедур проводили измерения люминесценции на микропланшетном ридере StatFax 4400, Awareness Technology Inc (США). Интенсивность биолюминесценции выражали в относительных единицах светового потока (relative light units – RLU). Статистическую обработку данных проводили в надстройке “Анализ данных” Microsoft Excel, StatPlus и WINPЕPI (РEPI-for-Windows) Во всех случаях на графиках представлены средние значения и ошибки среднего. Значимость эффектов оценивалась с помощью многомерного регрессионного анализа (SPSS 20.0.0.).
РЕЗУЛЬТАТЫ
Известно, что H2O2 является генотоксикантом и индуцирует SOS-ответ в клетках E. сoli [21, 22]. В индукции SOS-ответа важную роль играют продукты генов lexA и recA, а также наличие однонитевых разрывов в ДНК, которые возникают как при прямой индукции разрывов, так и при блокировании синтеза повреждающими ДНК агентами [23–26].
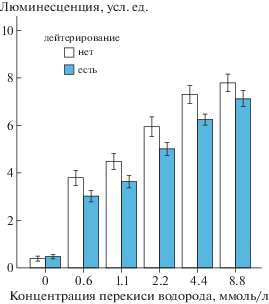
Для изучения влияния дейтерирования на индукцию SOS-ответа в клетках E. coli MG1655 (pRecA-lux) перекисью нами были использованы D2O в концентрации 7.5% в растущей культуре и 45-минутная экспозиция предварительного дейтерирования. Перекись водорода использовали в концентрациях 0.6–8.8 ммоль/л. Выбор данного диапазона обусловлен тем, что в предварительных экспериментах это соединение в более высоких концентрациях подавляло люминесценцию бактерий, что свидетельствовало о его токсичности. Из рис. 1 следует, что предварительное дейтерирование бактерий штамма E. сoli MG1655 (pRecA-lux) усиливает экспрессию гена recA, индуцированной Н2О2. Различие между уровнями экспрессии гена recA у недейтерированных и дейтерированных бактерий достигало максимума при концентрации перекиси 8.8 ммоль/л.
В табл. 1 представлены параметры линейной модели с двумя предикторами (множественный регрессионный анализ):
Таблица 1.
Влияние дейтерирования на экспрессию гена recA у биосенсора E. coli MG1655 (pRecA-lux)
| Модель | Нестандартизованные коэффициенты | Стандартизованные коэффициенты | t | р | |
|---|---|---|---|---|---|
| B | SE | β | |||
| (Константа) | 15283.7 | 11577.5 | 1.320 | 0.193 | |
| Дейтерирование | 36827.0 | 12557.6 | 0.223 | 2.933 | 0.005 |
| Перекись | 21082.4 | 1929.6 | 0.831 | 10.925 | 3.0Е-14 |
Видно, что дейтерирование приводит к существенному повышению интенсивности люминесценции (р = 0.005) при воздействии перекиси водорода. При этом, в отсутствие этого соединения, уровни экспрессии гена recA в чистом контроле и при дейтерировании значимо не различались (левая пара столбиков на рис. 1): р = 0.581.
Для подтверждения влияния дейтерия на индукцию SOS-ответа в бактериальных клетках были проведены эксперименты с различными концентрациями D2O в восьми повторностях. Для этого в растущие культуры бактерий добавляли D2O до конечных концентраций от 2.5 до 10% в среде и инкубировали в течение 60 мин при 37°С. Затем в эти культуры вносили перекись в концентрации 2.2 ммоль/л. Инкубировали 45 мин. Полученные результаты представлены на рис. 2. Само дейтерирование бактерий приводило к небольшому, но значимому изменению экспрессии гена recA по отношению к таковой у бактерий, не подвергнутых воздействию перекиси (FC = 1.2–1.3). Зависимость люминесценции от концентрации D2O значимо описывалась линейным уравнением вида:
Рис. 2.
Экспрессия гена recA при фиксированной концентрации Н2О2 и дейтерировании бактерий D2O в различных концентрациях.
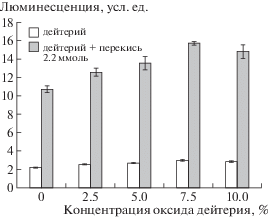
В присутствии H2O2 наблюдалась иная картина. Предварительное дейтерирование бактерий D2O в концентрациях от 2.5 до 10% в среде приводило к резкому усилению экспрессии гена recA, индуцированной H2O2. Концентрации D2O 5,0 и 7.5% были наиболее эффективными, что согласуетcя с ранее полученными нами данными [17].
Известно, что в присутствии дейтерия химические и биохимические реакции происходят медленнее [3, 6]. В этой связи мы предположили, что он может снижать уровень каталазной активности в бактериальной клетке, разрушающей перекись, что привело бы к увеличению концентрации последней. Для проверки этого предположения были проведены эксперименты с использованием биосенсора E. coli MG1655 (pKatG-lux), дейтерированного в среде c 7.5% D2O. В ответ на действие перекиси у E. coli экспрессируются около 30 генов, девять из которых относятся к OxyR – регулону. Среди них katG (гидропероксидаза), gorA (глутатионредуктаза) и другие [27–29]. Поэтому интенсивность люминесценции бактерий E. coli MG1655(pKatG-lux) является показателем уровня экспрессии генов, входящих OxyR – регулон. Из рис. 2. видно, что интенсивность люминесценции бактерий растет линейно с увеличением концентрации Н2О2. При этом люминесценция у дейтерированных бактерий ниже, чем у недейтерированных.
Выполнен множественный регрессионный анализ данных, полученных в 16 независимых экспериментах, каждый из которых проводился в восьми повторностях. В табл. 2 приведены параметры полученной линейной регрессионной модели с двумя предикторами:
Таблица 2.
Влияние дейтерирования на экспрессию гена каталазы у биосенсора E. coli MG1655 (pKatG-lux)
| Модель | Нестандартизованные коэффициенты | Стандартизованные коэффициенты | t | р | |
|---|---|---|---|---|---|
| B | SE | β | |||
| (Константа) | 30982.5 | 1735.6 | 17.8 | 0.000 | |
| Перекись | 6571.8 | 346.2 | 0.642 | 19.0 | 6.1E-61 |
| Дейтерирование | –7323.8 | 2051.6 | –0.121 | –3.570 | 3.9E-4 |
Корреляция между люминесценцией и дейтерированием при фиксированной концентрации перекиси (частная корреляция) равна –0.157 при р = 0.0004. Это означает, что дейтерирование значимо понижает люминесценцию биосенсора E. coli MG1655 (pKatG-lux). Этот эффект обусловлен снижением уровня каталазы в бактериальных клетках (р = 0.0004).
ОБСУЖДЕНИЕ
Перекись водорода не является в прямом смысле свободным радикалом, однако обладает способностью инициировать свободнорадикальное окисление, поэтому является цитотоксическим соединением. В результате реакции Фентона между ионами металлов переменной валентности, в первую очередь ионами 2-валентного железа, образуется гидроксильный радикал: Н2О2 + + Fe2+ > Fe3+ + OH– + OH• [30].
Важность ионов железа объясняется тем, что они входят в большом количестве в состав крови (гемоглобин, миоглобин и пр.), где они находятся в связанной форме с трансферрином. Гидроксильные радикалы чрезвычайно активны и оказывают разрушающее действие на различные молекулы, включая ДНК и РНК, вызывают мутации и гибель клеток [31–33]. Цитотоксическое и канцерогенное действие ионизирующих излучений на живые организмы напрямую связывают с генерацией OH• в процессе радиолиза воды. Генотоксичность H2O2 показана как для прокариотических, так и для эукариотических клеток [34–36]. Будучи главным медиатором окислительного стресса, H2O2 может косвенно приводить к повреждению генома вследствие индукции деградации хроматина [37], индуцировать разрывы ДНК в клетках млекопитающих как соматического, так и генеративного ряда [34, 36]. Повреждения ДНК в выживших клетках могут быть причиной соматических мутаций с неопластическим потенциалом.
Биологические эффекты D2O объясняют разницей ядерных масс пары H/D, т.е. изотопными эффектами. Показано, что химические реакции в D2O протекают медленнее, чем в H2O; D2O слабее ионизирована, чем H2O; водородные связи с участием дейтерия прочнее обычных [3]. Наше предположение, что предварительное дейтерирование может снижать уровень активности каталазы в бактериальной клетке, разрушающей H2O2, что привело бы к увеличению концентрации последней и соответственно усилению индукции SOS-ответа, получило экспериментальное подтверждение (рис. 3). Дейтерирование приводило к снижению уровня каталазной активности и в бактериях, не подвергнутых воздействию перекиси. Данный феномен является предметом специального исследования.
Каталаза – это гемсодержащий фермент, катализирует реакцию 2Н2О2 = 2Н2О + О2. Каталазная активность обнаруживается во всех растениях и микроорганизмах, за исключением облигатных анаэробов [36]. Наряду с каталазой, реакцию расщепления Н2О2 может катализировать и глутатионпероксидаза: 2GSH + H2O2 = GSSG + 2Н2О. При этом образуется окисленный глутатион (GSSG), восстановление которого осуществляется с участием глутатионредуктазы (1.6.4.2) и систем восстановления НАДФ+ [27, 28].
Ген каталазы активируется белком OxyR. Под действием Н2О2 у белка OxyR происходит образование внутримолекулярной дисульфидной связи между Cys199 и Cys208, ведущее к конформационному изменению в регуляторном домене OxyR и активации гена каталазы [27].
Известно, что образование из Н2О2 реакционноспособных соединений в клетке является результатом целого комплекса ферментативных реакций. Использованная нами система биосенсоров может свидетельствовать только о выраженности последствий присутствия Н2О2 в клетке, к которым можно отнести индукцию SOS-ответа в результате образования гидроксильного радикала и индукцию экспрессии гена katG (гидропероксидаза), зависящую от концентрации Н2О2. Дейтерирование, по-видимому, оказывает влияние на регистрируемые эффекты Н2О2 через изменение активностей целого ряда ферментов, начиная от ферментов, расщепляющих Н2О2, до ферментов SOS-репарации повреждений ДНК. Снижение экспрессии гена каталазы под действием дейтерия, в конечном итоге, способствует увеличению пула гидроксильных радикалов, индуцирующих однонитевые разрывы в ДНК. Последнее обстоятельство приводит к индукции SOS-репарации ДНК в бактериальной клетке.
Список литературы
Urey H.C., Brickwedde F.G., Murphy G. A hydrogen isotope of mass 2 // Phys. Rev. 1932. V. 39. P. 164.
Андреев Б.М., Зельвенский Я.Д., Катальников С.Г. Тяжелые изотопы водорода в ядерной технике. М.: Энергоатомиздат, 1987. 455 с.
Лобышев В.И., Калиниченко Л.П. Изотопные эффекты D2O в биологических системах. М.: Наука, 1978. 215 с.
Blake G.A., Qi C., Hogerheijde M.R. et al. Sublimation from icy jets as a probe of the interstellar volatile content of comets // Nature. 1999. V. 398. № 6724. P. 213–16.5.
Czajka D.M., Finkel A.J., Fischer C.S., Katz J.J. Physiological effects of deuterium on dogs // Am. J. Physiol. 1961. V. 201. P. 357–362.
Денько Е.И. Действие тяжелой воды (D2O) на клетки животных, растений и микроорганизмы // Успехи совр. биол. 1973. Т. 70. № 4. С. 41–49.
Katz J.J., Crespi H.L. Deuterated organisms: Cultivation and uses // Science. 1966. V. 151. P. 1187–1194.
Kushner D.J., Baker A., Dunstall T.G. Pharmacological uses and perspectives of heavy water and deuterated compounds // Can. J. Physiol. Pharmacol. 1999. V. 77. № 2. P. 79–88.
Мосин О.В., Складнев Д.А., Швец В.И. Включение дейтерированных ароматических аминокислот в молекулу бактериородопсина Halobacterium halobium // Прикл. биохим. микробиол. 1999. Т. 35. № 1. С. 34–42.
Takeda H., Nio Y., Omori H., Uegaki K. et al. Mechanisms of cytotoxic effects of heavy water (deuterium oxide: D2O) on cancer cells // Anticancer Drugs. 1998. V. 9. № 8. P. 715–725.
Altermatt H.J., Gebbers J.O., Laissue J.A. et al. Heavy water delays growth of human carcinoma in nude mice // Cancer. 1988. V. 62. № 3. P. 462–466.
Hartmann J., Bader Y., Horvath Z. et al. Effects of heavy water (D2O) on human pancreatic tumor cells // Anticancer Res. 2005. V. 25. № 5. P. 3407–3411.
Uemura T., Moritake K., Akiyama Y. et al. Experimental validation of deuterium oxide–mediated antitumoral activity as it relates to apoptosis in murine malignant astrocytoma cells // J. Neurosurg. 2002 V. 96. P. 900–908.
Bader Y., Hartmann J., Horvath Z. et al. Synergistic effects of deuterium oxide and gemcitabine in human pancreatic cancer cell lines // Cancer Letters. 2008. V. 259. P. 231–239.
Altermatt H.J., Gebbers J.O., Laissue J.A. Heavy water enhances the antineoplastic effect of 5-fluoro-uracil and bleomycin in nude mice bearing human carcinoma // Int. J. Cancer. 1990. V. 45. № 3. P. 475–480.
Furuno-Fukushi I., Matsudaira H. Mutation Induction by Tritiated Water and Effects of Deuterium Oxide in Cultured Mouse Leukemia Source // Radiat. Res. 1985. V. 103. № 3. P. 466–470.
Абилев С.К., Смирнова С.В., Игонина Е.В. и др. Оксид дейтерия усиливает SOS-ответ клеток Esherichia coli, индуцированный генотоксикантами // ДАН. 2018. Т. 480. № 2. С. 239–243.
Смирнова С.В., Абилев С.К., Игонина Е.В. и др. Влияние дейтерия на индукцию ada-регулона алкилирующими веществами в клетках Escherichia coli // Генетика. 2018. Т. 54. № 8. С. 1–7.
Владимиров Ю.А., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых системах // Итоги науки и техники. Биофизика. 1992. Т. 29. 250 с.
Котова В.Ю., Манухов И.В., Завигельский Г.Б. Lux-биосенсоры для детекции SOS-ответа, теплового шока и окислительного стресса // Биотехнология. 2009. № 6. С. 16–25.
Goerlich O., Quillardet P., Hofnung M. Induction of the SOS response by hydrogen peroxide in various Escherichia coli mutants with altered protection against oxidative DNA damage // J. Bacteriol. 1989. V. 171. № 11. P. 6141–6147.
Игонина Е.В., Марсова М.В., Абилев С.К. Lux-биосенсоры: скрининг биологически активных соединений на генотоксичность // Экол. генетика. 2016. № 4. С. 52–62.
Ушаков В.Ю. SOS-система репарации ДНК у бактерий (обзор) // Вестн. Пермского ун-та. 2010. № 2. С. 19–30.
Завигельский Г.Б. SOS-репарации 60 лет // Молек. биол. 2013. Т. 47. № 5. С. 699–706.
Goodman M.F. Error-prone repair DNA polymerases in prokaryotes and eukaryotes // Annu. Rev. Biochem. 2002. V. 71. P. 17–50.
Baharoglu Z., Mazel D. SOS, the formidable strategy of bacteria against aggressions // FEMS Microbiol. Rev. 2014. V. 38. P. 1126–1145.
Aslund F., Zheng M., Beckwith J., Storz G. Regulation of the OxyR transcription factor by hydrogen peroxide and the cellular thiol-disulfide status // Proc. Natl. Acad. Sci. USA. 1999. V. 96. P. 6161–6165.
Aslund F., Ehn B., Miranda-Vizuete A. et al. Two additional glutaredoxins exist in Escherichia coli: Glutaredoxin 3 is a hydrogen donor for ribonucleotide reductase in a thioredoxin/glutaredoxin 1 double mutant // Proc. Natl. Acad. Sci. USA. 1994. V. 91. P. 9813–9817.
Choi H.J., Kim S.J., Mukhopadhyay P. et al. Structural basis of the redox switch in the OxyR transcription factor // Cell. 2001. V. 105. № 1. P. 103–113.
Imlay J.A., Chin S.M., Linn S. Toxic DNA damage by hydrogen peroxide through the Fenton reaction in vivo and in vitro // Science. 1988. V. 240. P. 640–642.
Cadet J.D., Douki T., Gasparutto T. et al. Hydroxyl radicals and DNA base damage // Mutat. Res. 1999. V. 424. P. 9–12.
Cadet J., Douki T., Ravanat J.-L. Oxidatively generated base damage to cellular DNA // Free Radical Biol. Med. 2010. V. 49. № 1. P. 9–21.
Cadet J., Ravanat J.-L., TavernaPorro M. et al. Oxidatively generated complex DNA damage: Tandem and clustered lesions // Cancer Lett. 2012. V. 327. № 1–2. P. 5–10.
Berthelot-Ricou A., Perrin J., Di Giorgio C. et al. Comet assay on mouse oocytes: an improved technique to evaluate genotoxic risk on female germ cells // Fertility and Sterility. 2011. V. 95. № 4. P. 1197–1534.
Benhusein G.M., Mulch E., Aburawi S., Williams F.M. Genotoxic effect induced by hydrogen peroxide in human hepatoma cells using comet assay // Libyan. J. Med. 2010. V. 5. P. 4637–4642.
Asad N.R., Asad L.M.B.O., Almeida C.E.B. et al. Several pathways of hydrogen peroxide action that damage the E. coli genome // Gen. Mol. Biol. 2004. V. 27. № 2. P. 291–303.
Konat G.W. H2O2-induced higher order chromatin de-gradation: A novel mechanism of oxidative genotoxicity // J. Biosci. 2003. V. 28. P. 57–60.
Mongkolsuk S., Helmann J.D. Regulation of inducible peroxide stress responses // Mol. Microbiol. 2002. V. 45. № 1. P. 9–15.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология