Радиационная биология. Радиоэкология, 2019, T. 59, № 4, стр. 419-429
СОВРЕМЕННЫЕ ДОЗОВЫЕ НАГРУЗКИ ОТ ИЗЛУЧЕНИЙ ТЕХНОГЕННОГО 137Cs И ПРИРОДНЫХ РАДИОНУКЛИДОВ НА ЖАБРОНОГОГО РАЧКА Artemia spp. ИЗ СОЛЕНЫХ ОЗЕР КРЫМА
Н. Ю. Мирзоева 1, А. А. Коротков 1, *, Г. Е. Лазоренко 1
1 Институт морских биологических исследований им. А.О. Ковалевского
Севастополь, Россия
* E-mail: a.korotkoff@mail.ru
Поступила в редакцию 28.03.2018
Аннотация
Впервые в истории радиоэкологических исследований Крымского региона была выполнена оценка дозовой нагрузки от ионизирующего излучения искусственного (137Сs) и естественных радионуклидов (210Ро, 40K, 232Th, 238U, 234Th, 226Ra) на цисты и взрослых особей Artemia spp. из соленых озер Крыма (Кирлеутсткое, Джарылгач, Сасык-Сиваш, Акташское). Для сравнения полученных результатов использовалась шкала Зон хронического действия ионизирующего излучения Г.Г. Поликарпова. Определено, что 210Po является основным дозообразующим радионуклидом для цист и взрослых особей артемии из соленых озер Крыма. Поглощенная доза от ионизирующего излучения 210Po для взрослых рачков в среднем составляла 6.8 × 10–2 Гр/год и на порядок превышала таковую для цист этих гидробионтов. Дозовые нагрузки от техногенного 137Сs и природных (40K, 232Th, 238U, 234Th, 226Ra) радионуклидов не достигали значений, способных оказать регистрируемое влияние как на цисты, так и на взрослых особей артемии из соленых озер Крыма.
На территории Крымского полуострова расположено большое число озер и лиманов. Почти все эти озера – соленые, континентального и морского типа [1, 2]. Каждое из них представляет собой уникальную экосистему со своеобразным гидрохимическим режимом и структурой сообществ живых организмов [1, 3, 4]. Соленые озера с большой выгодой эксплуатируются для получения биопродуктов, используемых в химической промышленности, сельском хозяйстве, биотехнологиях, аквакультуре и медицине [5, 6]. Обычным и наиболее массовым обитателем соленых озер Крыма является жаброногий рачок Artemia spp. (Crustacea, Anostraca). В настоящее время в Крыму известно более сотни мест обитания артемии [7]. Цисты артемии являются ценнейшим кормовым ресурсом, необходимым для развития аквакультуры. Науплиусы этого жаброногого рачка являются самым распространенным живым стартовым кормом для личинок рыб и ракообразных во всем мире [8]. Кроме того, Artemia spp. является удобным объектом для радиоэкологических исследований в экспериментальных условиях [9, 10].
Радиоактивное загрязнение озер Крыма имеет естественную и искусственную составляющую. Естественная радиоактивность природных вод обусловлена, прежде всего, присутствием 222Rn, 226Ra, 228Ra, 224Ra, 234U, 238U, 40K, 232Th, 234Th 210Po, 210Pb [11–13]. При этом наибольший вклад в дозу, которую гидробионты получают от естественной радиоактивности, вносит 210Ро [14–17]. В современный период к естественному облучению живых организмов прибавились антропогенные источники внешнего и внутреннего облучения. Одним из основных антропогенных радиоактивных загрязнителей гидросферы и источников облучения гидробионтов является 137Cs [16, 18]. Значительное количество этого радионуклида попало в соленые озера Крыма после аварии на Чернобыльской АЭС. Известно, что в мае 1986 г. на поверхность Черного моря и Крыма выпало 1.7–2.4 ПБк 137Cs [17, 19, 20]. В послеаварийные годы радиоэкологическая ситуация в Крыму определялась вторичным поступлением 137Cs со стоками рек (главным образом – Днепра), что привело к хроническому радиоактивному загрязнению, в основном, за счет использования днепровской воды из Северо-Крымского канала (СКК) [17, 19, 21]. Получено, что за период 1986–1995 гг. с днепровскими водами на орошаемые земли юга Украины и в Крым поступило 674 ГБк 137Cs, из них 506 ГБк – на поливные сельхозугодия Херсонской области и Крыма. При этом около 70% 137Сs, поступившего с днепровской водой по западной ветке СКК в Крым, аккумулировалось орошаемыми территориями, а оставшаяся часть выносилась вместе со сбросными водами в Каркинитский залив [17].
Цель настоящей работы состояла в сравнительной оценке дозовых нагрузок и возможных последствий радиационного воздействия излучений искусственного 137Cs и природных радионуклидов (226Ra, 232Th, 234Th, 238U, 210Po, 40К) в качестве внешних и внутренних источников облучения цист и взрослых особей Artemia spp. из соленых озер Крыма. При этом также учитывалась доза от γ-квантов 137mBa, дочернего продукта, образующегося при β-распаде ядра 137Cs.
В связи с поставленной целью решались следующие задачи:
– определить концентрацию искусственного (137Cs) и природных (226Ra, 232Th, 234Th, 238U, 210Po, 40К) радионуклидов в цистах и взрослых особях Artemia spp., отобранных из соленых озер Крыма Перекопской, Тарханкутской и Керченской групп;
– определить концентрацию искусственного 137Cs в абиотических компонентах экосистем (вода, донные отложения) исследуемых водоемов;
– рассчитать дозовые нагрузки на жаброногого рачка Artemia spp. (цисты и взрослые особи) от ионизирующего излучения 137Cs и естественных радионуклидов, сравнить полученные величины доз;
– оценить степень риска последствий радиационного воздействия искусственного 137Cs в качестве внешнего и внутреннего источника облучения цист и взрослых особей Artemia spp.
Актуальность определения дозовых нагрузок от ионизирующего излучения природных (226Ra, 232Th, 234Th, 238U, 210Po, 40К) и искусственных (137Cs) радионуклидов на различные стадии Artemia spp. (цисты и взрослые особи) обусловлена потребностью оценки риска радиационного воздействия на этих гидробионтов, что производится впервые.
МАТЕРИАЛЫ И МЕТОДИКА
Радиоэкологическое изучение соленых озер Крыма проводилось в 2016–2017 гг. на базе Отдела радиационной и химической биологии (ОРХБ) ФГБУН ИМБИ РАН. Материал для исследования был отобран во время сухопутных экспедиций на соленые озера Крыма: Кирлеутсткое, (Перекопская группа озер), Джарылгач (Тарханкутская группа озер), Сасык-Сиваш (Евпаторийская группа озер), Акташское (Керченская группа озер) (рис. 1, табл. 1).
Рис. 1.
Расположение станций отбора проб из соленых озер Крыма (1–4 – контрольные станции в Черном море).
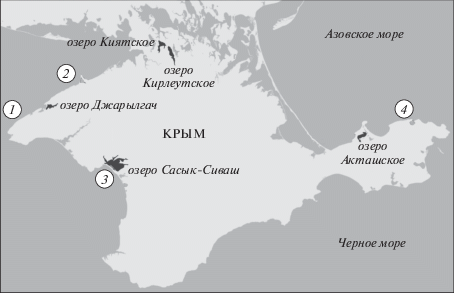
Таблица 1.
Координаты и характеристика районов отбора проб
| Название объектов исследования | Дата отбора проб | Координаты мест отбора проб | Соленость, ‰ | рН |
|---|---|---|---|---|
| Оз. Кирлеутское | 14.06.2016 | 45°55.231′ с.ш. | 235.0 | 7.9 |
| 34°02.681′ в.д. | ||||
| 22.06.2017 | 45°55.479′ с.ш. | 267.0 | 7.2 | |
| 34°02.730′ в.д. | ||||
| Оз. Джарылгач | 18.05.2016 | 45° 34.990′ с.ш. | 115.0 | 8.5 |
| 32° 51.505′ в.д. | ||||
| 14.07.2017 | 45° 34.011′ с.ш. | 140.0 | 8.0 | |
| 32° 51.438′ в.д. | ||||
| Оз. Сасык-Сиваш | 08.11.2016 | 45°12.282′ с.ш. | 280.0 | 7.7 |
| 33°31.526′ в.д. | ||||
| Оз. Акташское | 08.06.2016 | 45°25.299′ с.ш. | 88.5 | 8.5 |
| 35°50.468′ в.д. | ||||
| 29.08.2017 | 45°23.145′ с.ш. | 55.0 | 8.1 | |
| 35°50.029′ в.д. |
Для определения концентрации 238U, 232Th, 226Ra, 40К и 137Cs отбор цист в период 2016–2017 гг. производили в озерах Кирлеутсткое, Джарылгач и Акташское. Именно в этих озерах, согласно методам определения радионуклидов [17, 22], удалось собрать необходимое количество живого материала (от 996 до 1034 г сырой массы цист из каждого озера). В результате долговременных траловых ловов минимально необходимое количество (390–420 г сырой массы) взрослых особей артемии удалось отобрать только в озерах Джарылгач и Акташское в 2017 г. Пробы цист и взрослых особей этого жаброногого рачка промывали пресной водой, а затем высушивали до постоянной массы при температуре 100–110°С. Коэффициенты усушки для цист артемии изменялись в диапазоне от 11.4 до 17.7, а для взрослых особей рачков это значение было равно 60.
Для радиохимического анализа 210Po в период 2016–2017 гг. были отобраны цисты артемии в озерах Джарылгач и Сасык-Сиваш, взрослые особи – из озер Кирлеутское и Джарылгач. При определении содержания 210Po для радиохимического анализа использовали от 1 до 10 г сырой массы живого материала. Что касается донных отложений, то для анализа было достаточно около 0.5 г сухой массы [23]. Одновременно с отбором гидробионтов были отобраны пробы донных отложений, в которых также определялись концентрации всех заявленных в работе радионуклидов. Полученные данные использовали для определения доз внешнего облучения гидробионтов от ионизирующего излучения 137Cs. С этой же целью отбирали воду в озерах Кирлеутское, Джарылгач и Акташское (60 л для каждого отдельного измерения).
Для проведения исследований было отобрано шесть проб воды, 10 проб донных отложений, девять проб цист и семь проб живых артемий.
Содержание радионуклидов 238U, 232Th, 226Ra, 40К и 137Cs определяли по общепринятым в мировой практике методам [17, 24, 25] с использованием полупроводникового детектора ORTEC GMX-10 (США), выполненного на основе кристалла сверхчистого германия. Калибровку детектора осуществляли с помощью стандартных образцов донных отложений IAEA-306 и IAEA-315, поставляемых МАГАТЭ [17, 22]. Форма и размеры измерительных емкостей для стандартных образцов и для исследованных нами проб донных отложений были одинаковыми. Концентрацию 226Ra определяли по γ-излучению его короткоживущих дочерних радионуклидов: 214Pb (энергия γ-квантов 295.2 и 351.9 кэВ) и 214Bi (609.3 кэВ), а 238U – по его дочернему радионуклиду 234Th (энергия 63.3 и 92.6 кэВ) в состоянии радиоактивного равновесия между дочерними и материнскими радионуклидами, достигнутого за счет длительного (до 5 мес.) выдерживания проб перед измерениями [24, 25]. Статистическая ошибка гамма-спектрометрических измерений рассчитана по величине одного стандартного отклонения (1σ) от средних значений с учетом уровня внешнего радиоактивного фона, погрешности эффективности детектора и погрешности определения объема или массы. В целом величина относительной погрешности не превышала 20%. Для достижения такого уровня погрешности время измерений каждой пробы составляло 1 сут и более [17, 24, 25].
Для выделения 210Ро из отобранных образцов применяли радиохимический метод, основанный на спонтанном осаждении полония на серебряном диске [23]. Химический выход 210Ро определяли с помощью трассера – изотопа 208Ро, с периодом полураспада 2.898 г. и энергией α-частиц 5,114 МэВ (AEA Technology, Великобритания). Изотопы полония осаждали на серебряный диск, а затем измеряли их активность на альфа-спектрометре EG&G ORTEC OCTÊTÊ PC (США). Управление прибором и обработку спектров осуществляли с помощью программы Maestrotm II, модель A64–B1 этой же фирмы. Концентрации 210Ро в пробах рассчитывали на дату отбора по методике, описанной в работе [26]. Статистическую ошибку альфа-спектрометрии рассчитывали по величине одного стандартного отклонения (1σ) от средних значений [26].
Расчет поглощенных доз для отобранных цист и взрослых особей Artemia spp. базировался на использовании коэффициента DCF (дозового конверсионного фактора, (Гр ⋅ год–1)/(Бк ⋅ кг–1) для 238U, 232Th, 234Th, 226Ra, 40К, 137Cs. Взвешивающие коэффициенты для γ- и β-излучений равны 1 [28]. Таким образом, поглощенная и эквивалентная дозы, получаемые Artemia spp. от ионизирующего излучения 238U, 232Th, 234Th, 226Ra, 40К и 137Cs, были равны.
Для определения дозовой нагрузки, получаемой гидробионтами от внутреннего и внешнего источника облучения, применяли уравнение с использованием DCFint и DCFext факторов (1) [15, 28].
(1)
${{D}_{i}} = {\text{C}}_{i}^{{\text{w}}}DCF_{i}^{{\operatorname{int} }}CF_{i}^{{{\text{hydr}}.}} + C_{i}^{{{\text{sed}}}}DCF_{{i{\text{ext}}}}^{{{\text{sed}}}},\;{\text{Г р /г о д ,}}$В связи с тем, что DCF для расчета внешних доз, получаемых гидробионтами от ионизирующего излучения природных (238U, 232Th, 234Th, 226Ra, 40K) радионуклидов, находящихся в донных отложениях водоемов, не предусмотрен [30], а внешнее облучение для гидробионтов в водной среде от α-излучающего 210Ро отсутствует [24, 26], в настоящей работе рассматриваются только дозы внутреннего облучения цист и взрослых особей артемии, получаемые ими от всех природных радионуклидов. Концентрации 238U, 232Th, 234Th, 226Ra, 40K, 210Ро в донных отложениях не учитывались.
Суммарную дозу, полученную гидробионтами от внешнего (донные отложения) и внутреннего облучения, рассчитывали только для искусственного радионуклида 137Cs [15, 27, 28, 30–32].
Для расчета мощностей поглощенных доз, формируемых излучением α-частиц 210Ро в живых объектах, нами использованы подходы и критерии, изложенные в работах [29, 34, 35], а также формула (2), предложенная Б. Дж. Блейлоком с соавт. [34]:
(2)
$D = {\text{5}}.0{\text{4}} \times {\text{1}}{{{\text{0}}}^{{ - {\text{6}}}}}{{C}_{{{\text{oр г }}}}}{\text{E}},$Действие α-излучающих радионуклидов в морской среде оценивается только по их доле, инкорпорированной гидробионтами, так как вклад внешней составляющей от воды и донных отложений исключается в силу физических характеристик α-частиц [26, 29].
Для оценки максимально возможных годовых поглощенных доз облучения, получаемых гидробионтами, обитающими в озерах Крыма, от α-частиц 210Po использовали максимальные величины концентраций этого радионуклида, из определенных в исследованных объектах.
Для расчета поглощенных доз облучения взрослой артемии и ее цист использовали взвешивающий коэффициент, равный 20 для α-частиц [27].
Полученные результаты сравнивали со шкалой Зон хронического действия ионизирующего излучения, предложенной Г.Г. Поликарповым [17, 36, 37].
РЕЗУЛЬТАТЫ
Концентрации 137Сs в воде, донных отложениях, цистах и взрослых особях артемии из озер Кирлеутское, Джарылгач и Акташское представлены в табл. 2. Наибольшие концентрации природных радионуклидов, определенные для цист и взрослых особей Artemia spp. из соленых озер Крыма в период 2016–2017 гг., показаны в табл. 3.
Таблица 2.
137Сs в воде, донных отложениях и Artemia из соленых озер Крыма
| Название озер | Концентрация 137Сs ± 1σ | |||
|---|---|---|---|---|
| вода, Бк/м3 | донные отложения, Бк/кг сухой массы | артемия, Бк/кг сырой массы | ||
| цисты | взрослые особи | |||
| Перекопская группа | ||||
| Кирлеутское | 2.6 ± 0.1 | н.д.* | н.д.* | н.и.** |
| 4.7 ± 0.3 | н.д.* | н.и.** | ||
| Тарханкутская группа | ||||
| Джарылгач | 22.2 ± 1.0 | 6.2 ± 1.2 | н.д.* | н.и.** |
| 36.7 ± 2.0 | 11.6 ± 1.6 | н.д.* | 0.7 ± 0.2 | |
| Керченская группа | ||||
| Акташское | 11.5 ± 0.5 | 5.3 ± 0.9 | н.д.* | н.и.** |
| 14.9 ± 0.7 | н.д.* | н.д.* | 0.6 ± 0.1 | |
Таблица 3.
Наибольшие концентрации природных радионуклидов в Artemia из соленых озер Крыма (2016–2017 гг.)
| Стадии развития | Концентрация, Бк/кг сырой массы ± 1σ | ||||
|---|---|---|---|---|---|
| 226Ra | 232Th | 234Th | 238U | 40K | |
| Цисты | 0.4 ± 0.02 | 0.1 ± 0.01 | 0.02 | 0.9 ± 0.07 | 3.5 ± 0.3 |
| Взрослые особи | 0.2 ± 0.01 | – | 0.8 ± 0.04 | 2.5 ± 1.1 | 4.1 ± 0.3 |
Определено (табл. 2, 3), что в цистах артемии содержание 137Сs было ниже предела измерения активности этого радионуклида, тогда как концентрации природных радионуклидов 226Ra, 232Th, 234Th, 238U, 40К достоверно определялись. Во взрослых особях рачка концентрации 137Сs были одинаковы и не зависели от даты и района отбора проб. Содержание природных радионуклидов во взрослых артемиях, в целом, на порядок превышало таковое для их цист.
Получено (табл. 4), что суммарные дозы от внешнего и внутреннего облучения 137Сs для взрослых артемий составляли величины, равные n × 10–6 Гр/год, что на порядок ниже доз, рассчитанных для черноморских гидробионтов [17]. Этого же порядка были и дозы, сформированные излучением естественных радионуклидов для цист и взрослых особей Artemia из соленых озер Крыма (табл. 5). Общая сумма поглощенных доз, полученных взрослыми особями артемии как от ионизирующего излучения искусственного 137Сs (табл. 4), так и природных 226Ra, 232Th, 234Th, 238U, 40К (табл. 5), составляли 1.1 × 10–5 Гр/год, что соответствует значениям поглощенных доз, получаемых черноморскими моллюсками от искусственных радионуклидов 90Sr и 137Cs в период 1999–2005 гг. [17].
Таблица 4.
Дозы, сформированные излучением 137Сs в воде, донных отложениях и взрослых Artemia из соленых озер Крыма
| Название озера | Поглощенная доза, Гр/год | |||
|---|---|---|---|---|
| внешнее облучение, водная среда | внешнее облучение, донные отложения | внутреннее облучение | Суммарная, (суммарная средняя) | |
| Джарылгач | 7.3 × 10–8 | 2.3 ×10–6 | 3.0 × 10–6 | 5.3 × 10–6 |
| Акташское | 3.0 × 10–8 | – | 2.6 × 10–6 | 2.6 × 10–6 |
| (4.0 × 10–6) | ||||
Таблица 5.
Дозы, сформированные излучением естественных радионуклидов в цистах и взрослых особях Artemia из соленых озер Крыма
| Стадии развития | Поглощенные дозы Гр/год | Суммарная доза, Гр/год | ||||
|---|---|---|---|---|---|---|
| 226Ra | 232Th | 234Th | 238U | 40K | ||
| Цисты | 2.1 × 10–6 | 8.7 × 10–8 | 3.5 × 10–9 | 8.2 × 10–7 | 3.5 × 10–7 | 3.3 × 10–6 |
| Взрослые особи | 1.1 × 10–6 | – | 1.4 × 10–7 | 2.3 × 10–6 | 2.6 × 10–6 | 6.1 × 10–6 |
Результаты определения концентрации 210Ро в гидробионтах в период 2016–2017 гг. и расчеты доз, полученных цистами и взрослыми особями артемии от ионизирующего излучения 210Ро, приведены в табл. 6. Отмечено, что наибольшие концентрации этого радионуклида были обнаружены во взрослых артемиях из озера Джарылгач (табл. 6). Здесь этот показатель был сравним с концентрациями 210Ро, определенными в донных отложениях указанного озера, которые варьировали от 50.5 до 115.8 Бк/кг сухой массы.
Таблица 6.
Концентрации 210Po в цистах и взрослых особях Artemia spp. и дозы, формируемые внутренним облучением этих организмов
| Объект | Место отбора | Дата | Бк/кг сырой массы ± 1σ | Поглощенная доза, Гр/год |
|---|---|---|---|---|
| Цисты артемии | Джарылгач | 08.11.2016 | 16.0 ± 2.0 | 8.6 × 10–3 |
| 14.07.2017 | 7.7 ± 2.2 | 4.1 × 10–3 | ||
| 18.05.2016 | 8.5 ± 2.4 | 4.5 × 10–3 | ||
| средняя: 5.7 × 10–3 | ||||
| Артемия | Джарылгач | 06.09.2016 | 198.3 ± 16.5 | 1.1 × 10–1 |
| 18.05.2016 | 114.8 ± 9.7 | 6.1 × 10–2 | ||
| 14.07.2017 | 69.2 ± 10.0 | 3.7 × 10–2 | ||
| 14.07.2017 | 121.2 ± 13.3 | 6.5 × 10–2 | ||
| средняя: 6.8 × 10–2 | ||||
| Цисты артемии | Сасык-Сиваш | 08.11.2016 | 14.3 ± 2.2 | 7.6 × 10–3 |
| Артемия | Кирлеутское | 23.06.2017 | 25.3 ± 3.6 | 1.4 × 10–2 |
Средние значения поглощенных доз облучения, полученных цистами артемий от ионизирующего излучения 210Ро, составляли 5.7 × 10–3 Гр/год, а для взрослых особей – 6.8 × 10–2 Гр/год. Это на 3–4 порядка превышало суммарные дозы, которые рачки на этой стадии развития получают от других природных радионуклидов: 226Ra, 232Th, 234Th, 238U, 40K, и на четыре порядка – от доз облучения, получаемых взрослыми особями артемии от искусственного радионуклида 137Cs.
Максимальная величина поглощенной дозы (около 10–1 Гр/год), полученная от ионизирующего излучения 210Ро взрослыми особями артемии, была определена для проб гидробионтов, отобранных из озера Джарылгач осенью 2016 г.
ОБСУЖДЕНИЕ
Анализ полученных результатов показал (табл. 2), что концентрация природного радионуклида 40K, который является химическим аналогом цезия [38], была в (1.6–2.5) × 102 раза выше, чем концентрация других природных радионуклидов (226Ra, 232Th, 234Th, 238U) в цистах артемии. Так, концентрация 40K в цистах рачка составляла в среднем 3.5 Бк/кг сырой массы, тогда как для других природных радионуклидов это значение изменялось в диапазоне 0.02–0.9 Бк/кг сырой массы. То есть 40К, являясь конкурирующим с 137Cs элементом при накоплении гидробионтами и находясь в природной среде в большем количестве, чем этот искусственный радионуклид, более интенсивно накапливался цистами артемий, тогда как содержание 137Cs во всех пробах цист рачка было ниже уровня детектирования (табл. 2). В связи с этим было отмечено, что в период исследования 2016–2017 гг. дозовые нагрузки на цисты артемии от ионизирующего излучения искусственного радионуклида 137Cs, находящегося в соленых озерах Крыма, не были сформированы.
Выявлено (табл. 3), что концентрация 226Ra в цистах артемий была в 2 раза больше, а содержание 40K, 238U и 234Th было соответственно в 1.2, 2.7 и 40 раз меньше, чем во взрослых особях рачков. Вероятно, это связано с тем, что по биогеохимическим свойствам и особенностям концентрирования гидробионтами 226Ra является аналогичным стабильному кальцию, биологически значимому элементу [39, 40]. При этом поглощенные дозы, сформированные излучением естественных радионуклидов в цистах, были в 1.8 раз меньше таковых для взрослых артемий (табл. 5). Средние суммарные дозовые нагрузки на взрослых особей артемии от ионизирующего излучения искусственного радионуклида 137Cs и природных радионуклидов (226Ra, 232Th, 234Th, 238U) были, в целом, одного порядка, составляя 4.0 × 10–6 Гр/год и 6.1 × 10–6 Гр/год.
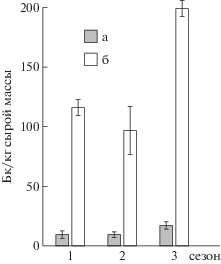
210Ро является одним из значимых дозообразующих природных радионуклидов [10]. Было отмечено, что артемия из оз. Джарылгач аккумулировала значительные количества природного радионуклида 210Ро – до 198 Бк/кг сырой массы, в то время как концентрации этого радионуклида в ее цистах были на порядок ниже (табл. 6, рис. 2). Самые низкие концентрации полония были отмечены в летних пробах, а наиболее высокие – в осенних (рис. 2). Возможно, это объясняется тем, что поступление 210Ро в организм гидробионтов происходит пищевым путем [41], и наблюдаемые изменения могут быть связаны с сезонными колебаниями концентраций этого радионуклида в пищевых объектах артемии – микроводорослях и, отчасти, детрите. Считаем, что на процесс накопления 210Ро гидробионтами могут влиять сезонные биологические изменения, связанные с жизненным циклом рачков.
Рис. 2.
210Ро в цистах (а) и взрослых особях (б) Artemia из оз. Джарылгач: 1 – весна, 2 – лето, 3 – осень.
Известно, что при благоприятных условиях среды обитания продолжительность жизни взрослых особей артемии не превышает 4 мес. [42]. Наряду с этим, Artemia spp. – это типичные фильтраторы, которые питаются различными микроводорослями, бактериями, мелкими простейшими, детритом, постоянно пропуская через себя воду и частички ила [42]. В этот период и происходит накопление в организме артемии различных веществ, в том числе и радиоактивных. В свою очередь, толстостенные цисты рачка могут находиться в состоянии покоя и сохраняться в водоеме значительное время [42].
То есть количественные, физико-химические характеристики искусственных и природных радионуклидов, находящихся в соленых озерах Крыма, а также биологические особенности различных стадий развития Artemia spp. являются основными факторами, влияющими как на накопление этих радионуклидов в цистах и взрослых особях рачка, так и формирование дозовых нагрузок на изучаемых гидробионтов.
Сопоставление полученных результатов со шкалой Зон хронического действия ионизирующего излучения Г.Г. Поликарпова [17, 36] позволило оценить степень риска последствий радиационного воздействия искусственных и естественных радионуклидов в качестве источников облучения цист и взрослых особей Artemia spp. из соленых озер Крыма (рис. 3, 4). Результаты исследований показали, что суммарные дозовые нагрузки на взрослых особей артемий за счет излучений 137Cs, а также на цисты и взрослых особей от ионизирующего излучения природных радионуклидов (226Ra, 232Th, 234Th, 238U) не поднимались выше уровней “Зоны неопределенности” (рис. 3, 4). Это первая Зона, согласно “Зонам мощностей доз и их действия в Биосфере”, предложенной академиком Г.Г. Поликарповым [17, 36], с наименьшими мощностями доз ионизирующей радиации. За условный верхний предел “Зоны неопределенности” принята мощность дозы 0.00004 Гр/год, которую создает излучение в процессе распада 40К [17, 36].
Рис. 3.
Сравнительные дозовые нагрузки (Гр/год), получаемые цистами и взрослыми особями Artemia от антропогенного радионуклида 137Cs (1), попавшего в соленые озера Крыма после аварии на ЧАЭС и природного радионуклида 210Po (2).

Рис. 4.
Сравнительные дозовые нагрузки (Гр/год), получаемые цистами и взрослыми особями Artemia от природных радионуклидов 226Ra, 232Th, 234Th, 238U, 40K (1) и 210Po (2).
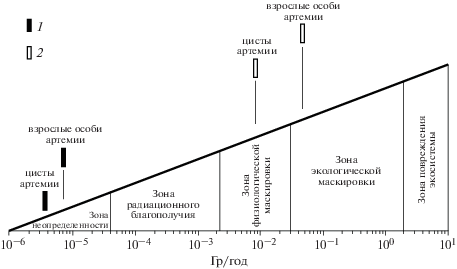
Определено, что дозы, полученные цистами артемии от ионизирующего излучения 210Ро, лежат в пределах Зоны “Физиологической маскировки” (рис. 3, 4). В ее пределах радиационные эффекты маскируются во многих случаях природной вариабельностью различных физиологических функций и содержанием биохимических компонентов. Уровень облучения в пределах этой Зоны (верхняя граница – 0.1 Гр/год) достаточен для продуцирования реальных эффектов, которые становятся регистрируемыми [17, 36]. Так, ряд эффектов, таких как увеличение частоты новых хромосомных аберраций у Chironomus, были зарегистрированы в этой Зоне мощностей доз [17, 36]. Дозы, полученные взрослыми особями артемии от ионизирующего излучения 210Ро, лежат в пределах Зоны “Экологической маскировки” (верхняя граница – 4.0 Гр/год). Значительный маскирующий эффект в этой Зоне может обеспечиваться благодаря различному состоянию популяций, сезонных изменений и вариабельности экологических условий, результатом действий естественного отбора [17, 36].
Таким образом, в результате проведенных исследований было определено, что из всех рассматриваемых радионуклидов только α-излучение поглощенного 210Po создает мощности доз, способные вызвать в цистах и взрослых особях Artemia spp. биологические эффекты, которые могут быть выявлены современными методами и аппаратурой.
ЗАКЛЮЧЕНИЕ
В ходе исследований была выполнена сравнительная оценка дозовых нагрузок от искусственного радионуклида 137Cs и природных радионуклидов (226Ra, 232Th, 234Th, 238U, 210Po, 40К) в качестве внешних и внутренних источников облучения цист и взрослых особей Artemia spp. из соленых озер Крыма (Кирлеутсткое, Джарылгач, Сасык-Сиваш, Акташское). В истории радиоэкологических исследований Крымского региона подобные исследования были проведены впервые.
Определено, что цисты артемии отличаются низкой (по сравнению со взрослыми особями рачка) аккумулирующей способностью искусственного радионуклида 137Cs и всех рассматриваемых природных радионуклидов, включая 210Ро. Основными факторами, влияющими на накопление этих радионуклидов цистами и взрослыми особями Artemia spp и формирование дозовых нагрузок на этих гидробионтов, являются количественные физико-химические характеристики искусственных и природных радионуклидов, находящихся в соленых озерах Крыма, а также биологические особенности различных стадий развития рачка.
210Po является основным дозообразующим радионуклидом для цист и взрослых особей артемии из соленых озер Крыма. Согласно предложенной академиком Г.Г. Поликарповым шкале “Зон мощностей доз и их действия в Биосфере”, определено, что поглощенные дозы, полученные цистами и взрослыми особями артемии от ионизирующего излучения 210Ро, достаточны для продуцирования реальных регистрируемых эффектов [17, 36] в исследуемых стадиях Artemia spp.
Результаты расчетов также показали, что дозовые нагрузки от ионизирующего излучения техногенного 137Сs и природных радионуклидов (40K, 232Th, 238U, 234Th, 226Ra) ни в одном из исследованных водоемов не достигали значений, способных оказать регистрируемое влияние на цисты и взрослых особей артемии.
Сопоставление рассчитанных дозовых нагрузок со шкалой “Зон мощностей доз и их действия в Биосфере” [36] – один из методов оценки степени риска последствий, получаемых гидробионтами от излучения искусственных и природных радионуклидов. Метод может быть использован для реализации контроля радиоэкологического состояния водных экосистем.
Список литературы
Балушкина Е.В., Голубков С.М., Голубков М.С. и др. Влияние абиотических и биотических факторов на структурно-функциональную организацию экосистем соленых озер Крыма // Журн. общей биологии. 2009. Т. 70. № 6. С. 504–514.
Balushkina E.V., Golubkov S.M., Golubkov M.S. et al. Characteristic features of ecosystems of hyperhaline lakes of the Crimea // Proc. Zoological Institute of Russian Academy of Sciences. 2005. V. 308. P. 5–13.
Бульон В.В., Анохина Л.Е., Аракелова Е.С. Первичная продукция гипергалинных озер Крыма // Тр. Зоологического института АН СССР. 1989. Т. 205. С. 14–25.
Шадрин Н.В., Голубков С.М., Балушкина Е.В. и др. Отклик экосистемы гиперсоленого Бакальского озера (Крым) на климатические особенности 2004 года // Морской экол. журн. 2004. Т. 3. № 4. С. 74.
Zheng Mianping, Qi Wen, Jiang Xianfeng et al. Trend of salt lake changes in the background of global warming and tactics for adaptation to the changes // Acta Geol. Sinica. 2004. V. 78. № 3 P. 795–807.
Ануфриева Е.В., Шадрин Н.В., Шадрина С.Н. История изучения биоразнообразия гиперсоленых водоемов Крыма // Аридные экосистемы. 2017. Т. 23/. № 1 (70). С. 64–71.
Шадрин Н.В. Ракообразные в гиперсоленых водоемах: специфика существования и адаптация / Актуальные проблемы изучения ракообразных континентальных вод: Мат. лекций и докл. Международ. школы-конф. Борок, 2012. С. 316–319.
Леонова Г.А., Богуш А.А., Бобров В.А. Биоиндикация: оценка состояния соляных озер Кулунды (Алтайский, край) по биогеохимическим критериям // Съезд Гидробиологического общества РАН (г. Тольятти, Россия, 18–22 сентября 2006 г.). Т. 1. 2006. С. 44–46.
Радченко Л.А. Влияние гамма-облучения на выживаемость артемии // Радиобиология. 1982. Т. 22. № 3. С. 423–426.
Радченко Л.А. Влияние температуры на пострадиационную выживаемость артемии Artemia salina (L.) // Гидробиол. журн. 1984. Т. 20. № 1. С. 61–65.
Токарев А.Н., Куцель E.H., Попова Т.П. и др. Радиогидрогеологический метод поисков месторождений урана. М.: Недра, 1975. 255 с.
Сборник государственных стандартов. М.: Изд-во стандартов, 1994.
Булатов В.И. Россия радиоактивная. Новосибирск: ЦЭРИС, 1996. 283 с.
Aarkrog A., Baxter M.S., Battercourt A.O. et al. A comparison of doses from 137Cs and 210Po in marine food: A major international study // J. Environ. Radioactiv. 1997. V. 34. № 1. P. 69–90.
Amiro B.D. Radiological dose conversion factors for generic non-human biota used for screening potential ecological impacts // J. Environ. Radioactiv. 1997. V. 35. № 1. P. 37–51.
Sources of radioactivity in the marine environment and their relative contributions to overall dose assessment from marine radioactivity (MARDOS). Technical Document 838. Vienna: IAEA, 1995.
Поликарпов Г.Г., Егоров В.Н., Гулин С.Б. и др. Радиоэкологический отклик Чёрного моря на Чернобыльскую аварию / Под ред. Г.Г. Поликарпова и В.Н. Егорова. Севастополь: ЭКОСИ–Гидрофизика, 2008. 667 с.
Aarkrog A. Input of anthropogenic radionuclides into the World Ocean // Deep Sea Res. Part. II: Top. Studies Oceanogr. 2003. V. 50. № 17. P. 2597–2606.
Егоров В.Н., Поликарпов Г.Г., Кулебакина Л.Г. и др. Модель крупномасштабного загрязнения Черного моря долгоживущими радионуклидами цезием-137 и стронцием-90 в результате аварии на ЧАЭС // Водные ресурсы. 1993. Т. 20. № 3. С. 326–330.
Livingston H., Clarke W., Honjo S. et al. Chernobyl fallout studies in the Black Sea and other oceans areas // Environ. Marine Lab. 1986. № 460. P. 214–223.
Гулин С.Б., Мирзоева Н.Ю., Лазоренко Г.Е. и др. Современная радиологическая ситуация, связанная с режимом функционирования Северо-Крымского канала // Радиац. биология. Радиоэкология. 2016. Т. 56. № 6. С. 647–654.
IAEA – International Atomic Energy Agency. AQCS: Catalogue for reference materials and intercomparison exercises 1998/1999 / International Atomic Energy Agency, Analytical Control Services. Vienna: IAEA, 1998. 64 p.
Chen Q., Dalhgaard H., Nielsen S.P., Aarkrog A. Determination of 210Po and 210Pb in mussel, fish, sediment, petroleum / Deprt. of Nuclear Safety Research and Facilities, Risoe National Laboratory, Denmark. Nov. 1998. P. 23.
Cutshall N.H., Larsen N.L., Olsen C.R. Direct analysis of 210Pb in sediment samples: self-absorption correction // Nucl. Instruments and Methods. 1983. № 206. P. 309–312.
Delfanti R. Gamma spectrometry of marine environmental samples: problems and suggestions. Strategies and Methodologies for Applied Marine Radioactivity Studies. Training Course Ser. № 7. Vienna: IAEA, 1997. P. 263–270.
EPA (Environmental Protection Agency, USA). Radiochemistry Procedures Manual Eastern Environmental Radiation Facility. EPA 520/5–96–006. P.00.03.01–03, 1984. 342 p.
ICRP. Dose coefficients for nonhuman biota environmentally exposed to radiation. ICRP Publication 136 // Ann. ICRP. 2017. V. 46. № 2. 92 p.
US DOE. United States Department of Energy. DOE Standard. A Graded approach for evaluating radiation doses to aquatic and terrestrial biota. № ENVR-0011: Third Printing, 2001. 347 p.
Thomas P., Liber K. An estimation of radiation doses to benthic invertebrates from sediments collected near a Canadian uranium mine // J. Environ. Int. 2001. V. 27. P. 341–353.
Ulanovsky A., Pröhl G. A practical method for assessment of dose coefficients for aquatic biota // Radiat. Environ. Biophys. 2006. V. 45. № 4. P. 203–214.
Ulanovsky A., Pröhl G. Tables of dose coefficients for estimating internal and external radiation exposures to terrestrial and aquatic biota // Radiat. Environ. Biophys. 2008. V. 47. № 2. P. 195–203.
Ulanovsky A., Pröhl G., Gómez-Ros J.M. Methods for calculating dose conversion coefficients for terrestrial and aquatic biota // J. Environ. Radioact. 2008. V. 99. P. 1440–1448.
Kershaw P.J. Pilot study for the update of the MARINA Project on the radiological exposure of the European community from radioactivity in North European marine waters. Final report for the european commission, directorate-general XI “Environment, nuclear safety and civil protection”. 1999. 77 p.
Blaylock B.G., Frank M.I., O’Neal B.R. Methodology for estimating radiation dose rates to freshwater biota exposed to radionuclides in the environment. Report ES/ER/TM–78: Prepared for the U.S. DOE, Contract DE-AC05-84OR21400. Oak Ridge, TN, USA: Oak Ridge National Laboratory, 1993. 40 p.
Kryshev I., Sazykina T., Kryshev A. et al. Ecological dosimetry models. Radionuclides uptake and transfer in pelagic food chains of the Barents Sea and resulting doses to man and biota. Project of NRPA, IMR, AUN, IET (Norway) and SPA TYPHOON (Russia). Norway: NRPA, 2002. 97 p.
Polikarpov G.G. Conceptual model of responses of organisms, populations and ecosystems to all possible dose rates of ionizing radiation in the environment // Radiat. Prot. Dosim. 1998. V. 75. № 1–4. P. 181–185.
Mirzoyeva N.Yu., Egorov V.N., Polikarpov G.G. Distribution and migration of 90Sr in components of the Dnieper River basin and the Black Sea ecosystems after the Chernobyl NPP accident // J. Environ. Radioact. 2013. V. 125. P. 27–35.
Романенко В. Д. Основы гидроэкологии: Учебник для студентов высш. учеб. заведений. К.: Генеза, 2004. 664 с.
Вдовенко В.М., Дубасов Ю.В. Аналитическая химия радия. Л.: Наука, 1973. 192 с.
Коренман И.М. Аналитическая химия калия. М.: Наука, 1964. 255 с.
Heyraud M., Cherry R.D. Polonium-210 and lead-210 in marine food chains // Mar. Biol. 1979. V. 52. № 3. P. 227–236.
Студеникина Т.Л. Особенности биологии рачка Artemia salina в условиях соленых озер // Водоемы Алтайского края. Новосибирск, 1999. С. 112–122.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


