Радиационная биология. Радиоэкология, 2020, T. 60, № 1, стр. 71-81
ИССЛЕДОВАНИЯ ПО НАКОПЛЕНИЮ ТРИТИЯ НЕКОТОРЫМИ ВОДНЫМИ ОРГАНИЗМАМИ: ИКРА и РЫБА (Carassius gibelio), ВОДНЫЕ РАСТЕНИЯ (Ceratophyllum и Lemna)
Л. Г. Бондарева *
Федеральный научный центр гигиены им. Ф.Ф. Эрисмана Роспотребнадзора
Мытищи, Россия
* E-mail: lydiabondareva@gmail.com
Поступила в редакцию 04.01.2019
Аннотация
Проведены длительные исследования по накоплению трития водными организмами: икра, водные растения, рыба, состоящие из трех этапов. В конце первой стадии (25 дней) было выявлено токсическое действие трития (5000 и 50 000 Бк/л) на стадии эмбриогенеза икры карася (Carassius gibelio). Однако дальнейший перевод молоди рыб в условия без трития позволил вырастить физиологически нормальных особей рыб. На втором этапе тритий накапливался в биомассе водных растений Ceratophyllum и Lemna. Было обнаружено, что основное снижение содержания трития наблюдается в течение первых 48 ч после начала эксперимента (до 70%). Когда рыбы потребляли растительную пищу, обогащенную тритием (результат второй стадии эксперимента), было установлено, что до 50% общего накопленного трития находилось в мышечной ткани и 30% в печени рыбы. При этом наибольший вклад в накопление трития оказал холестерин ~30% от общего количества трития, а с учетом эфиров холестерина – 50%.
Тритий (3H) в окружающей среде, поступающий из природных и антропогенных источников, часто используется для оценки воздействия радиации на человека. Как изотоп водорода тритий может легко проникать в различные материалы окружающей среды, содержащие водород. В воде поверхностных водоемов, расположенных вне влияния предприятий ядерно-топливного цикла, концентрация 3H (“фон”) в настоящее время находится в диапазоне от 1 до 4 Бк/л. В компонентах окружающей среды тритий связан с молекулами воды, называемой тритиевой водой (НТО), а также с органическими соединениями в виде органически связанного трития (OСT) [1–5].
Органически связанный тритий, или “органический тритий” – сумма всех атомов трития, связанных с органическими молекулами в биологических организмах. Широко признается, что органический тритий может быть разделен на две фракции [1, 2, 6]: обменная фракция и необменная фракция. Обменный органический тритий связан в соединениях главным образом с атомами кислорода, азота и находится в изотопном равновесии со свободной водой и атмосферной влагой [1, 2]. И наоборот, необменный органический тритий связан с атомами углерода, входящими в состав вещества (некоторые авторы называют эту фракцию “С-связанный тритий”), и таким образом, прочно связан с органической структурой. Он представляет собой интеграцию экологических уровней в периоды роста биологических организмов [1, 2, 6, 7].
Поведение в окружающей среде трития привело к тому, что проникновение трития в биосферу, миграцию, аккумуляцию и ассимиляцию у высших организмов, в том числе и водных, можно в целом описать поведением воды, а также метаболизмом соединений, содержащих тритийорганический углерод. Именно поэтому 3H является биодоступным и свободно аккумулируется в высших организмах. В конечном итоге тритий поступает в организм человека [6, 7].
Независимо от пути поступления тритий равномерно распределяется по органам и тканям. Среди практически важных радионуклидов тритий является примером наименее селективного распределения в живом организме с относительно быстрым накоплением дозы во всех богатых жидкостью частях тела [8–12].
Целью данного исследования было изучение накопления трития в некоторых водных организмах (рыбе), с учетом потенциального воздействия трития на развитие икры и при приеме обогащенной тритием растительной пищи.
МАТЕРИАЛЫ И МЕТОДИКА
В качестве объекта исследований был взят используемый в пищу наиболее распространенный вид рыб – карась серебряный (Carassius gibelio).
Среди основных факторов, повлиявших на выбор данного вида рыб для экспериментов, были следующие:
• хорошие адаптивные свойства карася;
• невысокие требования к качеству внешней среды;
• быстрая адаптация к переменам температуры воды;
• устойчивость этого вида рыб к возможным водным болезням.
В первой части эксперимента изучали влияние трития на эмбриогенез икры карася.
Для проведения экспериментов использовали промышленную оплодотворенную икру карася. Средний диаметр икринок составлял ~1 мм. В каждую модельную систему вносили до 125 г икры. В течение всего эксперимента икра находилась в водопроницаемом контейнере для предотвращения смыва икры в фильтрующее устройство. Объем водной среды в каждом случае составлял 50 л, в которую до внесения икры вносили тритий в виде тритиевой воды (НТО): 500, 5000 и 50 000 Бк/л. В качестве контрольной рассматривалась система, в которую не вносился тритий, за исключением ранее присутствующего, фонового содержания (~4 Бк/л) [13, 14].
В течение всего периода эмбриогенеза (25 дней, при температуре 16.5 ± 2.5°C) модельные системы находились в инкубационных условиях. Через 25 дней воздействия трития с разной активностью часть мальков карася были изъяты из систем с тритием и подвергнуты исследованиям.
Другая часть была помещена в аквариумы с чистой водой для доращивания и использования в следующих экспериментах и питалась чистым кормом.
В период доращивания мальки карася приобрели форму взрослой рыбы, появилась чешуя, т.е. мальки превратились в молодь карася.
На втором этапе эксперимента исследовали накопление трития зелеными водными растениями, которые в последующем были высушены и использовались в качестве добавки к пище рыбам. Экспериментальной средой служила вода, отобранная в р. Енисей. В качестве растений-гидробионтов использовали роголистник и ряску. Ряска выращена в лабораторных условиях, роголистник отобран в р. Енисей, в пункте отбора проб воды. Непосредственно перед экспериментом проводили анализ используемых водных растений для получения исходных данных по содержанию трития, микро- и макрокомпонентов. Вода была предварительно профильтрована через мембранные фильтры с диаметром пор 0.2 мкм.
Стандарт тритиевой воды (Packard Bioscience Ltd) с концентрацией 33 кБк/мл использован для получения экспериментальных сред.
На втором этапе зеленые растения-гидробионты накапливали биомассой тритий, который был внесен в количестве 10 МБк на аквариум объемом 100 л. Удельная активность составила 100 кБк/л. Тритий вносили в виде свободной тритиевой воды – НТО. Масса растений составляла (сырой вес): роголистник – 3000 г, ряски – 3000 г.
Процесс накопления растениями трития сопровождался мониторингом содержания радионуклида в водной и воздушной средах. Пробы воды отбирали из каждого аквариума с середины водного слоя с помощью черпака с длинной ручкой. Объем отобранной пробы воды составлял ~50 мл. Для определения содержания трития в камере использовали предварительно высушенный силикагель, который помещали на оптимальной высоте от уровня водного слоя (~30 см) и по мере необходимости заменяли на свежую порцию силикагеля. Тритий из вынутого силикагеля выделяли в виде поровой жидкости с использованием установки, созданной автором статьи.
Условия проведения эксперимента были следующие – климатическая камера (объемом 1.6 м3, высотой 1.3 м) использовалась для создания рабочих условий. Скорость кондиционирования воздуха была 100 л/мин. Влажность поддерживали на уровне 50–70%. Температура была около 15°C. Освещение поддерживалось двадцатью лампами 58-W Phyton.
Длительность экспериментов по накоплению трития растительной биомассой составляла от 168 ч (для ряски) до 336 ч (для роголистника). Окончание экспериментов фиксировалось по выходу на насыщение линии убыли трития из водной среды плюс период стабилизации систем.
Для изучения изменения прироста площади ряски использовали фотоаппарат SONY-A580 (Япония), делали фотографии и после считали площадь в программе ImageJ.
Для определения длины побегов роголистника использовали канцелярскую линейку.
По окончании второй стадии эксперимента растения с накопленным тритием высушивали при температуре ~45°С.
После высушивания безводные концентраты зеленой массы смешивали с сухим кормом для рыб, состоящим из смеси животных и растительных остатков (1 : 1). Другие компоненты, входящие в корм – кукурузная мука, рыбий жир, соевый протеин, соевое масло, витамины, минералы и др. Смесь формовали в гранулы массой 0.3 г и хранили в герметичной упаковке до полного использования в эксперименте. Содержание трития в каждой грануле составляло ~50 Бк. Гранулы не были гомогенизированы. Тритийсодержащие гранулы служили в качестве ежедневной добавки к рациону.
На третьем этапе эксперимента в аквариумы со свежеотфильтрованной водой помещали наиболее здоровую молодь исследуемого вида рыб (после первого этапа эксперимента из системы с внесением 50 000 Бк/л трития) – по 10 особей в каждый аквариум. Большее количество рыб было не целесообразно из-за стесненных условий проводимых экспериментов.
На этом этапе молодь карася кормили пищей, в состав которой были включены растения с накопленным тритием: в одном аквариуме использовали в качестве добавки ряску, во втором – роголистник. Третий аквариум служил в качестве контроля.
Ежедневно скармливали рыбам в каждом аквариуме 600 Бк трития. Максимальное внесенное количество трития за 550 сут составило 330 кБк на особь.
Продолжительность третьей части эксперимента составляла 550 сут с промежуточным отбором из каждого аквариума по пять особей через 250 сут. Общая длительность третьей стадии эксперимента была выбрана с учетом того, что тритий, находящийся в необменной форме, имеет период полувыведения около 500 сут [1, 2, 8] плюс еще 50 сут, а интервал 250 сут был выбран как 1/2 от 500 сут.
Несмотря на то что количество особей карася в опытных системах через 250 сут уменьшилось, рацион оставшихся рыб никак не изменился, т.е. на каждого карася приходилось по 600 Бк трития в корме.
На каждом этапе рыб вынимали из воды и аккуратно высушивали бумажными полотенцами, но не промывали. После этого каждая особь была измерена и взвешена.
Во всех случаях проводилось препарирование всех рыб на фрагменты: чешуя, кожа с плавниками, жабры, скелет вместе с головой, мышечная масса, кишечник со всем содержимым, желудок со всем содержимым.
Мышечная масса каждой особи была взвешена и разделена на три части: из одной части определяли содержание общего трития, вторую использовали для определения содержания трития, связанного с липидами. Третью часть использовали для определения содержания трития, связанного с протеинами.
Особи, находившиеся в контрольной системе, анализировались на общее содержание липидов, золы, видов и массы белков. Данные исследования проводили в соответствии с рекомендациями, разработанными для анализа рыб [8, 10, 11], а полученные результаты использовали для расчетов доли распределения трития по составным частям и соблюдения баланса по основным компонентам исследуемого организма. В составных частях экспериментальных особей определяли содержание органически связанного трития с последующей интерпретацией данных. Данный подход достаточно широко распространен в радиобиологических исследованиях ввиду сложностей детектирования трития в биологическом материале [8, 10, 11].
Особое внимание уделялось печени, которая предварительно была очищена от всех сосудов. В печени контрольных образцов определяли содержание общих липидов, белка, фосфолипидов, холестерина, триацилглицерина [15]. Полученные данные использовали при оценке вклада каждой составляющей в связывании трития.
Перед измерением пробы воды (из аквариума и выделенной из силикагеля) фильтровали через ацетат-целлюлозный фильтр с диаметром пор 0.22 мкм. Определение содержания трития в воде проводили с использованием традиционной методики [16–18].
Определение трития в образцах рыбы и ее органах
Для определения трития в твердых образцах необходимо перевести исследуемые объекты в жидкое состояние. Для этого использовали около 15 г сырого веса водных растений или рыбы (определение содержания общего трития). Каждую навеску помещали в круглодонную колбу, смешивая с толуолом в соотношении 1 : 10, и подвергали отгонке азеотропной смеси. Отгонка продолжалась в течение 4 ч при температуре ~70°С на установке, созданной Л.Г. Бондаревой.
После выделения жидкой фракции из исследуемых объектов аликвоту смешивали со сцинтилляционным коктейлем, либо, при необходимости, подвергали дистилляции с KMnO4 для устранения опалесценции и окраски растворов [18–20]. После дистилляции также отбирали аликвоту и смешивали с коктейлем.
Содержание трития в образце рассчитывали согласно следующим рекомендациям [21, 22]:
где: c – содержание трития в образце (Бк/л); R – скорость счета в образце в секунду; R0 – скорость счета фонового образца в секунду; ε – эффективность счета; V – объем образца в виале, л; λ – константа распада, λ = 0.05576; Δt – интервал времени между получением образца и его измерением, год.Метод измерения содержания трития
Содержание трития в водных средах определяли методом жидкостно-сцинтилляционной спектрометрии [18–20]. Предел обнаружения составлял ≤1 Бк/л [20].
В качестве стандарта использовали тритиевую воду с сертифицированным содержанием радионуклида – 0.1 Бк/л. Перед измерениями в чистые виалы наливали сцинтилляционный коктейль (V ~ 10 мл). Охлаждали до заданной температуры в отсутствие света. Затем пипеткой отбирали необходимый объем исследуемого образца (V ~ 10 мл) и вводили в виалу. Виалу закрывали пробкой и встряхивали до полного смешивания пробы со сцинтилляционным коктейлем. Перед измерениями смесь выдерживали в темном и прохладном месте (t = +7°C ± 1°C) в течение 24 ч для стабилизации люминесценции [5].
Стандартные и фоновые пробы готовили одновременно с основными пробами, чтобы свести к минимуму ошибку измерения. Время измерения исследуемых проб составляло 8–24 ч.
Содержание трития в исследуемых пробах измеряли с использованием жидкостно-сцинтилляционного спектрометра Quantuluse-1220, США (Центр коллективного пользования Красноярского научного центра СО РАН).
Фоновые значения содержания трития в воде определены в интервале 0.926–1.002 CPM, эффективность счета рассчитана согласно стандартному методу [23] и составила 25.37–26.10%.
Статистические расчеты
Статистическую обработку результатов количественного, химического, биологического и токсикологического анализов проводили с использованием методов кластерного, факторного и регрессионного анализа с помощью программного продукта STATISTICA 6.0 [24]. Анализ проводили после проверки нормальности распределения, данные с большими разбросами относительно среднего нормализовали по формуле $Z = \frac{{X - \mu }}{\sigma }$, где X – нормируемая величина, μ – среднее арифметическое распределения, σ – стандартное отклонение распределения. Достоверность полученных результатов оценивали с использованием коэффициента Стьюдента (р < < 0.05) [24].
РЕЗУЛЬТАТЫ
В табл. 1 приведены химический состав и физические показатели воды, используемой в настоящих исследованиях.
Таблица 1.
Химический состав и физические показатели воды Table 1. Chemical and physical parameters of water
| Химический состав воды | |||||
|---|---|---|---|---|---|
| элемент | содержание | элемент | содержание | элемент | содержание |
| мг/л | |||||
| С | 46 ± 3 | Na | 4.0 ± 0.2 | Mg | 2.1 ± 0.1 |
| Si | 8.0 ± 0.4 | S | 4.2 ± 0.2 | Fe | 2.8 ± 0.2 |
| Cl | 3.3 ± 0.2 | Ca | 1.9 ± 0.1 | Al | 6.2 ± 0.3 |
| мкг/л | |||||
| P | 460 ± 23 | Cu | 1.10 ± 0.05 | V | 5.0 ± 0.3 |
| K | 190 ± 8 | Zn | 16 ± 1 | Sr | 460 ± 20 |
| нг/л | |||||
| Cd | 180 ± 6 | Bi | 7.8 ± 0.4 | Th | 4.6 ± 0.2 |
| U | 160 ± 8 | ||||
| Бк/л | |||||
| 3H | 4 ± 2 | 90Sr+90Y | 0.217 ± 0.098 | 212Pb | 0.165 ± 0.091 |
| 214Bi | 0.262 ± 0.052 | 214Pb | 0.27 ± 0.09 | 234Th | 0.63 ± 0.42 |
| Физические показатели воды | |||||
| рН | 7.6 | Температура, °С | ~7 | минерализация | 0.08 г/л |
В экспериментах также контролировались следующие параметры воды: растворенный кислород, температура, рН, электропроводность, содержание ${\text{NO}}_{2}^{ - }$, ${\text{N}}{{{\text{H}}}_{{\text{3}}}}{\text{/NH}}_{4}^{ + }$, ${\text{NO}}_{3}^{ - }$.
1. Изучение влияния трития на развитие икры
Эмбриональный период развития – это не только выход зародыша из оболочки, он также включает в себя период в течение некоторого времени после выклева, пока предличинка, обладая еще рядом эмбриональных особенностей строения органов дыхания, кровообращения и пищеварения, проходит заключительные этапы эмбрионального развития. По окончании первого этапа в каждой экспериментальной системе рассчитывали количество погибшей икры, количество мальков с аномалиями в развитии и количество мальков с развитием, близким к физиологическому. Результаты приведены в табл. 2.
Таблица 2.
Эффект действия тритиевой воды на развитие икры, через 25 дней после начала эксперимента Table 2. The effect of tritium water on the development of eggs, 25 days after the start of the experiment
| Удельная активность трития, Бк/л | Количество икринок, шт. | Количество погибших икринок, шт. (%) | Количество икринок с аномальным развитием, шт. (%) |
|---|---|---|---|
| Контроль | 3500 ± 150 | 280 ± 20 (9) | 250 ± 15 (7) |
| 500 | 7600 ± 200 | 850 ± 15 (11) | 750 ± 20 (10) |
| 5000 | 3500 ± 100 | 700 ± 10 (20) | 1100 ± 100 (30) |
| 50000 | 4400 ± 200 | 950 ± 30 (20) | 1400 ± 50 (30) |
По истечению 25 сут и появлению основной масcы мальков часть их подвергалась исследованиям (взвешивание, определение длины и пр.).
По результатам оценки внешних признаков, на уровне воздействия трития, примерно равному (5000 Бк/л) или превышающего (в 6.5 раз) уровень вмешательства (7700 Бк/л), явный радиационный эффект проявляется только на стадии развития икры. При этом доля погибших икринок и мальков с аномальным развитием в системах с 5000 Бк/л и 50 000 Бк/л сопоставима.
Большая часть мальков из варианта с внесением 50 000 Бк/л была помещена в чистую среду (чистая вода, чистый корм), где оставалась для подращивания и последующего использования. Мальки из модельных систем с внесением 500 и 5000 Бк/л в дальнейших исследованиях не использовали.
В табл. 3 приведены результаты изменения длины мальков в условиях доращивания в чистой воде, где в качестве пищи использовали чистый корм. В таких условиях мальки находились в течение 150 дней, до начала проведения третьего этапа эксперимента.
Таблица 3.
Длина мальков рыбы разного возраста Table 3. The length of young fish in deferent age
| Модельная система | Возраст мальков, сут | Количество, шт. | Длина, мм | |
|---|---|---|---|---|
| средняя (разница по отношению к контролю, %) | диапазон | |||
| Контроль | 35 | 800 ± 50 | 17 ± 1 | 16.8–17.4 |
| 50 000 Бк/л | 850 ± 50 | 18 ± 1 | 17.6–18.1 | |
| (1.1 ± 0.2%) | ||||
| Контроль | 76 | 500 ± 50 | 28.3 ± 2.8 | 27.8–28.9 |
| 50 000 Бк/л | 500 ± 50 | 28.4 ± 2.4 | 28.0–28.9 | |
| (0.4 ± 0.1%) | ||||
| Контроль | 125 | 210 ± 30 | 65.7 ± 6.6 | 65.0–67.0 |
| 50 000 Бк/л | 210 ± 30 | 70.6 ± 6.7 | 69.6–77.5 | |
| (9.7 ± 0.3%) | ||||
| Контроль | 150 | 75 ± 15 | 80.3 ± 8.6 | 88.3–92.2 |
| 50 000 Бк/л | 100 ± 15 | 81.7 ± 7.9 | 70.1–93.3 | |
| (2.2 ± 0.2%) | ||||
Как видно из результатов, представленных в табл. 3, максимальная разница длины выявлена только у мальков на 125-е сут (9.7%), однако на 150-е сут эта разница уменьшилась в несколько раз. Длина мальков из опытной системы отличалась от мальков контрольной системы в пределах погрешности.
Так как молодь рыбы после 150 сут. доращивания использовалась в третьей стадии эксперимента, морфологические параметры изучали на ограниченном количестве рыб. Отобранные образцы молоди использовали в том числе и при определении химического состава.
2. Накопление трития водными растениями
На рис. 1 приведена динамика убыли трития в воде на этапе накопления трития исследуемыми гидробионтами и содержание трития в атмосфере климатической камеры.
Рис. 1.
Динамика изменения содержания трития в воде экспериментальных систем (1) и в воздухе климатической камеры (2): а – с роголистником, б – с ряской.
Fig. 1. Dynamics of changes in the tritium content in the water of the experimental systems (1) and in the air of the climate chamber (2): a – with Ceratophyllum, b – with Lemna.
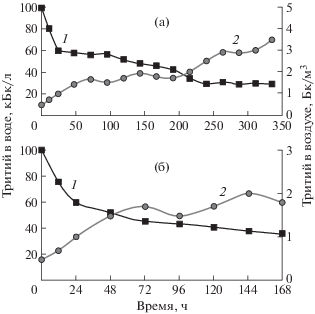
Как можно заметить, основная убыль трития наблюдалась первые 48 ч от начала эксперимента, затем проходил добор радионуклида биомассой. Общая убыль трития составила от 60 до 70% от исходной активности для ряски и роголистника соответственно.
Условия проведения экспериментов были выбраны оптимальными, следствием чего было минимальное испарение с поверхности аквариумов, на это указывают показатели гигрометра, которые варьировали в диапазоне погрешности, установленной для данного вида оборудования. Влажность в течение всего времени экспериментов не превышала 70%. На оптимальность выбранных условий окружающей среды в климатической камере указывает отсутствие резких перепадов определяемых содержаний трития в воздухе камер (кривые 2, рис. 1).
В табл. 4 приведены результаты определения морфологических показателей биомассы исследуемых растений и распределение трития в виде свободной тритиевой воды и ОСТ.
Таблица 4.
Динамика изменения морфологических параметров биомассы исследуемых растений и распределения трития по формам нахождения Table 4. Dynamics of changes in the morphological parameters of the studied aquatic plants and the distribution of tritium in the forms of location
| Вариант опыта | Длина, см/площадь, см2 | Масса, г (сырой вес) | Содержание трития, кБк/кг сырого веса (%) | |||||
|---|---|---|---|---|---|---|---|---|
| НТО | OBT | |||||||
| Роголистник (n = 10) | ||||||||
| Контр. | 0 ч | 336 ч | 0 ч | 336 ч | 0 ч | 336 ч | 0 ч | 336 ч |
| (5 ± 1)/–* | (8 ± 2)/–* | 2.5 ± 0.6 | 5.7 ± 0.5 | (1.0 ± 0.2) × × 10–3 (100) | (1.0 ± 0.3) × × 10–3 (100) | <МДА** | <МДА | |
| Эксп. | (5 ± 1)/– | (10 ± 1)/– | 2.5 ± 0.7 | 8.4 ± 0.8 | (1.0 ± 0.2) × × 10–3 (100) | 22 ± 1 (79) | <МДА | 6 ± 1 (21) |
| Ряска (n = 50) | ||||||||
| Контр. | 0 ч | 168 ч | 0 ч | 168 ч | 0 ч | 168 ч | 0 ч | 168 ч |
| –/(0.10 ± 0.06) | –/(0.18 ± 0.07 | 0.12 ± 0.05 | 0.17 ± 0.05 | (0.9 ± 0.5) × × 10–3 (100) | (0.8 ± 0.6) × × 10–3 (100) | <МДА | <МДА | |
| Эксп. | –/(0.11 ± 0.07) | –/(0.25 ± 0.05) | 0.12 ± 0.06 | 0.21 ± 0.03 | (0.9 ± 0.5) × × 10–3 (100) | 17 ± 1 (81) | <МДА | 4 ± 1 (19) |
Из представленных результатов видно, что доля трития в виде OСT в биомассе растений составила 19–21% от общего содержания трития, которое накопилось в ходе экспериментов (табл. 4).
При этом внешний вид и морфология практически всех растений были удовлетворительны, наблюдался заметный прирост биомассы (табл. 4).
3. Накопление трития в системе водные растения–рыба
Перед началом третьего этапа исследований было проведено определение концентрации ряда химических элементов и трития в биомассе рыб. Результаты приведены в табл. 5.
Таблица 5.
Результаты анализа исходных образцов рыб (n = 70) Table 5. Results analysis of initial samples of fish
| Радионуклиды | Содержание | ||||
|---|---|---|---|---|---|
| 3H | <MДА | ||||
| мг/кг сырого веса | |||||
| элемент | содержание | элемент | содержание | элемент | содержание |
| Na | 73 ± 3 | Mn | 2 ± 1 | Cu | 0.8 ± 0.2 |
| K | 54 ± 4 | P | 14 ± 2 | Cl | 10 ± 1 |
| C | 46 ± 5 | S | 15 ± 3 | Ca | 14 ± 1 |
| Fe | 11 ± 2 | Si | 27 ± 4 | Mg | 7 ± 2 |
В табл. 6 представлены данные изменения морфологических параметров исследуемых рыб при проведении третьей стадии исследований.
Таблица 6.
Изменение морфологических параметров исследуемых особей карася (n = 5) в контрольной и опытных системах Table 6. Changes in the morphological parameters of the fish samples in control and test systems
| Параметры | Исходные | 250-е сутки | 550-е сутки |
|---|---|---|---|
| контроль | |||
| Масса, г | 120 ± 17 | 500 ± 55 | 800 ± 110 |
| Длина, см | 17 ± 3 | 35 ± 5 | 60 ± 6 |
| Опыт: ряска/роголистник | |||
| Масса, г | 121 ± 16/122 ± 15 | 508 ± 60/504 ± 55 | 805 ± 110/802 ± 108 |
| Длина, см | 16 ± 2/17 ± 2 | 34 ± 5/37 ± 6 | 61 ± 5/63 ± 6 |
Из представленных результатов можно заметить, что рыбы развивались достаточно хорошо. Это видно по увеличению массы и длины особей (табл. 6). При этом вес и длина рыб в контрольной и опытных системах были сопоставимы, т.е. варьировались в пределах погрешности.
В связи с тем, что условия содержания рыб были более благоприятными (достаточное количество пищи, оптимальный режим освещения и температуры, циркуляция воды в аквариумах) по сравнению с естественными, наблюдался достаточно быстрый набор веса [25].
ОБСУЖДЕНИЕ
Известно, что потребление рыбной продукции возрастает во всем мире. Количество и качество этого продукта зависят от вида рыбы, а также от природы ее происхождения (выращенная в естественных или в искусственных условиях). В количественном соотношении содержание мышечной ткани каждой особи варьирует в пределах 40–50% от общей массы рыбы. Следовательно, при потреблении рыбы человеком основной дозообразующей частью является, главным образом, мышечная ткань.
В соответствии с этим нами были проведены исследования по связыванию трития именно с этой частью рыб (табл. 7), а также была определена доля трития, связанного с печенью.
Таблица 7.
Уровни накопления трития мышечной тканью и печенью рыбы и суммарное содержание трития в рыбе Table 7. The levels of accumulation of tritium by muscle tissue and liver of fish and the total tritium content of the whole fish
| Фрагмент рыбы | Удельная активность, кБк/кг (%) | |||
|---|---|---|---|---|
| вариант с роголистником (n = 5) | вариант с ряской (n = 5) | |||
| 0 ч | 550 сут | 0 ч | 550 сут | |
| Вся рыба | <МДА | 7.8 ± 1.1 | <МДА | 8.4 ± 0.9 |
| Мышечная ткань (доля от всего содержания в рыбе, %) | <МДА | 4.2 ± 0.7 | <МДА | 4.7 ± 0.7 |
| (54 ± 5) | (56 ± 2) | |||
| Печень | <МДА | 2.7 ± 0.9 | <МДА | 3.0 ± 0.8 |
| (34 ± 3) | (36 ± 5) | |||
Как видно из представленных результатов, мышечная ткань накапливает большую долю трития, поглощенного всей рыбой (до 56%), при этом доля накопленного трития не зависит от пищи, которая употреблялась рыбой. В обоих случаях с печенью было связано около 35% от всего накопленного рыбой трития.
В табл. 8 приведены данные по содержанию воды, общих липидов, белков и их фракций в печени рыб в конце всего эксперимента.
Таблица 8.
Пределы биохимических показателей печени у образцов рыб (n = 5) Table 8. The limits of biochemical parameters of the liver in fish samples (n = 5)
| № | Показатели | % |
|---|---|---|
| % от сырой массы ткани, (5 ± 1) г | ||
| 1 | Общие липиды | 16–18 |
| 2 | Белок | 10–12 |
| 3 | Вода | 70 |
| % от сухой массы, (1.5 ± 0.2) г | ||
| 4 | Фосфолипиды | 12–13 |
| 5 | Холестерин | 11–15 |
| 6 | Триацилглицерины | 25–27 |
| 7 | Эфиры холестерина | 43–45 |
Полученные результаты указывают на незначимый разброс показателей в выделенных фракциях липидов и белка. В связи с этим оценку вклада каждой из выделенных фракций печени на накопление трития проводили по усредненному показателю (табл. 9).
Таблица 9.
Содержание трития в составных частях печени рыб, Бк/г (% к общему содержанию трития в печени), (n = 5) Table 9. Determination of tritium content in fish liver components, Bq /g (% of total tritium content in the liver).
| Опыты с ряской | Опыты с роголистником | |
|---|---|---|
| Сырая масса, Бк/г (%) | ||
| Вода | 0.022 ± 0.003 | 0.022 ± 0.002 |
| (3) | (3) | |
| Общие липиды | 0.303 ± 0.007 | 0.294 ± 0.008 |
| (39) | (39) | |
| Общие белки | 0.146 ± 0.006 | 0.136 ± 0.007 |
| (19) | (18) | |
| Сухая масса, Бк/г (%) | ||
| Фосфолипиды | 0.104 ± 0.009 | 0.106 ± 0.008 |
| (7.8) | (7.5) | |
| Холестерин | 0.398 ± 0.005 | 0.411 ± 0.008 |
| (30) | (29) | |
| Триалглицерины | 0.261 ± 0.015 | 0.286 ± 0.014 |
| (19.5) | (20.7) | |
| Эфиры холестерина | 0.274 ± 0.010 | 0.300 ± 0.011 |
| (20) | (21) | |
Представленные результаты свидетельствуют о том, что тритий накапливается в печени, преимущественно связываясь жировыми тканями, в состав которых входят липиды (~39%). Чуть меньше трития связано с белками (~19%). Меньше всего трития находится в виде свободной воды (~3% от всего содержания трития в печени).
Неучтенное содержание трития, накопленное печенью, связано с неидентифицированными веществами, входящими в состав печени.
Печень является самым крупным из паренхиматозных органов. Она выполняет ряд функций:
1) принимает и распределяет вещества, поступившие в организм из пищеварительного тракта, которые приносятся с кровью. Эти вещества проникают в гепатоциты, подвергаются химическим превращениям и в виде промежуточных или конечных метаболитов поступают в кровь и разносятся в другие органы и ткани;
2) служит местом образования желчи;
3) синтезирует вещества, которые используются в других тканях;
4) инактивирует экзогенные и эндогенные вещества, а также гормоны.
Такое разнообразие функций обусловлено особенностями строения печени и ее отдельных клеток.
Печень имеет очень высокий уровень метаболической активности. В печени реэстерифицируются липиды пищи, откуда они разносятся кровью в другие ткани и жировые депо, а мобилизующие из депо липиды вновь переносятся в печень – основное место их окисления и синтеза [26, 27]. Был выявлен рост уровня трития в мышечной массе рыб, связанного с липидами, до 39% от содержания трития всей рыбы, и больший вклад липидов, входящих в состав печени, в накопление трития (~39% от общего содержания трития в печени).
Количество фосфолипидов в тканях, по сравнению с другими фракциями, в меньшей степени связано с физиологическим состоянием рыб. Оно не зависит от особенностей питания [26, 27]. Поскольку условия содержания всех рыб было одинаковым, то и содержание фосфолипидов имеет низкую вариативность, что влияет и на долю связывания трития этой фракцией, максимум которой составил 7.9%.
Использование холестерина в процессах биосинтеза, а также в регуляции мембран является причиной пристального внимания к оценкам доли связывания трития. В проведенных экспериментах был выявлен наибольший вклад в накопление трития именно холестерином (~30%). С учетом эфиров холестерина доля связывания трития достигает 50% (в пересчете на сухую массу) от всего накопленного печенью трития.
В период интенсивного накопления веса липиды запасаются в депо в виде триацилглицеринов. В связи с тем, что рацион питания и режим содержания особей рыб не менялись в течение всего срока проведения эксперимента, то и содержание триацилглицеринов увеличивалось. На это указывает общий прирост массы мышечной ткани рыб, особенно увеличение содержания липидов. Эта закономерность была перенесена и на исследуемый орган – печень. Следовательно, увеличение содержания трития в триацилглицерине имеет прямую зависимость от содержания липидов в печени. Увеличение доли необменного органически связанного трития как в печени, так и во всем организме в целом увеличивает радиотоксичность трития по сравнению со свободной тритиевой водой.
Важную роль в физико-химических процессах, сопровождающих распад трития, играет перераспределение электронной плотности в среде. Атом трития при распаде излучает β-частицу, кроме того образуется 3He, который и химически, и физически отличается от атома водорода. Частица 3He чрезвычайно активна и склонна к акцептированию электрона из окружающей среды (например, ближайшей органической молекулы) с образованием устойчивой оболочки инертного газа. При этом инициируются катион-радикалы различной активности. Таким образом, продукты бета-распада трития способны запускать (или активировать) цепи переноса заряда/электрона в биохимических процессах. 3He, образованный вместо включенного нуклида водорода, создает ситуацию, когда электрон-нейтральная биологическая макромолекула приобретает положительный заряд. Это приводит к увеличению ее химической активности, последствия которой могут быть неконтролируемыми и, чаще всего, очень негативными. Примером такого процесса являются трансмутационные генетические эффекты у живых организмов [28–30].
Таким образом, проведенные исследования, на примере распространенного вида пресноводных рыб (карася серебряного Carassius gibelio), показали важность изучения поведения трития в живых организмах.
ЗАКЛЮЧЕНИЕ
По результатам проведенных долгосрочных модельных экспериментов по накоплению трития некоторыми водными организмами – икра и рыба карася серебряного (Carassius gibelio), водные растения – Ceratophyllum и Lemna, получено следующее:
1. Набольший эффект, связанный со смертностью икры Carassius gibelio и аномальным развитием мальков, проявляется в системах, содержащих тритий в концентрациях 5000 и 50 000 Бк/л. Для концентрации 500 Бк/л трития видимый эффект не выявлен, так как данные сопоставимы с результатами, полученными для контрольной системы.
2. При доращивании мальков, после воздействия водной среды, содержащей 50000 Бк/ л трития, в чистой системе, длина и вес молоди карася сопоставимы с образцами из контрольной системы.
3. Накопление трития водными растениями Ceratophyllum и Lemna происходит в течение первых 48 час. от внесения растений в модельную систему. По окончанию эксперимента высушенная биомасса использовалась как наполнитель корма для рыб.
4. При употреблении обогащенной тритием растительной пищи выявлено, что при хроническом поступлении трития в течение 550 сут. основное количество накопленного трития обнаружено в мышечной ткани рыб (~55%) и печени (~35%). При этом до 39% от накопленного печенью трития связано с жировой тканью печени.
Список литературы
EPA 680\4-74-001. Accumulation of tritium in various species of fish reared in tritiated water. Program Element 1HA325. 20 p.
Fecundity and Fertility. Proc. Workshop on Tritium Radiobiology and Health Physics. Oct 1981 / Eds Ma-tsudaira et al. (NIRS-M-41. Chiba 260, Japan). P. 207–220.
Effects of Ionizing Radiation on Aquatic Organisms. NCRP Report № 109. Bethesda, Maryland, USA, 1991. 115 p.
Effects of radiation on the environment. UNSCEAR 2008 Report to the General Assembly with Scientific Annexes. V. II. Scientific Annex E. Effect of ionizing radiation on non-human biota. New York: United Nations, 2011. 164 p.
NCRP. Tritium in the Environment. National Council on Radiation Protection and Measurements, Report № 109. Washington, DC. 1979. 62 p.
Иваницкая М.В., Малофеева А.И. Источники поступления трития в окружающую среду // Тритий – это опасно. Челябинск, 2001. С. 22–29. [Ivanitskaya M.V., Malofeeva A.I. Sources of tritium in the environment // Tritium is dangerous. Chelyabinsk, 2001. P. 22–29. (In Russian)]
Дозиметрический и радиометрический контроль при работе с радиоактивными веществами и источниками ионизирующих излучений: метод. руководство: В 2 т. / Под общей ред. В.И. Гришмановского. Т. 2: Индивидуальный контроль: Радиометрия проб. М.: Энергоиздат, 1980. 204 с. [Dosimetric and radiometric control when working with radioactive substances and sources of ionizing radiation: method. guide: in 2 t. / Under the general ed. I.V. Grishmanovsky. M.: Energoizdat, 1980. V. 2: Individual control: Radiometry of samples. 204 p. (In Russian)]
Melintescu A., Galeriu D. Dynamic model for tritium transfer in an aquatic food chain // Radiat. Environ. Biophys. 2011. V. 50. P. 459–473.
ISO/DIS 20079. Water quality – Determination of the toxic effect of water constituents and waste water to duckweed (Lemna minor) – Duckweed growth inhibition test. Reference number ISO 20079:2005(E).
Galeriu D. Tritium. Radionuclides in the Environment / Ed. D.A. Atwood. West Sussex, England: John Wiley& Sons Ltd., 2010. P. 47–65.
McCubbin D., Leonard K.S., Bailey T.A. et al. Incorporation of organic tritium (3H) by marine organisms and sediment in the severn estuary / Bristol channel (UK) // Mar. Pollut. Bull. 2001. V. 42. № 10. P. 852–863.
Murphy C.E. Tritium transport and cycling in the environment // Health Phys. 1993. V. 65. P. 6683–6697.
Bondareva L., Schultz M.K. Investigation of the tritium content in surface water, bottom sediments (zoobenthos), macrophytes, and fish in the mid-stream region of the Yenisei River (Siberia, Russia) // Environ. Sci. Pollut. Res. Int. 2015. V. 22. № 2. P. 18127–18136.
Bondareva L. Tritium in the freshwater ecosystem of the Yenisei River: behavior, accumulation, and transformation // Tritium: Advance in Research and Application / Ed. Jankovic. New York: Nova Science Publishers, Inc., 2018. pp. 47–98.
Практикум по биохимии: Учеб. пособие / Под ред. С.Е. Северина, Г.А. Соловьевой. 2-е изд., перераб. и доп. М.: Изд-во МГУ, 1989. 509 с. [Workshop on biochemistry: Studies. Allowance / Ed. S.E. Severin, G.A. Solovieva. M.: Publishing House of Moscow State University, 1989. 509 р. (In Russian)]
UNSCEAR Document A/AC.82/R.360: Contamination from Nuclear Explosions, UNSCEAR, March 1979.
The Tritium Systems Test Assembly at the Los Alamos National Laboratory, Los Alamos National Security, Benefits LANL, NNSA & National Security, DOE, 2002. 36 p.
Tritium measurement techniques: Recommendations of the National Council on Radiation Protection and Measurements (NCRP report; no. 47) Paperback – 1976. 99 p.
Bondareva L. Natural occurrence of tritium in the ecosystem of the Yenisei River // Fus. Sci. Technol. 2011. V. 4. P. 1304–1307.
Pointurier F., Baglan N., Alanic G. A method for the determination of low-level organic-bound tritium activities in environmental samples // Appl. Radiat. Isotop. 2004. V. 61. Issues 2–3. P. 293–298.
NCRP. Tritium in the Environment. National Council on Radiation Protection and Measurements. Report № 62. Bethesda MD US, 1979. 24 p.
NCRP Tritium and Other Radionuclide Labelled Organic Compounds Incorporated in Genetic Material. National Council on Radiation Protection and Measurements. Report №63. Bethesda MD US, 1979. 31 p.
ISO 9698: 2010. Water quality – Determination of tritium activity concentration – Liquid scintillation counting method. 24 p.
Боровиков В.П. STATISTICA. Искусство анализа данных на компьютере: Для профессионалов. СПб.: Питер, 2003. 688 с. [Borovikov V.P. STATISTICA. The art of analyzing data on a computer: For professionals. St. Petersburg: Piter, 2003, 688 p. (In Russian)]
Привезенцев Ю.А., Власов В.А. Рыбоводство. М.: Мир, 2004. 456 с. [Privezentsev Yu. A., Vlasov V. A. Fish breeding. M.: Mir, 2004. 456 p. (In Russian)]
Baumgartner F. Theoretical Foundation and Experimental Proof of the Accumulating Transfer of Tritium from Water into DNA and other Biomolecules in vitro and in vivo // Radiat. Biol. Radiol. 2002. V. 40. № 5. P 495–499.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. Учебник / Под ред. акад. АМН СССР Дебова С.С. 2-е изд., перераб. и доп. М.: Медицина, 1990. 528 с. [Berezov T. T., Korovkin B. F. Biological chemistry. Textbook / Ed. Acad. USSR Acad. of Medical Sciences Debov S.S. 2nd ed. M.: Medicine, 1990. 528 p. (In Russian)]
Ueno A.M. et al. Cell killing and mutation to 6-thioguanine resistance after exposure to tritiated amino acids and tritiated thymidine in cultured mammalian cells // Tritium Radiobiology and Health Physics / Ed. S. Okada. Proceedings of Third Japan-US Workshop, Kyoto, Japan, 1988. IPPJ-REV-3.
Tano S. Effects of low dose tritiated water and tritium labelled compounds on the induction of somatic mutations in Tradescantia // Radiat. Prot. Dos. 1986. V. 16. № 1–2. P. 141–144.
Hyodo-Taguchi Y. Tritium effects on the gonads of aquarium fish, Oryzias latipes. 1. Fecundity and fertility. Proc. Workshop on Tritium Radiobiology and Health Physics. Oct 1981 / Eds Matsudaira et al. (NIRS-M- 41. Chiba 260, Japan). 1985. P. 207–220.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


