Радиационная биология. Радиоэкология, 2020, T. 60, № 1, стр. 51-62
РОЛЬ ТИПОЛОГИЧЕСКИХ ОСОБЕННОСТЕЙ ВЫСШЕЙ НЕРВНОЙ ДЕЯТЕЛЬНОСТИ КРЫС В НЕЙРОБИОЛОГИЧЕСКИХ ЭФФЕКТАХ КОМБИНИРОВАННОГО ДЕЙСТВИЯ АНТИОРТОСТАТИЧЕСКОГО ВЫВЕШИВАНИЯ, γ-ИЗЛУЧЕНИЯ, ПРОТОНОВ И ИОНОВ УГЛЕРОДА 12С
А. С. Штемберг 1, *, А. А. Перевезенцев 1, К. Б. Лебедева-Георгиевская 1, О. В. Митрофанова 1, В. С. Кудрин 1, А. С. Базян 1, 2
1 Институт медико-биологических проблем РАН
Москва, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: andrei_shtemberg@mail.ru
Поступила в редакцию 24.01.2019
Аннотация
Эксперименты по изучению влияния типологических особенностей высшей нервной деятельности (ВНД) экспериментальных животных на нейробиологические эффекты (поведение и его нейрохимические механизмы) комбинированного воздействия 10-суточного антиортостатического вывешивания (АнОВ), γ-облучения, облучения ионами углерода 12С и высокоэнергетическими протонами продемонстрировали, что вклад облучения ионами углерода 12С приводит к более глубоким нарушениям соотношения ориентировочно-исследовательской активности и пассивно-оборонительного поведения и тревожности по сравнению с облучением протонами, наиболее выраженным у крыс возбудимого, тревожного, эмоционального типа. В эксперименте с облучением протонами различия между типологическими группами оказались более сглаженными, однако по ряду показателей пассивно-оборонительные компоненты поведения и тревожность у крыс экспериментальных групп также были повышены. Данные изменения сопровождались снижением обмена моноаминов преимущественно в префронтальной коре.
Исследование эффектов воздействия космической радиации на функции центральной нервной системы (ЦНС) приобретает особенную актуальность в последнее время в связи с планированием и подготовкой дальних длительных космических экспедиций (в частности, Марсианской миссии). В таких экспедициях, связанных с выходом корабля за пределы магнитосферы Земли, одним из основных лимитирующих возможность их осуществления факторов становится радиационный, который, в сочетании с другими факторами космического полета, может привести к нарушениям функций ЦНС, лежащих в основе операторской деятельности космонавтов. При этом основную опасность представляют галактические космические лучи – протоны высоких энергий и тяжелые ионы, обладающие энергиями в широком диапазоне, вплоть до сверхвысоких энергий порядка 1020 МэВ [1].
Одной из ключевых, и в то же время наименее изученных проблем является комбинированное действие ионизирующих излучений и нерадиационных факторов космического полета, важнейшим из которых является гипогравитация [2, 3]. Общепринятой моделью гипогравитации для мелких лабораторных животных является антиортостатическое вывешивание (АнОВ) [2, 4]. В предыдущих наших работах были изучены различные нейробиологические эффекты комбинированного действия АнОВ и разных видов ионизирующих излучений [5–7].
Важность роли индивидуальных и типологических особенностей в функциональной реакции ЦНС на облучение подчеркивали большинство исследователей, занимавшихся изучением действия радиации на ее функции, однако систематических данных по этому вопросу сравнительно немного и они были получены давно [8–11]. Значение типологических особенностей ВНД для нейробиологических эффектов при комбинированном действии радиационных и нерадиационных факторов ранее не исследовалось.
В связи с этим целью настоящей работы было изучение изменений поведения животных и показателей обмена моноаминов в ключевых структурах мозга у животных с разными типологическими особенностями ВНД при комбинированном воздействии АнОВ и трех видов ионизирующих излучений – γ-излучения, высокоэнергетических протонов и ионов углерода 12С.
МАТЕРИАЛЫ И МЕТОДИКА
При создании АнОВ использовали индивидуальные секции из оргстекла размером 42 × 42 × 40 см, скомпонованные в два стеллажа по 15 секций каждый. Животных вывешивали за основание хвоста под углом 30–40° с расчетом снятия статической нагрузки с задних конечностей. При этом крыс крепили с помощью специальных карабинов, надевающихся на металлический стержень, так, чтобы они могли свободно перемещаться в пределах клетки. Таким образом, создавался антиортостаз, вызывающий перераспределение жидкостей в организме, и снималась статическая нагрузка с задних конечностей. Данная методика – принятая экспериментальная наземная модель невесомости для мелких лабораторных животных.
Стеллажи с вывешенными животными были размещены в облучательской: стеллаж с крысами, подвергавшимися воздействию и АнОВ и γ-излучения – в зоне облучения на расстоянии 3.3 м от источника излучения, с таким расчетом, чтобы облучение всех крыс было равномерным; стеллаж с крысами, подвергавшимися воздействию только АнОВ – в том же помещении, но вне зоны облучения. Крысы, подвергавшиеся только облучению, были размещены на стеллаже в домашних клетках.
Было проведено два эксперимента по исследованию нейробиологических эффектов синхронного комбинированного действия АнОВ и ионизирующих излучений с учетом типологических особенностей ВНД животных. АнОВ продолжалось в течение 10 сут. Для γ-облучения использовали установку ГОБО-60 с источником 137Cs (72 г-экв. Ra). Мощность дозы составила 2.34 сГр/ч. Был проведен один суточный сеанс облучения через 3 дня после вывешивания. После окончания γ-облучения и снятия крыс с вывешивания в первом эксперименте было проведено однократное облучение головы животных ионами углерода 12С с энергией 420 МэВ в дозе 1 Гр на ускорителе У-70 на базе Института физики высоких энергий (Протвино). Во втором эксперименте было проведено однократное облучение головы животных протонами с энергией 170 МэВ при поглощенной дозе 1 Гр на протонном ускорителе на базе Медицинского радиологического научного центра им. А.Ф. Цыба (Обнинск).
Выбор режима облучения основывался на следующем: суммарная доза 3 Гр для крыс (исходя из их видовой радиочувствительности) примерно соответствует расчетной дозе, которая может быть получена космонавтами в межпланетном полете.
Были использованы общепринятые для проведения подобных исследований методы: нейрохимические методы (высокоэффективная жидкостная хроматография – HPLC) и поведенческие методы (“открытое поле”, приподнятый крестообразный лабиринт, водный тест Морриса, условный рефлекс активного избегания).
Для типологизации животных использовали методику выработки условного рефлекса избегания закрытого (темного) пространства (“эмоционального резонанса”) по модифицированной методике П. В. Симонова) [12]. Экспериментальная камера состояла из открытой (освещенной) и закрытой (затемненной) частей. В каждом эксперименте участвовали две крысы, экспериментальная крыса и крыса-“жертва”. В течение 4–6 опытов каждую экспериментальную крысу помещали в открытую (светлую) часть камеры. Это стрессовая ситуация для крыс и они переходили в темный отсек камеры (норковый рефлекс). Пребывание экспериментальной крысы в темном отсеке сопровождалось электроболевым раздражением крысы-“жертвы”, вызывающим у нее тревожную вокализацию и двигательные реакции. Регистрировали общее время нахождения экспериментальной крысы в закрытом отсеке и частоту выходов оттуда в течение 5 мин наблюдения. Показано, что различия в поведении животных в такой ситуации отражают индивидуальные типологические особенности их высшей нервной деятельности и дают возможность применять данную методику для исходного группирования животных по этому признаку [11, 13, 14].
В поведенческих исследованиях использовали метод “открытого поля” с целью выявления уровня двигательной, ориентировочно-исследовательской активности, соотношения активных и пассивно-оборонительных реакций в умеренной стрессирующей обстановке и эффективности угашения этих реакций. “Открытое поле” (ОП) представляло собой круг диаметром 100 см, разделенный на сектора с отверстием в центре каждого. Крысу помещали в центр ОП и в течение 4 мин тестирования (раздельно за первые и последующие 2 мин) регистрировали следующие показатели: горизонтальную двигательную активность (по числу пересеченных линий), вертикальную (ориентировочную) активность (по числу стоек), исследовательскую активность (по числу заглядываний в отверстия), число выходов в центр ОП и латентный период ориентировочно-исследовательской реакции (время выхода из центра площадки), число актов груминга и эмоциональную реактивность (по числу фекальных болюсов). Тестирование проводили при ярком искусственном свете.
Для выработки условного рефлекса активного избегания (УРАИ) использовали челночную камеру размером 9 × 60 см и высотой 30 см, разделенную перегородкой на два одинаковых отсека с независимым электрифицированным полом. Перегородка имела прямоугольное отверстие шириной 8 см и 6 см в высоту с управляемой извне дверцей, сдвигаемой вдоль плоскости проема. В съемную крышку камеры были вмонтированы две независимые лампы, располагающиеся (при закрытой крышке) по центру отсеков. Животное помешали в одну из камер при закрытой дверце между отсеками и выключенным освещением. Камеру закрывали крышкой, после чего дверцу между отсеками открывали. Выемку животного проводили в обратном порядке. Тест начинали с включения освещения в отсеке, где находилась крыса. Через 6 с на электродный пол подавали ток (0.5 мА, 100 Гц, меандр) до тех пор, пока крыса не переходила в другой отсек, где освещение выключено и тока нет. После перехода крысы освещение выключали и выдерживали паузу 10 с. Затем такую последовательность действий повторяли установленное число раз, что составляло одну серию сочетаний. Регистрировали число реакций избегания (перебежек по условному сигналу) и реакций избавления (перебежек под током). Подсчитывали коэффициент обучения – соотношение числа реакций избегания к общему числу сочетаний.
Для исследования гиппокамп-зависимого поведения крыс использовали водный тест Морриса – общепринятый тест оценки пространственной памяти и ориентации. Лабиринт Морриса представлял собой бассейн голубого цвета диаметром 150 см и высотой стенок 40 см, глубина наполнения его водой составляла 21 см. В геометрический центр одного из четырех секторов бассейна помещали круглую платформу из прозрачного оргстекла диаметром 10 см, скрытую под поверхностью воды на глубине 1 см, и, таким образом, невидимую для животного на голубом фоне; воду не подкрашивали. Платформа оставалась на одном и том же месте на протяжении всего эксперимента. Крысу помещали в воду в произвольном месте бассейна и давали свободно плавать в течение 60 с. В течение одного сеанса обучения всех тестируемых крыс запускали с одного и того же места. В случае нахождения крысой платформы ранее 60 с регистрировали время ее обнаружения и предоставляли животному в течение 20 с пребывать на платформе для ориентирования. После этого крысу снимали с платформы и запускали снова в бассейн с другого произвольного места; таким образом, два сеанса обучения формировали одну сессию. В день проводили две сессии с перерывом 4 ч. В случае, если крыса не находила платформу, фиксировали время для обнаружения платформы, равное 60 с. Тест проводили в течение 6 дней. На 7-й день проводили тест без установки платформы в один подход в течение 60 с, фиксировали время пребывания крыс в секторе, в котором платформа располагалась ранее.
Для оценки тревожности экспериментальных животных использовали приподнятый крестообразный лабиринт с длиной отсеков, равной 50 см и шириной аллеи 10 см; высота стенок огороженных отсеков составляла 40 см. Освещенность в центре огороженных отсеков составляла 12 лк, неогороженных – 60 лк. Крысу помещали в угол огороженного отсека лабиринта (одного и того же для всех тестируемых животных) и фиксировали следующие параметры: латентный период выхода на неогороженный участок, число таких выходов и общее время пребывания на неогороженном участке лабиринта.
Полученные данные были усреднены внутри каждой группы по исследуемому параметру, далее проводили статистический анализ данных. В качестве статистического критерия использовался однофакторный дисперсионный анализ (one-way ANOVA) и апостериорный тест Дункана, при наличии различий в дисперсии. Уровень значимости во всех тестах был принят как р < 0.05.
Для анализа полученных данных в тесте водного лабиринта Морриса усредняли время достижения платформы в среднем за день, полученные данные также оценивали с использованием статистического критерия однофакторного дисперсионного анализа (one-way ANOVA) и апостериорного теста Дункана, при наличии различий в дисперсии.
Нейрохимические исследования. Для нейрохимических исследований контрольных и подвергнутых экспериментальным воздействиям крыс декапитировали через 10 сут, выделяли соответствующие структуры мозга: префронтальную кору, прилежащее ядро (nucleus accumbens), гипоталамус, гиппокамп и стриатум. Структуры мозга замораживали в жидком азоте и взвешивали. Выделенные структуры гомогенизировали при +4°С в стеклянном гомогенизаторе с тефлоновым пестиком (0.2 мм) при скорости вращения пестика 3000 об/мин. В качестве среды гомогенизации и выделения использовали 0.1 н НСlО4 с добавлением внутреннего стандарта ДОБА (3,4-диоксибензиламин) – вещество катехоламиновой природы, но не встречающегося в нативной ткани, в концентрации – 0.5 нмоль/мл. Прилежащее ядро гомогенизировали в 40 объемах, остальные структуры мозга – в 20 объемах среды выделения. Пробы центрифугировали при +4°С, 10 000 g в течение 15 мин. Супернатант использовали в дальнейшем для определения моноаминов и их метаболитов.
Концентрацию моноаминов и их метаболитов определяли с помощью метода высокоэффективной жидкостной хроматографии (ионпарная хроматография) с электрохимической детекцией на хроматографе LC-304T (BAS, WestLafayette, США) с инжектором Rheodyne 7125, петля для нанесения образцов – 20 мкл. Изучаемые вещества разделяли на обращенно-фазной колонке ReproSil-Pur, ODS-3, 4 × 100 мм, 3 мкм (Dr. Majsch GMBH, “Элсико”, Москва). Насос PM-80 (BAS, США), скорость подвижной фазы 1.0 мл/мин, при давлении 200 атм. Мобильная фаза: 0.1 моль/л цитратно-фосфатный буфер, содержащий 1.1 ммомдь/л октансульфоновой кислоты, 0.1 ммоль/л ЭДТА и 9% ацетонитрила (pН = 3.0). Скорость протока 1 мл/мин. Измерение проводили с помощью электрохимического детектора LC-4B (BAS, США) на стеклоугольном электроде (+0.85 V) против электрода сравнения Ag/AgCl. Регистрацию образцов проводили с применением аппаратно-программного комплекса МУЛЬТИХРОМ 1.5 (АМПЕРСЕНД). Все использованные для анализа реактивы были высокой степени чистоты: о.с.ч., х.ч. или analyticalgrade. Для калибровки хроматографа использовали смеси рабочих стандартов определяемых веществ в концентрации 500 пмоль/мл. Величины концентрации моноаминов в опытных образцах рассчитывали методом “внутреннего стандарта”, исходя из отношений площади пиков в стандартной смеси и в образце. Определяли содержание норадреналина (НА), дофамина (ДА) и его метаболитов – 3,4-диоксифенилуксусной кислоты (ДОФУК) и гомованилиновой кислоты (ГВК), 3-метокситирамина (3-МТ), серотонина (5-окситриптамина, 5-ОТ) и его метаболита – 5-гидроксииндолуксусной кислоты (5-ОИУК) в пяти структурах мозга: префронтальная кора, прилежащее ядро (nucleus accumbens), гипоталамус, гиппокамп и стриатум.
Результаты нейрохимических исследований выражали в виде средних величин ± стандартная ошибка среднего. Полученные результаты анализировали с помощью односторонней ANOVA и posthoc тест Дункана. Статистически значимым результатом считали величину p < или =0.05. Величину p от 0.05 до 0.099 считали тенденцией изменений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены результаты тестирования крыс в камере П.В. Симонова – результаты выработки условного рефлекса избегания закрытого (темного) пространства при крике раздражаемой особи. По результатам тестирования типологические группы крыс можно охарактеризовать следующим образом:
Рис. 1.
Результаты тестирования животных в камере П.В. Симонова. А – время пребывания в закрытом (темном) отсеке; Б – число заходов в темный отсек камеры.
Fig. 1. The results of animal testing in Simonov’s case. Black columns – group 1; grey columns – group 2. A – the time of rats residence in closed (dark) space; B – number of visits to dark space.

1) с преобладанием возбуждения, эмоционально неустойчивые, с повышенной тревожностью;
2) с преобладанием торможения, низкоэмоциональные, с низкой тревожностью.
Видно, что крысы группы 1 характеризуются высокими показателями времени пребывания в закрытом (темном) отсеке камеры (рис. 1, А) и более низкими показателями числа выходов из него (рис. 1, Б).
В эксперименте по изучению воздействия АнОВ, γ-облучения и облучения ионами углерода 12С исследование поведения крыс в “открытом поле” показало существенное, статистически значимое повышение показателей пассивно-оборонительного поведения после экспериментальных воздействий у крыс с исходно повышенной возбудимостью и тревожностью, что характеризуют высокие показатели времени и числа реакций замирания у этих животных (рис. 2). Показатели активного поведения в “открытом поле” достоверно не изменились.
Рис. 2.
Показатели реакций замирания в “открытом поле” у животных экспериментальных групп: А – среднее время замирания; Б – число реакций замирания.
Fig. 2. The indexes of “freezing” reactions in “open field” of rats of experimental groups. A – average time of “freezing”; B – number of “freezing” reactions.

Эти данные в целом подтверждаются результатами исследования поведения животных в приподнятом крестообразном лабиринте – общепринятом тесте на состояние тревожности. Крысы группы 1 характеризовались наиболее низкими показателями пребывания в открытом отсеке лабиринта (рис. 3, Б) и большим числом перебежек между отсеками (рис. 3, А).
Рис. 3.
Показатели поведения крыс экспериментальных групп в приподнятом крестообразном лабиринте: А – число реакций; Б – время, с.
Fig. 3. The indexes of rats in experimental groups behavior in elevated cross maze. A – number of reactions; B – time.
Исследование пространственной ориентации и памяти в водном тесте Морриса показало достоверное повышение скорости обучения у крыс экспериментальных групп, более выраженное у животных с преобладанием возбуждения (рис. 4).
Рис. 4.
Показатели поведения крыс экспериментальных групп в водном тесте Морриса. К – контроль; SR_A – группа 1; SR_R – группа 2.
Fig. 4. The indexes of rats in experimental groups behavior in Morris water maze. K – control; SR_A – group 1; SR_R – group 2.

В эксперименте по изучению воздействия АнОВ, γ-облучения и облучения высокоэнергетическими протонами исследование поведения крыс в “открытом поле” показало существенное повышение показателей пассивно-оборонительного поведения крыс экспериментальных групп, однако не выявило достоверных различий между типологическими группами по критерию длительности реакций замирания (рис. 5, А). Было зарегистрировано достоверное повышение числа акций уринации у крыс возбудимого (эмоционального, высокотревожного) типа, что свидетельствует о стимуляции эмоциональности и тревожности животных при воздействии изучаемых факторов (рис. 5, Б). Показатели активного поведения крыс экспериментальных групп в “открытом поле” после экспериментальных воздействий достоверно не изменились.
Рис. 5.
Показатели пассивно-оборонительного поведения, тревожности и эмоциональности крыс экспериментальных групп в тесте “открытого поля” после воздействия экспериментальных факторов. А – время замирания; Б – число реакций уринации. K-R – контроль к группе 1; K-A – контроль к группе 2. Остальные обозначения как на рис. 2.
Fig. 5. The indexes of passive-defensive behavior, anxiety and emotionality in open field test after experimental factors impact. A – time of “freezing” reactions; B – number of urination reactions. K-R – control to group 1; K-A – control to group 2. Other names as on fig. 2.

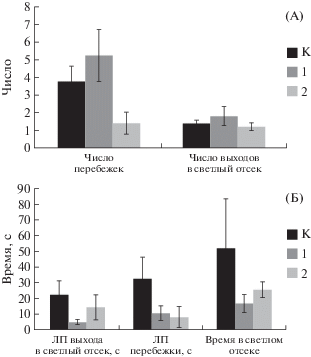
Исследование тревожности животных в тесте приподнятого крестообразного лабиринта показало, что у крыс возбудимого типа после экспериментальных воздействий происходит резкое повышение латентного периода выхода в открытый отсек лабиринта и в то же время резкое увеличение числа выходов в этот отсек и времени пребывания в нем (рис. 6).
Рис. 6.
Показатели поведения крыс экспериментальных групп в приподнятом крестообразном лабиринте. А – латентный период выхода в открытый отсек лабиринта и время пребывания в нем; Б – число переходов между отсеками. Остальные обозначения как на рис. 5.
Fig. 6. The indexes of rats in experimental groups behavior in elevated cross maze. A – latent time of rats exits to open space (left) and time of rats residence in open space (right); B – number of crossing between parts of maze. Other names as on fig. 5.

При тестировании крыс экспериментальных групп в водном тесте Морриса существенных различий в скорости обучения не было обнаружено (рис. 7).
Рис. 7.
Показатели поведения крыс экспериментальных групп в водном тесте Морриса. Обозначения как на рис. 5 и 6.
Fig. 7. The indexes of rats in experimental groups behavior in Morris water maze. Names as on fig. 5 and 6.

Для оценки когнитивных функций экспериментальных животных в этом эксперименте мы также провели исследование скорости их обучения по методике выработки условного рефлекса активного избегания (УРАИ) в “челночной камере”. Результаты исследования показаны на рис. 8. Видно, что у крыс тормозного (с низкой тревожностью) типа происходит существенное замедление обучения после экспериментальных воздействий по сравнению с крысами возбудимого типа и обеими контрольными группами.
Таким образом, сравнение результатов двух экспериментов по изучению комбинированного действия АнОВ и ионизирующих излучений, различающихся только одним фактором (в первом случае – облучение ионами углерода 12С, во втором – высокоэнергетическими протонами), на поведение экспериментальных животных показало следующее.
Вклад облучения ионами углерода 12С приводит к более глубоким нарушениям соотношения ориентировочно-исследовательской активности и пассивно-оборонительного поведения и тревожности в умеренно стрессирующей ситуации в тестах “открытого поля” и приподнятого крестообразного лабиринта по сравнению с облучением протонами, наиболее выраженным у крыс возбудимого, тревожного, эмоционального типа. Именно в этом эксперименте типологические различия в поведении животных проявились наиболее ярко.
Эффект улучшения обучения животных после облучения, зарегистрированный в этом эксперименте при тестировании крыс в лабиринте Морриса, известен достаточно давно и показан как на крысах [15], так и на обезьянах [16, 17]. Причины его до сих пор окончательно не выяснены. Есть предположение, что, с одной стороны, это может объясняться так называемым эффектом “сужения внимания” – подавлением исполнительных механизмов ориентировочной реакции в ретикулярной формации и таламусе, в результате чего животные меньше отвлекаются на посторонние раздражители; с другой стороны, может иметь место активизация компенсаторных процессов в ЦНС, вызванная облучением на первом этапе лучевой реакции.
В эксперименте с облучением протонами различия между типологическими группами оказались более сглаженными, однако по ряду показателей пассивно-оборонительные компоненты поведения и тревожность у крыс экспериментальных групп также были повышены. По-видимому, замедление обучения у крыс тормозного типа в тесте УРАИ следует отнести на счет развития запредельного торможения при воздействии оборонительного подкрепления.
По результатам нейрохимических исследований наиболее значительные изменения наблюдаются в префронтальной коре. У крыс группы 1 зарегистрировано достоверное уменьшение концентрации ДОФУК, ГВК и 3-МТ. У крыс группы 2 происходит достоверное снижение концентрации ДОФУК и 3-МТ. Кроме того, выявлено достоверное уменьшение концентрации 5-ОИУК у крыс группы 2 относительно животных группы 1 (табл. 1).
Таблица 1.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в префронтальной коре крыс Table 1. Monoamines and their metabolites concentration (nmol/g tissue) in prefrontal cortex of rats
| Группы | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|
| Контр. | 6.09 ± 1.15 | 1.18 ± 0.07 | 1.51 ± 0.24 | 0.70 ± 0.13 | 0.47 ± 0.07 | 4.31 ± 0.37 | 6.73 ± 0.49 |
| 1 группа | 5.79 ± 0.49 | 0.87 ± 0.05 | 1.04 ± 0.04 | 0.28 ± 0.07 | 0.23 ± 0.06 | 3.64 ± 0.14 | 6.65 ± 0.36 |
| р = 1 vs 2 | 0.833 | 0.010 | 0.123 | 0.033 | 0.032 | 0.173 | 0.913 |
| 2 группа | 5.36 ± 0.43 | 0.82 ± 0.06 | 1.09 ± 0.03 | 0.45 ± 0.07 | 0.18 ± 0.07 | 3.07 ± 0.11 | 7.15 ± 0.24 |
| р = 1 vs 3 | 0.607 | 0.007 | 0.166 | 0.171 | 0.039 | 0.021 | 0.511 |
| р = 2 vs 3 | 0.571 | 0.595 | 0.326 | 0.163 | 0.723 | 0.022 | 0.332 |
Значительные изменения в концентрации моноаминов и их метаболитов в префронтальной коре при декапитации животных на ранних этапах исследований, в данном случае через сутки, после предпринятых воздействий было показано многократно, в частности, через сутки после облучения крыс ионами углерода 12C [18], но не через 30 и 90 сут [19]. Аналогичные изменения происходили у крыс линии WAG/Raj на ранних этапах формирования абсансной эпилепсии, а также в ответ на фармакологическое воздействие – введение медапара, через 1 сут после облучения протонами высоких энергий как на пролете [20], так и в пике Брэгга [21].
Высокая чувствительность и реактивность префронтальной коры относительно других исследованных структур мозга является фундаментальным свойством функционирования этой структуры. Повышенная реактивность префронтальной коры крыс к стрессу показана в ряде работ, в частности, в работе [22]. Медиальная префронтальная кора крыс является одним из важнейших узлов системы быстрого обучения, который извлекает недавние и отдаленные воспоминания [23]. Наблюдали быстрое усиление функционального сопряжения латеральной префронтальной коры, базальных ганглиев (хвостатого ядра – caudate nucleus и неостриатума – putamen) и орбитофронтальной коры, а также между латеральной префронтальной корой и премоторной корой [24]. Обнаружена быстрая реакция дорзо-латеральной верхней префронтальной коры к кодированию новых стимулов, в ходе задач требующих высокого уровня рабочей памяти [25].
Обнаружены также клеточные механизмы, способствующие реализации быстрых реакций нейронов префронтальной коры. Взаимодействие между ингибирующими быстрыми спайковыми интернейронами и возбуждающими пирамидальными нейронами крыс облегчает реализацию фундаментальных свойств корковых сетей. Ключевой функцией быстрых спайковых интернейронов является обеспечение быстрого торможения в локальных сетях сенсорной и моторной коры и обработки входной информации из таламуса в кору. Эти результаты свидетельствуют о наличии различных льготных подсетей или локальных сетей между быстрыми спайковыми интернейронами и пирамидальными клетками префронтальной коры крыс, которые могут быть специфическими для этой области коры [26]. Выявлена быстрая ДА-ергическая модуляция кальция и быстрых потенциалов в дендритах пирамидных нейронов префронтальной коры крыс [27]. В префронтальной коре ДА-ергическая модуляция реализуется менее чем за 0,5 с, в то время как в других структурах эта реакция занимает несколько секунд.
Помимо того, что префронтальная кора формирует и контролирует эмоциональные и мотивационные состояния [28, 29], она играет ключевую роль в когнитивных процессах [30]. Если у человека когнитивные процессы можно определить как приобретение знаний и опыта и их дальнейшее использование, то у животных это приобретение опыта и его дальнейшее использование. Еще одной из основных функций префронтальной коры при реализации поведения животными является принятие решения и выбор действия [31], также связанное с когнитивной деятельностью.
Значительных изменений не было выявлено в прилежащем ядре и в гиппокампе (табл. 2 и 3).
Таблица 2.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в прилежащем ядре крыс Table 2. Monoamines and their metabolites concentration (nmol/g tissue) in nucleus accumbens of rats
| Группы | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|
| Контр. | 2.71 ± 0.65 | 5.13 ± 0.52 | 36.73 ± 5.92 | 3.69 ± 0.33 | 0.50 ± 0.09 | 1.45 ± 0.27 | 1.84 ± 0.28 |
| 1 группа | 2.47 ± 0.45 | 4.81 ± 0.42 | 39.87 ± 4.51 | 2.88 ± 0.1 | 0.72 ± 0.15 | 1.97 ± 0.27 | 2.01 ± 0.28 |
| р = 1 vs 2 | 0.790 | 0.678 | 0.716 | 0.067 | 0.290 | 0.262 | 0.706 |
| 2 группа | 3.16 ± 0.34 | 3.03 ± 0.78 | 43.65 ± 6.51 | 4.19 ± 0.64 | 0.60 ± 0.09 | 1.72 ± 0.42 | 2.24 ± 0.43 |
| р = 1 vs 3 | 0.601 | 0.922 | 0.502 | 0.551 | 0.509 | 0.652 | 0.505 |
| р = 2 vs 3 | 0.305 | 0.831 | 0.680 | 0.110 | 0.537 | 0.665 | 0.703 |
Таблица 3.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в гиппокампе крыс Table 3. Monoamines and their metabolites concentration (nmol/g tissue) in hippocampus of rats
| Группы | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|
| Контр. | 7.79 ± 1.13 | 0.82 ± 0.27 | 0.68 ± 0.24 | 0.49 ± 0.11 | 0.35 ± 0.08 | 13.03 ± 1.44 | 7.88 ± 0.62 |
| 1 группа | 7.40 ± 0.80 | 0.41 ± 0.07 | 0.54 ± 0.18 | 0.35 ± 0.05 | 0.32 ± 0.06 | 14.07 ± 1.05 | 8.38 ± 0.95 |
| р = 1 vs 2 | 0.907 | 0.218 | 0.679 | 0.337 | 0.795 | 0.618 | 0.702 |
| 2 группа | 7.99 ± 0.77 | 0.55 ± 0.18 | 0.88 ± 0.22 | 0.30 ± 0.05 | 0.24 ± 0.03 | 13.52 ± 1.44 | 9.39 ± 0.64 |
| р = 1 vs 3 | 0.801 | 0.472 | 0.595 | 0.198 | 0.306 | 0.837 | 0.165 |
| р = 2 vs 3 | 0.644 | 0.523 | 0.315 | 0.523 | 0.335 | 0.789 | 0.449 |
В стриатуме (табл. 4) было обнаружено снижение концентрации ГВК у крыс группы 2 относительно контроля.
Таблица 4.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в стриатуме крыс Table 4. Monoamines and their metabolites concentration (nmol/g tissue) in striatum of rats
| Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|
| Контр. | 0.52 ± 0.12 | 4.75 ± 0.36 | 44.16 ± 3.08 | 4.07 ± 0.30 | 0.8 ± 0.09 | 3.87 ± 0.33 | 1.450.13 |
| 1 групп | 0.98 ± 0.3 | 5.67 ± 1.51 | 59.29 ± 10.03 | 4.27 ± 1.15 | 1.23 ± 0.39 | 4.34 ± 2.00 | 2.00 ± 0.72 |
| р = 1 vs 2 | 0.234 | 0.631 | 0.505 | 0.880 | 0.463 | 0.534 | 0.570 |
| 2 гуппа | 0.68 ± 0.11 | 4.05 ± 0.32 | 45.54 ± 2.93 | 2.64 ± 0.19 | 0.84 ± 0.1 | 3.14 ± 0.40 | 1.74 ± 0.08 |
| р = 1 vs 3 | 0.405 | 0.227 | 0.828 | 0.022 | 0.752 | 0.652 | 0.171 |
| р = 2 vs 3 | 0.428 | 0.403 | 0.535 | 0.338 | 0.407 | 0.613 | 0.774 |
В гипоталамусе (табл. 5) было выявлено уменьшение концентрации ДОФУК у крыс группы 2 относительно контроля. В миндалине (табл. 6) произошло снижение концентрации НА у крыс группы 1 относительно контроля и крыс группы 2.
Таблица 5.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в гипоталамусе крыс Table 5. Monoamines and their metabolites concentration (nmol/g tissue) in hypothalamus of rats
| Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|
| Контр | 6.70 ± 0.16 | 0.33 ± 0.03 | 2.43 ± 0.25 | 0.31 ± 0.04 | 0.10 ± 0.01 | 3.34 ± 0.23 | 4.24 ± 0.13 |
| 1 группа | 6.96 ± 0.28 | 0.31 ± 0.05 | 1.95 ± 0.16 | 0.33 ± 0.07 | 0.15 ± 0.08 | 3.60 ± 0.19 | 4.06 ± 0.12 |
| р = 1 vs 2 | 0.498 | 0.741 | 0.184 | 0.803 | 0.528 | 0.464 | 0.392 |
| 2 группа | 7.27 ± 0.64 | 0.22 ± 0.03 | 1.69 ± 0.18 | 0.24 ± 0.04 | 0.10 ± 0.02 | 3.04 ± 0.43 | 3.77 ± 0.05 |
| р = 1 vs 3 | 0.459 | 0.023 | 0.063 | 0.307 | 0.915 | 0.597 | 0.436 |
| р = 2 vs 3 | 0.697 | 0.189 | 0.355 | 0.333 | 0.552 | 0.321 | 0.621 |
Таблица 6.
Концентрация моноаминов и их метаболитов (нмоль/г ткани) в миндалине крыс Table 6. Monoamines and their metabolites concentration (nmol/g tissue) in amygdala of rats
| Группа | НА | ДОФУК | ДА | ГВК | 3-МТ | 5-ОИУК | 5-ОТ |
|---|---|---|---|---|---|---|---|
| Контр. | 1.93 ± 0.41 | 0.87 ± 0.23 | 9.24 ± 3.13 | 1.25 ± 0.45 | 1.01 ± 0.26 | 4.75 ± 0.09 | 3.93 ± 0.67 |
| 1 группа | 0.81 ± 0.08 | 1.42 ± 0.31 | 15.03 ± 3.66 | 1.68 ± 0.32 | 0.63 ± 0.12 | 5.22 ± 0.45 | 3.02 ± 0.38 |
| р = 1 vs 2 | 0.046 | 0.237 | 0.249 | 0.508 | 0.273 | 0.688 | 0.318 |
| 2 группа | 1.76 ± 0.19 | 1.52 ± 0.34 | 15.75 ± 3.73 | 1.89 ± 0.45 | 1.46 ± 0.39 | 5.41 ± 0.08 | 3.72 ± 0.66 |
| р = 1 vs 3 | 0.755 | 0.201 | 0.266 | 0.397 | 0.411 | 0.641 | 0.845 |
| р = 2 vs 3 | 0.003 | 0.857 | 0.976 | 0.862 | 0.741 | 0.104 | 0.435 |
Таким образом, основной реакцией моноаминергических систем на примененные нами воздействия можно считать снижение активности ДА системы.
Список литературы
Ушаков И.Б., Штемберг А.С. Проблемы воздействия факторов дальних длительных космических полетов на высшую нервную деятельность в модельных экспериментах на животных // Авиакосм. и экол. медицина. 2012. Т. 46. № 1. С. 5–16. [Ushakov I.B., Shtemberg A.S. The problems of long-distance longtime spaceflights factors on higher nervous activity in model experiments in animals // Aviakosmicheskaya i ekologicheskaya medicina. 2012. V. 46. № 1. P. 5–16. (In Russian)]
Ушаков И.Б., Штемберг А.С., Шафиркин А.В. Реактивность и резистентность организма млекопитающих. Принципы формирования, регуляции и прогнозирования. М.: Наука, 2007. 493 с. [Ushakov I.B., Shtemberg A.S., Shafirkin A.V. Reactivity and resistance of mammal organism. Principles of formation, regulation and prediction. M.: Nauka, 2007. 493 p. (In Russian)]
Штемберг А.С. Проблемы экспериментального исследования комбинированного действия факторов космического полета на функции организма животных // Рос. физиол. журн. 2014. Т. 100. № 10. С. 1152–1168. [Shtemberg A.S. Problems of experimental investigation of spaceflight factors combined impact on animals organism // Rossiyskiy fisiologicheskiy journal. 2014. V. 100. № 10. P. 1152–1168. (In Russian)]
Mao X.W., Nishiyama N.C., Pecaut M.J. et al. Simulated microgravity and low-dose/low-dose-rate radiation induced oxidative damage in the mouse brain // Radiat. Res. 2016. C. 185.
Штемберг А.С., Лебедева-Георгиевская К.Б., Матвеева М.И. и др. Влияние факторов космического полета, моделируемых в наземных условиях, на поведение, дискриминантное обучение и обмен моноаминов в различных структурах мозга крыс // Изв. РАН. Сер. биол. 2014. № 2. С. 168–175. [Shtemberg A.S., Lebedeva-Georgievskaya K.B., Matveeva M.I. et al. The influence of spaceflight factors modeling in ground experiments on behavior, discriminant learning, monoamines metabolism in different brain structures in rats // Izvestiya RAN. Seriya biologicheskaya. 2014. № 2. P. 168–175. (In Russian)]
Kokhan V.S., Matveeva M.I., Bazyan A.S. et al. Combinedeffects of antiorthostatic suspension and ionizing radiation on the behaviour and neurotransmitters changes in different brain structures of rats // Behav. Brain Res. 2017. № 320. P. 473–483.
Kokhan V.S., Lebedeva-Georgievskaya K.B., Kudrin V.S. et al. An investigation of the single and combined effects of hypogravity and ionizing radiation on brain monoamine metabolism and rats’ behavior // Life Sci. Space Res. 2019. V. 20. № 1. P. 12–19.
Котляревский Л.И., Горшелева Л.С., Хозак Л. Б. Значение типа нервной системы животных в поступательном и обратном развитии изменений высшей нервной деятельности, вызванных проникающей радиацией // Тр. ин-та высш. нервн. деят. Сер. патофизиол. 1958. Т. 4. С. 95–98. [Kotlyarev-skiy l.I., Gorsheleva L.S., Khozak L.B. The importance of type nervous system in animals in progressive and backward development of higher nervous activity changes provoked by penetrating radiation // Proc. Inst. Higher Nervous Activity. Seriya Patofisiol. 1958. V. 4. P. 95–98. (In Russian)]
Саркисова К.Ю., Куликов М.А. Индивидуальные различия в реакциях на острый стресс, связанные с типом поведения (прогнозирование устойчивости к стрессу) // Бюл. эксперим. биологии и медицины. 1994. Т. 47. № 1. С. 89. [Sarkisova K.Ju., Kulikov M.A. Individual differences in reactions to acute stress dependtd with behavioral type (the prediction of stress resistance) // Bull. Experim. Biol. Med. 1994. V. 47. № 1. P. 89. (In Russian)]
Семагин В.Н., Зухарь А.В., Куликов М.А. Тип нервной системы, стрессоустойчивость и репродуктивная функция. М.: Наука, 1988. [Semagin V.N., Zukhar A.V., Kulikov M.A. Type of nervous system, stress-resistance and reproductive function. M.: Nauka, 1988. (In Russian)]
Штемберг А.С. Роль индивидуальных типологических особенностей высшей нервной деятельности в формировании и радиационной устойчивости упроченных двигательно-оборонительных условных рефлексов у крыс // Изв. АН СССР. Сер. Биол. 1987. № 4. С. 547–557. [Shtemberg A.S. The role of higher nervous activity individual typological characteristics in formation and radiation resistance of motor defensive conditioned reflexes in rats // Izvestiya AN SSSR. Ser. Biol. 1987. № 4. P. 547–557. (In Russian)]
Симонов П.В. Условные реакции эмоционального резонанса у крыс // Нейрофизиологический подход к анализу внутривидового поведения. М.: Наука, 1976. С. 6. [Simonov P.V. Conditioned reactions of emotional resonance in rats // Neurophysiological approach to analysis of intraspecific behavior. M.: Nauka, 1976. (In Russian)]
Айрапетянц М.Г., Хоничева Н.М., Мехедова А.Я., Ильяна-Вильяр X. Реакции на умеренные функциональные нагрузки у крыс с индивидуальными особенностями поведения // Журн. высш. нервн. деят. 1980. Т. 30. № 5. С. 994. [Airapetyanz M.G., Kho-nicheva N.M., Mekhedova A.Ja., Ilyana-Vilyar H. Reactions on middle functional pressures in rats with individual characteristics of behavior // Journal visshey nervnoy deyatelnosti. 1980. V. 30. № 5. P. 994. (In Russian)]
Хоничева Н.М., Ильяна-Вильяр Х. Характер поведения в ситуации избегания как критерий оценки типологических особенностей крыс // Журн. высш. нервн. деят. 1981. Т. 31. № 5. С. 975–983. [Khonicheva N.M., Ilyana-Vilyar H. The character of behavior in the avoidance situation as estimation criterion of typological characteristic in rats // Journal vis-shey nervnoy deyatelnosti. 1981. V. 31. № 5. P. 975–983. (In Russian)]
Blair W.C. The effects of cranial X-irradiation on maze acquisition in rats. // J. Compar. and Physiol. Psychol. 1958. V. 54. № 2. P. 175–178.
Harlow H.F., Scrier A.M., Simons D.G. Exposure of primates by cosmic radiation above 90000 feet // J. Compar. Physiol. Psychol. 1956. V. 49. № 2. P. 195–200.
Riopelle A.J., Gronsky M.A., Ades H.W. Learned performance of monkeys after single and repeated X-irradiation // J. Compar. Physiol. Psychol. 1956. V. 49. № 5. P. 521–524.
Matveeva M.I., Shtemberg A.S., Timoshenko G.N. et al. The Effects of Irradiation by 12C Carbon Ions on Monoamine Exchange in Several Rat Brain Structures // Neurochem. J. 2013. V. 7. № 4. P. 303–307.
Белокопытова К.В., Белов О.В., Кудрин В.С. и др. Распределение моноаминов и их метаболитов в структурах головного мозга крыс в поздние сроки после облучения ионами 12C // Нейрохимия. 2015. Т. 32. № 3. С. 243–251. [Belokopitova K.V., Belov O.V., Kudrin V.S. et al. The distribution of monoamines and their metabolites in rats brain structures in the late times after 12C ions irradiation // Neurochimia. 2015. V. 32. № 3. P. 243–251. (In Russian)]
Штемберг А.С., Базян А.С., Лебедева-Георгиевская К.Б. и др. Влияние облучения протонами высокой энергии на поведение крыс и его нейрохимические механизмы // Авиакосм. и экол. медицина. 2013. Т. 47. № 6. С. 54–60. [Shtemberg A.S., Bazyan A.S., Lebedeva-Georgievskaya K.B. et al. The influence of high energy protons irradiation on rats behavior and their neurochemical mechanisms // Aviakosmicheskaya i ekologicheskaya medicina. 2013. V. 47. № 6. P. 54–60. (In Russian)]
Shtemberg A.S., Kokhan V.S., Kudrin V.S. et al. The effect of high-energy protons in Bragg peak on the exchange of monoamines in some brain structures // Neurochem. J. 2015. V. 9. № 1. P. 66–72.
King D., Zigmond M.J., Finlay J.M. Effects of dopamine depletion in the medial prefrontal cortex on the stress-induced increases in extracellular dopamine in the nucleus accumbens and shell // Neurology. 1997. V. 77. №1. P. 141–153.
Gonzalez C., Kramar C., Garagoli F. et al. Medial prefrontal cortex is a crucial node of a rapid learning system that retrieves recent and remote memories // Neurobiol. Learn. Mem. 2013. V. 103. P. 19–25.
Ruge H., Wolfensteller U. Functional integration processes underlying the instruction-based learning of novel goal-directed behaviors // Neuroimage. 2013. V. 68. P. 162–172.
Hung Y., Smith M.L., Taylor M.J. Functional dissociations in prefrontal-hippocampal working memory systems // Cortex. 2013. V. 49. № 4. P. 961–967.
Zaitsev A.V., Lewis D.A. Functional properties and short-term dynamics of unidirectional and reciprocal synaptic connections between layer 2/3 pyramidal cells and fast-spiking interneurons in juvenile rat prefrontal cortex // Eur. J. Neurosci. 2013. V. 38. № 7. P. 2988–2998.
Zhou W.L., Antic S.D. Rapid dopaminergic and GABAergic modulation of calcium and voltage transients in dendrites of prefrontal cortex pyramidal neurons // J. Physiol. 2012. V. 590. № 16. P. 3891–3911.
Раевский К.С., Сотникова Т.Д., Гейнетдинов Р.Р. Дофаминергическая система мозга: Гетерогенность рецепторов, функциональная роль, фармакологическая регуляция // Успехи физиол. наук. 1996. Т. 27. № 1. С. 3–29. [Raevskiy K.S., Sotnikova T.D., Geynetdinov R.R. Brain dopaminergic system: receptors geterogenicity, functional role, pharmacological regulation // Uspekhi fisiol. nauk. 1996. V. 27. № 1. P. 3–29. (In Russian)]
McGregor I.S. Contrasting effects of stress on medial and sulcal prefrontal cortex self-stimulation // Brain Res. Bul. 1991. V. 27. № 2. P. 225–229.
Базян А.С., Мидзяновская И.C., Кузнецова Г.Д. и др. Возможные механизмы формирования типологических особенностей поведения крыс линии WAG/Rij // Журн. высш. нервн. деят. 2001. Т. 51. № 6. С. 720–727. [Bazyan A.S., Midzyanovskaya I.S., Kuznetsova G.D. et al. The possible mechanisms of typological characteristics of rats WAG/Rij behavior formation // Journal visshey nervnoy deyatelnosti. 2001. V. 51. № 6. P. 720–727. (In Russian)]
Bechara A., Damasio A.R. The Somatic Marker Hypothesis: A neural theory of economic decision // Games and Economic Behavior. 2005. № 52(2). P. 336–372. http://www.psychwiki.com/index.php?title=Bechara,_A.,_and_Damasio,_A._R._(2005)&action=edit&redlink=1
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология



