Радиационная биология. Радиоэкология, 2020, T. 60, № 3, стр. 249-264
ЦИТОГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ У ТОНКОНОГА ТОНКОГО С ПЛОЩАДКИ, ГДЕ ПРОВОДИЛИ ИСПЫТАНИЯ БОЕВЫХ РАДИОАКТИВНЫХ ВЕЩЕСТВ НА СЕМИПАЛАТИНСКОМ ИСПЫТАТЕЛЬНОМ ПОЛИГОНЕ
К. С. Минкенова 1, Ж. А. Байгазинов 1, С. А. Гераськин 2, *, А. Н. Переволоцкий 2
1 Филиал “Институт радиационной безопасности и экологии” РГП “НЯЦ РК”
Курчатов, Казахстан
2 Всероссийский научно-исследовательский институт радиологии и агроэкологии
Обнинск, Россия
* E-mail: stgeraskin@gmail.com
Поступила в редакцию 09.10.2019
После доработки 09.10.2019
Принята к публикации 20.11.2019
Аннотация
Оценка цитогенетических эффектов у тонконога тонкого выполнена на 38 участках площадки “4А” Семипалатинского испытательного полигона (Казахстан), не отличающихся по почвенным характеристикам и загрязнению тяжелыми металлами, но контрастных по уровню радиоактивного загрязнения. На площадке “4А” в 1954–1957 гг. проводили испытания боевых радиоактивных веществ. Дозовые нагрузки на растения на этой площадке варьируют в диапазоне 0.00014–15 Гр, основной вклад в поглощенную растениями дозу вносит внутреннее облучение 90Sr. Показано, что дозовая зависимость распадается на два участка, в пределах которых характер изменения частоты цитогенетических нарушений с дозой принципиально отличается. В диапазоне 0.14–250 мГр частота цитогенетических эффектов статистически значимо не отличается от контрольного уровня. Увеличение дозы выше этого предела ведет к линейному росту частоты цитогенетических нарушений. Основной вклад в формирование цитогенетических эффектов вносят двойные мосты, что служит дополнительным доказательством радиационной природы наблюдаемых в популяциях тонконога тонкого изменений.
В результате испытаний ядерного оружия на территории Семипалатинского испытательного полигона (СИП) образовались многочисленные участки с повышенным радиационным фоном. Большинство загрязненных участков расположено на площадках “Опытное поле”, “Дегелен”, “Балапан”, “Сары-Узень” и “4А” [1]. Радиоактивное загрязнение площадок существенно различается по составу радионуклидов, что делает особенно ценными исследования на них хронического радиационного воздействия на биоту. Однако исследования биологических эффектов хронического облучения растений и животных в полевых условиях СИП немногочисленны, в большинстве публикаций отсутствует информация об уровнях радиоактивного и химического загрязнения и величинах поглощенных доз [2]. Большая часть выполненных на СИП исследований посвящена оценке плотности радиоактивного загрязнения природных сред, изучению механизмов миграции радионуклидов, а также оценке доз и медицинских последствий для населения прилегающих населенных пунктов [1, 3].
В настоящей работе рассмотрены цитогенетические эффекты у растений с площадки СИП “4А”, где в 1953–1957 гг. проводили испытания боевых радиоактивных веществ (БРВ). БРВ представляли собой жидкие или порошкообразные смеси радионуклидов, в которых доминирующее положение занимал 90Sr. Уровни радиоактивного загрязнения на площадке “4А” различаются на несколько порядков [4], что предполагает наличие выраженных радиобиологических эффектов у населяющих площадку животных и растений. Однако до настоящего времени исследования биологических эффектов на этой площадке были немногочисленными.
Травянистое растение – один из референтных видов в современной концепции радиационной защиты биоты [5]. Многолетний злак тонконог тонкий – типичный представитель растительности Казахстана, широко распространен на территории СИП с разными уровнями радиоактивного загрязнения. Новая информация о радиобиологических эффектах для одного из референтных видов может быть использована для уточнения оценок риска хронического облучения и вносит вклад в совершенствование концепции радиационной защиты биоты.
В нашем предварительном исследовании [6] было показано, что цитогенетические эффекты в популяциях тонконога тонкого с наиболее загрязненных радионуклидами площадок СИП статистически значимо превышают контрольный уровень. Настоящая работа посвящена изучению цитогенетических эффектов в популяциях тонконога тонкого, произрастающего на площадке “4А”, где проводили испытания боевых радиоактивных веществ.
МАТЕРИАЛЫ И МЕТОДИКА
Район исследования. Пробы для исследования отбирали на площадке “4А” площадью 63 км2, где в 1953–1957 гг. проводили испытания боевых радиоактивных веществ. БРВ представляли собой отходы радиохимического производства или смеси радионуклидов, полученные путем облучения нейтронами на атомном реакторе специально подобранных веществ [7]. Испытания включали рассеяние БРВ путем подрыва отдельных снарядов, бомбардировки участков минометами, сброса бомб или распыления БРВ с самолетов. В результате на площадке “4А” было сформировано порядка 30 радиоактивно загрязненных участков [8].
Территория площадки по ботанико-географическому районированию относится к подзоне сухих типчаково-ковыльных степей, входит в состав Восточно-Казахстанского мелкосопочника и находится на границе смены подзон каштановых и светло-каштановых почв. Климат континентальный и засушливый [9]. Исследуемая площадка представлена полынно-злаковым сообществом, в том числе: доминантный вид – полынь Маршалла (Artemisia marschalliana Spreng), кодоминантные виды – тонконог тонкий (Koeleria gracilis Pers.), ломкоколосник ситниковый (Psathyrostachys juncea Nevski), ковыль волосовидный (Stipa capillata L.), солонечник татарский (Galatella tatarica Less.), подмаренник настоящий (Galium verum L.). Изредка встречается овсяница валлисская (Festuca valesiaca Gaudin). Единично встречаются карагана низкорослая (Caragana pumila Pojark) и таволга зверобоелистная (Spiraea hypericifolia L.).
Объект исследования. Объектом исследования являлся многолетний дикорастущий злак – тонконог тонкий (Koeleria gracilis Pers.), образующий плотные дерновины. Стебли – 45–55 см высоты. Метелки – 5–10 см длины, 4–8 мм ширины, плотные, цилиндрические, постепенно суженные к верхушке и к основанию [10].
Полевые работы и отбор проб растительности. Полевые работы проведены в период созревания семян тонконога, в конце июля–начале августа 2013–2014 гг. Участки для исследований выбирали на основе данных о распределении плотности потока β-частиц и мощности эквивалентной дозы на поверхности почвы, которые измеряли дозиметром-радиометром МКС-АТ6130 (Беларусь).
Обследование радиационной обстановки на загрязненной территории проводили согласно методике [11]. Всего на трех участках площадки было заложено 38 исследовательских точек (β – от <10 до 60 000 част/(мин см2); мощность эквивалентной дозы по β- и γ-излучению – от 0.1 до 60 мкЗв/ч), в том числе на участке № 1 – 10, на участке № 2 – 10 и на участке № 3 – 18 точек (рис. 1). В качестве контрольных были выбраны пять точек (одна на участке № 1 и по две на участках № 2 и 3). В этих точках мощность эквивалентной дозы по β- и γ-излучению не отличалась от фонового уровня. Данные о плотности потока β-частиц и мощности эквивалентной дозы на исследуемых участках представлены в табл. 1.
Рис. 1.
Схема расположения исследовательских точек на участках 1 (а) (50°33′51.2″ 77°45′58.3″); 2 (б) (50°33′28.9″ 77°49′59.3″);, 3 (в) (50°33′13.6″ 77°45′22.2″) площадки “4А”. Знаком “+” обозначены точки, для которых определены географические координаты.
Fig. 1. Layout of research points chart on plots 1 (а) (50°33′51.2″ 77°45′58.3″); 2 (b) (50°33′28.9″ 77°49′59.3″); 3 (c) (50°33′13.6″ 77°45′22.2″) from site “4А”. The “+” sign indicates points for which geographical coordinates were determined.
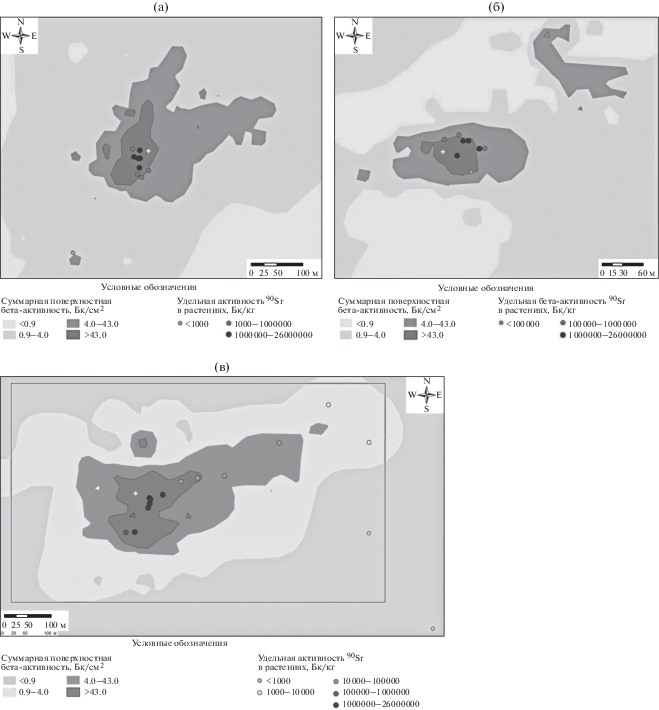
Таблица 1.
Плотность потока β-частиц и мощность эквивалентной дозы на исследуемых участках Table 1. β-particles flux density and exposure dose rate at research plots
| Участок 1 | Участок 2 | Участок 3 | ||||||
|---|---|---|---|---|---|---|---|---|
| № | β, част/(мин см2) | МЭД, мкЗв/ч | № | β, част/(мин см2) | МЭД, мкЗв/ч | № | β, част/(мин см2) | МЭД, мкЗв/ч |
| 1 | <10 | 0.1 | 1 | <10 | 0.1 | 1 | <10 | 0.06 |
| 2 | 200 | 0.4 | 2 | 150 | 1 | 2 | <10 | 0.06 |
| 3 | 500 | 0.8 | 3 | 200 | 0.4 | 3 | 14 | 0.1 |
| 4 | 1200 | 2 | 4 | 500 | 0.8 | 4 | 16 | 0.1 |
| 5 | 2200 | 4 | 5 | 1100 | 1.5 | 5 | 60 | 0.2 |
| 6 | 4200 | 6 | 6 | 2100 | 3 | 6 | 200 | 0.3 |
| 7 | 8500 | 11 | 7 | 4000 | 4 | 7 | 440 | 0.8 |
| 8 | 20 000 | 23 | 8 | 8700 | 14 | 8 | 550 | 0.6 |
| 9 | 31 000 | 37 | 9 | 16 000 | 13 | 9 | 2000 | 1.2 |
| 10 | 45 000 | 58 | 10 | 26 000 | 38 | 10 | 5000 | 10 |
| – | – | – | – | – | – | 11 | 10 000 | 5 |
| – | – | – | – | – | – | 12 | 20 000 | 24 |
| – | – | – | – | – | – | 13 | 30 000 | 45 |
| – | – | – | – | – | – | 14 | 40 000 | 42 |
| – | – | – | – | – | – | 15 | 60 000 | 60 |
| – | – | – | – | – | – | 16 | 40 000 | 40 |
| – | – | – | – | – | – | 17 | 20 000 | 23 |
| – | – | – | – | – | – | 18 | 60 000 | 60 |
В каждой точке производили отбор надземной части растений, в том числе вегетативную часть (150–300 г) – для анализа растений на содержание химических элементов и радионуклидов, генеративную часть (колос, 150–300 г) – для цитогенетического анализа.
Пробы растений отбирали на площади 1–2 м2 в зависимости от плотности их произрастания. В местах, где плотность потока β-частиц была от 10 до 4000 част/(мин см2), расстояние между точками отбора проб растений составляло от 100 до 800 м. Ввиду того, что площади с высокими уровнями загрязнения малы, в местах, где плотность потока β-частиц была выше 4000 част/(мин см2), расстояния между точками отбора проб растений составляли от 5 до 20 м.
Определение содержания радионуклидов в растениях. Пробы растений измельчали, промывали и ополаскивали дистиллированной водой, сушили при температуре 100°C, затем перемалывали до состояния травяной муки. Температура озоления проб растений для определения 137Сs составляла 400°С, 90Sr – 550°С, 241Am – 650°С. Чашки с золой охлаждали в эксикаторе. Готовую золу просеивали через сито для удаления незольного остатка. Остывший зольный остаток взвешивали и определяли коэффициент озоления.
Определение удельной активности радионуклидов 137Cs, 40K, 232Th, 236Ra, 60Co, 152Eu, 154Eu, 155Eu, 238U, 235U, 214Pb и 241Am в пробах растений проводили на γ-спектрометре “Canberra” (США) c германиевым детектором (ВЕ 2020), предел обнаружения 0.7–20 Бк/кг [12]. Определение 90Sr в пробах растений проводили на β-спектрометре “Прогресс” (Россия), предел обнаружения 100 Бк/кг [13]. Погрешность измерений в основном не превышала 30%. Калибровку спектрометра проводили по энергии с использованием твердотельных источников 90Sr и/или 24Na. Удельная активность радионуклидов в растениях приведена в табл. 2 на воздушно сухой вес.
Таблица 2.
Удельная активность радионуклидов в растениях тонконога тонкого Table 2. Radionuclide activity concentrations in crested hairgrass plants
| № точки | Удельная активность радионуклидов в растениях, Бк/кг | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 90Sr | 40K | 232Th | 226Ra | 137Cs | 241Am | 60Co | 152Eu | 154Eu | 155Eu | 238U | 235U | 214Pb | |
| Участок № 1 | |||||||||||||
| 1 контроль | <100 | 490 ± 100 | 9.2 ± 2.1 | 16 ± 3 | 2.9 ± 0.6 | <0.4 | <1 | <5 | <2 | <2 | <3.8 | <1.5 | 11 ± 2 |
| 2 | (2.9 ± 0.3) × 105 | 840 ± 170 | <19 | 27 ± 7 | 8.7 ± 2.7 | <11 | <4 | <5 | <9 | <11 | <94 | <6 | 29 ± 6 |
| 3 | (3.2 ± 0.4) × 105 | 200 ± 60 | <13 | <7.2 | 17.2 ± 2.0 | <15 | <1 | <5 | <6 | 12 ± 7 | <120 | <3 | <5 |
| 4 | (4.6 ± 0.6) × 105 | 1200 ± 200 | <16 | 47 ± 6 | 7.8 ± 2.3 | 22 ± 8 | <2 | <5 | <7 | <13 | <120 | <4 | 32 ± 6 |
| 5 | (5.0 ± 0.5) × 105 | 770 ± 150 | <9 | 30 ± 6 | 10.7 ± 1.7 | 11.3 ± 4.0 | <1 | <5 | <6 | <9 | <63 | <9 | 25 ± 5 |
| 6 | (1.6 ± 0.2) × 106 | 470 ± 160 | <84 | <37 | 63 ± 15 | 22 ± 6 | <1 | <7 | <6 | <13 | <105 | <3 | <21 |
| 7 | (2.6 ± 0.3) × 106 | 570 ± 110 | 3.6 ± 1.7 | <9 | 22 ± 4 | 22 ± 4 | <1 | <5 | 6.7 ± 1.3 | <8 | <34 | <3 | 6.4 ± 2.4 |
| 8- | (3.1 ± 0.3) × 106 | 261 ± 70 | 27 ± 11 | <9 | 48.6 ± 3.4 | 58 ± 29 | <4 | <8 | 33.6 ± 54 | <10 | <385 | <8 | <10 |
| 9 | (4.3 ± 0.4) × 106 | 360 ± 70 | <6 | 11 ± 3 | 35.9 ± 1.7 | 21 ± 5 | <1 | <5 | 11 ± 3 | <10 | <77 | <4 | 14 ± 3 |
| 10 | (4.3 ± 0.4) × 106 | 280 ± 60 | <18 | <10 | 190 ± 40 | 180 ± 40 | <3 | <8 | 94 ± 7 | 71±24 | <450 | <9 | <22 |
| Участок № 2 | |||||||||||||
| 1 контроль | <100 | 950 ± 190 | 17 ± 3 | 29 ± 6 | 2.6 ± 0.6 | <0.5 | <0.8 | <1 | <4 | <1 | 22 ± 4 | <2 | 26 ± 5 |
| 2 контроль | <100 | – | – | – | 5.1 ± 1.5 | 4.79 ± 0.67 | – | <3 | – | <2 | <13 | – | <11 |
| 3 | (5.5 ± 0.7) × 104 | 210 ± 60 | <11 | <6 | 3.3 ± 1.6 | <8.6 | <1 | <3 | <5 | <7 | <70 | <2 | <3 |
| 4 | (2.2 ± 0.3) × 105 | 170 ± 80 | <16 | <8 | 9.7 ± 2.3 | 38 ± 11 | <1 | <5 | 14 ± 4 | <13 | <150 | <3 | <5 |
| 5 | (4.4 ± 0.5) × 105 | 1500 ± 300 | <17 | <10 | 15.2 ± 2.6 | 125 ± 11 | <2 | <5 | <7 | <16 | <140 | <4 | <6 |
| 6 | (9.1 ± 0.9) × 105 | 1400 ± 100 | 33 ± 12 | <11 | 6.1 ± 2.7 | 28 ± 14 | <2 | <6 | 17 ± 6 | <21 | <190 | <5 | <7 |
| 7 | (1.6 ± 0.2) × 106 | 490 ± 100 | <7 | <4 | 3.3 ± 1.1 | 27 ± 7 | <1 | <3 | 9.4 ± 2.3 | 15 ± 6 | <94 | <2 | <6 |
| 8 | (4.1 ± 0.4) × 106 | <121 | <19 | <11 | 19.7 ± 3.4 | 164 ± 34 | 2.6 ± 1.3 | <8 | 40 ± 6 | <38 | <443 | <8 | <9 |
| 9 | (7.9 ± 0.8) × 106 | 340 ± 70 | <14 | <9 | 6.8 ± 2.6 | <41 | <12 | <7 | 14 ± 5 | <35 | <344 | <7 | <19 |
| 10 | (1.0 ± 0.1) × 107 | 292 ± 66 | <23 | <14 | 35.0 ± 4.7 | 225 ± 53 | 4.5±1.6 | <9 | 74 ± 8 | <61 | <728 | <14 | <15 |
| Участок № 3 | |||||||||||||
| 1 контроль | <100 | <190 | <24 | <13 | <6 | <3 | <4 | <5 | <18 | <9 | <54 | <6 | <8 |
| 2 контроль | <100 | 140 ± 30 | <7 | <3 | <1.6 | <0.9 | <1.0 | <1.5 | <4 | <3 | <12 | <1.1 | <4 |
| 3 | (1.4 ± 0.6) × 103 | 140 ± 51 | <10 | <5 | <3 | <2 | <1.8 | <3 | <8 | <8 | <24 | <2 | <4 |
| 4 | (1.1 ± 0.5) × 103 | <76 | <10 | <5 | 5 ± 2 | <2 | <1.6 | <2 | <6 | <7 | <27 | <2 | <4 |
| 5 | (2.2 ± 0.4) × 104 | <140 | <16 | <10 | <5 | <4 | <3 | <5 | <14 | <10 | <88 | <5 | <7 |
| 6 | (3.9 ± 0.6) × 104 | 140 ± 70 | <16 | <8 | <4 | <4 | <2 | <5 | <10 | <10 | <80 | <3 | <6 |
| 7 | (7.3 ± 0.1) × 104 | 200 ± 90 | <21 | <12 | 9 ± 4 | <8 | <3 | <7 | <13 | <22 | <94 | <5 | <9 |
| 8 | (8.4 ± 1.1) × 104 | 930 ± 190 | <9 | 29 ± 3 | <2 | <4 | <1.3 | <3 | <6 | <10 | <71 | <2 | 32±2 |
| 9 | (1.8 ± 0.2) × 105 | 3300 ± 1700 | <22 | 49 ± 7 | <5 | <10 | <3 | <9 | <15 | <28 | <175 | 11 ± 4 | 36 ± 6 |
| 10 | (1.8 ± 0.2) × 106 | 2700 ± 500 | 45 ± 20 | <22 | 18 ± 7 | <52 | <4 | <20 | 42 ± 13 | <200 | 860 ± 390 | <42 | 63 ± 18 |
| 11 | (4.1 ± 0.4) × 106 | 735 ± 101 | <48 | <33 | 57 ± 12 | <110 | <6 | <30 | 57 ± 16 | <240 | <1200 | <46 | <64 |
| 12 | (4.8 ± 0.5) × 106 | 750 ± 15 | <36 | <24 | 24 ± 8 | <73 | <4 | 26 ± 15 | <21 | <140 | <870 | <32 | 42 ± 22 |
| 13 | (7.2 ± 0.7) × 106 | 1400 ± 300 | <42 | 49 ± 17 | <15 | <75 | 6 ± 4 | <25 | <29 | <240 | <1400 | <54 | 47 ± 24 |
| 14 | (1.4 ± 0.1) × 107 | 950 ± 190 | <25 | 38 ± 10 | 42 ± 6 | 107 ± 23 | <3 | <16 | 35 ± 12 | 86 ± 49 | <480 | <25 | 41 ± 12 |
| 15 | (2.6 ± 0.3) × 107 | 410 ± 130 | <79 | <50 | 72 ± 18 | <178 | 16 ± 6 | <46 | <35 | <370 | <2200 | <84 | <80 |
| 16 | (1.4 ± 0.1) × 107 | – | – | – | 290 | 230 ± 50 | – | – | – | – | – | – | – |
| 17 | (4.8 ± 0.5) × 106 | – | – | – | 350 ± 70 | 230 ± 50 | – | – | – | – | – | – | – |
| 18 | (2.6 ± 0.3) × 107 | – | – | – | <440 | <440 | – | – | – | – | – | – | – |
Оценка содержания радионуклидов в почве. Ввиду крайне высоких уровней радиоактивного загрязнения почвы на площадке “4А” сбор и исследование в лаборатории образцов почвы оказались невозможными по соображениям радиационной безопасности. Поэтому удельную активность радионуклидов в почве оценивали с использованием полученных экспериментально значений удельной активности радионуклидов в растениях и коэффициентов накопления радионуклидов растениями из справочника МАГАТЭ [14].
Мощность поглощенной растениями дозы для i-го радионуклида рассчитывали согласно основным допущениям и положениям дозиметрической модели оценки поглощенной растениями дозы, изложенным в публикации МКРЗ 108 [4]:
(1)
${{P}_{{{\text{общ}},i}}} = {\text{КДП}}_{{{\text{внеш,}}i}}^{{{\text{почва}}}}{{\sigma }_{{{\text{почва,}}i}}} + {\text{КДП}}_{{{\text{внутр,}}i}}^{{{\text{раст}}}}{{C}_{{{\text{раст,}}i}}},$Время от прорастания семян (начало апреля) до их созревания (конец июля) составляет порядка 120 сут.
Определение содержания тяжелых металлов в растениях. В растениях определяли содержание следующих тяжелых металлов: ванадий, хром, марганец, кобальт, никель, медь, цинк, мышьяк, стронций, кадмий, теллур, цезий, свинец и уран. Пробы растений готовили методом автоклавного разложения по стандартной методике [15]. Определение концентраций элементов проводили методом масс-спектрометрии с индуктивно-связанной плазмой на приборе “Elan 9000” (Perkin Elmer SCIEX, США) [16].
Цитогенетическое исследование образцов растений. Собранные семена подвергали предварительной камеральной обработке (очистка, стратификация и др.). Удаляли поврежденные семена, обломки стеблей и шелуху. Отобранные семена высушивали при комнатной температуре, после чего подвергали холодной стратификации. Для этого их выдерживали в течение 30 сут при температуре 1–5°С в холодильнике.
Воздушно-сухие семена раскладывали на влажную фильтровальную бумагу в чашках Петри. Семена проращивали в термостате MIR-253 при температуре 18–25°С в течение 7 ± 2 сут [17]. Проросшие семена, у которых главный корешок имел длину не менее длины семени, фиксировали в смеси 96%-ного этилового спирта и ледяной уксусной кислоты в соотношении 3:1 (фиксатор Кларка).
Для приготовления “давленных” препаратов проводили мацерацию растительной ткани, затем корешки помещали в краситель (ацетоорсеин). Корешки окрашивали в закрытых стеклянных бюксах в течение 1–2 ч. Окрашенные корешки наносили на предметное стекло, отрезали кончики (2–3 мм), добавляли каплю 45%-ного раствора уксусной кислоты, накрывали покровным стеклом и раздавливали объект так, чтобы клетки корешка распределились в один слой. Цитогенетический анализ проводили с использованием микроскопа “AxioImager M2” (Германия) при увеличении объектива ×100 (масляная иммерсия) и ×40.
Анализировали частоту аберрантных клеток в апикальной меристеме корешков прорастающих семян тонконога. При анализе учитывали такие цитогенетические аномалии, как мосты, фрагменты, отстающие хромосомы, забегающие хромосомы и многополюсные митозы [18]. Процент аберрантных клеток (М) определяли по формуле:
где: A – сумма ана-телофазных клеток с перестройками; N – общее число изученных ана-телофаз.Статистический анализ данных. Статистическую значимость различий по частоте встречаемости цитогенетических нарушений при разных дозах облучения по сравнению с контролем оценивали с помощью двухвыборочного t-критерия Стьюдента для альтернативных признаков с учетом поправки Йетса [19, 20]. Связь радиоактивного загрязнения с цитогенетическими нарушениями в апикальной меристеме корешков проростков тонконога тонкого исследовали методами корреляционного анализа. Для сравнения данных, находящихся в широком диапазоне значений (мощность поглощенной дозы в растениях изменяется на 5 порядков, а частота аберрантных клеток только на один порядок), применяли логарифмическое преобразование для первого показателя.
Анализ частоты цитогенетических нарушений в зависимости от дозы облучения проводили с применением кусочно-линейной регрессионной модели методом наименьших квадратов. При расчетах принят критический уровень значимости 0.05. Была принята гипотеза H0 о предполагаемой точке разрыва регрессионной кривой (Тр) для двух сегментов, относительно которой частота нарушений на единицу десятичного логарифма мощности поглощенной дозы в растениях статистически значимо отличается. Статистическая оценка групп данных, характеризующих частоту цитогенетических нарушений в зависимости от логарифма мощности поглощенной дозы, расположенных слева и справа от Тр, выполнена с применением уравнения линейной регрессии:
где Y – частота цитогенетических нарушений, %; Х – десятичный логарифм мощности поглощенной дозы в растениях; Тр – десятичный логарифм мощности поглощенной дозы в растениях, соответствующий положению точки разрыва на оси абсцисс; а1 – свободный член регрессии; а2 и а3 – коэффициенты регрессии.РЕЗУЛЬТАТЫ
Содержание радионуклидов в растениях. Результаты определения удельной активности радионуклидов в пробах растений приведены в табл. 2. Основной вклад в загрязнение растений вносит 90Sr, удельная активность которого в растениях контрольных участков ниже предела обнаружения β-спектрометра, в то время как на загрязненных участках она находится в диапазоне n × 103–n × 107 Бк/кг. Можно также отметить 40K и 238U, удельная активность которых в растениях некоторых экспериментальных точек превышала 1000 Бк/кг.
Дозовые нагрузки на генеративные органы растений. Поглощенная растениями доза в зависимости от участка менялась от 0.00014 до 15 Гр (табл. 3). Основную часть дозы растения получали от внутреннего облучения 90Sr. Вклад других радионуклидов в суммарную поглощенную дозу пренебрежимо мал.
Таблица 3.
Годовые дозы облучения растений тонконога тонкого Table 3. Absorbed by plants annual doses
| Внутренняя доза, мкГр | Внешняя доза, мкГр | Суммарная доза, Гр | ||
|---|---|---|---|---|
| 90Sr | другие радионуклиды | 90Sr | другие радионуклиды | |
| Участок № 1 | ||||
| 57.6 | 468.4 | 0.000019 | 0.56 | 0.00052 |
| 167 040 | 1066 | 0.056 | 1.16 | 0.168 |
| 184 320 | 611.6 | 0.06 | 0.76 | 0.184 |
| 264 960 | 1598 | 0.088 | 1.64 | 0.268 |
| 288 000 | 990 | 0.092 | 1.24 | 0.288 |
| 921 600 | 1481.6 | 0.3 | 3.48 | 0.92 |
| 1 497 600 | 534.4 | 0.48 | 1 | 1.48 |
| 1 785 600 | 1640.4 | 0.6 | 1.96 | 1.8 |
| 2 476 800 | 615.6 | 0.8 | 1.52 | 2.48 |
| 2 476 800 | 2292.8 | 0.8 | 6.56 | 2.48 |
| Участок № 2 | ||||
| 57.6 | 889.6 | 0.000019 | 0.96 | 0.00096 |
| 57.6 | 78.4 | 0.000019 | 0.164 | 0.00014 |
| 31 680 | 426 | 0.0104 | 0.308 | 0.032 |
| 126 720 | 808.8 | 0.04 | 0.6 | 0.128 |
| 253 440 | 1523.6 | 0.084 | 0.84 | 0.256 |
| 524 160 | 1336.8 | 0.172 | 0.6 | 0.52 |
| 921 600 | 604 | 0.3 | 0.26 | 0.92 |
| 2 361 600 | 2146.4 | 0.76 | 1.04 | 2.36 |
| 4 550 400 | 1426.4 | 1.48 | 0.56 | 4.56 |
| 5 760 000 | 3301.2 | 1.88 | 1.68 | 5.76 |
| Участок № 3 | ||||
| 57.6 | 518.4 | 0 | 0.64 | 0.00056 |
| 57.6 | 150.4 | 0 | 0.164 | 0.000208 |
| 806.4 | 232.4 | 0 | 0.28 | 0.00104 |
| 633.6 | 220.8 | 0 | 0.344 | 0.00084 |
| 12 672 | 528 | 0.004 | 0.52 | 0.0132 |
| 22 464 | 465.2 | 0.008 | 0.4 | 0.0228 |
| 42 048 | 622.4 | 0.012 | 0.72 | 0.044 |
| 48 384 | 994.8 | 0.016 | 0.92 | 0.048 |
| 103 680 | 2403.6 | 0.032 | 1.68 | 0.12 |
| 1 036 800 | 4018.4 | 0.336 | 1.44 | 1.04 |
| 2 361 600 | 4806.4 | 0.768 | 3 | 2.36 |
| 2 764 800 | 3516.8 | 0.9 | 1.6 | 2.76 |
| 4 147 200 | 5688.8 | 1.348 | 2.08 | 4.16 |
| 8 064 000 | 2796.4 | 2.62 | 2.52 | 8.08 |
| 14 976 000 | 8226.8 | 4.868 | 4.24 | 15 |
| 8 064 000 | 2812 | 2.62 | 10.6 | 8.08 |
| 27 64 800 | 2826 | 0.9 | 12.2 | 2.76 |
| 14 976 000 | 9170.8 | 4.868 | 16.48 | 15 |
Содержание тяжелых металлов в растениях. Сравнение результатов оценки концентраций тяжелых металлов в тканях тонконога с экспериментальных участков (табл. 4) с данными В.С. Добровольского [21] о средних концентрациях тяжелых металлов в растительности свидетельствует о том, что во всех случаях концентрации исследуемых элементов в пробах растений существенно ниже средних. Таким образом, концентрации тяжелых металлов не должны оказать токсическое воздействие на растения наших экспериментальных участков.
Таблица 4.
Содержание тяжелых металлов в растениях тонконога тонкого Table 4. The content of heavy metals in crested hairgrass plants
| Элемент | Содержание элементов, мг/кг | |||
|---|---|---|---|---|
| m* | g* | Ме(Q1/2–Q3/4) | кларк в расти-тельности суши [21] | |
| V, n = 34 | 2.2 | 1.7 | 1.2 (1–2) | 30 |
| Cr, n = 31 | 4.2 | 2.7 | 3.2 (1–6.3) | 35 |
| Mn, n = 34 | 89.0 | 78.2 | 84.5 (60–109) | 4100 |
| Co, n = 34 | 0.52 | 0.34 | 0.3 (0.2–0.4) | 10 |
| Cu, n = 34 | 3.3 | 3.2 | 3.2 (2.4–4) | 160 |
| Zn, n = 34 | 14.5 | 13.3 | 13.5 (10–17) | 600 |
| As, n = 32 | 0.32 | 0.25 | 0.2 (0.2–0.4) | 3 |
| Sr, n = 34 | 45.0 | 42.6 | 43 (34–54) | 700 |
| Cd, n = 34 | 0.13 | 0.12 | 0.1 (0.1–0.2) | 0.7 |
| Сs, n = 34 | 0.064 | 0.053 | 0.04 (0.03–0.1) | 3 |
| Pb , n = 34 | 3.0 | 2.7 | 2.4 (2–3) | 25 |
| U, n = 34 | 0.11 | 0.09 | 0.1 (0.1–0.1) | 0.4 |
Частота аберрантных клеток. Всего было изучено 1404 препарата апикальной меристемы проростков, 12 749 ана-телофазных клеток, из них аберрантных ана-телофаз – 874 (табл. 5).
Таблица 5.
Частота и спектр цитогенетических нарушений в проростках тонконога тонкого Table 5. Frequency and spectrum of cytogenetic abnormalities in seedlings of crested hairgrass
| № точки | Просмотрены и изучены | Число нарушений | Спектр нарушений, % ± m | Частота ана-телофаз с цитогенетическими нарушениями % ± m | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Число корешков | Число ана- телофазных клеток | Аберрантные клетки | Общее число нарушений | m' | m'' | f' | f'' | g | s | 3p | m' + f ' | m'' + f '' | g + s + 3p | ||
| Участок № 1 | |||||||||||||||
| 1(К) | 37 | 251 | 4 | 5 | 2 | 3 | – | – | – | – | – | 0.8 ± 0.6 | 1.2 ± 0.7 | – | 1.6 ± 0.8 |
| 2 | 41 | 236 | 7 | 9 | 5 | 2 | 1 | – | 1 | – | – | 2.5 ± 1.0 | 0.9 ± 0.6 | 0.4 ± 0.4 | 3.0 ± 1.1 |
| 3 | 32 | 185 | 7 | 9 | 3 | – | 3 | 2 | – | 1 | – | 3.2 ± 1.3 | 1.1 ± 0.8 | 0.5 ± 0.5 | 3.8 ± 1.4 |
| 4 | 22 | 161 | 2 | 2 | – | 1 | – | – | – | 1 | – | – | 0.6 ± 0.6 | 0.6 ± 0.6 | 1.2 ± 0.9 |
| 5 | 24 | 127 | 6 | 6 | 3 | 2 | – | 1 | – | – | – | 2.4 ± 1.4 | 2.4 ± 1.4 | – | 4.7 ± 2.0 |
| 6 | 42 | 290 | 14 | 20 | 6 | 6 | – | 1 | 1 | 6 | – | 2.1 ± 0.8 | 2.4 ± 0.9 | 2.4 ± 0.9* | 4.8 ± 1.3* |
| 7 | 36 | 183 | 21 | 22 | 8 | 5 | 4 | – | 1 | 1 | 7.0 ± 2.0** | 5.0 ± 1.6* | 1.1 ± 0.8 | 11.5 ± 2.4** | |
| 8 | 31 | 222 | 20 | 20 | 5 | 9 | 3 | 1 | – | 2 | – | 3.6 ± 1.3* | 4.5 ± 1.4* | 0.9 ± 0.6 | 9.0 ± 3.0* |
| 9 | 28 | 228 | 32 | 32 | 7 | 9 | 6 | 5 | 3 | 2 | – | 5.7 ± 1.5** | 6.1 ± 1.6** | 2.2 ± 1.0 | 14 ± 2.3** |
| 10 | 30 | 189 | 29 | 31 | 8 | 13 | 1 | 4 | 3 | 2 | – | 4.8 ± 1.6* | 9.0 ± 2.1*** | 2.6 ± 1.2 | 15.3 ± 2.6** |
| Участок № 2 | |||||||||||||||
| 1(К) | 39 | 402 | 6 | 9 | 4 | 1 | 3 | – | 1 | – | – | 1.7 ± 0.6 | 0.2 ± 0.2 | 0.2 ± 0.2 | 1.5 ± 0.6 |
| 2(К) | 124 | 107 | 1 | 1 | - | - | 1 | – | – | – | – | 0.9 ± 0.9 | – | – | 0.9 ± 1.0 |
| 3 | 23 | 172 | 4 | 6 | 2 | 1 | 3 | – | – | – | – | 3.0 ± 1.3 | 0.6 ± 0.6 | – | 2.3 ± 1.1 |
| 4 | 49 | 254 | 6 | 8 | 6 | 1 | 1 | – | – | – | – | 2.8 ± 1.0 | 0.4 ± 0.4 | – | 2.4 ± 1.0 |
| 5 | 56 | 459 | 12 | 12 | 3 | - | 2 | – | 2 | – | – | 1.1 ± 0.5 | 0.4 ± 0.3 | – | 2.6 ± 0.7 |
| 6 | 48 | 251 | 10 | 14 | 3 | 5 | 2 | – | 4 | – | – | 2.0 ± 0.9 | 2.0 ± 0.9 | 1.6 ± 0.8 | 4.0 ± 1.2 |
| 7 | 30 | 199 | 11 | 13 | 6 | 1 | 1 | 1 | 4 | – | – | 3.5 ± 1.3 | 1.0 ± 0.7 | 2.0 ± 1.0 | 5.5 ± 1.6* |
| 8 | 34 | 263 | 18 | 18 | 3 | 6 | 5 | 2 | 2 | – | – | 3.0 ± 1.1 | 3.0 ± 1.1* | 0.8 ± 0.5 | 6.8 ± 1.6* |
| 9 | 50 | 448 | 55 | 56 | 12 | 25 | 2 | 6 | 5 | 6 | – | 3.1 ± 0.8 | 7.0 ± 1.2*** | 2.9 ± 0.8*** | 12.3 ± 1.6** |
| 10 | 59 | 475 | 43 | 44 | 11 | 13 | 5 | 4 | 4 | 7 | – | 3.4 ± 0.8 | 3.6 ± 0.9*** | 2.3 ± 0.7** | 9.0 ± 1.3** |
| Участок № 3 | |||||||||||||||
| 1(К) | 32 | 330 | 4 | 4 | 1 | 1 | 1 | 1 | – | – | – | 0.6 ± 0.4 | 0.6 ± 0.4 | – | 1.2 ± 0.6 |
| 2(К) | 26 | 299 | 4 | 4 | 1 | 3 | – | – | – | – | – | 0.3 ± 0.3 | 1.0 ± 0.6 | – | 1.3 ± 0.7 |
| 3 | 41 | 508 | 9 | 9 | 2 | 3 | 1 | 1 | 1 | 1 | – | 0.6 ± 0.3 | 0.8 ± 0.4 | 0.4 ± 0.3 | 1.7 ± 0.6 |
| 4 | 33 | 424 | 8 | 8 | 2 | 3 | 1 | 1 | 1 | – | – | 0.7 ± 0.4 | 1.0 ± 0.5 | 0.2 ± 0.2 | 1.9 ± 0.7 |
| 5 | 25 | 281 | 5 | 5 | 2 | 1 | 2 | – | – | – | – | 1.4 ± 0.7 | 0.4 ± 0.4 | – | 1.8 ± 0.8 |
| 6 | 29 | 445 | 10 | 10 | 4 | 3 | 1 | 1 | 1 | – | – | 1.1 ± 0.5 | 0.9 ± 0.4 | 0.2 ± 0.2 | 2.2 ± 0.7 |
| 7 | 26 | 275 | 8 | 8 | 1 | 4 | 1 | 1 | 1 | – | – | 0.7 ± 0.5 | 1.8 ± 0.8 | 0.4 ± 0.4 | 3.0 ± 1.0 |
| 8 | 31 | 466 | 16 | 16 | 2 | 8 | 2 | 2 | – | 1 | 1 | 0.9 ± 0.4 | 2.1 ± 0.7 | 0.4 ± 0.3 | 3.4 ± 0.8* |
| 9 | 34 | 441 | 27 | 29 | 6 | 5 | 5 | 5 | 4 | 4 | – | 2.5 ± 0.7* | 2.3 ± 0.7* | 1.8 ± 0.6 | 6.0 ± 1.1** |
| 10 | 37 | 408 | 30 | 30 | 5 | 11 | 2 | 5 | 3 | 4 | – | 1.7 ± 0.6 | 4.0 ± 1.0*** | 1.7 ± 0.6 | 7.4 ± 1.3** |
| 11 | 23 | 228 | 24 | 24 | 7 | 9 | 2 | 4 | 1 | 1 | – | 4.0 ± 1.3* | 5.7 ± 1.5** | 0.9 ± 0.6 | 10.5 ± 2.0** |
| 12 | 40 | 627 | 56 | 59 | 9 | 32 | 4 | 5 | 5 | 5 | 1 | 2.1 ± 0.6* | 6.0 ± 1.0*** | 1.8 ± 0.5 | 9.0 ± 1.1** |
| 13 | 22 | 256 | 31 | 33 | 12 | 11 | 1 | 5 | 2 | 2 | – | 5.0 ± 1.4** | 6.3 ± 1.5*** | 1.6 ± 0.8 | 12 ± 2.0** |
| 14 | 20 | 266 | 36 | 36 | 3 | 16 | 4 | 8 | 4 | 1 | – | 2.6 ± 1.0* | 9.0 ± 1.8*** | 1.9 ± 0.8 | 13.5 ± 2.1** |
| 15 | 47 | 532 | 73 | 74 | 11 | 31 | 13 | 9 | 3 | 7 | – | 4.5 ± 0.9*** | 7.5 ± 1.0*** | 1.9 ± 0.6* | 13.7 ± 1.5** |
| 16 | 30 | 632 | 62 | 63 | 6 | 32 | 3 | 4 | 3 | 10 | 5 | 1.4 ± 0.5 | 5.7 ± 1.0*** | 2.8 ± 0.7** | 10 ± 1.2** |
| 17 | 28 | 482 | 69 | 76 | 10 | 19 | 9 | 14 | 2 | 18 | 4 | 4.0 ± 0.9*** | 6.8 ± 1.1*** | 5.0 ± 1.0*** | 14.3 ± 1.6** |
| 18 | 45 | 747 | 94 | 100 | 18 | 37 | 9 | 10 | 5 | 17 | 4 | 3.6 ± 0.7*** | 6.3 ± 0.9*** | 3.5 ± 0.7*** | 12.7 ± 1.2** |
Примечание. К – контроль; f ' и f '' – одиночные и двойные фрагменты; m' и m'' – одиночные и двойные мосты; m' + f ' – хроматидные мосты и фрагменты; m'' + f '' – хромосомные мосты и фрагменты; g – отставания хромосом; s – забегания хромосом; 3р – трехполюсные митозы. Различия с контролем статистически значимы при уровне значимости: * р < 0.05, ** р < 0.01, – *** р < 0.001. Note. C – control; f ' and f '' – single and double fragments; m' and m'' – single and double bridges; m' + f ' – chromatide (single) bridges and fragments; m" + f " – chromosome (double) bridges and fragments; g – chromosome lags; s – overlapping chromosome; 3p-triple pole mitosis. Significant difference from the control: * р < 0.05, ** р < 0.001, ***р < 0.001.
Уникальный для полевых исследований как по количеству экспериментальных точек, так и по диапазону поглощенных доз набор данных позволил оценить форму дозовой зависимости по частоте цитогенетических нарушений. Результаты статистической оценки параметров уравнения (3) приведены в табл. 6. Свободный член данной зависимости а1 может быть интерпретирован как частота цитогенетических нарушений при равной нулю мощности дозы, а2 и а3 – как тангенс угла наклона к оси абсцисс на участках зависимости до и после точки перегиба.
Таблица 6.
Статистические оценки параметров зависимости цитогенетических нарушений от десятичного логарифма мощности поглощенной дозы Table 6. Statistical estimates of parameters of the dependence of cytogenetic abnormalities on decimal logarithm of the absorbed dose rate
| Вид цитогенетических нарушений | Параметр | Параметр и его стандартная ошибка | Критерий Стьюдента | Уровень значимости, отн. ед. | Доверительный интервал параметра | |
|---|---|---|---|---|---|---|
| нижний | верхний | |||||
| Частота аберрантных клеток | a1 | 3.734 ± 0.886 | 4.216 | 0.000 | 1.934 | 5.534 |
| a2 | 0.711 ± 0.395 | 1.803 | 0.080 | –0.062 | 1.485 | |
| Tp | 5.401 ± 0.215 | 24.764 | 0.000 | 4.958 | 5.844 | |
| a3 | 6.188 ± 0.854 | 7.248 | 0.000 | 4.453 | 7.923 | |
| Частота одиночных фрагментов и мостов | a1 | 0.502 ± 1.151 | 0.436 | 0.665 | –1.836 | 2.840 |
| a2 | –0.222 ± 0.941 | –0.236 | 0.815 | –2.134 | 1.690 | |
| Tp | 3.513 ± 1.265 | 2.777 | 0.009 | 0.942 | 6.084 | |
| a3 | 0.988 ± 0.248 | 3.988 | 0.000 | 0.484 | 1.491 | |
| Частота двойных фрагментов и мостов | a1 | 1.402 ± 0.538 | 2.607 | 0.014 | 0.307 | 2.497 |
| a2 | 0.193 ± 0.246 | 0.784 | 0.439 | –0.308 | 0.694 | |
| Tp | 5.366 ± 0.250 | 21.503 | 0.000 | 4.858 | 5.875 | |
| a3 | 3.617 ± 0.614 | 5.894 | 0.000 | 2.367 | 4.868 | |
| Частота трехполюсных митозов, забеганий и отставаний хромосом | a1 | 0.323 ± 2.039 | 0.158 | 0.875 | –3.868 | 4.513 |
| a2 | 0.020 ± 1.041 | 0.019 | 0.985 | –2.120 | 2.160 | |
| Tp | 4.350 ± 2.587 | 1.682 | 0.105 | –0.968 | 9.667 | |
| a3 | 0.803 ± 0.217 | 3.708 | 0.001 | 0.358 | 1.249 | |
В контрольных точках поглощенная доза находится в интервале 0.14–0.96 мГр, а частота аберрантных клеток в среднем составляет 1.4 ± 0.3% (n = 5). Необходимо отметить неравномерное распределение пар наблюдений (доза – частота цитогенетических нарушений) в пределах исследуемого диапазона доз, поскольку при дозе менее 10 мГр имеются только семь точек, причем пять из них являются контрольными. Для снижения разброса значений мощности поглощенной в растениях дозы, которая изменялась на пять математических порядков при изменениях частоты аберрантных клеток только на один порядок, выполнено логарифмическое преобразование значений мощности поглощенной дозы. Из представленных на рис. 2 данных можно предположить существование двух участков, в пределах которых изменение частоты цитогенетических нарушений с дозой принципиально отличается. Результаты расчета параметров представленной на рис. 2 зависимости (см. табл. 6) показали, что с 95%-ной доверительной вероятностью абсцисса точки перегиба соответствует поглощенной дозе 250 мГр, а доверительный диапазон поглощенных доз, в котором она находится – 90–690 мГр. При этом до точки перегиба частота аберрантных клеток статистически значимо не увеличивается с дозой (a2 = 0.711 ± 0.395 при р > 0.05). Превышение соответствующей точке перегиба дозы 250 мГр ведет к резкому увеличению частоты аберрантных клеток с дозой (на 6.2% при 10-кратном увеличении мощности поглощенной дозы). Таким образом, исходя из представленных в настоящей работе результатов полевых исследований, можно предположить наличие статистически значимой пороговой дозы, ниже которой частота цитогенетических эффектов в природных популяциях растений не превышает значимо спонтанный уровень. Однако, поскольку статистические параметры этой зависимости находятся на границе значимости (см. табл. 6), для обоснования или опровержения этой гипотезы необходимо проведение дополнительных исследований.
Рис. 2.
Зависимость частоты аберрантных клеток от десятичного логарифма поглощенной растениями дозы.
Fig. 2. Dependence of the aberrant cells frequency on the decimal logarithm of absorbed by plants dose.

Спектр цитогенетических нарушений. В ходе цитогенетического анализа были обнаружены следующие типы нарушений (рис. 3): одиночные и двойные мосты, одиночные и двойные фрагменты, митотические нарушения (забегания, отставания хромосом, трехполюсные митозы). В некоторых клетках присутствовали сразу несколько типов нарушений. Данные о частоте аберраций разного типа и их относительном вкладе в спектр цитогенетических нарушений представлены в табл. 5, из которой следует, что в условиях хронического облучения основной вклад (40–80%) в спектр структурных мутаций в популяциях тонконога тонкого вносят одиночные и двойные мосты. Вклад одиночных, двойных фрагментов и митотических аномалий менее 50% (табл. 5). Частота аберраций хроматидного и хромосомного типа статистически значимо превышала контрольный уровень на участках с поглощенной растениями дозой более 0.1 Гр, митотических аномалий – на участках с поглощенной дозой более 2.7 Гр (табл. 3, табл. 5).
Рис. 3.
Цитогенетические аномалии в ана-телофазных клетках тонконога с площадки “4А”: а – нормальная анафаза; б – одиночный мост; в – одиночный мост и забегание хромосомы (сложное нарушение); г – двойной мост и забегания хромосом (сложное нарушение); д – двойной мост; е – двойной фрагмент; ж – забегания хромосом, з – трехполюсный митоз; и) отставания хромосом.
Fig. 3. Cytogenetic abnormalities in the ana-telophase cells of crested hairgrass growing in the “4А” site: а – normal ana-telophase cell; b – single bridge; c – single bridge and chromosome overlapping (complex abnormalities); d – double bridge and chromosome overlapping (complex abnormalities); e – double bridge; f – double fragment; g – chromosome overlapping, h – triple pole mitosis; i – chromosome lagging.

Статистический анализ зависимостей “мощность поглощенной дозы–частота разных типов цитогенетических нарушений” свидетельствует о наличии точек перегиба, характеризующих резкое изменение частоты выхода данного типа нарушений с дозой (табл. 6). В частности, для частоты двойных мостов и фрагментов значение точки перегиба (232 мГр) и ее доверительный интервал (70–750 мГр) практически совпадают с показателями для частоты аберрантных клеток, что подчеркивает ведущий вклад этого вида цитогенетических нарушений в формирование аберрантных клеток.
Поскольку повышенная частота двойных мостов и фрагментов типична для облученных организмов [22], эти данные являются еще одним подтверждением радиационной природы наблюдаемых изменений. Для остальных цитогенетических эффектов связь с мощностью дозы несколько ниже, а для митотических аномалий значимость точки перегиба вообще не удалось показать. Наиболее сильная связь с мощностью дозы обнаружена для двойных мостов, дозовая зависимость для которых фактически повторяет зависимость для частоты аберрантных клеток (рис. 2, 4). Таким образом, в условиях загрязнения среды обитания тонконога тонкого преимущественно 90Sr основной вклад в формирование цитогенетических эффектов вносят двойные мосты.
Рис. 4.
Зависимость частоты двойных мостов от поглощенной дозы на экспериментальных участках СИП.
Fig. 4. The relationship between the frequency of double bridges and the absorbed dose at the experimental sites of the STS.

До точки перегиба частота всех видов цитогенетических нарушений не зависит от дозы (параметр а2 не отличается статистически значимо от нуля (а2 = –0.222 – 0.193 при значении t-критерия Стьюдента = –0.236–0.784 и уровне значимости р > 0.44). После точки перегиба ситуация кардинально меняется: значения тангенса угла наклона а3 рассчитаны с высокой степенью надежности (t > 3.7 при p < 0.001). Таким образом, статистический анализ параметров зависимости “доза–эффект” по всем видам цитогенетических нарушений подтверждает наличие пороговой дозы, ниже которой частота нарушений не отличается от спонтанного уровня, а выше – возрастает с увеличением дозы. Тем не менее полученные результаты в силу неравномерного распределения экспериментальных данных в пределах исследуемого диапазона доз и присущей полевым наблюдениям неопределенности в оценках доз требуют дополнительного исследования.
ОБСУЖДЕНИЕ
Выбранные для проведения исследований на площадке “4А” 38 экспериментальных точек (в том числе пять контрольных) не отличались друг от друга по почвенно-климатическим условиям и загрязнению тяжелыми металлами (табл. 4), но были контрастны по уровню радиоактивного загрязнения (табл. 2). Доминирующую роль в радиоактивном загрязнении площадки “4А” играет 90Sr, удельная активность которого в отдельных пробах растений достигала нескольких МБк/кг. Учитывая высокую подвижность 90Sr в системе почва–растение [23], не удивительно, что основной вклад в дозовую нагрузку растений внесло внутреннее облучение 90Sr (табл. 3). Исходя из однородности участков по почвенно-климатическим условиям и содержанию тяжелых металлов, можно утверждать, что наблюдаемые в популяциях тонконога цитогенетические эффекты являются следствием радиационного воздействия.
По мнению МКРЗ [4], значимые изменения в популяциях злаковых растений начинаются с годовой дозы ∼3.65 Гр. Поэтому радиационное воздействие на природные популяции тонконога на площадке “4А”, где проводили испытания боевых радиоактивных веществ, было достаточно высоким для индукции значительных биологических эффектов. Действительно, частота цитогенетических нарушений в проростках семян на участках с поглощенной дозой выше 250 мГр статистически значимо превышала уровень контроля и увеличивалась до 15% (табл. 5). Впервые по данным полевых исследований установлена пороговая доза, ниже которой частота цитогенетических нарушений не превышает статистически значимо спонтанный уровень. Этот результат имеет важное значение для развития системы радиационной защиты биоты. Однако полученные результаты, в силу недостаточной статистической нагруженности и присущей полевым наблюдениям неопределенности в оценках доз, требуют дополнительного исследования.
Ранее пороговый характер дозовой зависимости был установлен нами в лабораторных экспериментах с облучением семян пшеницы [24], семян [25] и проростков ячменя [26]. Представленные в работе [27] результаты эксперимента с корневым поступлением радионуклидов 90Sr в растения ячменя также позволяют предположить наличие дозонезависимого участка по частоте клеток с аберрациями вплоть до 0.2 Гр (в нашем случае 0.25 Гр) с последующим линейным ростом до 2.4 Гр, после чего частота цитогенетических нарушений выходит на плато. В нашем исследовании прирост частоты цитогенетических нарушений с дозой также резко замедляется, начиная с доз порядка 4 Гр. Однако имеющихся в нашем распоряжении данных оказалось недостаточно, чтобы обосновать статистически значимое плато в диапазоне 4–15 Гр. Тем не менее сопоставление выявленной в ходе настоящего исследования формы эмпирической дозовой зависимости с полученными ранее результатами показало, что кривые имеют схожий вид. Результаты различаются лишь значениями доз, при которых происходит выход на плато (2.4 Гр в работе [27], 4 Гр в нашем случае). При этом надо учитывать, что ячмень гораздо чувствительнее тонконога к действию ионизирующего излучения [28], а цитогенетические эффекты в работе [27] оценивались в более чувствительной фазе мейоза.
Таким образом, в ходе исследования цитогенетических эффектов у тонконога, произрастающего в местах испытания боевых радиоактивных веществ, установлена нелинейная зависимость между частотой цитогенетических нарушений в апикальной меристеме корешков проростков семян и дозой, поглощенной критическими органами растений. В диапазоне доз 0.14–250 мГр частота цитогенетических эффектов не отличается от контрольного уровня, т.е. установлен порог для данного типа эффектов. Превышение пороговой дозы ведет к линейному росту частоты цитогенетических нарушений вплоть до 15%. Основной вклад в формирование цитогенетических эффектов вносят двойные мосты, что служит еще одним подтверждением радиационной природы наблюдаемых изменений.
Сложившаяся на территории СИП уникальная радиоэкологическая ситуация, характеризующаяся значительным диапазоном уровней радиоактивного загрязнения, широким спектром радионуклидов, наличием участков с доминирующим вкладом излучений разного типа в формирование дозовой нагрузки на объекты живой природы, а также климатическими особенностями данного региона, предоставляет широкие возможности для изучения биологических эффектов в биоценозах, подвергающихся хроническому радиационному воздействию на фоне экстремальных условий среды обитания. Населяющие в настоящее время территорию СИП организмы являются потомками растений и животных, испытавших острое радиационное воздействие в период проведения ядерных испытаний и в течение многих поколений подвергавшихся хроническому облучению. Очевидна ценность получаемых в таких условиях данных как для научного обоснования оценок риска радиационного воздействия для человека и живой природы, так и для понимания сложных процессов, происходящих в биосфере в условиях увеличивающегося техногенного воздействия.
Список литературы
Логачёв В.А. Ядерные испытания СССР. Семипалатинский полигон: факты, свидетельства, воспоминания. Обеспечение общей и радиационной безопасности ядерных испытаний. М.: ФУ Медбиоэкстрем, 1997. 319 с. [Logachyov V.A. Yadernye ispytaniya SSSR. Semipalatinskij poligon: fakty, svidetel’stva, vospominaniya. Obespechenie obshchej i radiacionnoj bezopasnosti yadernyh ispytanij. M.: FU Medbioekstrem, 1997. 319 p. (In Russian)]
Мозолин Е.М., Гераськин С.А., Минкенова К.С. Радиобиологические эффекты у растений и животных Семипалатинского испытательного полигона (Казахстан) // Радиац. биология. Радиоэкология. 2008. Т. 48. № 4. С. 422–431. [Mozolin E.M., Geras’kin S.A. Minkenova K.S. Radiobiologicheskie effekty u rastenij i zhivotnyh Semipalatinskogo ispytatel’nogo poligona (Kazahstan) // Radiac. biologiya. Radioekologiya. 2008. V. 48. № 4. Р. 422–431. (In Russian)]
Кундузбаева А.Е., Кабдыракова А.М., Лукашенко С.Н., Магашева Р.Ю. Сравнительная оценка форм нахождения радионуклидов в почвах некоторых участков территории СИП // Актуальные вопросы радиоэкологии Казахстана: Сборник трудов Национального ядерного центра Республики Казахстан за 2011 г. Т. 2. Вып. 3. Павлодар: Дом печати, 2011. С. 101–119. [Kunduzbaeva A.E., Kabdyrakova A.M., Lukashenko S.N., Magasheva R.Yu. Sravnitel’naya ocenka form nahozhdeniya radionuklidov v pochvah nekotoryh uchastkov territorii SIP // Aktual’nye voprosy radioekologii Kazahstana: Sbornik trudov Nacional’nogo yadernogo centra Respubliki Kazahstan za 2011 g. V. 2. № 3. Pavlodar: Dom pechati, 2011. Р. 101–119. (In Russian)]
Осинцев А.Ю., Сальменбаев С.Е. Исследование характера и уровней радиоактивного загрязнения площадки испытаний боевых радиоактивных веществ // Актуальные вопросы радиоэкологии Казахстана. Вып. 4. Т. 1. Павлодар: Дом печати, 2013. С. 189–201. [Osincev A.YU., Sal’menbaev S.E. Issledovanie haraktera i urovnej radioaktivnogo zagryazneniya ploshchadki ispytanij boevyh radioaktivnyh veshchestv // Aktual’nye voprosy radioekologii Kazahstana. V. 1. № 4. Pavlodar: Dom pechati, 2013. Р. 189–201. (In Russian)]
ICRP Publication 108. Environmental protection: the concept and use of reference animals and plants. Annals ICRP 38. 2009. P. 1–242.
Гераськин С.А., Мозолин Е.М., Дикарев В.Г. и др. Цитогенетические эффекты в популяциях Koeleria gracilis Pers. с территории Семипалатинского испытательного полигона // Радиац. биология. Радиоэкология. 2009. Т. 49. № 2. С. 147–157. [Geras’kin S.A., Mozolin E.M., Dikarev V.G. et al. Citogeneticheskie effekty v populyaciyah Koeleria gracilis Pers. s territorii Semipalatinskogo ispytatel’nogo poligona // Radiac. biologiya. Radioekologiya. 2009. V. 49. №2. Р. 147–157. (In Russian)]
Назарбаев Н.А., Школьник В.С., Батырбеков Э.Г. и др. Проведение комплекса научно-технических и инженерных работ по приведению бывшего Семипалатинского испытательного полигона в безопасное состояние (монография). Т. 1. Павлодар: Дом Печати, 2016. 320 с. [Nazarbaev N.A., Shkol’nik V.S., Batyrbekov E.G. i dr. Provedenie kompleksa nauchno-tekhnicheskih i inzhenernyh rabot po privedeniyu byvshego Semipalatinskogo ispytatel’nogo poligona v bezopasnoe sostoyanie (monografiya). V. 1. Pavlodar: Dom Pechati, 2016. 320 p. (In Russian)]
Актуальные вопросы радиоэкологии Казахстана. Радиоэкологическое состояние “Северной” части территории Семипалатинского испытательного полигона / Под ред. С.Н. Лукашенко. Павлодар: Дом печати, 2010. Вып. 1. 234 с. [Aktual’nye voprosy radioekologii Kazahstana. Radioekologicheskoe sostoya-nie “Severnoj” chasti territorii Semipalatinskogo ispytatel’nogo poligona / Pod red. S.N. Lukashenko. V. 1. Pavlodar: Dom pechati, 2010. 234 p. (In Russian)]
Карамышева З.В., Рачковская Е.И. Ботаническая география степной части Центрального Казахстана. Л.: Наука, 1973. 277 с. [Karamysheva Z.V., Rachkovskaya E.I. Botanicheskaya geografiya stepnoj chasti Central’nogo Kazahstana. L.: Nauka; 1973. 277 p (In Russian)]
Власова Н.В. Флора Сибири. Т. 2. Новосибирск: Наука, 1990. 361 с. [Vlasova N.V. Flora Sibiri. V. 2. Novosibirsk: Nauka, 1990. 361 p. (In Russian)]
Инструкция и методические указания по наземному обследованию радиационной обстановки на загрязненной территории. Межведомственная комиссия по радиационному контролю природной среды при Госкомгидромете СССР. М., 1989. 118 с. [Instrukciya i metodicheskie ukazaniya po nazemnomu obsledovaniyu radiacionnoj obstanovki na zagryaznennoj territorii. Mezhvedomstvennaya komissiya po radiacionnomu kontrolyu prirodnoj sredy pri Goskomgidromete SSSR. M.: 1989. 118 p. (In Russian)]
МИ 5.06.001.98 РК Активность радионуклидов в объемных образцах. Методика выполнения измерений на гамма-спектрометре. МИ 2143-91. 18 с. [MI 5.06.001.98 RK Aktivnost’ radionuklidov v ob"emnyh obrazcah. Metodika vypolneniya izmerenij na gamma-spektrometre. MI 2143-91. 18 p. (In Russian)]
Методика измерения активности радионуклидов с использованием сцинтилляционного бета-спектрометра с программным обеспечением “Прогресс” МВИ №40090.4Г006, Менделеево. 20 с. [Metodika izmereniya aktivnosti radionuklidov s ispol’zovaniem scintillyacionnogo beta-spektrometra s programmnym obespecheniem “Progress” MVI №40090.4G006, Mendeleevo. 20 p. (In Russian)]
Handbook of Parameter Values for the Prediction of Radionuclide Transfer in Terrestrial and Freshwater Environments Technical Reports Series No. 472. Vienna: IAEA, 2010. 194 p.
Подготовка проб для элементного анализа методом автоклавного разложения. Рабочая инструкция. РИ 03-02-03 (А). Курчатов: ИРБЭ НЯЦ РК, 2014. 12 с. [Podgotovka prob dlya elementnogo analiza metodom avtoklavnogo razlozheniya. Rabochaya instrukciya. RI 03-02-03 (A). Kurchatov: IRBE NYAC RK, 2014. 12 p. (In Russian)]
Рабочая инструкция. Проведение элементного анализа проб растений методом масс-спектрометрии с индуктивно связанной плазмой на масс-спектрометре ELAN 9000. Курчатов, 2018. 25 с. [Rabochaya instrukciya. Provedenie elementnogo analiza prob rastenij metodom mass-spektrometrii s induktivno svyazannoj plazmoj na mass-spektrometre ELAN 9000. Kurchatov: 2018. 25 p. (In Russian)]
Майсурян Н.А. Практикум по растениеводству. М.: 1980. 447 с. [Majsuryan N.A. Praktikum po rastenievodstvu. M.: Kolos, 1980. 447 p. (In Russian)]
Паушева З.В. Практикум по цитологии растений. М.: Колос, 1980. 225 с. [Pausheva Z.V. Praktikum po citologii rastenij. M.: Kolos, 1980. 225 p. (In Russian)]
Лакин Г.Ф. Биометрия. М.: Высш. школа, 1990. 352 с. [Lakin G.F. Biometriya. M.: Vysshaya shkola, 1990. 352 p. (In Russian)]
Кобзарь А.И. Прикладная математическая статистика. М.: Физматлит, 2006. 816 с. [Kobzar’ A.I. Prikladnaya matematicheskaya statistika. M.: Fizmatlit; 2006. 816 p. (In Russian)]
Добровольский В.С. Основы биогеохимии. М.: Академия, 2003. 400 с. [Dobrovol’skij V.S. Osnovy biogeohimii. M.: Akademiya, 2003. 400 p. (In Russian)]
Streffer C., Bolt H., Follesdal D. et al. Low dose exposures in the environment. Dose-effect relations and risk evaluation. Berlin–Heidelberg: Springer-Verlag, 2004. 471 p.
Burger A., Lichtscheidl I. Strontium in the environment: Review about reactions of plants towards stable and radioactive strontium isotopes // Sci. Total Environ. 2019. V. 653. P. 1458–1512.
Гераськин С.А., Зяблицкая Е.Я., Удалова А.А. Закономерности индукции γ-излучением структурных мутаций в корневой меристеме проростков семян гексаплоидной пшеницы // Радиац. биология. Радиоэкология. 1995. Т. 35. Вып. 2. С. 137–149. [Geras’kin S.A., Zyablickaya E.Ya., Udalova A.A. Zakonomernosti induktsii γ-izlucheniem strukturnih mutatsiy v kornevoy meristeme propostkov semian geksaploidnoy pshenitsi // Radiac. biologiya. Radioekologiya. 1995. V. 35. № 2. P. 137–149. (In Russian)]
Гераськин С.А., Зяблицкая Е.Я., Удалова А.А. Закономерности выхода структурных мутаций в корневой меристеме облученных ионизирующим излучением семян ячменя // Радиац. биология. Радиоэкология. 1997. Т. 37. Вып. 1. С. 82–90. [Geras’kin S.A., Zyablickaya E.Ya., Udalova A.A. Zakonomernosti vihoda strukturnih mutatsiy v kornevoy meristeme obluchennih ioniziruyuschim izlucheniem semian yachmenia // Radiac. biologiya. Radioekologiya. 1997. V. 37. № 1. P. 82–90. (In Russian)]
Гераськин С.А., Дикарев В.Г., Удалова А.А., Дикарева Н.С. Закономерности индукции малыми дозами ионизирующего излучения цитогенетических повреждений в корневой меристеме проростков ячменя // Радиац. биология. Радиоэкология. 1999. Т. 39. Вып. 4. С. 373–383. [Geras’kin S.A., Dikarev V.G., Udalova A.A., Dikareva N.S. Zakonomernosti indukcii malymi dozami ioniziruyushchego izlucheniya citogeneticheskih povrezhdenij v kornevoj meristeme prorostkov yachmenya // Radiac. biologiya. Radioekologiya. 1999. V. 39. № 4. P. 373–383. (In Russian)]
Зяблицкая Е.Я., Кальченко В.А., Алексахин Р.М., Зуев Н.Д. Кинетика формирования поглощенных доз и влияние хронического ß-излучения на цитогенетические показатели и урожай у ячменя // Радиобиология. 1984. Т. 24. Вып. 6. С. 774–778. [Zyablickaya E.Ya., Kal’chenko V.A., Aleakhin R.M., Zuev N.D. Kinetika formirovaniya pogloshchennyh doz i vliyanie hronicheskogo ß-izlucheniya na citogeneticheskie pokazateli i urozhaj u yachmenya // Radiobiologiya. 1984. V. 24. №6. P. 774–778. (In Russian)]
Преображенская Е.И. Радиоустойчивость семян растений. М.: Атомиздат, 1971. 239 с. [Preobrazhenskaya E.I. Radioustojchivost’ semyan rastenij. M.: Atomizdat, 1971. 239 p. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


