Радиационная биология. Радиоэкология, 2021, T. 61, № 1, стр. 54-68
Современные представления о механизмах действия ультрафиолетового излучения на клетки и субклеточные системы
В. Г. Артюхов 1, О. В. Башарина 1, *
1 Воронежский государственный университет
Воронеж, Россия
* E-mail: bov-bio@yandex.ru
Поступила в редакцию 23.04.2020
После доработки 24.08.2020
Принята к публикации 28.08.2020
Аннотация
Представлен анализ воздействия УФ-облучения на лимфоциты и кератиноциты человека. Основные эффекты УФ-излучения связаны с изменением передачи сигнала или функционирования сигнальных путей в клетках. В результате изменяется ряд внутриклеточных процессов (синтез белков, метаболизм клетки, запуск программируемой или непрограммируемой клеточной гибели и др.). Рассматривается влияние УФ-облучения на метаболизм клеток, на синтез ряда белков (в том числе регуляция транскрипции активными формами кислорода), на концентрацию кальция в клетке и на кальций-зависимые регуляторные пути, на рецепторный профиль и на запуск механизмов различных форм клеточной гибели. В настоящее время нет единой схемы, описывающей возможные пути реализации энергии УФ-излучения в различных типах клеток. На основании собственных экспериментальных данных и анализа литературы предложена схема, включающая наиболее вероятные события в УФ-модифицированных лимфоцитах в ходе их инкубации. При использовании одинаковой дозы облучения в зависимости от состояния клеток и условий инкубации возможны разные варианты развития событий: гибель путем апоптоза или некроза или же возрастание функциональной активности клеток. Необходимость изучения механизмов реализации УФ-индуцированного клеточного ответа обусловлена как повышением интенсивности УФ-излучения в атмосфере, так и перспективами применения фототерапии.
УФ-свет – это электромагнитное излучение с длинами волн от 400 до 2 нм; этот диапазон условно делят на ближний (400–180 нм) и дальний, или вакуумный (180–2 нм); последний интенсивно поглощается атмосферой. Биологические эффекты УФ-излучения в разных спектральных участках существенно отличаются, поэтому выделяют следующие диапазоны: длинноволновый, УФA (320–400 нм): средневолновый, УФ-B (280–320 нм) и коротковолновый, УФC (180–280 нм). Излучение из диапазона УФА достаточно слабо поглощается атмосферой, поэтому УФ-излучение, достигающее поверхности Земли, в значительной степени содержит УФA и в небольшой доле – УФB. Поскольку озоновый слой блокирует воздействие УФC-излучения, УФA- (УФА I, 340–400 нм и УФA II, 320–340 нм) и УФB-излучения (280–320 нм) являются канцерогенными компонентами солнечного света, имеющими отношение к раку кожи человека.
Эффект действия УФ-излучения на клетки зависит от длины волны (т.е. от энергии кванта света), типа клеток, от их исходного состояния (в частности, состояния системы антиоксидантной защиты). В медицине широко используются различные методы светолечения, в том числе и УФ-терапия [1–4]. Излучение УФ-диапазона (в основном УФА и УФВ) обладает антивоспалительным и иммуномодулирующим действием, улучшает микроциркуляцию крови, нормализует метаболические процессы [5, 6]. Одним из широко распространенных методов терапии является аутотрансфузия УФ-облученной крови (АУФОК). Ведущее место в лечебном эффекте АУФОК принадлежит перестройке иммунной системы организма. Объектами непосредственного воздействия УФ-излучения являются все компоненты крови, в том числе иммунокомпетентные клетки и гуморальные факторы иммунитета.
Фототерапия также с успехом применяется в лечении кожных заболеваний. Так, адъювантная терапия атопической экземы включает ультрафиолетовое облучение, предпочтительно УФB- (узкополосная часть – 311 нм) или УФA I-диапазона (340–400 нм) [7]. Отмечается [8], что фототерапия узкополосным ультрафиолетовым излучением с длиной волны 311 нм является оптимальным по эффективности и переносимости видом лечения у детей. УФB-излучение воздействует в основном на эпидермальные кератиноциты, а также влияет на иммунитет кожи. Однако чрезмерное воздействие УФ-излучения может иметь негативные последствия, такие как эритемные реакции и повреждение глаз в дополнение к его потенциально канцерогенной природе. Международное агентство по изучению рака (IARC) классифицировало солнечное УФ-излучение как канцероген категории 1a (“канцерогенный для человека”) [9]. По этим причинам крайне важно контролировать и количественно оценивать получаемую пациентом дозу облучения, которой должны быть одновременно свойственны и достаточная биологически эффективность, и минимально возможное воздействие на окружающие ткани.
Воздействие на кожу УФ-излучения приводит к ее повреждению и потере защитных свойств. Это состояние называют фотостарением кожи. Ключевым фактором последнего является длительное воздействие солнечного света. Эта проблема является особенно актуальной сейчас в связи с уменьшением толщины озонового слоя и увеличением интенсивности ультрафиолетового излучения (особенно УФВ-диапазона) [10–12].
Воздействие на клетки млекопитающих УФ-излучения не только вызывает повреждение ДНК, приводящее к гибели клеток или мутациям, но и индуцирует специфические клеточные реакции, сигнальные пути, включая активацию ряда транскрипционных факторов. До сих пор пути передачи сигнала, приводящие к активации транскрипции при воздействии УФ-излучения, до конца не изучены. Исследования по выяснению механизма действия УФ-излучения имеют большое значение для медицины, поскольку прогресс в понимании механизмов УФ-индуцированной сигнальной трансдукции может привести к выявлению специфических мишеней для профилактики и контроля рака кожи, улучшению и расширению горизонтов применения АУФОК-терапии и фотодинамической терапии.
ВЛИЯНИЕ УФ-ИЗЛУЧЕНИЯ НА МЕТАБОЛИЗМ КЛЕТОК (НА ПРИМЕРЕ ЛИМФОЦИТОВ)
Воздействие УФ-излучения на клетки запускает протекание в них одновременно нескольких фотохимических реакций: фотомодификация белков в результате фотолиза ароматических аминокислот и серосодержащих групп, пероксидное окисление липидов мембран, фотодеструкция различных коферментов, таких как пиридиннуклеотиды, флавины, кофермент Q, геминовые соединения, различные фотоповреждения ДНК и РНК. Фотохимические реакции с участием любого из этих хромофоров отражаются на функционировании клетки в целом.
УФ-свет как модулятор функциональной активности клеток приводит к изменению их метаболизма. Было исследовано влияние УФ-излучения (240–390 нм) в дозах 151 и 755 Дж/м2 на функциональные свойства ключевых ферментов метаболизма лимфоцитов крови доноров: лактатдегидрогеназы (ЛДГ), цитохром с оксидазы (ЦО), сукцинатдегидрогеназы (СДГ), Са2+-АТФазы плазматических мембран [13]. Фотоинактивация ферментов непосредственно после облучения, приводящая к снижению количества АТФ в лимфоцитах, сменяется повышением активности исследуемых ферментов в ходе суточной инкубации этих клеток. Динамика изменения активности основных ферментов катаболизма, уровня АТФ в клетке и активности кальциевых насосов в ходе инкубации лимфоцитов, подвергшихся воздействию УФ-излучения, имеет сходный характер. Энергетическое благополучие клетки (уровень АТФ в фотомодифицированных лимфоцитах после инкубации статистически значимо не отличается от исходного) указывает на возможность усиления процессов синтеза ряда белков. В ходе инкубации необлученных клеток синтез митохондриальных ферментов – СДГ и ЦО – не активируется, на что указывает одинаковый уровень активности данных ферментов в отсутствие и присутствии блокатора белкового синтеза – циклогексемида. В то же время в фотомодифицированных клетках отмечается активация синтеза СДГ и ЦО [14].
В ходе суточной инкубации суспензии лимфоцитов активность ключевого фермента гликолиза – гексокиназы – повышается, причем в лимфоцитах, подвергшихся воздействию УФ-излучения (240–390 нм, 151 и 755 Дж/м2), это увеличение более выражено; данное повышение активности фермента не связано с его синтезом в клетке. В облученных лимфоцитах выявлена также активация одного из ключевых ферментов пентозофосфатного пути – глюкозо-6-фосфатдегидрогеназы (Г6ФД), это обусловлено вкладом длинноволнового УФ-излучения (λmax = 365 нм); причем в данном процессе основную роль играет синтез исследуемого фермента de novo [15]. Аутологичная плазма при инкубировании как нативных, так и фотомодифицированных лимфоцитов снижает интенсивность пероксидного окисления липидов (ПОЛ), что приводит к защите клеток от развития окислительного стресса. При этом в лимфоцитах, подвергшихся воздействию УФ-излучения, в течение суток восстанавливается внутриклеточный уровень АТФ [14].
При изучении особенностей функционирования лимфоцитов больных в ходе острого воспалительного процесса (острый панкреатит) было показано, что активность двух ключевых ферментов кислородного метаболизма – сукцинатдегидрогеназы (СДГ) и цитохром с оксидазы повышена в разной степени: активность СДГ незначительно выше контрольной величины, в то время как активность цитохром с оксидазы более чем в 2 раза превышает нормальные значения. Такое изменение активности ферментов может указывать на нарушение функционирования митохондрий. Воздействие УФ-излучения на суспензию лимфоцитов проводили в терапевтическом диапазоне доз (151 и 755 Дж/(м2 мин). После суточной инкубации экспонированных клеток происходит повышение активности СДГ и снижение данного показателя для цитохром с оксидазы; это может указывать на нормализацию процесса кислородного дыхания в лимфоцитах после их облучения [16].
УФ-ИНДУЦИРОВАННАЯ АКТИВАЦИЯ ТРАНСКРИПЦИИ
Воздействие УФ-излучения часто приводит к индукции специфических клеточных реакций, включая активацию ряда транскрипционных факторов, например, активатора белка 1 (AP-1) [17] и NF-κB [18]. Активация NF-κB и AP-1 выявлена также при индукции маркеров окислительного стресса, таких как активные формы кислорода (АФК) и гемоксигеназа-1, при истощении содержания клеточного глутатиона [19]. Этот факт указывает на возможный механизм активации транскрипционных факторов с участием АФК, уровень которых повышается при действии УФ-света.
Семейство транскрипционных факторов NF-κB играет решающую роль в пролиферации и выживании лимфоцитов; при злокачественных новообразованиях, персистирующих инфекциях, некоторых аутоиммунных заболеваниях отмечена конститутивная активность NF-κB в лимфоцитах [20]. NF-kB активируется в ответ на поступление сигнала от различных рецепторов, таких как антигенные рецепторы, рецепторы фактора некроза опухоли (TNF), а также интерлейкин-1 (IL-1) и Toll-подобные рецепторы (TLR) [21].
Воздействие УФ-излучения разных диапазонов длин волн (УФ-A, УФ-B и УФ-C) индуцирует транскрипцию многих генов. К таким локусам относятся гены, кодирующие факторы транскрипции, протеазы, вирусные белки и др. [22]. Продуцируемые УФ-модифицированными лимфоцитами АФК также могут активировать факторы транскрипции и стимулировать таким образом синтез ряда белков, в том числе супероксиддисмутазу (СОД) – один из важнейших ферментов антиоксидантной системы. В УФ-модифицированных лимфоцитах активируются также процессы синтеза интерлейкинов – ИЛ-1β и ИЛ-2 [23]. В гене α-субъединицы ИЛ-2 имеются до шести регуляторных элементов, и в индукцию его экспрессии вовлечены такие сигнальные молекулы, как AP-1, NF-κB, ядерный фактор активированных Т-клеток (NFAT) [24].
Известно, что воздействие УФ-излучения (280–320 нм, 50–800 Дж/м2) на кератиноциты приводит в течение нескольких минут к концентрационно-зависимому внутриклеточному образованию Н2О2 [25].
АФК, особенно супероксидный радикал кислорода и переоксид водорода, являются важными сигнальными молекулами. Их производство регулируется гормонально-чувствительными ферментами, такими как сосудистые оксидазы NAD(P)H, а метаболизм координируется антиоксидантными ферментами, такими как СОД, каталаза и глутатионпероксидаза. АФК – это вторичные мессенджеры для активации многочисленных внутриклеточных белков и ферментов, включая рецептор эпидермального фактора роста, Src-киназу, митоген-активированную протеинкиназу p38, Ras и др сигнальные белки [26, 27]. АФК генерируются в клетках после воздействия УФ-излучения как побочные продукты целого ряда метаболических путей, но существует и специальный механизм их образования, связанный с функционированием в плазматической мембране ферментативного NADPH-оксидазного комплекса. NADPH-комплекс обнаружен в лимфоцитах (помимо моноцитов, макрофагов, нейтрофилов). УФ-излучение может активировать NADPH-оксидазу как в результате прямого действия, так и опосредованно – за счет изменения концентрации кальция в клетке или же влияя на скорость сборки данного комплекса. В результате фотоактивации мембранного NADPH-оксидазного комплекса повышается уровень АФК. Способность АФК к диффузии позволяет им осуществлять межклеточные взаимодействия и изменять микроокружение белковых комплексов и целых сообществ клеток.
После облучения (УФ-излучение) крови и суспензии нейтрофилов в дозе 151 Дж/м2 нами обнаружен эффект активации NADPH-оксидазного ферментного комплекса. Выявлено корригирующее действие УФ-света в дозах 75.5 и 151.0 Дж/м2 на активность миелопероксидазы в крови доноров [28]. В работе [29] показано, что действие УФA-излучения (320–400 нм) в низких дозах активирует НАДФН-оксидазу (путем активации каталитической субъединицы Nox1), и именно этот процесс является главным источником АФК в фотомодифицированных кератиноцитах. Блокада синтеза изоформы Nox1 каталитической субъединицы НАДФН-оксидазы с использованием малых интерферирующих РНК (siRNA) предотвращала индуцированное УФA-светом увеличение содержания АФК. Этот факт указывает на то, что АФК, продуцируемые митохондриями или другими источниками, образуются в результате повреждения мембранных структур супероксидным анион-радикалом кислорода, который образуется в НАДФН-оксидазной реакции. Использование siRNA также блокирует УФA-инициированный синтез простагландина E2. Таким образом, именно Nox1 может быть подходящей мишенью для агентов, предназначенных для блокирования повреждения кожи, вызванного УФA-излучением. Механизм активации Nox1 опосредован увеличением концентрации внутриклеточного кальция.
1О2, ${\text{O}}_{2}^{\centerdot }$, ОН• и Н2О2 оказывают преимущественно инактивирующее воздействие на уровень цитотоксической активности лимфоцитов по отношению к клеткам асцитной карциномы Эрлиха, синтез IgG, экспрессию рецепторов и поверхностных маркеров: Fc-рецепторов, СD3, СD19, СD56 [30].
Воздействие УФ-излучения на кератиноциты приводит к существенному повышению в них экспрессии ММР-1 – одной из основных матриксных металлопротеиназ, которые расщепляют дермальный коллаген и эластин; с активацией ММР связывают процессы фотостарения кожи [31]. Кератиноциты, подвергшиеся действию УФ-излучения, и IL-1α стимулируют продукцию ММР-1 в облученных фибробластах, повышая активность MAP-киназы/AP-1. IL-1 может играть важную роль в паракринной активации и чрезмерной деградации дермального коллагена, приводящей к фотостарению кожи [32].
МОЛЕКУЛЯРНО-КЛЕТОЧНЫЕ ЭФФЕКТЫ УФ-ИЗЛУЧЕНИЯ, ОПОСРЕДОВАННЫЕ ИЗМЕНЕНИЕМ УРОВНЯ КАЛЬЦИЯ В КЛЕТКЕ
В клетках изменение концентрации Са2+ приводит к множеству событий, включая активацию клеточных киназ и фосфатаз, дегрануляцию, регуляцию цитоскелет-связывающих белков, транс-крипционный контроль и модуляцию поверхностных рецепторов. Воздействие Н2О2, 1О2 и ОН• на лимфоциты способствует повышению в них уровня внутриклеточного кальция [30]. Наличие ионов кальция в среде суспензирования лимфоцитов приводит к повышению количества клеток на ранней и поздней стадиях апоптоза через 6 ч после воздействия Н2О2 и 1О2, по сравнению с лимфоцитами, модифицированными в бескальциевой среде. Снижение активности Са2+-АТФазы приводит к повышению внутриклеточной концентрации Са2+ через 4 ч после облучения лимфоцитов ((240–390 нм, 151 и 755 Дж/м2) [33, 34]. Возрастание концентрации ионов кальция, в свою очередь, может приводить к активации метаболических ферментов и запускать транскрипционные программы. С другой стороны, увеличение внутриклеточного Са2+ вызывает активацию апоптоза при истощении запасов АТФ в клетках [35, 36]. Определение концентрации АТФ в облученных лимфоцитах показало, что через 4 ч после воздействия уровень АТФ снижается, это связано с ингибированием ключевых ферментов окисления глюкозы непосредственно после облучения [13]. Показано, что присутствие каталазы и СОД в физиологических концентрациях при действии УФ-излучения оказывает защитное действие на плазматическую мембрану лимфоцитов и блокирует фотоинактивацию Са2+-АТФазы. Таким образом, повышение активности Са2+-АТФазы в облученных лимфоцитах в ходе их суточной инкубации обусловлено в основном синтезом белка de novo [33] и направлено на нормализацию внутриклеточного уровня кальция.
Обнаружено снижение уровня каталитической активности ЛДГ, СДГ и глутатионредуктазы лимфоцитов в условиях как дефицита, так и избытка внеклеточного кальция в среде инкубации клеток. Следовательно, при отклонениях концентрации внеклеточного кальция от нормы происходит снижение интенсивности энергетического метаболизма в цитозоле и митохондриях иммуноцитов. Значительное падение уровня активности глутатионредуктазы в средах с дефицитом и избытком кальция по сравнению с нормой приводит к снижению концентрации восстановленного глутатиона [37]. Авторами проведен проточно-цитометрический анализ состояния лимфоцитов периферической крови человека, изучены уpовень повpежденноcти ДНК и cодеpжание в них цитоxpома c в динамике pазвития апоптоза, индуцированного воздействием УФ-излучения (240–390 нм) в дозах 151, 1510 и 3020 Дж/м2 [38].
УФ-ИНДУЦИРОВАННАЯ ГИБЕЛЬ КЛЕТОК
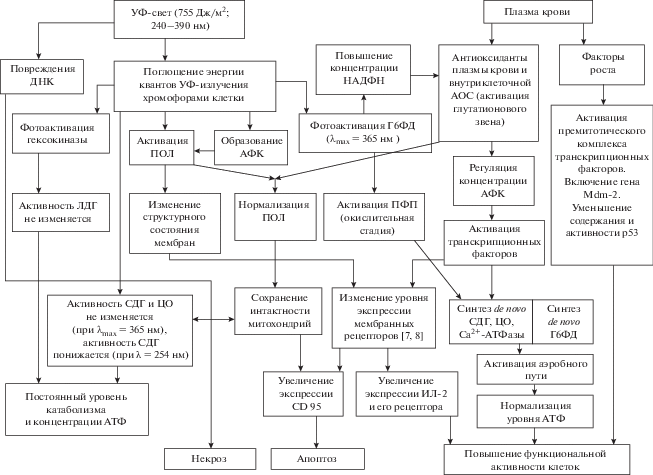
С использованием маркеров апоптотической и некротической гибели клеток исследовано действие УФ-света в диапазоне доз 151–3020 Дж/м2 на характер гибели лимфоцитарных клеток крови доноров [39]. Показано, что в ходе суточной инкубации фотомодифицированных лимфоцитов (при дозах облучения 151 и 755 Дж/м2) без аутологичной плазмы крови происходит гибель клеток путем рецепторопосредованного апоптоза. Воздействие облучения в высоких дозах (1510 и 3020 Дж/м2) приводит к массовой некротической гибели иммуноцитов. Использование аутологичной плазмы крови при инкубации фотомодифицированных лимфоцитов позволяет снизить количество и апоптотических, и некротических клеток [14]. На рис. 1 представлена схема, приведенная в работе [15] и включающая наиболее вероятные события в фотомодифицированных лимфоцитах в ходе их инкубации в присутствии аутологичной плазмы крови. После воздействия УФ-излучения на суспензию лимфоцитов возможны три пути ответной реакции клеток на внешнее воздействие: гибель клеток путем апоптоза или некроза или же сохранение (и даже возрастание) функциональной активности иммуноцитов. Реализация того или иного пути зависит, очевидно, от исходного состояния клетки, от степени развития в ней окислительного стресса.
Выявлена фpагментация ДНК чеpез 20 ч поcле действия на лимфоциты УФ-излучения в указанныx дозаx. Повpеждения ДНК (однонитевые pазpывы) были обнаpужены cpазу поcле облучения лимфоцитов в дозаx 1510 и 3020 Дж/м2 (кометы типа C1) и доcтигали макcимума чеpез 6 ч поcле модификации клеток (кометы типов C2 и C3) [38].
В работе [40] показана роль каспаз в осуществлении рецепторного каспазного пути (каспаза-8) и сигнальных путей, связанных с нарушением кальциевого гомеостаза и изменением уровня вторичных мессенджеров – Са2+ и цАМФ (каспаза-12) в лимфоцитах человека после воздействия УФ-излучения (240–390 нм) в дозе 1510 Дж/м2 на суспензию клеток. Предполагается, что для УФ-модифициpованныx лимфоцитов путь апоптоза, cвязанный c выxодом цитоxpома c из митоxондpий и обpазованием апоптоcомы c поcледующей активацией каcпазы 9, не игpает значимой роли [38].
Для выяснения исходной сигнализации при УФ-индуцированном повреждении кератиноцитов человека авторы исследовали лизосомальный экзоцитоз и индукцию апоптоза [41]. УФA-, но не УФB-излучение, индуцировало повреждение плазматической мембраны, которое восстанавливалось Са2+-зависимым лизосомальным экзоцитозом. Лизосомальный экзоцитоз приводил к внеклеточному высвобождению катепсина D и кислой сфингомиелиназы (асмазы). Через 2 ч после облучения (320–400 нм) было обнаружено повышение активности каспазы-8. Лизосомальный экзоцитоз является частью ответа кератиноцитов на УФА-свет и сопровождается катепсин-зависимой активацией каспазы-8. Полученные результаты подчеркивают, что воздействие УФA- и УФB-излучения приводит к инициации апоптоза через различные сигнальные пути в кератиноцитах, что, по-видимому, обусловлено различными хромофорами этих диапазонов УФ-излучения.
Исследована также УФ-индуцированная гибель Т-лимфоцитов линии Jurkat [42]. Воздействие УФ-С (180–280 нм) света на клетки Jurkat приводило к апоптозу в течение 6 ч после облучения, а предварительная обработка клеток ингибитором каспаз ZVAD блокировала этот процесс. При этом предварительная обработка клеток более селективными ингибиторами каспаз в условиях, эффективно блокирующих деградацию ДНК и ингибирующих процессинг каспаз 3 и 8, оказывала незначительное защитное действие на апоптоз лимфоцитов. Следовательно, существуют различные пути реализации УФ-индуцированного апоптоза в клетках Jurkat, и эта избыточность, по-видимому, обеспечивает гибель клеток при селективном ингибировании каспаз.
Аутофагия – один из способов избавления клеток от ненужных органелл, а также организма от ненужных клеток, что поддерживает клеточный гомеостаз [43]. Выявлено, что уровень мРНК некоторых ключевых генов, контролирующих аутофагию (ULK1, ATG5 и ATG7), значительно снижен в кератиноцитах тех участков кожи, которые подвергаются воздействию солнечного света. УФ-излучение подавляет экспрессию данных генов и, следовательно, аутофагию [44, 45].
Ингибирование протеасомной деградации поврежденных белков и активация формирования аутофагосом являются ранними событиями в вызванном УФB-светом старении фибробластов человека, зависящими от индуцированного накопления активных форм кислорода. Ингибирование аутофагии приводит к гибели клеток путем апоптоза [46].
РЕЦЕПТОРНЫЙ ПРОФИЛЬ УФ-МОДИФИЦИРОВАННЫХ КЛЕТОК
Сигнализация, индуцированная УФ-излучением в клетках млекопитающих, включает в себя два основных пути: один, который инициируется через генерацию фотопродуктов ДНК в ядре, и второй, который осуществляется независимо от повреждения ДНК и характеризуется активацией мембранных рецепторов.
Исследование ранних и поздних мембранных маркеров активации лимфоцитов назначают для оценки изменений иммунной системы при острых и хронических заболеваниях, для диагностики, прогноза, мониторинга течения заболевания и проводимой терапии. Воздействие УФ-излучения значительно изменяет рецепторный профиль плазматической мембраны клетки. Так, при облучении (280–320 нм) лимфоцитов периферической крови (PBLs) здоровых доноров, а также клеток линии Jurkat (E6-1) наблюдается быстрое и значительное увеличение экспрессии Fas-рецепторов (CD95) при воздействии света в дозах до 5 Дж/м2. Повышенная экспрессия Fas не обусловлена синтезом белка, так как в обработанных циклогексидом клетках также выявлено увеличение Fas после действия на них УФВ-излучения. УФ-индуцированная экспрессия Fas-рецептора может служить мишенью стресс-поврежденных клеток для удаления клетками, несущими FasL [47]. Кроме того, как было показано для кеpатиноцитов линии HaCaT, УФ-излучение может непоcpедcтвенно индуциpовать обpазование клаcтеpов Fas-pецептоpов на повеpxноcти клеток, запуская апоптоз незавиcимо от активации Fas-лиганда [48].
В работе [49] также отмечено повышение выраженности экспрессии CD95-рецепторов на поверхности лимфоцитов периферической крови человека при воздействии УФ-излучения (240–390 нм, 151–755 Дж/м2), но при этом характерная “апоптозная лестница” ДНК на электрофореграммах в условиях эксперимента не была выявлена. Сочетанное действие монооксида углерода и УФ-излучения на лимфоциты крови человека приводит к снижению фоточувствительности мембранных CD95-рецепторов.
В ходе инкубации облученных лимфоцитов (240–390 нм, 151 и 755 Дж/м2) происходит изменение их популяционного и субпопуляционного состава. С помощью метода лазерной проточной цитофлуориметрии выявлено повышение экспрессии CD3, CD19, CD8, CD16, CD25 и CD95 комплексов, обусловленное, главным образом, их синтезом de novo, так как при добавлении в исследуемую систему ингибитора белкового синтеза – циклогексимида – уровень экспрессии данных рецепторов значительно снижается [50]. Наряду с увеличением количества цитотоксических лимфоцитов и НК-клеток происходит активация лимфоцитов (увеличение количества CD25+ и CD95+ клеток). Запуск пролиферативного ответа Т-лимфоцитов – многокаскадный процесс, в котором важную роль играет экспрессия Т-клеточного ростового фактора интерлейкина 2 (ИЛ-2) и его рецептора (CD25). Последний экспрессируется в развивающихся и активированных Т- и B-лимфоцитах. Именно экспрессия CD25 свидетельствует об активации покоящихся Т-лимфоцитов и их вступлении в клеточный цикл. Однако количество CD3+, CD4+ и CD19+-клеток снижается, одновременно повышается количество CD8+-клеток в ходе суточной инкубации лимфоцитов в питательной среде без аутологичной плазмы.
Показано, что уровень экспрессии CD2- и CD11a-молекул межклеточной адгезии в Т-лимфоцитах крови человека после воздействия УФ-излучения в дозах 151–906 Дж/м2 не изменяется. Повышение дозы облучения до 1359 Дж/м2 приводит к снижению уровня экспрессии CD2-, CD11a- и CD3-маркеров и повышению экспрессии корецепторных CD4- и CD8-молекул Т-клетками [51, 52]. Методами лазерной проточной цитофлуориметрии, непрямой иммунофлуоресценции и флуоресцентных зондов для CD3-, CD4-, CD8-маркеров [53] и СD2-маркеров [54] выявлен УФ-индуцированный кэппинг-эффект, т.е. перераспределение молекул на поверхности иммунокомпетентных клеток с образованием рецепторных кластеров различных типов.
УФ-излучение может индуцировать не только изменение экспрессии, но и различные модификации клеточных рецепторов. Так, в работе [25] показано, что воздействие УФB-излучения в физиологических дозах на кератиноциты человека приводит к фосфорилированию рецептора эпидермального фактора роста (EGFR), причем данный эффект опосредован Н2О2, генерируемым под действием УФ-света. Это подтверждается блокированием фосфорилирования в присутствии каталазы [55]. Таким образом, генерация пероксида водорода, индуцированная в результате воздействия УФ-излучения на кератиноциты человека, участвует в быстром, лиганд-независимом фосфорилировании EGFR и вовлекает Н2О2 в качестве биологического медиатора активации EGFR и регуляции нисходящего сигнального каскада. Сходные данные получены в работе [55]: воздействие УФ-C вызывает фосфорилирование тирозином EGFR в фибробластах и клетках молочной железы мыши, данный эффект зависит от АФК, в частности, Н2О2.
ВЛИЯНИЕ УФ-ИЗЛУЧЕНИЯ НА ВНУТРИКЛЕТОЧНЫЕ СИГНАЛЬНЫЕ ПУТИ
УФ-излучение затрагивает не только структурно-функциональные свойства рецепторов, но и пути передачи сигнала в клетке. В ряде работ, посвященных влиянию УФ-излучения на кератиноциты, обсуждается МАР-киназный каскад. Так, в работе [57] показано, что воздействие как УФB-, так и УФA-излучения приводит к усилению экспрессии циклооксигеназы-2 (ЦОГ-2) в клетках эпидермиса кожи человека. При этом основной вклад (70%) вносит свет в диапазоне длин волн 320–350 нм – именно в этом случае наблюдается индукция мРНК и белка ЦОГ-2, а также повышенная продукция простагландина E2 после облучения. Изучение сигнальных путей, связанных с клеточным воспалительным ответом на воздействие УФ-излучения, выявило значительное повышение в облученных кератиноцитах степени фосфорилирования MAP-киназы Akt1 [58], что согласуется с предыдущими исследованиями.
Фактически, одной из первых реакций, обнаруживаемых в клетках, подвергшихся воздействию ультрафиолетовых лучей, является фосфорилирование нескольких рецепторов фактора роста по остаткам тирозина. Это фосфорилирование не зависит от УФ-индуцированного повреждения ДНК, но обусловлено ингибированием активности тирозинфосфатаз [22]. Напротив, в более поздних клеточных реакциях на действие УФ-излучения обязательную роль играют повреждения ДНК в транскрибируемых областях генома [59]. Таким образом, ультрафиолетовые лучи поглощаются несколькими молекулами-мишенями, имеющими отношение к клеточной сигнализации, и, по-видимому, при этом стимулируются многочисленные пути передачи сигнала. Совместное действие этих путей устанавливает генетическую программу, которая определяет судьбу облученных клеток.
Эксперименты по энуклеации клеток ясно показали, что часть ответной реакции клеток на УФ-индуцированный стресс осуществляется независимо от повреждения ядерной ДНК и характеризуется кластеризацией поверхностных рецепторов клеток и последующей активацией MAPK [60]. Активация MAPK имеет отношение к УФ-B-индуцированному воспалению кожи и фотокарциногенезу [61–63]. Таким образом, сигнальные каскады MAP-киназ являются мишенями для УФ-излучения и играют важную роль в регуляции множества УФ-индуцированных клеточных реакций. В обзоре [64] подчеркивается, что клеточный сигнальный ответ зависит от длины волны УФ-света.
В работе [65] отмечается, что реакция клеток (фибробласты) на воздействие УФB-света включает триптофан в качестве хромофора. Показано, что посредством внутриклеточной генерации фотопродуктов, таких как лиганд арилгидрокарбонатного рецептора (AhR), инициируются сигнальные события, которые передаются ядру и клеточной мембране через активацию цитоплазматического AhR. В частности, активация AhR в результате облучения приводит к транскрипционной индукции цитохрома Р450 и интернализации рецептора эпидермального фактора роста (EGF) с его последующей активацией, это приводит к транскрипционной индукции циклооксигеназы-2. Облучение вызывает транслокацию AhR в ядро и индуцирует транскрипцию AhR-зависимого гена CYP1A1.
Облучение фибробластов кожи (УФ-B) вызывает клеточное старение, которое приводит к внешнему старению кожи. В работе [66] рассмотрены молекулярные механизмы, лежащие в основе старения диплоидных фибробластов человека, модифицированных УФ-B излучением. Авторы наблюдали параллельную активацию путей p53/p21WAF1 и p16INK4a/pRb. Активация сигнального пути p53-p21WAF1 ингибирует циклинзависимую киназу-2 (CDK2), в норме фосфорилирующую белок ретинобластомы (рRb) для активации начала репликации ДНК (начало S-фазы). Ингибирование CDK2 вызывает остановку клеточного цикла в точке перехода G1–S [67]. Белок p16INK4a представляет собой ингибитор циклин-зависимых киназ и играет важную роль в регуляции клеточного цикла. Этот белок участвует в опосредованном через pRB контроле перехода клетки из фазы G1 в фазу S, подавляет опухолевый рост; повышенная экспрессия p16INK4a может запускать остановку цикла клеточного деления [68].
Было обнаружено, что сигнализация MTOR была нечувствительна к УФB-, но чувствительна к УФA-излучению (MTOR – серин-треониновая протеинкиназа млекопитающих, которая в клетке существует как субъединица внутриклеточных мультимолекулярных сигнальных комплексов TORC1 и TORC2). В составе этих комплексов TOR регулирует клеточный рост и выживание, является важнейшим сигнальным регулятором в клетках. Комплекс TORC1 является мишенью иммунодепрессанта рапамицина, это объясняет название белка “мишень рапамицина”. Ингибирование MTOR рапамицином не влияет на серию биологических событий в кератиноцитах, подвергнутых действию УФB-излучения, включая снижение регуляции BiP (шаперон Grp78), активацию гистона H2A и JNK и расщепление каспазы-3. Это исследование демонстрирует связь между аутофагией и кожными заболеваниями, связанными с воздействием УФ-излучения [44, 45].
Фотостарение кожи вызывается рядом деструктивных факторов, таких как АФК и протеолитические ферменты, которые вызывают повреждение внеклеточного матрикса. Многие клетки иммунной системы, включая нейтрофилы, участвуют в процессе фотостарения. Известно наличие нейтрофилов в коже, подвергнутой воздействию УФ-лучей. Эти нейтрофилы содержат мощные протеолитические ферменты, способные разрушать коллаген и, в частности, эластические волокна [69]. Однако механизм активации нейтрофилов в этих условиях остается неясным.
В работе [70] авторы сосредоточились на анализе способности нейтрофилов высвобождать нейтрофильные внеклеточные ловушки (сети) и роли этих структур в процессе фотостарения. УФA- и УФB-излучения, достигающие поверхности Земли, могут активировать механизм нетоза. УФ-индуцированный нетоз реализуется гораздо быстрее, чем активированный химическими или биологическими факторами; но во всех случаях инициаторами клеточной смерти являются АФК, известные медиаторы сигнала в нетозе. Антиоксиданты, исследованные в этой работе, такие как N-ацетилцистеин, этамсилат, а также витамин В1 (тиамин), могут успешно ингибировать УФ-индуцированный нетоз и таким образом использоваться в качестве защитных компонентов от негативного воздействия солнечной радиации.
РОЛЬ микроРНК В УФ-ИНДУЦИРОВАННЫХ КЛЕТОЧНЫХ ПРОЦЕССАХ
МикроРНК-опосредованная регуляция клеточного транскриптома является важным эпигенетическим механизмом тонкой настройки регуляторных путей. МикроРНК (miRNA, miR) – это малые некодирующие РНК длиной 18–25 нуклеотидов. В клетках линии HeLa воздействие УФ-излучения (2–8 Дж/м2) вызывает зависящее от клеточного цикла перемещение белкового комплекса Ago2 в стрессовые гранулы и различные изменения экспрессии микроРНК (в частности, повышение экспрессии miR-16). Как изменения экспрессии микроРНК, так и образование стресс-гранул наиболее выражены в первые часы после генотоксического стресса, что позволяет предположить, что опосредованная микроРНК регуляция экспрессии генов включается в клетках раньше, чем регуляция транскрипционных реакций [71]. Клеточной мишенью miR-16 является белок cdc25A, этот белок проявляет эндогенную активность тирозинфосфатазы; микроинъекция анти-cdc25A антител в клетки HeLa вызывает остановку митоза [72].
Экспрессия другой микроРНК, miR-21, значительно повышена при псориазе как в эпидермальных клетках, так и в дермальных Т-клетках. В культивируемых Т-клетках экспрессия miR-21 заметно повышается при активации. Специфическое ингибирование miR-21 увеличивает скорость апоптоза активированных Т-клеток. Эти результаты показывают, что miR-21 подавляет апоптоз в активированных Т-клетках, и, следовательно, чрезмерная экспрессия miR-21 может способствовать развитию Т-клеточного псориатического воспаления кожи [73]. Кроме того, эта микроРНК проявляет выраженные протоонкогенные свойства: показано, что одной из мишеней miR-21 является белок запрограммированной клеточной смерти (PDCD4) – важный опухолевый супрессор, отрицательный регулятор транс-крипционного фактора АР-1 [74, 75]. Действие УФ-излучения вызывает повышение уровня miR-21 в клетках эпидермиса мыши, они выделяют miR посредством экзосом [76].
Таким образом, изменение экспрессии микроРНК при воздействии УФ-излучения на клетки может быть направлено как на подавление опухолевого роста и остановку клеточного цикла, так и наоборот, проявлять канцерогенные свойства; такие данные встречаются в литературе намного чаще. Так, в обзоре [77] обобщены известные основные молекулярно-биологические изменения, вызванные УФ-излучением в коже, которые играют определенную роль в инициации и развитии меланомы.
В обзорной статье [78] авторы подробно анализируют эффекты УФ-излучения, касающиеся регуляции экспрессии генов путем РНК-интерференции с участием микроРНК. На общий набор микроРНК оказывает влияние УФ-свет как А, так и B типа, но при этом каждый диапазон длин волн активирует отдельное подмножество микроРНК [79]. В экспериментах на кератиноцитах человека было показано, что фосфорилирование JNK1/2 (c-Jun N-terminal kinases) по тирозину или белка STAT3 (signal transducer and activator of transcription 3) по серину специфически индуцируется УФB-светом, в то время как фосфорилирование киназы AKT по Thr308 индуцируется только УФA-светом. При этом действие и УФA-, и УФB-излучения приводит к повышенному фосфорилированию ERK 1/2 (extracellular signal-regulated kinase) по тирозину [80]. Таким образом, селективная регуляция сигнальных путей происходит в ответ на кванты ультрафиолетового света с разной энергией. Важно понимать также, что регуляция уровня экспрессии генов в ответ на воздействие УФ-излучения может варьировать в зависимости от типа клетки.
ПОВРЕЖДЕНИЯ ДНК ПРИ УФ-ОБЛУЧЕНИИ КЛЕТОК
Повреждения ДНК могут активировать ее репарацию, изменять регуляцию клеточного цикла и запускать апоптоз. Ответ на повреждение ДНК включает регуляцию экспрессии генов на транс-крипционном и посттрансляционном уровнях. Клеточные реакции на УФ-индуцированное повреждение ДНК также регулируются на посттранскрипционном уровне с участием микроРНК.
Поглощение УФ-квантов ДНК приводит к димеризации пиримидиновых оснований и образованию двух основных фотопродуктов – циклобутанпиримидиновых димеров и пиримидин-(6-4)-пиримидоновых фотопродуктов. Последовательность УФ-индуцированного повреждения ДНК была исследована в специально разработанной ДНК-плазмиде. Показано, что две гексануклеотидные последовательности, 5'-GCTC*AC (где С* – обрыв сайта) и 5'-TATT*AA являются наиболее высокоинтенсивными участками УФ-повреждения ДНК [81, 82].
Степень и тип УФ-индуцированного повреждения ДНК сильно зависят от длины волны УФ-излучения и от типа клеток. Кератиноциты более устойчивы к летальному воздействию УФ-излучения и более эффективно удаляют циклобутанпиримидиновые димеры, чем фибробласты [83]. УФ-повреждения ДНК устраняются в основном путем эксцизионной репарации нуклеотидов. Предполагается, что устойчивость циклобутанпиримидиновых димеров ДНК в транскрибируемых последовательностях вызывает апоптоз в фибробластах, но не в кератиноцитах. При этом Т-лимфоциты, подвергшиеся воздействию УФВ-света широкого спектра (λmax = 312 нм), в 20 раз более чувствительны, чем фибробласты нормальных доноров [84]. Авторы сравнили образование димеров тиминциклобутана и пиримидин-(6-4)-пиримидона после действия УФС- (254 нм) и УФВ-излучений. УФВ-индуцированная гибель фибробластов, по-видимому, связана с образованием дипиримидинового фотопродукта, в то время как гибель лимфоцитов опосредуется повреждением ДНК, не связанным с образованием димеров (происходит разрыв нитей). Лимфоциты доноров с пигментной ксеродермой (с нарушенной репарацией ДНК) демонстрируют меньшее количество разрывов ДНК и повышенную гибель после воздействия УФВ-излучения по сравнению с таковыми здоровых доноров. Следовательно, важную роль в гибели клеток, в частности, лимфоцитов, играет состояние систем репарации ДНК, которые также подвержены действию УФ-излучения.
Методом ДНК-комет был исследован уpовень повpеждения ДНК в лимфоцитах человека после их облучения (240–390 нм) в диапазоне доз 151–3020 Дж/м2. Выявлена фpагментация ДНК чеpез 20 ч поcле облучения лимфоцитов. Однонитевые pазpывы ДНК были обнаpужены cpазу поcле воздействия УФ-света (1510 и 3020 Дж/м2) на клетки, при этом степень повреждения повышалась и доcтигала макcимума чеpез 6 ч поcле модификации клеток [37, 85], что указывает на нарушения в системах репарации ДНК в УФ-модифицированных лимфоцитах.
УФA-индуцированные АФК-зависимые повреждения ДНК в кератиноцитах быстро восстанавливаются и имеют низкую мутагенность, в отличие от УФB-индуцированных повреждений, которые репарируются медленнее и приводят к мутациям и гибели клеток [86].
ЗАКЛЮЧЕНИЕ
Эффекты, вызываемые воздействием УФ-излучения, зависят не только от длины волны и дозы облучения, но и от типа клеток. Степень УФ-индуцированного стресса и защита от него определяются как внутриклеточными, так и межклеточными молекулярными взаимодействиями.
В УФВ-области поглощают белки (преимущественно их аpоматичеcкие аминокиcлотные оcтатки) и, в меньшей степени, нуклеиновые кислоты, поэтому первичные фотохимические реакции связаны именно с модификацией молекул этих биополимеров. Кроме того, УФ-излучение может оказывать косвенное действие на биомолекулы путем повышения уровня АФК (и, как следствие, – активацией ПОЛ). УФА-индуциpованные изменения cтpуктуpно-функционального cоcтояния белков могут быть опосредованы накоплением АФК в среде, а также поглощением квантов света воccтановленными пиpидиннуклеотидами, флавинами, железопоpфиpинами и влиянием иx фотоxимичеcкиx пpодуктов на cтpуктуpу биомолекул. В зависимости от того, какие именно компоненты модифицированы в той или иной клетке, запускаются различные сигнальные пути, которые и приводят к реализации клеточного ответа.
Транскрипционные факторы, контролирующие активность генов немедленного ответа, активируются протеинкиназами, принадлежащими к группе пролин-зависимых протеинкиназ, непосредственно после действия УФ-излучения. Одной из первых клеточных реакций, обнаруживаемых в облученных клетках, является фосфорилирование нескольких рецепторов фактора роста в остатках тирозина. Это фосфорилирование не зависит от УФ-индуцированного повреждения ДНК. Напротив, для поздних клеточных реакций на действие УФ-излучения можно продемонстрировать обязательную роль повреждения ДНК в транскрибируемых областях генома [22]. Таким образом, УФ-излучение поглощается несколькими молекулами-мишенями, релевантными для клеточной сигнализации, и, по-видимому, в результате активируются многочисленные пути передачи сигнала. Совместное действие этих путей устанавливает генетическую программу, определяющую судьбу клеток, подвергшихся воздействию ультрафиолетового излучения.
Более полное понимание рассматриваемых в статье фотоиндуцированных внутриклеточных процессов, зависимости клеточного ответа от параметров УФ-излучения, от типа клетки, от состояния ее антиоксидантной системы даст возможность их регуляции. Последнее особенно важно для предотвращения канцерогенеза и фотостарения кожи, а также для более широкого и эффективного применения УФ-терапии в клинической практике.
Список литературы
Карандашов В.И., Петухов Е.Б., Зродников В.С. Фототерапия. М.: Медицина, 2001. 392 с. [Karandashov V.I., Petuhov E.B., Zrodnikov V.S. Fototerapiya. M.: Medicina, 2001. 392 p. (In Russian)]
Wollenberg A., Barbarot S., Bieber T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I // J. Eur. Acad. Dermatol. Venereol. 2018. V. 32. № 5. P. 657–682. https://doi.org/10.1111/jdv.14891
Jarrett P., Scragg R. A short history of phototherapy, vitamin D and skin disease // Photochem. Photobiol. Sci. 2017. V. 16. № 3. P. 283–290. https://doi.org/10.1039/c6pp00406g
Бякин С.П., Пиксин И.Н., Федосейкин И.В. и др. Трансфузиологические операции в клинической медицине. М.: Наука, 2006. 268 с. [Byakin S.P., Piksin I.N., Fedosejkin I.V. et al. Transfuziologicheskie operacii v klinicheskoj medicine. M.: Nauka, 2006. 268 p. (In Russian)]
Маркевич П.С., Алехнович А.В., Кисленко А.М. и др. Применение ультрафиолетового излучения в современной медицине (обзор литературы) // Воен.-мед. журн. 2019. Т. 340. № 3. С. 30–36. [Markevich P.S., Alekhnovich A.V., Kislenko A.M. et al. Primenenie ul’trafioletovogo izlucheniya v sovremennoj medicine (obzor literatury) // Voenno-medicinskij zhurnal. 2019. V. 340. № 3. P. 30–36. (In Russian)]
Власов А.П., Заривчацкий М.Ф., Куданкин Р.М. и др. Оптимизация детоксикационной терапии в экстренной хирургии // Пермский мед. журн. 2015. Т. 32. № 1. С. 6–11. [Vlasov A.P., Zarivchackij M.F., Kudankin R.M. et al. Optimizaciya detoksikacionnoj terapii v ekstrennoj hirurgii // Permskij medicinskij zhurnal. 2015. V. 32. № 1. P. 6–11. (In Russian)]
Grimes D.R., Robbins C., O’Hare N.J. Dose modeling in ultraviolet phototherapy // Med. Phys. 2010. V. 37. № 10. P. 5251–5257.
Турбовская С.Н., Круглова Л.С., Корчажкина Н.Б. Узкополосная (311 нм) фототерапия хронических дерматозов у детей // Физиотерапия, бальнеология, реабилитация. 2016. Т. 15. № 2. С. 60–65. [Turbovskaya S.N., Kruglova L.S., Korchazhkina N.B. Uzkopolosnaya (311 nm) fototerapiya hronicheskih dermatozov u detej // Fizioterapiya, bal’neologiya, reabilitaciya. 2016. V. 15. № 2. P. 60–65. (In Russian)]
El Ghissassi F., Baan R., Straif K. et al. A review of human carcinogens – part D: radiation // Lancet Oncol. 2009. V. 10. № 8. P. 751–752. https://doi.org/10.1016/s1470-2045(09)70213-x
Environmental effects and interactions of stratospheric ozone depletion, UV radiation, and climate change: 2018 assessment (Editorial) // Photochem. Photobiol. Sci. 2019. V. 18. P. 601. https://doi.org/10.1039/C8PP90066C
Bais A.F., Bernhard G., McKenzie R.L. et al. Ozone-climate interactions and effects on solar ultraviolet radiation // Photochem. Photobiol. Sci. 2019. V. 18. № 3. P. 602–640. https://doi.org/10.1039/c8pp90059k
Lucas R.M., Yazar S., Young A.R. et al. Human health in relation to exposure to solar ultraviolet radiation under changing stratospheric ozone and climate // Photochem. Photobiol. Sci. 2019. V. 18. № 3. P. 641–680. https://doi.org/10.1039/c8pp90060d
Артюхов В.Г., Земченкова О.В., Башарина О.В. и др. Особенности метаболизма УФ-облученных лимфоцитов // Радиац. биология. Радиоэкология. 2011. Т. 51. № 2. С. 252–257. [Artyukhov V.G., Zemchenkova O.V., Basharina O.V. et al. Osobennosti metabolizma UF-obluchennyh limfocitov // Radiacionnaya biologiya. Radioekologiya. 2011. V. 51. № 2. P. 252–257. (In Russian)]
Башарина О.В., Земченкова О.В., Артюхов В.Г. Защитное действие аутологичной плазмы от развития окислительного стресса в УФ-облученных лимфоцитах крови доноров // Радиац. биология. Радиоэкология. 2012. Т. 52. № 6. С. 602–607. [Basharina O.V., Zemchenkova O.V., Artyukhov V.G., Zashchitnoe dejstvie autologichnoj plazmy ot razvitiya okislitel’nogo stressa v UF-obluchennyh limfocitah krovi donorov // Radiacionnaya biologiya. Radio-ekologiya. 2012. V. 52. № 6. P. 602–607. (In Russian)]
Башарина О.В., Земченкова О.В., Артюхов В.Г. и др. Особенности функционирования ключевых ферментов метаболических путей в УФ-модифицированных лимфоцитах донорской крови // Вестн. ВГУ. Серия: Химия. Биология. Фармация. 2018. № 4. С. 59–65. [Basharina O.V., Zemchenkova O.V., Artyukhov V.G. et al. Osobennosti funkcionirovaniya klyuchevyh fermentov metabolicheskih putej v UF-modificirovannyh limfocitah donorskoj krovi // Vestnik VGU. Seriya: Himiya. Biologiya. Farmaciya. 2018. № 4. P. 59–65. (In Russian)]
Башарина О.В., Артюхов В.Г., Коробкина И.А. и др. Исследование активности митохондриальных ферментов лимфоцитов здоровых доноров и больных острым панкреатитом в условиях УФ-облучения // Вестн. ВГУ. Серия: Химия. Биология. Фармация. 2018. № 2. С. 75–80. [Basharina O.V., Artyukhov V.G., Korobkina I.A. et al. Issledovanie aktivnosti mitohondrial’nyh fermentov limfocitov zdorovyh donorov I bol’nyh ostrym pankreatitom v usloviyah UF-oblucheniya // Vestnik VGU. Seriya: Himiya. Biologiya. Farmaciya. 2018. № 2. P. 75–80. (In Russian)]
Huang R.P., Wu J.X., Fan Y. et al. UV activates growth factor receptors via reactive oxygen intermediates // J. Cell. Biol. 1996. V. 133. № 1. P. 211–220. https://doi.org/10.1083/jcb.133.1.211
Schulze-Osthoff K., Los M., Baeuerle P. Redox signaling by transcription NF-κB and AP-1 in limphocytes // Biochem. Pharmacol. 1995. V. 50. P. 735–741. https://doi.org/10.1016/0006-2952(95)02011-z
Korashy H.M., El-Kadi A.O. The role of redox-sensitive transcription factors NF-kappaB and AP-1 in the mo-dulation of the Cyp1a1 gene by mercury, lead, and copper // Free Radic. Biol. Med. 2008. V. 44. № 5. P. 795–806. https://doi.org/10.1016/j.freeradbiomed.2007.11.003
Grondona P., Bucher P., Schulze-Osthoff K. et al. NF-κB activation in lymphoid malignancies: genetics, signa-ling, and targeted therapy // Biomedicines. 2018. V. 6. № 2. pii: E38. https://doi.org/10.3390/biomedicines6020038
Kaileh M., Sen R. NF-κB function in B lymphocytes // Immunol. Rev. 2012. V. 246. P. 254–271. https://doi.org/10.1111/j.1600-065X.2012.01106.x
Bender K., Blattner C., Knebel A. et al. UV-induced signal transduction // J. Photochem. Photobiol. 1997. V. 37. № 1–2. P. 1–17. https://doi.org/10.1016/s1011-1344(96)07459-3
Башарина О.В., Артюхов В.Г., Савостина И.Е. Влияние УФ-света на синтез некоторых белков лимфоцитами // Иммунология. 2009. Т. 30. № 3. С. 152–154. [Basharina O.V., Artyukhov V.G., Savostina I.E. Vliyanie UF-sveta na sintez nekotoryh belkov limfocitami // Immunologiya. 2009. V. 30. № 3. P. 152–154. (In Russian)]
Kim H.P., Leonard W.J. The basis of TCR-mediated regulation of the IL-2 receptor alpha chain gene: role of widely separated regulatory elements // EMBO J. 2002. V. 21. № 12. P. 3051–3059. https://doi.org/10.1093/emboj/cdf321
Peus D., Vasa R.A., Meves A. et al. H2O2 is an important mediator of UVB induced EGF-receptor phosphorylation in cultured keratinocytes // J. Investigat. Dermatol. 1998. V. 110. P. 966–971. https://doi.org/10.1046/j.1523-1747.1998.00210.x
Griendling K.K., Sorescu D., Lassegue B. et al. Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology // Arteriosclerosis, Thrombosis and Vascular Biology. 2000. V. 20. № 10. P. 2175–2185. https://doi.org/10.1161/01.atv.20.10.2175
Reth M. Hydrogen peroxide as second messenger in lymphocyte activation // Nature Immunol. 2002. V. 3. № 12. P. 1129–1134. https://doi.org/10.1038/ni1202-1129
Артюхов В.Г., Искусных А.Ю., Башарина О.В. и др. Влияние УФ-облучения на функциональную активность нейтрофилов крови доноров // Бюл. эксперим. биологии и медицины. 2005. Т. 139. № 3. С. 291–293. [Artyukhov V.G., Iskusnykh A.Yu., Basharina O.V., et al. Еffect of UV irradiation on functional activity of donor blood neutrophils // Bulletin of Experimental Biology and Medicine. 2005. V. 139. № 3. P. 313–315. (In Russian)]
Valencia A., Kochevar I.E. Nox1-based NADPH oxidase is the major source of UVA-induced reactive oxygen species in human keratinocytes // J. Investigat. Dermatol. 2008. V. 128. P. 214–222. https://doi.org/10.1038/sj.jid.5700960
Наквасина М.А., Попова Л.И., Лидохова О.В. и др. Модуляция структурно-функциональных свойств лимфоцитов человека в условиях воздействия активных форм кислорода // Бюл. эксперим. Биологии и медицины. 2018. Т. 166. № 10. С. 475–481. [Nakvasina M.A., Artyukhov V.G., Popova L.I. et al. Modulation of structural and functional properties of human lymphocytes by reactive oxygen species // Bulletin of Experimental Biology and Medicine. 2019. V. 166. № 4. P. 481–486. (In Russian)]
Bonamigo R.R., Dornelles S.I. Dermatology in public health environments: a comprehensive textbook. New York: Springer, 2018.
Wang X.Y., Bi Z.G. UVB-irradiated human keratinocytes and interleukin-1alpha indirectly increase MAP kinase/AP-1 activation and MMP-1 production in UVA-irradiated dermal fibroblasts // Chin. Med. J. (Engl). 2006. V. 119. № 10. P. 827–831.
Земченкова О.В., Артюхов В.Г., Башарина О.В. и др. Активность Са2+-АТФазы плазматических мембран фотомодифицированных лимфоцитов в присутствии ферментов антиоксидантной защиты // Вестн. ВГУ Серия: Химия. Биология. Фармация. 2011. № 2. С. 92–96. [Zemchenkova O.V., Artyukhov V.G., Basharina O.V. et al. Aktivnost’ Ca2+-ATFazy plazmaticheskih _erona_e fotomodificirovannyh limfocitov v prisutstvii fermentov antioksidantnoj zashchity // Vestnik VGU. Seriya: Himiya. Biologiya. Farmaciya. 2011. № 2. P. 92–96. (In Russian)]
Земченкова О.В., Артюхов В.Г., Башарина О.В. и др. О регуляции уровня АТФ в УФ-облученных лимфоцитах // Вестн. ВГУ. Серия: Химия. Биология. Фармация. 2011. № 1. С. 80–84. [Zemchenkova O.V., Artyukhov V.G., Basharina O.V., et al. O regulyacii urovnya ATF v UF-obluchennyh limfocitah // Vestnik VGU. Seriya: Himiya. Biologiya. Farmaciya. 2011. № 1. P. 80–84. (In Russian)]
Hajnoczky G., Davies E., Madesh M. Calcium signaling and apoptosis // Biochem. Biophys. Res. Commun. 2003. V. 304. № 3. P. 445–454.
Orrenius S., Zhivotovsky B., Nicotera P. Regulation of cell death: the calcium-apoptosis link // Nat. Rev. Mol. Cell. Biol. 2003. V. 4. № 7. P. 552–565. https://doi.org/10.1038/nrm1150
Наквасина М.А., Гюппенен М.А., Колтаков И.А. и др. Исследование влияния экзогенного кальция на структурно-функциональное состояние лимфоцитов человека // Вестн. ВГУ. Серия: Химия. Биология. Фармация. 2016. № 4. С. 67–72. [Nakvasina M.A., Gyuppenen M.A., Koltakov I.A., et al. Issledovanie vliyaniya ekzogennogo kal’ciya na strukturno-funkcio-nal’noe sostoyanie limfocitov cheloveka // Vestnik VGU. Seriya: Himiya. Biologiya. Farmaciya. 2016. № 4. P. 67–72. (In Russian)]
Накваcина М.А., Тpубицына М.C., Cоловьева Е.В. и др. Пути реализации апоптоза лимфоцитов человека, индуцированного УФ-излучением // Биофизика. 2012. Т. 57. № 4. С. 631–640. [Nakvasina M.A., Trubicina M.S., Solovieva E.V. et al. Ways of apoptosis deve-lopment in human lymphocytes, induced by UV-irradiation // Biophysics. 2012. V. 57. № 4. P. 477–484. (In Russian)]
Артюхов В.Г., Земченкова О.В., Башарина О.В. и др. Апоптоз и некроз лимфоцитов, индуцированные ультрафиолетовым облучением в присутствии аутологичной плазмы // Цитология. 2014. Т. 56. № 1. С. 77–83. [Artyukhov V.G., Basharina O.V., Zemchenkova O.V. et al. Аpoptosis and necrosis induced by ultraviolet radiation in the presence of autologous plasma // Cell and Tissue Biology. 2014. V. 8. № 3. P. 213–219. (In Russian)]
Наквасина М.А., Токмакова Е.В., Ефремова Д.С. и др. Инициирующие каспазы-8 и -12 в процессах реализации отдельных стадий УФ-индуцированного апоптоза лимфоцитов человека // Радиац. биология. Радиоэкология. 2018. Т. 58. № 5. С. 511–516. [Nakvasina M.A., Tokmakova E.V., Efremova D.S. et al. Iniciiruyushchie kaspazy-8 I -12 v processah realizacii otdel’nyh stadij UF-inducirovannogo apoptoza limfo-citov cheloveka // Radiacionnaya biologiya. Radio-ekologiya. 2018. V. 58. № 5. P. 511–516. (In Russian)]
Appelqvist H., Wäster P., Eriksson I. et al. Lysosomal exocytosis and caspase-8-mediated apoptosis in UVA-irradiated keratinocytes // J. Cell. Sci. 2013. V. 126. P. 5578–5584. https://doi.org/10.1016/s0014-5793(03)00238-2
Scoltock A.B., Cidlowski J.A. Activation of intrinsic and extrinsic pathways in apoptotic signaling during UV-C-induced death of Jurkat cells: the role of caspase inhibition // Exp. Cell. Res. 2004. V. 297. № 1. P. 212–223. https://doi.org/10.1016/j.yexcr.2004.03.025
Chun Y., Kim J. Autophagy: An Essential Degradation Program for Cellular Homeostasis and Life // Cells. 2018. V. 7. № 12. pii: E278. https://doi.org/10.3390/cells7120278
Chen X., Li L., Xu S., et al. Ultraviolet B radiation down-regulates ULK1 and ATG7 expression and impairs the autophagy response in human keratinocytes // J. Photochem. Photobiol. B: Biology. 2018. V. 178. P. 152–164.
Xu S., Li L., Li M. et al. Impact on Autophagy and Ultraviolet B Induced Responses of Treatment with the MTOR Inhibitors Rapamycin, Everolimus, Torin 1, and pp242 in Human Keratinocytes // Oxid. Med. Cell Longev. 2017. Epub. 2017. https://doi.org/10.1155/2017/5930639
Cavinato M., Kozieł R., Romani N. et al. UVB-Induced senescence of human dermal fibroblasts involves impairment of proteasome and enhanced autophagic activity // J. Gerontol. A Biol. Sci. Med. 2017. V. 72. № 5. P. 632–639. https://doi.org/10.1093/_erona/glw150
Caricchio R., Reap E.A., Cohen P.L. Fas/Fas ligand interactions are involved in ultraviolet-B-induced human lymphocyte apoptosis // J. Immunol. 1998. V. 161. № 1. P. 241–251.
Aragane Y., Kulms D., Metze D. et al. Ultraviolet light induces apoptosis via direct activation of CD95 (Fas/APO-1) independently of its ligand CD95L // J. Cell. Biol. 1998. V. 140. № 1. P. 171–182. https://doi.org/10.1083/jcb.140.1.171
Артюхов В.Г., Путинцева О.В., Тюнина О.И. и др. Исследование структурно-функциональных признаков (индикаторов) апоптоза лимфоцитов крови человека в условиях воздействия монооксида углерода и ультрафиолетового (УФ)-света // Радиац. биология. Радиоэкология. 2014. Т. 54. № 3. С. 297–304. [Artyukhov V.G., Putintseva O.V., Tyunina O.I. et al. Issledovanie strukturno-funkcional’nyh priznakov (indikatorov) apoptoza limfocitov krovi cheloveka v usloviyah vozdejstviya monooksida ugleroda I ul’trafioletovogo (UF)-sveta // Radiacionnaya biologiya. Radioekologiya. 2014. V. 54. № 3. P. 297–304. (In Russian)]
Артюхов В.Г., Башарина О.В., Земченкова О.В. и др. Влияние УФ-света на субпопуляционный состав и экспрессию мембранных маркеров лимфоцитов крови человека // Радиац. биология. Радиоэкология. 2016. Т. 56. № 1. С. 73–80. [Artyukhov V.G., Basharina O.V., Zemchenkova O.V. et al. Vliyanie UF-sveta na subpopulyacionnyj sostav I ekspressiyu membrannyh markerov limfocitov krovi cheloveka // Radiacionnaya biologiya. Radioekologiya. 2016. V. 56. № 1. P. 73–80. (In Russian)]
Артюхов В.Г., Путинцева О.В., Дубова С.М. и др. Изменения уровня экспрессии ряда поверхностных молекул лимфоцитов крови человека в условиях УФ-облучения их суспензий // Мед. иммунология. 2013. Т. 15. № 4. С. 361–368. [Artyukhov V.G., Putintseva O.V., Dubova S.M. et al. Izmeneniya urovnya ekspressii ryada poverhnostnyh molekul limfocitov krovi cheloveka v usloviyah UF-oblucheniya ih suspenzij // Medicinskaya immunologiya. 2013. V. 15. № 4. P. 361–368. (In Russian)]
Артюхов В.Г., Путинцева О.В., Дубова С.М. Уровень экспрессии некоторых адгезивных молекул интактными и УФ-облученными Т-лимфоцитами крови человека // Мед. иммунология. 2009. Т. 11. № 1. С. 79–84. [Artyukhov V.G., Putintseva O.V., Dubova S.M. Uroven’ ekspressii nekotoryh adgezivnyh molekul intaktnymi i UF-obluchennymi T-limfocitami krovi cheloveka // Medicinskaya Immunologiya. 2009. V. 11. № 1. P. 79–84. (In Russian)]
Артюхов В.Г., Путинцева О.В., Брагина В.А. и др. Флюоресцентные методы в исследовании УФ-индуцированных изменений структурно-функционального состояния лимфоцитов крови человека // Бюл. эксперим. биологии и медицины. 2012. Т. 153. № 6. С. 891–895. [Artyukhov V.G., Putintseva O.V., Bragina V.A. et al. Fluorescent methods in the study of UV-induced changes in structural and functional state of human blood lymphocytes // Bulletin of Experimental Biology and Medicine. 2012. V. 153. № 6. P. 908–912. (In Russian)]
Артюхов В.Г., Путинцева О.В., Дубова С.М. и др. Изменение уровня экспрессии CD2-рецепторов т-лимфоцитами крови человека под действием УФ-света // Иммунология. 2012. Т. 33. № 1. С. 6–10. [Artyukhov V.G., Putintseva O.V., Dubova S.M. et al. Izmenenie urovnya ekspressii CD2-receptorov t-limfocitami krovi cheloveka pod dejstviem UF-sveta // Immunologiya. 2012. V. 33. № 1. P. 6–10. (In Russian)]
Peus D., Meves A., Vasa R.A. et al. H2O2 is required for UVB-induced EGF receptor and downstream signaling pathway activation // Free Radic. Biol. Med. 1999. V. 27. № 11–12. P. 1197–202. https://doi.org/10.1016/s0891-5849(99)00198-7
Huang R., Wu J., Fan Y. et al. UV activates growth factor receptors via reactive oxygen intermediates // J. Cell. Biol. 1996. V. 133. № 1. P. 211–220. https://doi.org/10.1083/jcb.133.1.211
Mahns A., Wolber R., Stab F. et al. Contribution of UVB and UVA to UV-dependent stimulation of cyclooxygenase-2 expression in artificial epidermis // Photochem. Photobiol. Sci. 2004. V. 3. P. 257–262. https://doi.org/10.1039/b309067a
He Y.Y., Council S.E., Feng L. et al. UVA-induced cell cycle progression is mediated by a disintegrin and metalloprotease/epidermal growth factor receptor/AKT/Cyclin D1 pathways in keratinocytes // Cancer Res. 2008. V. 68. P. 3752–3758. https://doi.org/10.1158/0008-5472.CAN-07-6138
Blattner C., Bender K., Herrlich P. et al. Photoproducts in transcriptionally active DNA induce signal transduction to the delayed U.V.-responsive genes for collagenase and metallothionein // Oncogene. 1998. V. 16. № 22. P. 2827–2834. https://doi.org/10.1038/sj.onc.1201827
Devary Y., Rosette C., DiDonato J.A. et al. NF-kappa B activation by ultraviolet light not dependent on a nuclear signal // Science. 1993. V. 261. № 5127. P. 1442–1445. https://doi.org/10.1126/science.8367725
El-Abaseri T.B., Fuhrman J., Trempus C. et al. Chemoprevention of UV light-induced skin tumorigenesis by inhibition of the epidermal growth factor receptor // Cancer Res. 2005. V. 65. № 9. P. 3958–3965. https://doi.org/10.1158/0008-5472.CAN-04-2204
Bourcier C., Jacquel A., Hess J. et al. p44 mitogen-activated protein kinase (extracellular signal-regulated kinase 1)-dependent signaling contributes to epithelial skin carcinogenesis // Cancer Res. 2006. V. 66. № 5. P. 2700–2707. https://doi.org/10.1158/0008-5472.CAN-05-3129
Katsanakis K.D., Owen C., Zoumpourlis V. JNK and ERK signaling pathways in multistage mouse carcinogenesis: studies in the inhibition of signaling cascades as a means to understand their in vivo biological role // Anticancer Res. 2002. V. 22. № 2A. P. 755–759.
Bode A.M., Dong Z. Mitogen-activated protein kinase activation in UV-induced signal transduction // Science’s STKE. 2003. V. 167. RE2. https://doi.org/10.1126/stke.2003.167.re2
Fritsche E., Schaefer C., Calles Ch. Et al. Lightening up the UV response by identification of the arylhydrocarbon receptor as a cytoplasmatic target for ultraviolet B radiation // Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 21. P. 8851–8856. https://doi.org/10.1073/pnas.0701764104
Greussing R., Hackl M., Charoentong P. et al. Identification of microRNA-mRNA functional interactions in UVB-induced senescence of human diploid fibroblasts // BMC Genomics. 2013. V. 14. № 224. https://doi.org/10.1186/1471-2164-14-224
Романов В.С., Поспелов В.А., Поспелова Т.В. Ингибитор циклин-зависимых киназ p21Waf1: современный вгляд на роль в клеточном старении и онкогенезе // Биохимия. 2012. Т. 77. № 6. С. 701–712. [Romanov V.S., Pospelov V.A., Pospelova T.V. Cyclin-dependent kinase inhibitor p21Waf1: Contemporary view on its role in senescence and oncogenesis // Biochemi-stry (Moscow). 2012. V. 77. № 6. P. 575–584. (In Russian)]
Wolfel T., Hauer M. A p16INK4a-insensitive CDK4 mutant targeted by cytolytic T lymphocytes in a human melanoma // Science. 1995. V. 269. № 5228. P. 1281–1284.
Rijken F., Bruijnzeel P.L. The pathogenesis of photoaging: the role of neutrophils and neutrophil-derived enzymes // J. Investig. Dermatol. Symp. Proc. 2009. V. 14. № 1. P. 67–72. https://doi.org/10.1038/jidsymp.2009.15
Zawrotniak M., Bartnicka D., Rapala-Kozik M. UVA and UVB radiation induce the formation of neutrophil extracellular traps by human polymorphonuclear cells // J. Photochem. Photobiol. B: Biology. 2019. V. 196. P. 111511. https://doi.org/10.1016/j.jphotobiol.2019
Pothof J., Verkaik N.S., van Icken W. et al. MicroRNA-mediated gene silencing modulates the UV-induced DNA-damage response // EMBO J. 2009. V. 28. P. 2090–2099. https://doi.org/10.1038/emboj.2009.156
Galaktionov K., Beach D. Specific activation of cdc25 tyrosine phosphatases by B-type cyclins: evidence for multiple roles of mitotic cyclins // Cell. 1991. V. 67. № 6. P. 1181–1194.
Meisgen F., Xu N., Wei T. et al. miR-21 is up-regulated in psoriasis and suppresses T cell apoptosis // Exp. Dermatol. 2012. V. 21. № 4. P. 312–314. https://doi.org/10.1111/j.1600-0625.2012.01462.x
Allgayer H. Pdcd4, a colon cancer prognostic that is regulated by a microRNA // Crit. Rev. Oncol. Hematol. 2010. V. 73. № 3. P. 185–191. https://doi.org/10.1016/j.critrevonc.2009.09.001
Talotta F., Cimmino A., Matarazzo M.R. et al. An autoregulatory loop mediated by miR-21 and PDCD4 controls the AP-1 activity in RAS transformation // Oncogene. 2009. V. 28. № 1. P. 73–84. https://doi.org/10.1038/onc.2008.370
Melnik B.C. miR-21 : an environmental driver of malignant melanoma // J. Transl. Med. 2015. V. 13. P. 202. https://doi.org/10.1186/s12967-015-0570-5
Emri G., Tosaki A., Janka E. et al. Ultraviolet radiation-mediated development of cutaneous melanoma: an update // J. Photochem. Photobiol. B: Biology. 2018. V. 185. P. 169–175. https://doi.org/10.1016/j.jphotobiol.2018.06.005
Рукша Т.Г., Сергеева Е.Ю., Палкина Н.В. и др. МикроРНК как регуляторы эффектов ультрафиолетового излучения в клетках кожи // Цитология. 2016. Т. 58. № 10. С. 733–743. [Ruksha T.G., Sergeeva E.Yu., Palkina N.V. et al. MikroRNK kak regulyatory effektov ul’trafioletovogo izlucheniya v kletkah kozhi // Citologiya. 2016. V. 58. № 10. P. 733–743. (In Russian)]
Kraemer A., Chen I.P., Henning S. et al. UVA and UVB irradiation differentially regulate microRNA expression in human primary keratinocytes // PloS One. 2013. V. 8. № 12. e 83392. https://doi.org/10.1371/journal.pone.0083392
Syed D.N., Afaq F., Mukhtar H. Differential activation of signaling pathways by UVA and UVB radiation in normal human epidermal keratinocytes (dagger) // Photochem. Photobiol. 2012. V. 88. № 5. P. 1184–1190. https://doi.org/10.1111/j.1751-1097.2012.01115.x
Khoe C.V., Chung L.H., Murray V. The sequence specificity of UV-induced DNA damage in a systematically altered DNA sequence // J. Photochem. Photobiol. B: Biology. 2018. V. 183. P. 88–100. https://doi.org/10.1016/j.jphotobiol.2018.04.023
Chung L.H., Murray V. An extended sequence specifi-city for UV-induced DNA damage // J. Photochem. Photobiol. B: Biology. 2018. V. 178. P. 133–142. https://doi.org/10.1016/j.jphotobiol.2017.10.034
D’Errico M., Lemma T., Calcagnile A. et al. Cell type and DNA damage specific response of human skin cells to environmental agents // Mutat. Res. 2007. V. 614. № 1–2. P. 37–47. https://doi.org/10.1016/j.mrfmmm.2006.06.009
Arlett C.F., Lowe J.E., Harcourt S.A. et al. Hypersensitivity of human lymphocytes to UV-B and solar irradiation // Cancer Res. 1993. V. 53. № 3. P. 609–614.
Артюхов В.Г., Трубицына М.С., Наквасина М.А. и др. Фрагментация ДНК лимфоцитов человека в динамике развития апоптоза, индуцированного воздействием УФ-излучения и активных форм кислорода // Цитология. 2011. Т. 53. № 1. С. 61–67. [Artyukhov V.G., Trubitsyna M.S., Nakvasina M.A. et al. DNA fragmentation of human lymphocytes in dyna-mics of development of apoptosis induced by action of UV radiation and reactive oxygen species // Cell and Tissue Biology. 2011. V. 5. № 2. P. 127–135. (In Russian)]
Lisby S., Gniadecki R., Wulf H.C. UV-induced DNA damage in human keratinocytes: quantitation and correlation with long-term survival // Exp. Dermatol. 2005. V. 14. № 5. P. 349–355. https://doi.org/10.1111/j.0906-6705.2005.00282.x
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология