Радиационная биология. Радиоэкология, 2021, T. 61, № 1, стр. 14-24
Риск заболеваемости немеланомным раком кожи в когорте работников, подвергшихся хроническому облучению
М. В. Банникова 1, Т. В. Азизова 1, *, Е. С. Григорьева 1, В. Л. Рыбкина 1
1 Южно-Уральский институт биофизики МФБА России
Озёрск, Россия
* E-mail: clinic@subi.su
Поступила в редакцию 16.04.2020
После доработки 02.11.2020
Принята к публикации 11.11.2020
Аннотация
В последние десятилетия отмечается устойчивая тенденция к росту рака кожи, в том числе в когортах лиц, подвергшихся различным видам облучения. Однако до сих пор остаются неясными оценка риска и характер зависимости доза–эффект при хроническом облучении с низкой мощностью дозы. Цель настоящего исследования – оценка риска заболеваемости немеланомными раками кожи (НМРК) в когорте работников, подвергшихся хроническому низкоинтенсивному воздействию радиации. Рассчитаны относительный риск (ОР) и избыточный относительный риск на единицу дозы облучения (ИОР/Зв), используя модуль “AMFIT” программы “EPICURE”. В изучаемой когорте работников зарегистрированы 294 случая НМРК. Установлено, что заболеваемость НМРК в изучаемой когорте работников зависела от таких нерадиационных факторов, как пол, возраст, тип производства, уровень образования. Выявлен статистически значимый повышенный риск заболеваемости НМРК у работников, подвергшихся хроническому внешнему воздействию γ-излучения в суммарной дозе более 2.0 Зв, (ОР = 2.52; 95%-ный ДИ 1.60–3.97). Обнаружена значимая линейная зависимость заболеваемости НМРК от суммарной дозы облучения; ИОР/Зв составил 0.49 (95%-ный ДИ 0.22–0.90) и 0.51 (95%-ный ДИ 0.22–0.93) без включения и с включением поправки на дозу нейтронного облучения соответственно.
Злокачественные новообразования (ЗНО) кожи, включающие меланому (МК) и немеланомные раки (НМРК), являются наиболее распространенными ЗНО, с устойчивой тенденцией к росту в последние десятилетия [1–3]. Основными факторами, способствующими развитию этих патологий, являются пол, возраст, генетическая предрасположенность, особенности фенотипа кожи, воздействие ультрафиолетового излучения (УФИ) и др. [3–7]. Показан повышенный риск ЗНО кожи в когортах лиц, подвергшихся различным видам облучения [3, 7–13]. В обзоре [3] подробно представлены, систематизированы и критически оценены все исследования по изучению заболеваемости ЗНО кожи при различных сценариях радиационного воздействия. Авторы пришли к заключению о том, что исследования зависимости доза–эффект для этих заболеваний весьма ограничены в связи с тем, что отсутствует информация о дозах облучения. До сих пор остаются неясными оценка риска и характер зависимости доза–эффект при хроническом низкоинтенсивном воздействии радиации. Поэтому целью настоящего исследования была оценка риска заболеваемости НМРК в когорте работников производственного объединения (ПО) “Маяк”, подвергшихся хроническому облучению с низкой мощностью дозы.
МАТЕРИАЛЫ И МЕТОДИКА
Изучаемая когорта
Это исследование является ретроспективным когортным исследованием. Изучаемая когорта включала всех работников ПО “Маяк” (первого в России крупного предприятия атомной промышленности, расположенного на Южном Урале, вблизи города Озёрск), впервые нанятых на один из основных заводов (реакторы, радиохимический, плутониевый) в период с 1 января 1948 г. по 31 декабря 1982 г., независимо от пола, возраста, национальной принадлежности, профессии, продолжительности работы и других характеристик, – 22 377 человек (25.4% – женщины).
Период наблюдения за когортой начинался от даты найма на один из основных заводов и продолжался до первого из следующих событий: даты установления диагноза НМРК; даты смерти; 31 декабря 2013 г. для живых работников, проживающих в г. Озёрск (резиденты); даты “последней медицинской информации” для работников-резидентов с неизвестным жизненным статусом и для работников, выехавших из г. Озёрск на другое постоянное место жительства (мигранты).
Подробная характеристика изучаемой когорты представлена ранее [14]. Кратко, средний возраст на момент найма на ПО “Маяк” у мужчин составил 24.11 ± 7.13 года (± стандартное отклонение, СОт) и у женщин – 27.32 ± 7.97 года. Продолжительность работы варьировала от 1 мес до 60 лет и, в среднем, составила 18.04 ± 14.28 года; и только 4.7% работников проработали на ПО “Маяк” менее 1 года.
Жизненный статус к концу периода наблюдения известен для 95% членов изучаемой когорты; 53.5% из них умерли и 46.5% живы. Средний возраст на момент смерти у мужчин составил 61.52 ± ± 13.63 года, у женщин –70.4 ± 12.44 года, а средний возраст тех, кто жив – 68.50 ± 10.40 и 76.59 ± ± 9.75 соответственно.
В исследовании использованы поглощенные дозы внешнего воздействия γ- и нейтронного излучениий из дозиметрической системы работников ПО “Маяк” – 2008 (“ДСРМ-2008”), разработанной в рамках российско-американского сотрудничества [15]. В ДРСМ-2008 доступны поглощенные дозы на 18 органов, за исключением кожи, поэтому в настоящем исследовании была использована индивидуальная поглощенная доза равномерного γ-излучения на глубине 10 мм в точке ношения дозиметра – Hр(10) эквивалент (далее обозначен как “ γ-доза”) и индивидуальная поглощенная доза нейтронного излучения на глубине 10 мм в месте ношения дозиметра – Hp(10)n эквивалент (далее обозначен как “нейтронная доза”) [16]. Средняя суммарная γ-доза за исклю-чением кожи у мужчин составила 0.54 ± 0.76 Зв и у женщин – 0.44 ± 0.65 Зв; средняя годовая γ-доза – 0.06 ± 0.13 и 0.06 ± 0.11 Зв соответственно. Диапазон суммарных доз облучения был широким; 17% работников подверглись воздействию γ-излучения при уровнях выше 1.0 Зв и 35% – менее 0.1 Зв. (рис. 1).
Рис. 1.
Распределение работников изучаемой когорты в зависимости от суммарной поглощенной дозы внешнего воздействия γ-излучения Hр(10).
Fig. 1. The distribution of the study cohort workers by the cumulative dose of external γ-ray exposure Hр(10).
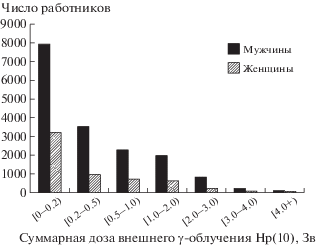
Средняя суммарная нейтронная доза составила 0.034 ± 0.080 Зв у мужчин и 0.033 ± 0.092 Зв у женщин (рис. 2).
Рис. 2.
Распределение работников изучаемой когорты в зависимости от суммарной поглощенной дозы внешнего воздействия нейтронного излучения Hp(10)n.
Fig. 2. The distribution of the study cohort workers by the cumulative dose of external neutron exposure Hp(10)n.
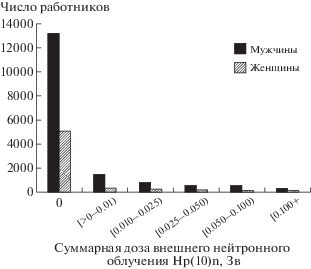
В настоящем исследовании был оценен риск НМРК, включающего базальноклеточный рак кожи, плоскоклеточный рак кожи и др. (С 44.0–С 44.9 коды МКБ-10) [17]. На основе медико-дозиметрической базы данных “Клиника” [18] были идентифицированы все верифицированные случаи НМРК в изучаемой когорте работников: 294 случая (187 случаев (63.6%) у мужчин и 107 случаев (36.4%) у женщин). Следует отметить, что НМРК в 100% случаев были подтверждены гистологическим исследованием. Из 294 случаев НМРК базальноклеточные раки кожи зарегистрированы у 294 работников (84.69%), плоскоклеточные раки кожи – у 40 работников (13.61%), и раки придатков кожи – у 5 работников (1.70%).
Статистический анализ
Стандартизованные показатели заболеваемости ЗНО кожи на 100 000 работников и 95%-ные доверительные интервалы (ДИ) были рассчитаны с использованием стандартного пакета Statistica 10.0. Стандартизация проводилась косвенным методом с использованием внутреннего стандарта. Кусочная лог-линейная модель использовалась для построения временных трендов и для оценки годовых процентных изменений (APC) показателей заболеваемости. Использовались двусторонние критерии статистической значимости, при уровне значимости 0.10 (без поправки на автокорреляцию).
Анализ включал оценку относительного риска (ОР) для категорий из одной или нескольких переменных с поправкой на другие переменные. ОР рассчитывался по методу максимального правдоподобия с помощью модуля “AMFIT” программы “EPICURE” [19]. 95%-ные доверительные интервалы для оценок ОР и р-значения для проверки статистической значимости были получены с помощью методов максимального правдоподобия, используя модуль “AMFIT”.
На первом этапе было изучено влияние нерадиационных факторов на заболеваемость ЗНО кожи, а затем – влияние внешнего воздействия γ-излучения с учетом нерадиационных факторов (пол, возраст, календарный период) и нейтронного излучения (с помощью стратификации).
Были также построены тренды заболеваемости в зависимости от дозы облучения с помощью метода Пуассоновской регрессии, с использованием модуля “AMFIT” программы “EPICURE”. В частности, избыточный относительный риск на единицу дозы (ИОР/Зв) описывался с помощью линейного тренда (зависимость от дозы внешнего облучения) с поправкой (с помощью стратификации) на нерадиационные факторы (пол, достигнутый возраст (<20, 20–25, …, 80–85, >85 лет) и календарный период (1946–1950, 1951–1955, 1956–1960, 1961–1965, …, 2011+)). То есть используемая модель Пуассоновской регрессии имела вид:
где λ – показатель заболеваемости ЗНО кожи; λ0 – фоновый показатель заболеваемости ЗНО кожи; s – пол; aa – достигнутый возраст; cc – календарный период; β – ИОР/Зв; D – суммарная доза внешнего воздействия γ-облучения в Зв.Для изучения влияния нейтронного излучения на полученную оценку риска был проведен анализ чувствительности, в котором доза рассматривалась как категориальная переменная и имела следующие категории: <0.01, 0.01–0.025, 0.025–0.05, 0.05–0.10, >0.10, неизмеренный 0.00. Поправку на нейтронную дозу делали с помощью стратификации, и модель Пуассоновской регрессии имела следующий вид:
где dn – суммарная доза воздействия нейтронного излучения в Зв. При этом работники, которые предположительно не подвергались такому облучению, не исключались из анализа, а относились к категории “неизмеренный 0.00”. Примененный способ анализа (поправка на нейтронную дозу с помощью стратификации) выбран потому, что лишь у 18.6% работников изучаемой когорты были измерены дозы нейтронного излучения, и исключение из анализа работников с неизвестными данными привело бы к значительному снижению статистической мощности.Кроме того, были проведены анализы чувствительности: исключение из анализа работников, проработавших менее года; использование различных периодов лагирования (0, 5, 10, 15 и 20) для доз облучения (γ и нейтронное). При лагировании доз чел.-годы считались от начала работы, а первые х лет после начала работы были отнесены к категории “нулевой дозы” при лагировании поглощенной дозы.
Также была изучена модификация радиогенного риска заболеваемости ЗНО кожи в зависимости от пола, достигнутого возраста и возраста на момент найма на ПО “Маяк” и типа производства (с оценкой гетерогенности и лог-линейного тренда ИОР/Зв с достигнутым возрастом). Все критерии значимости являлись двусторонними. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
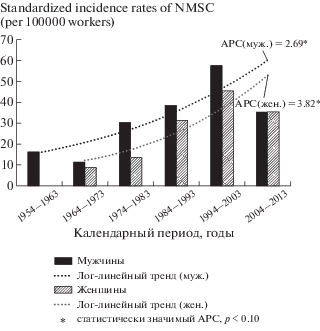
В изучаемой когорте работников ПО “Маяк” за весь период наблюдения были зарегистрированы 294 случая НМРК в течение 565 019 чел.-лет наблюдения. Распределение НМРК в зависимости от достигнутого возраста на дату установления диагноза представлено в табл. 1. Показано, что преобладающее большинство случаев НМРК впервые установлены у работников в возрасте старше 50 лет (86.4%). Известно, что возраст является одним из основных факторов риска развития ЗНО [3, 5]. Преобладающее большинство случаев НМРК зарегистрированы в 1986–2013 гг. (80.3%), что обусловлено, прежде всего, достигнутым возрастом работников в этот период. Стандартизованные показатели заболеваемости НМРК у мужчин составили 46.04 ± 3.40 и у женщин – 37.40 ± 4.72 на 100 000 работников. Рис. 3 демонстрирует существенное увеличение показателей заболеваемости НМРК в изучаемой когорте работников к концу периода наблюдения. Выявлен статистически значимый лог-линейный тренд увеличения показателей заболеваемости НМРК как у мужчин, так и у женщин (APC = = 2.69 и 3.82 соответственно, p < 0.10) (рис. 3).
Таблица 1.
Распределение случаев НМРК в зависимости от достигнутого возраста на дату установления диагноза Table 1. The distribution of workers by age as of the date of MNSC diagnosis
| Возраст, лет | Мужчины | Женщины | Оба пола | |||
|---|---|---|---|---|---|---|
| число | % | число | % | число | % | |
| <50 | 30 | 16.04 | 10 | 9.35 | 40 | 13.61 |
| [50–60) | 48 | 25.67 | 14 | 13.08 | 62 | 21.09 |
| [60–70) | 56 | 29.95 | 24 | 22.43 | 80 | 27.21 |
| [70+ | 53 | 28.34 | 59 | 55.14 | 112 | 38.1 |
| Всего | 187 | 100 | 107 | 100 | 294 | 100.01 |
| Средний возраст ± ± СОт | 62.23 ± 11.51 | 68.43 ± 10.75 | 64.49 ± 11.61 | |||
| Медиана (минимум; максимум) | 64 (30; 84) | 71 (41; 87) | 67 (30; 87) | |||
Рис. 3.
Стандартизованные показатели заболеваемости НМРК в изучаемой когорте работников.
Fig. 3. Standardized MNSC incidence rates for the study worker cohort.
Анализ заболеваемости НМРК в изучаемой когорте работников в зависимости от нерадиационных факторов представлен в табл. 2. Выявлено, что заболеваемость НМРК у женщин была статистически значимо ниже при сравнении с мужчинами (ОР = 0.77; 95%-ный ДИ 0.60–0.98). Заболеваемость НМРК возрастала с увеличением достигнутого возраста как у мужчин, так и у женщин. Так, например, ОР заболеваемости НМРК у мужчин в возрасте старше 70 лет составил 17.70 (95%-ный ДИ 10.43–30.67) при сравнении с референс-категорией (мужчины в возрасте <50 лет). ОР заболеваемости НМРК был статистически значимо ниже у мужчин, впервые нанятых на предприятие в возрасте старше 30 лет, при сравнении с работниками, нанятыми в возрасте моложе 20 лет (табл. 2). Обнаружено, что заболеваемость НМРК ниже у работниц реакторов при сравнении с работницами радиохимического завода (ОР = 0.54; 95%-ный ДИ 0.26 – 0.99, р < 0.05). Риск НМРК был выше у лиц с высшим образованием, но статистически значимые оценки риска наблюдались только у мужчин (табл. 2). Не выявлено значимого влияния календарного периода найма на предприятие, продолжительности работы, календарного периода установления диагноза, статуса курения и употребления алкоголя на заболеваемость НМРК (как у мужчин, так и у женщин).
Таблица 2.
Результаты анализа заболеваемости НМРК в зависимости от нерадиационных факторов Table 2. Analysis results for NMSC incidence association with non-radiation factors
| Факторы | ОР (95%-ный ДИ) | Число случаев | |
|---|---|---|---|
| Пол | |||
| Мужчины | 1 | 187 | |
| Женщины | 0.77 (0.60; 0.98) | 107 | |
| Достигнутый возраст, лет | |||
| Мужчины | <50 | 1 | 30 |
| [50−60) | 4.49 (2.76; 7.46) | 48 | |
| [60−70) | 8.35 (5.07; 14.05) | 56 | |
| [70+ | 17.70 (10.43; 30.67) | 53 | |
| Женщины | <50 | 1 | 10 |
| [50−60) | 2.07 (0.86; 5.20) | 14 | |
| [60−70) | 3.42 (1.43; 8.84) | 24 | |
| [70+ | 9.59 (4.04; 25.10) | 59 | |
| Возраст первого найма, лет | |||
| Мужчины | <20 | 1 | 50 |
| [20−30) | 0.82 (0.56; 1.20) | 101 | |
| [30+ | 0.53 (0.30; 0.92) | 36 | |
| Женщины | <20 | 1 | 20 |
| [20−30) | 0.68 (0.40; 1.21) | 48 | |
| [30+ | 0.81 (0.45; 1.47) | 39 | |
| Период первого найма, годы | |||
| Мужчины | 1948−1958 | 1 | 114 |
| 1959−1982 | 0.86 (0.56; 1.15) | 73 | |
| Женщины | 1948−1958 | 1 | 67 |
| 1959−1982 | 0.90 (0.56; 1.42) | 40 | |
| Календарный период установления диагноза, годы | |||
| Мужчины | 1946−1955 | 1.20 (0.19; 4.08) | 2 |
| 1956−1965 | 0.33 (0.05; 1.12) | 2 | |
| 1966−1975 | 0.84 (0.42; 1.58) | 12 | |
| 1976−1985 | 0.94 (0.58; 1.50) | 28 | |
| 1986−1995 | 0.93 (0.62; 1.37) | 44 | |
| 1996−2005 | 1 | 59 | |
| 2006−2013 | 0.90 (0.59; 1.35) | 40 | |
| Женщины | 1946−1955 | − | 0 |
| 1956−1965 | − | 0 | |
| 1966−1975 | 0.87 (0.29; 2.37) | 7 | |
| 1976−1985 | 0.45 (0.17; 1.05) | 7 | |
| 1986−1995 | 0.74 (0.41; 1.29) | 20 | |
| 1996−2005 | 1 | 44 | |
| 2006−2013 | 0.89 (0.54; 1.45) | 29 | |
| Тип производства | |||
| Мужчины | Реакторы | 1.02 (0.71; 1.45) | 49 |
| Радиохимический завод | 1 | 79 | |
| Плутониевый завод | 1.02 (0.72; 1.43) | 59 | |
| Женщины | Реакторы | 0.54 (0.26; 0.99) | 11 |
| Радиохимический завод | 1 | 50 | |
| Плутониевый завод | 1.19 (0.79; 1.79) | 46 | |
| Продолжительность работы, лет | |||
| Мужчины | <1 | 1.29 (0.49; 2.82) | 6 |
| [1–10) | 1 | 39 | |
| [10+ | 0.93 (0.65; 1.37) | 142 | |
| Женщины | <1 | 1.04 (0.25; 2.94) | 3 |
| [1–10) | 1 | 29 | |
| [10+ | 1.14 (0.74; 1.81) | 75 | |
| Употребление алкоголя | |||
| Мужчины | Не употребляет | 1 | 4 |
| Умеренно | 1.12 (0.47; 3.65) | 126 | |
| Злоупотребляет | 0.87 (0.36; 2.90) | 50 | |
| Неизвестно | 1.04 (n/a; n/a) | 7 | |
| Женщины | Не употребляет | 1 | 58 |
| Умеренно | 1.07 (0.71; 1.58) | 47 | |
| Злоупотребляет | 0.37 (0.02; 1.67) | 1 | |
| Неизвестно | 0.27 (0.02; 1.24) | 1 | |
| Курение | |||
| Мужчины | Не курит | 1 | 45 |
| Курит | 0.92 (0.66; 1.31) | 142 | |
| Неизвестно | − | 0 | |
| Женщины | Не курит | 1 | 102 |
| Курит | 0.88 (0.27; 2.13) | 4 | |
| Неизвестно | 0.56 (0.03; 2.54) | 1 | |
| Образование | |||
| Мужчины | Не высшее | 1 | 108 |
| Высшее | 1.51 (1.10; 2.06) | 63 | |
| Неизвестно | 1.02 (0.57; 1.72) | 16 | |
| Женщины | Не высшее | 1 | 84 |
| Высшее | 1.29 (0.67; 2.29) | 12 | |
| Неизвестно | 1.65 (0.81; 3.05) | 11 | |
Результаты анализа заболеваемости НМРК в изучаемой когорте работников, подвергшихся облучению в различных дозовых диапазонах (категориях), представлены в табл. 3. Обнаружен статистически значимый повышенный риск заболеваемости НМРК у работников, подвергшихся хроническому воздействию γ-излучения в суммарной дозе более 2.0 Зв, (ОР = 2.52; 95%-ный ДИ 1.60–3.97), при сравнении с референс-категорией (суммарная доза 0–0.05 Зв).
Таблица 3.
ОР заболеваемости НМРК в зависимости от суммарной γ-дозы Table 3. RR of NMSC incidence for various categories of cumulative dose of external γ-ray exposure
| Суммарная доза облучения (Зв), диапазон | Средняя суммарная доза облучения, Зв | Чел.-годы наблюдения | Случаи рака кожи | ОР (95%-ный ДИ) |
|---|---|---|---|---|
| [0−0.05) | 0.019 | 127 188.0 | 42 | 1 |
| [0.05−0.10) | 0.074 | 67 356.0 | 30 | 1.16 (0.72; 1.85) |
| [0.10−0.50) | 0.233 | 187 887.0 | 79 | 0.84 (0.57; 1.24) |
| [0.50−1.00) | 0.699 | 72 262.6 | 49 | 1.17 (0.76; 1.81) |
| [1.00−2.00) | 1.370 | 62 600.3 | 45 | 1.21 (0.78; 1.89) |
| ≥2.00 | 2.582 | 29 648.2 | 44 | 2.52 (1.60; 3.97) |
Избыточный относительный риск на единицу γ-дозы подвергшихся облучению (ИОР/1.0 Зв) для заболеваемости НМРК на основе линейной модели с учетом поправок на нерадиационные факторы (пол, достигнутый возраст и календарный период) представлен в табл. 4 и рис. 4.
Таблица 4.
Результаты анализа зависимости заболеваемости НМРК от суммарной γ-дозы Table 4. Results of the analysis of NMSC incidence association with cumulative dose of γ-ray exposure
| Анализ | ИОР/Зв (95%-ный ДИ) |
|---|---|
| Основной анализ, 0 лет лаг | 0.49 (0.22; 0.90) |
| Основной анализ, 5 лет лаг | 0.49 (0.21; 0.89) |
| Основной анализ, 10 лет лаг | 0.50 (0.22; 0.91) |
| Основной анализ, 15 лет лаг | 0.52 (0.23; 0.93) |
| Основной анализ, 20 лет лаг | 0.60 (0.28; 1.05) |
| Анализ чувствительности – добавление в стратификацию нейтронной дозы | 0.51 (0.22; 0.93) |
| Анализ чувствительности – исключение из анализа работников, проработавших менее года | 0.51 (0.23; 0.94) |
| Анализ, ограниченный работниками | |
| Мужчины | 0.70 (0.28; 1.41) |
| Женщины | 0.22 (–0.09; 0.77) |
| Тест на гетерогенность между мужчинами и женщинами | p1 = 0.16 |
| Достигнутый возраст, лет | |
| <50 | 0.99 (0.06; 3.45) |
| [50–59) | 2.17 (0.51; 8.63) |
| [60–69) | 1.32 (0.45; 3.36) |
| [70+ | 0.16 (–0.10; 0.60) |
| Тест на гетерогенность между группами работников различного достигнутого возраста | p2 = 0.02 |
| Тест на лог-линейный тренд ИОР/Зв по достигнутому возрасту | p3 = 0.25 |
| Возраст на момент найма, лет | |
| <20 | 0.61 (0.03; 2.12) |
| [20–29) | 0.39 (0.06; 0.98) |
| [30+ | 0.91 (0.09; 2.95) |
| Тест на гетерогенность между группами работников различного возраста найма | p4 > 0.5 |
| Тип производства | |
| Реакторы | 0.35 (–0.21; 1.78) |
| Радиохимический завод | 0.93 (0.32; 2.29) |
| Плутониевый завод | 0.72 (0.10; 1.86) |
| Тест на гетерогенность между группами работников различных типов производства | p5 > 0.5 |
Рис. 4.
Зависимость заболеваемости НМРК от суммарной поглощенной γ-дозы.
Fig. 4. The NMSC incidence association with the cumulative dose of γ-ray exposure.
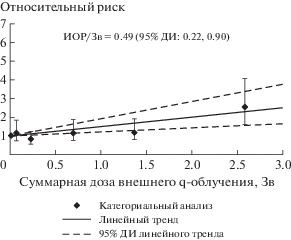
Обнаружена статистически значимая линейная зависимость заболеваемости НМРК от суммарной поглощенной дозы γ-излучения; ИОР/Зв составил 0.49 (95%-ный ДИ 0.22–0.90) и 0.51 (95%-ный ДИ 0.22–0.93) без включения и с включением поправки на нейтронную дозу соответственно.
Риск увеличивался с возрастанием периода лагирования, и при 20-летнем лаге ИОР/Зв составил 0.60 (95%-ный ДИ 0.28–1.05). Избыточный относительный риск на единицу поглощенной дозы γ-излучения обнаружен у мужчин (ИОР/Зв = 0.70; 95%-ный ДИ 0.28–1.41); однако статистически значимых различий между индивидами разного пола не выявлено (p = 0.16). Риск заболеваемости НМРК был статистически значимым во всех возрастных группах, за исключением работников старше 70 лет; и различия между возрастными группами были значимые (p = 0.02). Риск заболеваемости НМРК снижался с увеличением достигнутого возраста работников, но этот тренд был статистически незначимым (p = 0.25). Не выявлено модификации радиогенного риска заболеваемости НМРК в изучаемой когорте работников в зависимости от возраста найма на предприятие (р > 0.5) и типа производства (р > 0.5). Исключение из анализа индивидов, работавших на предприятии менее 1 года, не изменило полученные результаты.
ОБСУЖДЕНИЕ
В изучаемой когорте работников выявлен статистически значимый тренд увеличения показателей заболеваемости НМРК к концу периода наблюдения (1948–2013 гг.). Полученные результаты хорошо согласуются с результатами других исследований и подтверждают общую закономерность – рост заболеваемости ЗНО кожи [1–3]. В РФ тенденция к росту ЗНО кожи в последние десятилетия обусловлена, с одной стороны, увеличением продолжительности жизни, а с другой – выявлением заболеваний в период профилактических осмотров.
Увеличение заболеваемости ЗНО кожи с повышением достигнутого возраста было ожидаемо и обусловлено возрастной природой этого заболевания. Возраст – один из основных факторов риска развития рака кожи [3, 20].
В результате эпидемиологических и клинических исследований доказано, что главным внешним фактором, повышающим риск развития ЗНО кожи, является воздействие УФ-излучения [3, 6, 7]. В настоящем ретроспективном исследовании мы не имели возможности это исследовать более подробно. Но проведенный анализ риска для различных локализаций ЗНО кожи в изучаемой когорте работников показал, что заболеваемость НМРК, локализованных в области лица и шеи (постоянно открытых участках кожи), была статистически значимо ниже по сравнению с туловищем, в то время как в других исследованиях показано, что при высоком индексе УФИ значимо повышался риск ЗНО кожи, локализованных на лице и шее [21]. Следует отметить, что все работники изучаемой когорты в течение всего периода наблюдения проживали в г. Озёрск на Южном Урале в одних и тех же климатических условиях с низким индексом ультрафиолетового излучения. Также следует отметить, что все работники работали только в закрытых помещениях. В то же время было установлено, что риск НМРК был выше у мужчин с высшим образованием, что может быть обусловлено частыми и продолжительными отпусками на южных курортах, где индекс УФИ был в несколько раз выше, чем в г. Озёрск, с одной стороны, и более внимательным отношением к своему здоровью – с другой стороны.
Данные о влиянии других нерадиационных факторов (например, курение, употребление алкоголя) на развитие ЗНО кожи в различных исследованиях противоречивы [22–24]. В изучаемой когорте работников не выявлено влияния курения и употребления алкоголя на заболеваемость НМРК. Однако в других исследованиях показано, что риск ЗНО кожи повышен среди лиц, злоупотребляющих алкоголем [22] и чаще имеющих “солнечные” ожоги, которые, в свою очередь, являются фактором, способствующим развитию ЗНО кожи [23, 24].
Хорошо известно, что предраковые поражения кожи и актинические кератозы увеличивают риски рака кожи [25, 26], но, поскольку эти заболевания встречались у членов изучаемой когорты очень редко, они не были включены в анализ из-за слабой статистической мощности.
В результате исследования обнаружен статистически значимый повышенный риск заболеваемости НМРК у работников, подвергшихся хроническому облучению в суммарной дозе более 2.0 Зв. Анализ доза–эффект на основе линейной модели с учетом нерадиационных факторов (пол, достигнутый возраст и календарный период) и поглощенной дозы нейтронного излучения выявил статистически значимую зависимость заболеваемости НМРК с суммарной γ-дозой (как без включения поправки, так и с включением поправки на нейтронную дозу). Причем анализ чувствительности показал, что величина риска заболеваемости НМРК увеличивалась при включении поправки на нейтронную дозу. Не выявлено модификации избыточного относительного риска на единицу дозы в зависимости от пола (p = 0.16), возраста найма на предприятие (p > 0.5), типа производства (p > 0.5). Но обнаружена модификация риска в зависимости от достигнутого возраста (p = 0.02). ИОР/Зв γ-излучения для заболеваемости НМРК в группе лиц моложе 50 лет составил 0.99 (95%-ный ДИ 0.06–3.45), в возрастной группе 50–59 лет – 2.17 (95%-ный ДИ 0.51–8.63), возрастной группе 60–69 лет – 1.32 (95%-ный ДИ 0.45–3.36).
Оценка риска заболеваемости НМРК в изучаемой когорте работников (ИОР/Зв = 0.49; 95%-ный ДИ 0.22–0.90) была ниже при сравнении с оценкой риска в японской когорте лиц, выживших после атомной бомбардировки (ИОР/Зв = = 0.72; 95%-ный ДИ 0.36–1.2) [9]. В то же время риск заболеваемости НМРК в когорте работников ПО “Маяк” был существенно выше риска заболеваемости НМРК, в частности базальноклеточной карциномой, в когорте радиологов-технологов США (ИОР/Гр = 0.03; 95%-ный ДИ – 0.39–0.56) [11].
Преимуществами настоящего исследования является большая численность изучаемой когорты, длительный период наблюдения (около 70 лет), наличие информации об индивидуальных измеренных дозах внешнего облучения и достаточная статистическая мощность исследования. Одним из главных преимуществ изучаемой когорты является то, что осмотр врача-дерматолога и обследование кожи были обязательными мероприятиями во время ежегодных профилактических осмотров всех работников. Между тем мы признаем, что для исследований заболеваемости данного контингента характерен эффект скрининга. Последний подтверждается тем, что в изучаемой когорте работников наблюдаются более высокие уровни заболеваемости МК и НМРК по сравнению с соответствующими показателями для населения Российской Федерации и Уральского Федерального округа (регион, где расположены город Озёрск и ПО “Маяк”) [27, 28]. Следует подчеркнуть, что все работники изучаемой когорты, независимо от пола, возраста, места работы, типа и дозы облучения и т.д., в обязательном порядке проходили медицинские обследования в соответствии со стандартным протоколом, что исключает возможность систематических ошибок самоотбора (например, из-за плохого самочувствия) и отбора, обусловленного дозами облучения. Кроме того, следует подчеркнуть, что врачи, которые проводили эти обязательные медицинские осмотры, не имели доступа к информации о дозах облучения работников.
Одним из недостатков настоящего ретроспективного исследования является отсутствие информации об особенностях фенотипа кожи у работников изучаемой когорты. Кроме того, в дозиметрической системе работников ПО “Маяк” ДРСМ-2008 [15] отсутствуют сведения о поглощенных кожными покровами дозах радиационного воздействия в результате профессиональной деятельности. Но подробные истории облучения, индивидуальные измеренные дозиметром дозы излучения, подробные характеристики сценариев облучения и информация о профессиональных маршрутах позволят в будущем реконструировать поглощенные кожными покровами дозы внешнего γ- и нейтронного излучений и провести повторный анализ риска в изучаемой когорте работников с учетом гистологических типов ЗНО кожи.
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что заболеваемость НМРК в изучаемой когорте работников зависела как от нерадиационных (пол, возраст, тип производства, уровень образования), так и радиационных факторов (внешнее гамма-излучение). Выявлен статистически значимый повышенный риск заболеваемости НМРК у работников, подвергшихся хроническому облучению в суммарной дозе более 2.0 Зв (ОР = 2.52; 95%-ный ДИ 1.60–3.97). Обнаружена статистически значимая линейная зависимость заболеваемости НМРК от суммарной дозы внешнего воздействия γ-излучения; ИОР/Зв составил 0.49 (95%-ный ДИ 0.22–0.90) и 0.51 (95%-ный ДИ 0.22–0.93) без включения и с включением поправки на нейтронную дозу соответственно.
Список литературы
Ferlay J., Shin H.R., Bray F. et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 // Int. J. Cancer. 2010. V. 127. № 12. P. 2893–2917.
Дерматоонкология (злокачественные новообразования кожи, первичные лимфомы кожи). Атлас / Под ред. Н.В. Кунгурова. Екатеринбург: Макс-Инфо, 2016.168 с. [Dermatoonkologiya (zlokachestvennye novoobrazovaniya kozhi, pervichnye limfomy kozhi). Atlas / Pod red. N.V. Kungurova. Ekaterinburg: Maks-Info; 2016. 168 p. (In Russian)]
Risk of solid cancers following radiation exposure: Estimates for the UK population. Report of the Independent Advisory Group on Ionising Radiation. Chilton, UK: Health Protection Agency, 2011. 270 p.
Rastrelli M., Tropea S., Rossi C.R., Alaibac M. Melanoma: epidemiology, risk factors, pathogenesis, diagnosis and classification // In Vivo. 2014. V. 28. № 6. P. 1005–1011.
Bauer A., Diepgen T.L., Schmitt J. Is occupational solar ultraviolet irradiation a relevant risk factor for basal cell carcinoma? A systematic review and meta-analysis of the epidemiological literature // Br. J. Dermatol. 2011. V. 165. № 3. P. 612–625.
Gandini S., Sera F., Cattaruzza M.S et al. Meta-analysis of risk factors for cutaneous melanoma: II. Sun exposure // Eur. J. Cancer. 2005. V. 41. № 1. P. 45–60.
Shore R.E. Radiation induced skin cancer in humans // Med. Pediatr. Oncol. 2001. V. 36. № 5. P. 549–554.
Yoshinaga S., Hauptmann M., Sigurdson A.J. et al. Nonmelanoma skin cancer in relation to ionizing radiation exposure among U.S. radiologic technologists // Int. J. Cancer. 2005. V. 115. № 5. P. 828–834.
Sugiyama H., Misumi M., Kishikawa M., et al. Skin cancer incidence among atomic bomb survivors from 1958 to 1996 // Radiat. Res. 2014. V. 181. № 5. P. 531–539.
Karagas M.R., McDonald J.A., Greenberg E.R. et al. Risk of basal cell and squamous cell skin cancers after ionizing radiation therapy // J. Natl. Cancer. Inst. 1996. V. 88. № 24. P. 1848–1853.
Lee T., Sigurdson A.J., Preston D.L. et al. Occupational ionizing radiation and risk of basal cell carcinoma in US radiologic technologists (1983–2005) // Occup. Environ. Med. 2015. V. 72. № 12. P. 862–869.
Sanlorenzo M., Wehner M.R., Linos E. et al. The risk of melanoma in airline pilots and cabin crew a meta-ana-lysis // JAMA Dermatol. 2015. V. 151. № 1. P. 51–58.
Rajaraman P., Doody M.M., Yu C.L. et al. Cancer risks in U.S. Radiologic Technologists working with fluoroscopically guided interventional procedures, 1994–2008 // AJR Am. J. Roentgenol. 2016. V. 206. № 5. P. 1101–1108.
Azizova T.V., Briks K.V., Bannikova M.V., Grigorieva E.S. Hypertension Incidence Risk in a Cohort of Russian Workers Exposed to Radiation at the Mayak Production Association Over Prolonged Periods // Hypertension. 2019. V. 73. № 6. P. 1174–1184.
Vasilenko E.K., Scherpelz R.I., Gorelov M.V. et al. External Dosimetry Reconstruction for Mayak Workers. AAHP Special Session Health Physics Society Annual Meeting, 2010. http://www.hps1.org/aahp/public/AAHP_Special_ Sessions/2010_Salt_Lake_City/pm-1.pdf (дата обращения 01.11.2016).
The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103 // Ann. ICRP. 2007. V. 37. № 2–4. P. 1–332.
Международная статистическая классификация болезней и проблем, связанных со здоровьем, 10-го пересмотра. Женева: ВОЗ, 1992. 697 c. [MKB-10. Mezhdunarodnaya statisticheskaya klassifikaciya boleznej i problem, svyazannyh so zdorov’em, 10-go peresmotra. Zheneva: VOZ, 1992. 697 p. (In Russian)]
Azizova T.V., Day R.D., Wald N. et al. The “clinic” medical-dosimetric database of Mayak production association workers: Structure, characteristics and prospects of utilization // Health Phys. 2008. V. 94. № 5. P. 449–458.
Preston D., Lubin J., Pierce D., McConney M. Epicure Users Guide. Seattle, WA: Hirosoft International Corporation, 1993. 335 p.
Рыбкина В.Л., Азизова Т.В., Адамова Г.В. Факторы риска развития злокачественных новообразований кожи // Клин. дерматология и венерология. 2019. Т. 18. № 5. С. 548–555. [Rybkina V.L., Azizoav T.V., Adamova G.V. Risk factors of malignant neoplasms of the skin // Russian Journal of Clinical Dermatology and Venerology. 2019. V. 18. № 5. P. 548–555. (In Russian)]
Ouyang Y.H. Skin Cancer of the Head and Neck // Semin. Plast. Surg. 2010. V. 24. № 2. P. 117–126.
Rota M., Pasquali E., Bellocco R. et al. Alcohol drinking and cutaneous melanoma risk: a systematic review and dose-risk meta-analysis // Br. J. Dermatol. 2014. V. 170. № 5. P. 1021–1028.
Song F., Qureshi A.A., Gao X. et al. Smoking and risk of skin cancer: a prospective analysis and a meta-analysis // Int. J. Epidemiol. 2012. V. 41. № 6. P. 1694–1705.
Yen H., Dhana A., Okhovat J.P. et al. Alcohol intake and risk of nonmelanoma skin cancer: a systematic review and dose-response meta-analysis // Br. J. Dermatol. 2017. V. 177. № 3. P. 696–707.
Gandini S., Sera F., Cattaruzza M.S. et al. Meta-Analysis of Risk Factors for Cutaneous Melanoma: III. Family History, Actinic Damage and Phenotypic Factors // Eur. J. Cancer. 2005. V. 41. № 14. P. 2040–2059.
Khalesi M., Whiteman D.C., Doi S.A. et al. Cutaneous Markers of Photo-Damage and Risk of Basal Cell Carcinoma of the Skin: a Meta-Analysis // Cancer Epidemiol. Biomarkers Prev. 2013. V. 22. № 9. P. 1483–1489.
Петрова Г.В., Каприн А.Д., Грецова О.П., Старинский В.В. Злокачественные новообразования в России обзор статистической информации за 1993–2013 гг. / Под ред. А.Д. Каприна, В.В. Старинского. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ “НМИРЦ” Минздрава России, 2015. 511 c. [Petrova G.V., Kaprin A.D., Grecova O.P., Starinskij V.V. Zlokachestvennye novoobrazovaniya v Rossii obzor statisticheskoj informacii za 1993–2013 / Pod red. A.D. Kaprina, V.V. Starinskogo. M.: MNIOI im. P.A. Gercena – filial FGBU “NMIRC” Minzdrava Rossii, 2015. 511 p. (In Russian)]
Злокачественные новообразования России в 2014 году. Заболеваемость и смертность / Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П. А. Герцена – филиал ФГБУ “НМИРЦ” Минздрава России, 2016. 189 с. [Zlo-kachestvennye novoobrazovaniya Rossii v 2014 godu. Zabolevaemost’ i smertnost' / Pod red. A.D. Kaprina, V.V. Starinskogo, G.V. Petrovoj. M.: MNIOI im. P.A. Gercena – filial FGBU “NMIRC” Minzdrava Rossii, 2016. 189 p. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


