Радиационная биология. Радиоэкология, 2021, T. 61, № 1, стр. 32-43
Нарушение когнитивных функций и развитие нейровоспаления в отдаленный период после однократного γ-облучения головы мышей
А. С. Жирник 1, *, О. Д. Смирнова 1, Ю. П. Сёмочкина 1, К. Д. Шибаева 1, А. В. Родина 1, М. Г. Ратушняк 1, Е. Ю. Москалёва 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: Zhirnik_AS@nrcki.ru
Поступила в редакцию 07.07.2020
После доработки 03.11.2020
Принята к публикации 11.11.2020
Аннотация
Исследовано влияние однократного γ-облучения головы в дозах 2 и 8 Гр на когнитивные функции и состояние микроглии в головном мозге мышей линии С57ВL/6 в отдаленный период после облучения. При использовании теста “Открытое поле” обнаружено возрастание двигательной активности мышей через 2 мес., но не через 1 мес., после облучения в дозах 2 и 8 Гр, выраженное в увеличении средней скорости и пройденного пути. Различий в ориентировочно-исследовательской активности контрольных и облученных мышей, оцениваемой по количеству стоек и времени до первой стойки, в указанные сроки не обнаружено. При использовании теста “Условно-рефлекторное замирание” через 1 и 2 мес. после облучения обнаружен схожий уровень замираний контрольных и облученных мышей как в день обучения, так и в день тестирования (через 24 ч после обучения), что указывает на отсутствие нарушений ассоциативной памяти в данные периоды после облучения. Анализ данных, полученных при использовании теста “Водный лабиринт Морриса”, позволил выявить нарушения пространственной памяти у мышей, облученных в дозе 8 Гр, через 1 и 2 мес. после воздействия. Тем не менее, через 6 мес. различий с контрольной группой в параметрах теста не было обнаружено. Важно отметить, что облучение головы мышей в меньшей дозе, равной 2 Гр, не приводило к возникновению нарушений пространственной памяти в исследуемые периоды. Обнаружено длительное снижение количества клеток покоящейся и активированной микроглии в мозге, при этом через 1 и 2 мес. после облучения в дозе 8 Гр обнаружено увеличение доли клеток активированной микроглии в головном мозге мышей, что согласуется с результатами когнитивных тестов. Полученные в работе данные свидетельствуют о том, что возникновение пострадиационных когнитивных нарушений может быть обусловлено развитием нейровоспаления, в котором ведущую роль играют активация клеток микроглии и увеличение доли этих клеток в головном мозге.
Современное лечение пациентов со злокачественными новообразованиями головного мозга предполагает проведение локальной лучевой терапии. Данный вид терапии показан пациентам как с первичными опухолями головного мозга (глиомами низкой и высокой степени злокачественности), так и с метастазами в головном мозге, образовавшимися при прогрессировании первичных опухолей легкого и молочной железы, меланомы, почечно-клеточного и колоректального рака. Стандартным методом лечения метастатических поражений головного мозга, несмотря на развитие стереотаксической радиотерапии (радиохирургии, гипофракционирования), остается облучение всего органа [1]. При этом повреждающее действие ионизирующего излучения на нормальные ткани приводит к развитию осложнений, наиболее тяжелыми из которых являются когнитивные нарушения – снижение способности к обучению, ухудшение долговременной памяти, внимания и зрительно-пространственного восприятия, быстрая утомляемость при эмоциональных и умственных нагрузках и др. [2, 3]. По данным [4], такие нарушения развиваются и прогрессируют у 20–50% пациентов в отдаленный период после облучения, значительно снижая качество жизни. Этим обусловлена важность разработки способов и средств профилактики и лечения пострадиационных нейрокогнитивных расстройств, что делает актуальным проведение экспериментальных исследований с использованием лабораторных животных, направленных на изучение характера когнитивных нарушений, вызываемых действием ионизирующего излучения на головной мозг, и лежащих в их основе клеточных и молекулярных механизмов.
В настоящее время известно, что повреждение головного мозга при облучении заключается в развитии ряда патофизиологических процессов, среди которых важное место занимает подавление нейрогенеза в гиппокампе [5]. При этом в ранний период после радиационного воздействия наблюдается гибель значительного количества нейральных стволовых и/или прогениторных клеток, расположенных в зоне зубчатой извилины, в то время как в отдаленный период – снижение их пролиферативной активности и изменение способности к дифференцировке [6, 7]. Полагают, что последнее является одной из причин возникновения отдаленных последствий в виде когнитивных нарушений и может быть связано с развитием хронического нейровоспаления, в котором определяющую роль играет активация иммунных клеток ЦНС – клеток микроглии [8]. Результаты экспериментальных исследований свидетельствуют о том, что увеличение количества клеток активированной микроглии в разных областях гиппокампа, выявляемое через 1 нед. после воздействия рентгеновского и γ-излучения на область головы мышей [9–12], может сохраняться до 2 мес. после облучения [13] и сопровождаться нарушением гиппокамп-зависимых когнитивных функций. Стоит отметить, что эти данные получены при использовании дозы излучения, равной 10 Гр. В то же время, для более глубокого понимания механизмов развития радиационно-индуцированных когнитивных нарушений необходимы исследование когнитивных функций и определение доли клеток активированной микроглии в головном мозге как при высоких, так и при меньших дозах облучения – разовых очаговых дозах, используемых при фракционированной лучевой терапии, – и в более отдаленный срок после облучения.
В связи с этим целью данной работы было исследование когнитивных функций и состояния микроглии через 1, 2 и 6 мес. после однократного γ-облучения головы мышей в дозах 2 и 8 Гр. Состояние микроглии, кроме того, оценивали и через 3 сут, чтобы оценить чувствительность этих клеток мозга к облучению.
МАТЕРИАЛЫ И МЕТОДИКА
Лабораторные животные. В экспериментах использовали самцов мышей инбредной линии C57BL/6 в возрасте 7–8 нед., полученных из питомника “Столбовая”, массой 18–21 г. Животных содержали в стандартных условиях вивария, со свободным доступом к воде и пище (ad libitum). Все эксперименты с животными проводили в соответствии с требованиями этического комитета НИЦ “Курчатовский институт”.
Облучение. Мышей подвергали воздействию γ-излучения на область головы на установке “ГУТ-200М” (источник – 60Co, мощность дозы – 2.35 Гр/мин) при комнатной температуре в дозах 2 и 8 Гр. На время облучения животных помещали в специальные прозрачные пластмассовые фиксаторы. Для предотвращения воздействия γ-излучения на другие ткани использовали свинцовую защиту. При обращении с контрольными и облученными животными выполнен одинаковый набор экспериментальных процедур.
Подсчет количества лейкоцитов. Количество лейкоцитов определяли в периферической крови мышей через 3 сут и 1 мес. после облучения по общепринятой методике. Кровь собирали из хвостовой вены после подрезания кончика хвоста и 5 мкл крови добавляли в микропробирку, содержащую 95 мкл 3%-ной уксусной кислоты. Количество лейкоцитов подсчитывали с помощью камеры Горяева.
Анализ поведения мышей в тесте “Открытое поле” (“ОП”). Для проведения теста использовали круглую арену диаметром 120 см, окруженную стенками высотой 45 см. Пол арены и стенки изготовлены из серого поливинилхлорида. Перед помещением в арену каждого следующего животного стенки и пол протирали 70%-ным раствором этанола. Для тестирования каждое животное помещали в центр открытого поля и давали 5 мин для свободного обследования арены. Во время тестирования проводили видеорегистрацию поведения животного при помощи цветной аналоговой видеокамеры “WV-CP500G” (“Panasonic Corporation”, Япония), установленной над центром арены на высоте 2.5 м, и системы видеорегистрации поведения “EthoVision XT 8.5” (“Noldus Information Technology”, Нидерланды) при частоте сбора данных 25 кадров в секунду и разрешении видео 768 × 576 пикселей. Полученные видеозаписи поведения анализировали в программе “EthoVision XT 8.5”. Для каждого кадра автоматически находили точку центра масс проекции тела животного. В арене выделяли следующие зоны: пристеночная зона (кольцо шириной 10 см от стенки арены), промежуточная зона (кольцо в области от 10 до 30 см от стенки арены), центральная зона (непосредственный центр арены, диаметр 60 см). Проводили автоматический анализ следующих параметров поведения животного: общий пройденный путь в открытом поле (см); средняя скорость (см/с); время, проведенное в пристеночной зоне (с); время, проведенное в промежуточной зоне (с); время, проведенное в центральной зоне (с). Кроме того, подсчитывали общее количество стоек (без опоры и с опорой) и фиксировали время до первой стойки при анализе видеозаписи поведения мышей.
Анализ обстановочной ассоциативной памяти мышей в тесте “Условно-рефлекторное замирание” (“УРЗ”). Для проведения теста использовали установку “NIR Video Fear Conditioning Package for Mouse” (“Med Associates Inc.”, США), укомплектованную шумоизоляционной камерой размером 20 × 30 × 20 см с тремя непрозрачными и двумя прозрачными пластиковыми стенками, электропроводящим полом из стальных стержней, источником диффузного белого света и источником ближнего инфракрасного света. Перед помещением в камеру каждого следующего животного стенки и пол протирали 70%-ным раствором этанола. При обучении условно-рефлекторному замиранию мышей помещали в камеру, давали 3 мин для свободного обследования обстановки, далее 3 раза с интервалом 1 мин наносили электрокожное раздражение (ток силой 1 мА в течение 2 с), после чего сразу же возвращали в домашнюю клетку (общее время сеанса составляло 6 мин). Тестирование обстановочной ассоциативной памяти проводили через 24 ч после обучения при повторном предъявлении обстановки в течение 3 мин без электрокожного раздражения. Во время обучения и тестирования проводили видеорегистрацию поведения животного при помощи чувствительной к свету ближнего инфракрасного диапазона монохромной видеокамеры и системы видеорегистрации поведения “Video Freeze” (“Med Associates Inc.”, США) при частоте сбора данных 30 кадров в секунду и разрешении видео 320 × 240 пикселей. С помощью программы “Video Freeze 2.6.5.81” получали видеозаписи и проводили автоматический анализ поведения мышей по продолжительности актов замирания (отсутствия любых движений животного, кроме дыхательных), определяя долю времени (уровень) замираний от общей продолжительности экспериментальной процедуры (%). Для регистрации уровня спонтанных замираний животных в каждой экспериментальной группе использовали “активный контроль” (мыши, не подвергавшиеся действию электрокожного раздражения при обучении).
Анализ пространственного обучения и памяти мышей в тесте “Водный лабиринт Морриса” (“ВЛМ”). Для проведения теста использовали круглый бассейн диаметром 120 см с высотой стенок 60 см, заполненный водой до 40 см; температуру воды поддерживали на уровне 24–25°С. Бассейн находился в комнате с большим количеством пространственных ориентиров – цветных пластмассовых предметов, настенных плакатов и др. Бассейн был условно разделен на четыре квадранта, в центре одного из которых (“целевой” квадрант) на 1 см ниже поверхности воды располагалась “скрытая” круглая платформа диаметром 9 см; местоположение платформы оставалось неизменным на протяжении всего эксперимента. Животных обучали находить платформу в течение пяти дней (5 попыток в день, длительность попытки – 60 с, интервал между попытками – 1 ч), опуская в бассейн в одном из трех квадрантов, не содержащих платформу; места запуска чередовали случайным образом. Если мышь не находила платформу за отведенное время (60 с), ее аккуратно направляли на платформу, оставляли на 30 с, после чего снимали, вытирали насухо и возвращали в домашнюю клетку до следующей попытки. Тестирование выполняли на 6-й день – через 24 ч после последней попытки, предварительно убрав платформу из бассейна. Во время обучения и тестирования проводили видеорегистрацию траектории животного с использованием автоматизированной системы видеосъемки, состоящей из цветной видеокамеры “DCR-SR21E” (“Sony Corporation”, Япония), расположенной на 2.5 м выше бассейна, и модуля захвата кадров “Picolo U4 H.264” (“Euresys”, Бельгия) при частоте сбора данных 12.5 кадров в секунду и разрешении видео 1024 × 576 пикселей. Для каждого кадра автоматически находили точку центра масс проекции тела животного; для повышения точности детекции животного в воду добавляли белую водоэмульсионную краску. С помощью программы “EthoVision XT 8.5” рассчитывали следующие параметры: средняя скорость (см/с); время достижения платформы (с); число пересечений зоны платформы (ед.); доля времени, проведенного в «целевом» квадранте (%).
При исследовании когнитивных функций в каждой экспериментальной группе было по 12–15 животных. Все использованные тесты проводили на оборудовании ресурсного центра нейрокогнитивных исследований “Нейрон” НИЦ “Курчатовский институт”.
Выделение клеток из головного мозга мыши. Выделение клеток из головного мозга контрольных и облученных мышей проводили в соответствии с методом [14], как описано ранее [15]. Для каждого срока исследования одновременно анализировали мозг контрольных и облученных животных. Транскардиальную перфузию для удаления клеток крови проводили после анестезии мышей с использованием смеси золетила (0.04 мг на 1 г массы мыши в фосфатно-солевом буфере, ФСБ) и рометара (25 мкл на 100 г массы мышей), которую вводили в/м из расчета 0.1 мл на 10 г веса мыши. Мозг извлекали, удаляли мозжечок и обонятельные доли, помещали в чашку Петри и промывали холодным ФСБ с сахарозой (20 г/л) и глюкозой (0.9 г/л). Добавляли 2 мл аккутазы, тщательно измельчали мозг, переносили в пробирку, добавляли еще 1 мл аккутазы и инкубировали в течение 15 мин при 37°С в водяной бане при помешивании. Затем добавляли в каждую пробирку по 0.5 мл фетальной бычьей сыворотки (ФБС), помещали в ледяную баню, и гомогенат ткани дважды протирали через нейлоновое сито с диаметром пор 100 мкм (“SPL Life Sciences”, Республика Корея), затем 1 раз через сито с диаметром пор 70 мкм, переносили в центрифужные пробирки и центрифугировали при 4°С 7 мин при 500 g. Супернатант удаляли, осадок ресуспендировали в 20%-ном изотоническом растворе (10 мл на 1 мозг) перколла (“GE Healthcare”, США). На перколл наслаивали 5 мл раствора Хэнкса (“ПанЭко”, Россия) и центрифугировали 10 мин при 550 g без торможения. Слой миелина, сконцентрированный в интерфазе, и супернатант удаляли, осадок клеток дважды промывали ФСБ. Клетки ресуспендировали в 0.5 мл ФСБ, добавляли трипановый синий и подсчитывали в камере Горяева.
Фенотипирование клеток мозга мыши. Для идентификации микроглии суспензию клеток головного мозга окрашивали антителами к антигену мыши CD11b, конъюгированными с фико-эритрином, и к CD45, конъюгированными с красителем Alexa Fluor 488. Клетки покоящейся микроглии идентифицировали как субпопуляцию СD11b+/СD45low после двойного окрашивания антителами к CD11b и к СD45 (“ВioLegend”, США). Популяция клеток с фенотипом СD11b+/СD45high соответствует клеткам активированной микроглии и макрофагам. Разведение антител использовали в соответствии с указаниями фирмы-изготовителя. Флуоресценцию клеток анализировали на проточном цитофлуориметре “BD FACSCalibur” (“BD Biosciences”, США), оснащенном аргоновым лазером с длиной волны 488 нм и диодным красным лазером с длиной волны 635 нм (Ресурсный центр молекулярной и клеточной биологии). В каждом образце анализировали 10 тыс. клеток.
Статистическая обработка. Статистическую обработку результатов проводили по методу Стьюдента с использованием компьютерной программы “OriginPro”. Данные представляли в виде средних значений и стандартной ошибки среднего. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
Для контроля отсутствия повреждения других органов при облучении головы мышей анализировали количество лейкоцитов в периферической крови через 3 сут и 1 мес. после облучения. Полученные данные приведены в табл. 1. Статистически значимых различий в уровне лейкоцитов у контрольных и облученных в дозах 2 и 8 Гр мышей в указанные сроки не обнаружено.
Таблица 1.
Количество лейкоцитов в периферической крови контрольных и облученных в дозах 2 и 8 Гр мышей линии C57BL/6 через 3 сут и 1 мес. после облучения головы Table 1. White blood cell count in the peripheral blood of control and irradiated C57BL/6 mice 3 days and 1 month after head-only irradiation at doses of 2 and 8 Gy
| Группа | Количество лейкоцитов, 109/л | |
|---|---|---|
| 3 сут | 1 мес. | |
| Контроль | 13.4 ± 0.5 | 12.9 ± 0.8 |
| 2 Гр | 12.1 ± 0.4 | 13.3 ± 0.9 |
| 8 Гр | 11.5 ± 0.9 | 14.1 ± 0.9 |
Вес мышей во всех экспериментальных группах через 1, 2 и 6 мес. после воздействия γ-излучения не отличался от контроля (табл. 2). У мышей, облученных в дозе 8 Гр, но не у облученных в дозе 2 Гр и контрольных мышей, отмечено появление седины в области головы. Также важно отметить, что облучение головы в дозе 8 Гр приводило к развитию односторонней или двусторонней катаракты у 33% мышей через 6 мес. после воздействия, что было обнаружено при тщательном визуальном осмотре животных. Поскольку это могло повлиять на остроту зрения и из-за этого на поведение животных в когнитивных тестах, данные по этим животным были исключены из статистического анализа. Эффекты, наблюдаемые нами после γ-облучения головы мышей, были отмечены и другими авторами [13, 16–19].
Таблица 2.
Средний вес контрольных и облученных в дозах 2 и 8 Гр мышей линии C57BL/6 через 1, 2 и 6 мес. после облучения головы Table 2. Body weight of control and irradiated C57BL/6 mice 1, 2 and 6 months after head-only irradiation at doses of 2 and 8 Gy
| Группа | Средний вес, г | ||
|---|---|---|---|
| 1 мес. | 2 мес. | 6 мес. | |
| Контроль | 25.6 ± 0.5 | 27.8 ± 0.8 | 31.7 ± 0.9 |
| 2 Гр | 25.6 ± 0.4 | 27.6 ± 0.6 | 31.7 ± 1.0 |
| 8 Гр | 24.1 ± 0.6 | 25.9 ± 0.7 | 30.7 ± 0.4 |
Поведение мышей исследовали в тесте “ОП” через 1 и 2 мес. после облучения. Однократное γ-облучение головы в дозах 2 и 8 Гр не влияло на двигательную активность и уровень тревожности мышей через 1 мес. после облучения: различий в таких показателях, как общий пройденный путь, средняя скорость и длительность пребывания в пристеночной, промежуточной и центральной зонах, между контрольными и облученными мышами не обнаружено (табл. 3). Через 2 мес. после облучения длительность пребывания в пристеночной, промежуточной и центральной зонах не отличалась между группами, однако были отмечены большие в сравнении с контролем общий пройденный путь и средняя скорость мышей, облученных в дозах 2 и 8 Гр (табл. 4). Контрольные и облученные в дозах 2 и 8 Гр мыши характеризовались схожей ориентировочно-исследовательской активностью, оцениваемой по общему количеству стоек и времени до первой стойки, через 1 и 2 мес. после облучения (табл. 3, табл. 4).
Таблица 3.
Анализ параметров поведения мышей в тесте “ОП” через 1 мес. после облучения в дозах 2 и 8 Гр Table 3. Open field activity patterns of control and irradiated mice analyzed 1 month after irradiation at doses of 2 and 8 Gy
| Группа | Контроль | 2 Гр | 8 Гр | |
|---|---|---|---|---|
| Пройденный путь, см | 2110 ± 197 | 2387 ± 202 | 2561 ± 128 | |
| Длительность пребывания, с | в пристеночной зоне | 218 ± 12 | 219 ± 17 | 208 ± 15 |
| в промежуточной зоне | 66 ± 10 | 54 ± 13 | 72 ± 13 | |
| в центральной зоне | 16 ± 3 | 26 ± 10 | 19 ± 3 | |
| Средняя скорость, см/с | 7.0 ± 0.7 | 8.0 ± 0.7 | 8.5 ± 0.5 | |
| Количество стоек, ед. | 28 ± 3 | 27 ± 3 | 22 ± 1 | |
| Время до первой стойки, с | 21 ± 4 | 23 ± 4 | 20 ± 5 | |
Таблица 4.
Анализ параметров поведения мышей в тесте “ОП” через 2 мес. после облучения в дозах 2 и 8 Гр Table 4. Open field activity patterns of control and irradiated mice analyzed 2 months after irradiation at doses of 2 and 8 Gy
| Группа | Контроль | 2 Гр | 8 Гр | |
|---|---|---|---|---|
| Пройденный путь, см | 2107 ± 218 | 2809 ± 235* | 3589 ± 300* | |
| Длительность пребывания, с | в пристеночной зоне | 218 ± 19 | 203 ± 19 | 170 ± 16 |
| в промежуточной зоне | 58 ± 15 | 71 ± 11 | 89 ± 9 | |
| в центральной зоне | 22 ± 6 | 28 ± 10 | 39 ± 9 | |
| Средняя скорость, см/с | 7.0 ± 0.7 | 9.4 ± 0.8* | 12.0 ± 1.0* | |
| Количество стоек, ед. | 18 ± 4 | 24 ± 2 | 28 ± 3 | |
| Время до первой стойки, с | 22 ± 6 | 22 ± 6 | 17 ± 2 | |
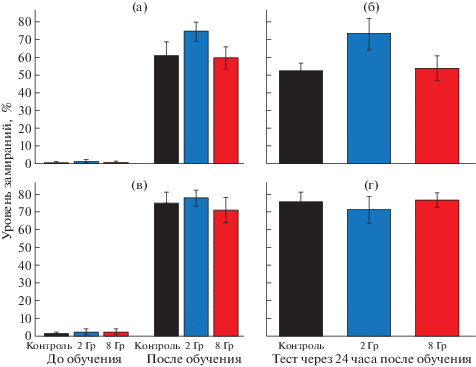
В качестве модели ассоциативной памяти у контрольных и облученных мышей использовали выработку реакции условно-рефлекторного замирания на «контекст». Тест выполняли через 1 и 2 мес. после облучения. Согласно полученным данным, представленным на рис. 1, у контрольных мышей и мышей, подвергнутых γ-облучению головы в дозах 2 и 8 Гр, через 1 мес. после воздействия уровень замираний составлял менее 3% до обучения (спонтанные замирания, группы “активного контроля”) и значительно увеличивался непосредственно после обучения (рис. 1, а), не снижаясь при повторном попадании в известную обстановку во время тестирования через 24 ч после обучения (рис. 1, б). Статистически значимые различия по этому показателю между контрольными и облученными мышами отсутствовали. Схожие результаты получены через 2 мес. после облучения (рис. 1, в, г).
Рис. 1.
Уровень замираний мышей в день обучения (а, в) и в день тестирования (б, г), оцениваемый через 1 мес. (а, б) и 2 мес. (в, г) после γ-облучения головы в дозах 2 и 8 Гр.
Fig. 1. Freezing behavior of mice on the training day (a, c) and on the testing day (b, d), assessed 1 month (a, b) and 2 months (c, d) after whole brain γ-irradiation at doses of 2 and 8 Gy.
Для исследования пространственного обучения и памяти мышей через 1, 2 и 6 мес. после облучения использовали тест “ВЛМ”. Полученные данные представлены на рис. 2 и в табл. 5. Важно отметить, что физическое состояние (двигательная активность) мышей во всех экспериментальных группах, оцениваемое по средней скорости их перемещения, в данном тесте было схожим (данные не представлены). Обнаружено, что однократное γ-облучение головы в дозе 2 Гр не приводит к развитию нарушений пространственного обучения и памяти мышей в исследуемые сроки. В то же время, у мышей, облученных в дозе 8 Гр, через 1 мес. после воздействия обнаружены статистически значимые отличия от контроля во времени достижения платформы при тестировании (6-й день; рис. 2, б) и числе пересечений зоны платформы. Через 2 мес. после облучения, в дополнение к указанным изменениям, были зарегистрированы статистически значимые отличия от контроля во времени достижения платформы при обучении (рис. 2, в) и длительности пребывания в “целевом” квадранте. Однако в более отдаленный период – через 6 мес. – после облучения в дозе 8 Гр изменения показателей пространственного обучения и памяти мышей не обнаружено (рис. 2, д, е). Так, большее в сравнении с контролем время достижения платформы было отмечено только в 5-й день обучения при отсутствии различий в других исследованных параметрах (табл. 5).
Рис. 2.
Время достижения платформы при обучении (а, в, д) и при тестировании через 24 ч после последней попытки в 5-й день обучения (б, г, е), оцениваемое через 1 мес. (а, б), 2 мес. (в, г) и 6 мес. (д, е) после γ-облучения мышей в дозах 2 и 8 Гр. 1 – контрольные мыши, 2 – мыши, облученные в дозе 2 Гр, 3 – мыши, облученные в дозе 8 Гр. * Отличия статистически значимы в сравнении с контролем, p < 0.05.
Fig. 2. Latency during learning period (a, c, e) and on the testing day 24 hours after the last trial on the fifth day of learning (b, d, f), assessed 1 month (a, b), 2 months (c, d), and 6 months (e, f) after γ-irradiation of mice at doses of 2 and 8 Gy. 1 – control group, 2 – 2 Gy irradiated mice, 3 – 8 Gy irradiated mice. * Significantly different from control, p < 0.05.

Таблица 5.
Анализ параметров пространственного обучения и памяти мышей при тестировании в “ВЛМ” в разные сроки после γ-облучения головы в дозах 2 и 8 Гр Table 5. Parameters of spatial learning and memory analyzed during probe trial in Morris water maze 1, 2 and 6 months after head-only γ-irradiation of mice at doses of 2 and 8 Gy
| Параметр | Период после облучения, мес. | Группа | ||
|---|---|---|---|---|
| Контроль | 2 Гр | 8 Гр | ||
| Длительность пребывания в “целевом” квадранте, % | 1 | 36.2 ± 4.0 | 34.2 ± 4.3 | 28.4 ± 3.2 |
| 2 | 34.4 ± 2.0 | 28.7 ± 3.0 | 23.2 ± 2.8* | |
| 6 | 30.2 ± 5.2 | 25.7 ± 5.5 | 26.5 ± 3.8 | |
| Количество пересечений зоны платформы, ед. | 1 | 3.0 ± 0.6 | 2.0 ± 0.4 | 1.3 ± 0.4* |
| 2 | 2.8 ± 0.5 | 1.8 ± 0.5 | 1.1 ± 0.3* | |
| 6 | 2.3 ± 0.7 | 1.6 ± 0.5 | 1.1 ± 0.4 | |
Наблюдаемые в отдаленный период пострадиационные нарушения пространственного обучения и памяти мышей могут быть обусловлены развитием нейровоспаления в головном мозге. Развитие нейровоспаления в отдаленный период после облучения связывают с возрастанием количества клеток активированной микроглии. При анализе системы микроглии количество клеток покоящейся и активированной микроглии оценивали с помощью проточной цитофлуориметрии после иммуноцитохимического окрашивания. На рис. 3, а показан выбор анализируемой популяции клеток мозга по данным светорассеяния, а на рис. 3, б – идентификация клеток покоящейся и активированной микроглии после окрашивания антителами.
Рис. 3.
Идентификация клеток микроглии с помощью проточной цитофлуориметрии: а – прямое/боковое светорассеяние типичного препарата клеток мозга мыши; б – dot-plot гистограмма клеток, окрашенных антителами к CD11b, конъюгированными с фикоэритрином, и к CD45, конъюгированными с красителем Alexa Fluor 488. R1 – область анализа клеток, R2 – популяция клеток с фенотипом CD11b+/CD45low – соответствует покоящейся микроглии, R3 – CD11b+/CD45high – активированной микроглии.
Fig. 3. Microglia identification by flow cytometry: a – typical forward/side scatter dot-plot of the mouse brain cells sample; b – cells stained with antibodies to CD11b labeled with PE and to CD45 labeled with Alexa Fluor 488. R1 – gating of the population of interest, R2 – CD11b+/CD45low subpopulation, representing quiescent microglia, R3 – CD11b+/CD45high subpopulation, representing activated microglia.

Данные о количественном изменении клеток покоящейся и активированной микроглии и доли активированной микроглии в общей популяции микроглии представлены на рис. 4. Из представленных данных следует, что облучение головы мышей и в дозе 2 Гр, и в дозе 8 Гр приводит к глубокому снижению количества клеток как покоящейся (рис. 4, а), так и активированной микроглии (рис. 4, б) через 3 сут – в ранний период после воздействия. Далее во все исследованные сроки – через 1, 2 и 6 мес. после облучения – и при дозе 2 Гр, и при дозе 8 Гр обнаружено пропорциональное дозе уменьшение количества клеток покоящейся микроглии (рис. 4, а). Следует подчеркнуть, что через 6 мес. наблюдения, т.е. в возрасте 8 мес., у контрольных мышей обнаружены уменьшение количества клеток покоящейся микроглии (рис. 4, а) и тенденция к увеличению количества клеток активированной микроглии (рис. 4, б). Количество клеток активированной микроглии через 1 и 2 мес. после облучения в дозе 2 Гр было снижено незначительно, но через 6 мес. снижение было статистически значимым (рис. 4, б). После облучения в дозе 8 Гр снижение количества клеток активированной микроглии обнаружено через 2 и 6 мес. (рис. 4, б).
Рис. 4.
Динамика изменения количества клеток покоящейся (а) и активированной (б) микроглии и доли клеток активированной микроглии (в) в мозге мышей линии С57ВL/6: 1 – контрольные мыши, 2 – мыши, облученные в дозе 2 Гр, 3 – мыши, облученные в дозе 8 Гр. * Отличия статистически значимы в сравнении с уровнем соответствующего контроля, p < 0.05; # – отличия статистически значимы в сравнении с уровнем исходного контроля, р < 0.05.
Fig. 4. Quiescent (a) and activated (b) microglia cell number dynamics and changes in the share of activated microglia (c) in brain of C57BL/6 mice after γ-irradiation at doses of 2 and 8 Gy: 1 – control group, 2 – 2 Gy irradiated mice, 3 – 8 Gy irradiated mice. * Significantly different from the corresponding control, p < 0.05; # – significantly different from initial control, p < 0.05.

Доля клеток активированной микроглии в головном мозге в отдаленный период после облучения в дозе 2 Гр не отличалась от контроля, а после облучения в дозе 8 Гр она была увеличена через 1 и 2 мес. после воздействия, но возвращалась к уровню контроля через 6 мес. (рис. 4, в). Полученные результаты свидетельствуют о повышенном уровне активации микроглии через 1 и 2 мес. после облучения в дозе 8 Гр, что свидетельствует о развитии нейровоспаления в этот период.
ОБСУЖДЕНИЕ
Для разработки средств профилактики и лечения отдаленных пострадиационных когнитивных расстройств необходимо исследовать клеточные механизмы, лежащие в их основе. Считается, что возникновение и прогрессирование когнитивных нарушений после облучения головного мозга могут быть связаны с развитием хронического нейровоспаления, ведущую роль в котором играет устойчивое нарушение соотношения покоящейся и активированной микроглии с увеличением доли последней. Целью данной работы было исследование когнитивных функций и состояния системы микроглии через 3 сут и 1, 2 и 6 мес. после однократного γ-облучения головы мышей. Для проведения исследования были выбраны две дозы облучения: 2 Гр – разовая очаговая доза, широко используемая при фракционированном облучении в процессе лучевой терапии, и более высокая доза – 8 Гр, которая по повреждающему действию соответствует дозе 18 Гр, “набранной” в режиме фракционированного облучения за 9 фракций по 2 Гр [20, 21].
Условия облучения головы позволили обеспечить локальное действие γ-излучения на головной мозг мышей без существенного воздействия на другие ткани, что подтверждается отсутствием снижения количества лейкоцитов в периферической крови облученных мышей через 3 сут и 1 мес. после воздействия (табл. 1) и отсутствием снижения веса в динамике после воздействия (табл. 2).
Анализ различных параметров при проведении теста “ОП” показывает, что облучение головы в дозах 2 и 8 Гр практически не влияет на двигательную активность и ориентировочно-исследовательское поведение мышей через 1 и 2 мес. после воздействия (табл. 3, табл. 4). В обеих группах облученных мышей отмечено лишь увеличение средней скорости и пройденного пути через 2 мес. после облучения, что отражает повышение двигательной активности. Обнаруженные различия, возможно, связаны с ослаблением отрицательной реакции у облученных мышей на мягкие аверсивные раздражители теста (рассеянный свет, новое пространство). Более активное поведение мышей в тесте “ОП” было также показано Kalm M. и соавт. (через 1 год после облучения головы в дозе 8 Гр) [21]. В то же время в ряде исследований воздействие γ-излучения в диапазоне доз 5–10 Гр на область головы мышей не приводило к изменению исследуемых параметров в тесте “ОП” в сравнении с контролем в период от 6 до 19 нед. после облучения [16, 20, 22, 23]. В работе [18] двигательная активность облученных мышей соответствовала уровню контроля через 2 и 6 мес., но была достоверно снижена через 3 и 4 мес. после облучения головы в более высокой дозе 10 Гр. Обобщая полученные нами данные и данные перечисленных выше работ, можно заключить, что облучение головы в использованных в настоящей работе умеренных дозах 2 и 8 Гр в отдаленный период после воздействия, по-видимому, не приводит к нарушению поведения животных.
В экспериментальных исследованиях когнитивные функции лабораторных животных, в том числе после повреждающих воздействий разной природы, оценивают с помощью различных моделей и тестов. В настоящей работе для изучения влияния облучения головного мозга на ассоциативную память мышей был использован тест “УРЗ”, при котором условным сигналом была обстановка обучения (“контекст”). Согласно полученным данным (рис. 1), воздействие γ-излучения в дозе 2 Гр на область головы животных не приводит к изменению длительности замираний ни при обучении, ни при тестировании через 1 и 2 мес. после воздействия. У мышей, облученных в дозе 8 Гр, различия с контрольной группой также отсутствовали. Таким образом, нарушений в формировании и воспроизведении ассоциативной памяти у облученных животных нами не обнаружено. Это согласуется с результатами исследований, полученными в более ранние сроки после облучения [24, 25].
Принимая во внимание важную, если не ведущую, роль повреждения гиппокампа в развитии отдаленных когнитивных нарушений, было проведено исследование пространственного обучения и памяти мышей с использованием теста “ВЛМ” (рис. 2, табл. 5). Данный тест очень чувствителен к повреждению гиппокампа и, по-видимому, в большей мере зависит от нормального функционирования данной структуры мозга, чем выработка условно-рефлекторного замирания на “контекст” [26, 27]. Действительно, у мышей через 1 мес. после облучения головы в дозе 8 Гр были обнаружены нарушения пространственной памяти, выраженные в большем времени достижения платформы и меньшем количестве пересечений зоны платформы при тестировании в сравнении с контрольной группой. Через 2 мес. после облучения в этой дозе статистически значимые различия в параметрах теста обнаружены не только при тестировании, но и при обучении: облученные в дозе 8 Гр мыши показывали большее время достижения платформы во 2-, 4-й и 5-й дни обучения. В то же время через 6 мес. у данной группы облученных мышей наблюдалась только тенденция к снижению обучаемости в сравнении с контролем. Облучение головы в дозе 2 Гр не оказывало негативного влияния на пространственную память мышей во все исследуемые периоды после воздействия.
Результаты исследования когнитивных функций мышей согласуются с данными по изменению соотношения клеток покоящейся и активированной микроглии в головном мозге в аналогичные периоды после облучения (рис. 4). Так, доля клеток активированной микроглии в мозге не отличалась от контроля после γ-облучения в дозе 2 Гр, но значительно возрастала через 1 и 2 мес. после γ-облучения в дозе 8 Гр, что свидетельствует о развитии нейровоспаления в данных условиях. В более отдаленный период – через 6 мес. после облучения – доля клеток активированной микроглии у контрольной и обеих групп облученных мышей не различалась, что, возможно, указывает на отсутствие нейровоспаления. В то же время, анализируя состояние клеток покоящейся и активированной микроглии после облучения, следует отметить, что и через 6 мес. количество клеток покоящейся и активированной микроглии остается сниженным после облучения головы мышей и в дозе 2 Гр, и в дозе 8 Гр (рис. 4). Это может быть отражением длительного нарушения гомеостаза в системе микроглии как в ранний (3 сут. после воздействия), так и в отдаленный период после облучения. Полученные данные об уменьшении количества клеток обоих типов микроглии через 3 сут после облучения (рис. 4, а, б) свидетельствуют о высокой радиочувствительности этих клеток при облучении головы и, как было показано нами ранее, при общем облучении мышей [15]. Длительное пострадиационное снижение клеток микроглии в мозге может приводить к снижению устойчивости мозга к развитию нейроинфекции.
Таким образом, показано возникновение нарушений в пространственной памяти мышей в отдаленный период – через 1 и 2 мес. – после однократного γ-облучения головы в дозе 8 Гр, которые восстанавливались к 6 мес. после воздействия. При этом показано отсутствие таких нарушений при меньшей дозе, равной 2 Гр, что может указывать на “подпороговое” повреждение структур головного мозга и/или их более быстрое восстановление при этой дозе. Нарушений ассоциативной памяти в изученных условиях в отдаленный период не обнаружено. Наблюдаемые эффекты воздействия ионизирующего излучения на когнитивные функции коррелируют с обнаруженным увеличением доли клеток активированной микроглии в мозге, отражающем развитие нейровоспаления. Предотвращение или подавление этого процесса с помощью экспериментальных и одобренных к медицинскому применению препаратов является перспективной стратегией профилактики и лечения отдаленных пострадиационных когнитивных расстройств.
Список литературы
Голанов А.В., Банов С.М., Ветлова Е.Р. Метастатическое поражение головного мозга: изменение парадигмы лучевого лечения // Вопр. онкологии. 2015. Т. 61. № 4. С. 530–545. [Golanov А.V., Banov S.М., Vetlova Е.R. Metastatic brain lesion paradigm shift in radiation therapy // Voprosy onkologii. 2015. V. 61. № 4. P. 530–545. (In Russian)]
Щербенко О.И., Говорина Е.В. Радиационные повреждения головного мозга после лучевой терапии опухолей ЦНС (обзор литературы) // Вопр. гематологии/онкологии и иммунопатологии в педиатрии. 2003. Т. 2. № 3. С. 40–43. [Shcherbenko O.I., Govorina E.V. Radiation-induced cerebral lesions following radiotherapy of CNS tumours (review of literature) // Pediatric Hematology/Oncology and Immunopathology. 2003. V. 2. № 3. P. 40–43. (In Russian)]
Behin A., Delattre J.Y. Complications of radiation therapy on the brain and spinal cord // Semin Neurol. 2004. V. 24. № 4. P. 405–417. https://doi.org/10.1055/s-2004-861535
Johannesen T.B., Lien H.H., Hole K.H. et al. Radiolo-gical and clinical assessment of long-term brain tumour survivors after radiotherapy // Radiother. Oncol. 2003. V. 69. № 2. P. 169–176. https://doi.org/10.1016/s0167-8140(03)00192-0
Yang L., Yang J., Li G. et al. Pathophysiological Responses in Rat and Mouse Models of Radiation-Induced Brain Injury // Mol. Neurobiol. 2017. V. 54. № 2. P. 1022–1032. https://doi.org/10.1007/s12035-015-9628-x
Raber J. Unintended effects of cranial irradiation on cognitive function // Toxicol. Pathol. 2010. V. 38. № 1. P. 198–202. https://doi.org/10.1177/0192623309352003
Pazzaglia S., Briganti G., Mancuso M. et al. Neurocognitive Decline Following Radiotherapy: Mechanisms and Therapeutic Implications // Cancers (Basel). 2020. V. 12. № 1. https://doi.org/10.3390/cancers12010146
DiSabato D.J., Quan N., Godbout J.P. Neuroinflammation: the devil is in the details // J. Neurochem. 2016. V. 139 Suppl. 2. P. 136–153. https://doi.org/10.1111/jnc.13607
Ramanan S., Kooshki M., Zhao W. et al. The PPARalpha agonist fenofibrate preserves hippocampal neurogenesis and inhibits microglial activation after whole-brain irradiation // Int. J. Radiat. Oncol. Biol. Phys. 2009. V. 75. № 3. P. 870–877. https://doi.org/10.1016/j.ijrobp.2009.06.059
Schnegg C.I., Greene-Schloesser D., Kooshki M. et al. The PPARdelta agonist GW0742 inhibits neuroinflammation, but does not restore neurogenesis or prevent early delayed hippocampal-dependent cognitive impairment after whole-brain irradiation // Free Radic. Biol. Med. 2013. V. 61. P. 1–9. https://doi.org/10.1016/j.freeradbiomed.2013.03.002
Dong X., Luo M., Huang G. et al. Relationship between irradiation-induced neuro-inflammatory environments and impaired cognitive function in the develo-ping brain of mice // Int. J. Radiat. Biol. 2015. V. 91. № 3. P. 224–239. https://doi.org/10.3109/09553002.2014.988895
Tong F., Zhang J., Liu L. et al. Corilagin Attenuates Radiation-Induced Brain Injury in Mice // Mol. Neurobiol. 2016. V. 53. № 10. P. 6982–6996. https://doi.org/10.1007/s12035-015-9591-6
Rosi S., Andres-Mach M., Fishman K.M. et al. Cranial irradiation alters the behaviorally induced immediate-early gene arc (activity-regulated cytoskeleton-associated protein) // Cancer Res. 2008. V. 68. № 23. P. 9763–9770. https://doi.org/10.1158/0008-5472.CAN-08-1861
Legroux L., Pittet C.L., Beauseigle D. et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry // J. Neurosci. Methods. 2015. V. 247. P. 23–31. https://doi.org/10.1016/j.jneumeth.2015.03.021
Родина А.В., Сёмочкина Ю.П., Ратушняк М.Г. и др. Анализ ориентировочно-исследовательской активности и уровня микроглии у мышей, подвергшихся воздействию γ-излучения в сублетальных дозах // Радиац. биология. Радиоэкология. 2019. Т. 59. № 6. С. 575–584. [Rodina A.V., Semochkina Yu.P., Ratushnyak M.G. et al. Analyzis of Exploratory Rearing and Microglia Level after γ-Irradiation of Mice at Sublethal Doses // Radiation biology. Radioecology. 2019. V. 59. № 6. P. 575–584. (In Russian)]. https://doi.org/10.1134/S0869803119060092
Raber J., Rola R., LeFevour A. et al. Radiation-induced cognitive impairments are associated with changes in indicators of hippocampal neurogenesis // Radiat. Res. 2004. V. 162. № 1. P. 39–47. https://doi.org/10.1667/rr3206
Wolf N., Pendergrass W., Singh N. et al. Radiation cataracts: mechanisms involved in their long delayed occurrence but then rapid progression // Mol. Vis. 2008. V. 14. P. 274–285.
Wu K.L., Tu B., Li Y.Q. et al. Role of intercellular adhesion molecule-1 in radiation-induced brain injury // Int. J. Radiat. Oncol. Biol. Phys. 2010. V. 76. № 1. P. 220–228. https://doi.org/10.1016/j.ijrobp.2009.08.017
Zhang J., Tong F., Cai Q. et al. Shenqi fuzheng injection attenuates irradiation-induced brain injury in mice via inhibition of the NF-kappaB signaling pathway and microglial activation // Acta Pharmacol. Sin. 2015. V. 36. № 11. P. 1288–1299. https://doi.org/10.1038/aps.2015.69
Karlsson N., Kalm M., Nilsson M.K. et al. Learning and activity after irradiation of the young mouse brain analyzed in adulthood using unbiased monitoring in a home cage environment // Radiat. Res. 2011. V. 175. № 3. P. 336–346. https://doi.org/10.1667/RR2231.1
Kalm M., Karlsson N., Nilsson M.K. et al. Loss of hippocampal neurogenesis, increased novelty-induced acti-vity, decreased home cage activity, and impaired reversal learning one year after irradiation of the young mouse brain // Exp. Neurol. 2013. V. 247. P. 402–409. https://doi.org/10.1016/j.expneurol.2013.01.006
Rola R., Raber J., Rizk A. et al. Radiation-induced impairment of hippocampal neurogenesis is associated with cognitive deficits in young mice // Exp. Neurol. 2004. V. 188. № 2. P. 316–330. https://doi.org/10.1016/j.expneurol.2004.05.005
Ben Abdallah N.M., Filipkowski R.K., Pruschy M. et al. Impaired long-term memory retention: common denominator for acutely or genetically reduced hippocampal neurogenesis in adult mice // Behav. Brain. Res. 2013. V. 252. P. 275–286. https://doi.org/10.1016/j.bbr.2013.05.034
Dayger C., Villasana L., Pfankuch T. et al. Effects of the SARM ACP-105 on rotorod performance and cued fear conditioning in sham-irradiated and irradiated female mice // Brain. Res. 2011. V. 1381. P. 134–140. https://doi.org/10.1016/j.brainres.2010.12.088
Stessin A.M., Banu M.A., Clausi M.G. et al. FTY720/fingolimod, an oral S1PR modulator, mitigates radiation induced cognitive deficits // Neurosci. Lett. 2017. V. 658. P. 1–5. https://doi.org/10.1016/j.neulet.2017.08.025
Sharma S., Rakoczy S., Brown-Borg H. Assessment of spatial memory in mice // Life Sci. 2010. V. 87. № 17–18. P. 521–536. https://doi.org/10.1016/j.lfs.2010.09.004
Maren S., Phan K.L., Liberzon I. The contextual brain: implications for fear conditioning, extinction and psychopathology // Nat. Rev. Neurosci. 2013. V. 14. № 6. P. 417–428. https://doi.org/10.1038/nrn3492
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


