Радиотехника и электроника, 2020, T. 65, № 10, стр. 987-993
Шум движения электродного датчика и его связь с пульсациями скорости жидкости
В. Г. Максименко *
Фрязинский филиал Института радиотехники и электроники им. В.А. Котельникова РАН
141190 Фрязино, Московской обл., пл. Введенского, 1, Российская Федерация
* E-mail: max54@ms.ire.rssi.ru
Поступила в редакцию 15.03.2019
После доработки 15.03.2019
Принята к публикации 30.10.2019
Аннотация
Уточнена и дополнена теория возникновения пульсаций напряжения на электродном датчике при его движении относительно электролита (в частности, морской воды), которая учитывает два различных механизма возникновения пульсаций. Получены формулы, связывающие скачок электродного потенциала со скачком скорости потока, применимые для электродов реальных размеров при длительной выдержке в электролите. Показано, что расчетное значение пульсационного напряжения по порядку величины совпадает с полученным в эксперименте.
ВВЕДЕНИЕ
Электродные датчики электрического поля в электролите, в частности в пресной и морской воде, нашли широкое применение. Их используют при измерении электрических полей искусственного и естественного происхождения в океане, в системах электромагнитной связи с подводным объектом, в электромагнитных расходомерах [1‒3]. В наших экспериментальных исследованиях обнаружена связь шума электродного датчика, движущегося относительно жидкости (шума движения), с пульсациями скорости движения [4, 5]. Собственный шум датчика ограничивает его чувствительность, поэтому исследование причин его возникновения является актуальным. В [6] рассмотрен механизм изменения потенциала (поляризации) электрода при обтекании его потоком электролита. Он основан на деформации набегающим потоком двойного электрического слоя (ДЭС) на передней кромке электрода. Получены выражения для величины избыточного заряда на электроде и изменения потенциала. Однако развитая теория применима лишь к электродам очень небольшого размера. В [7] рассмотрен другой механизм изменения потенциала электрода в электролите, основанный на изменении скорости адсорбции кислорода поверхностью электрода за счет модуляции толщины диффузионного слоя. Полученная формула для изменения потенциала хорошо согласуется с результатами экспериментальных исследований при времени выдержки электрода в электролите в течение нескольких часов. Однако измеренный электродный шум при длительной выдержке электродов в электролите существенно превышает теоретические значения.
Целью статьи является уточнение развитой теории возникновения шума движения для электродов реальных размеров и при длительной выдержке электродов в электролите.
1. ПУЛЬСАЦИЯ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА ПРИ ДЕФОРМАЦИИ ДЭС (ПОЛЯРИЗАЦИОННЫЙ ШУМ)
При погружении электрода в электролит на его поверхности образуется двойной электрический слой, подобный конденсатору с потерями. У обычно используемых для электродов металлов, имеющих на своей поверхности плотную диэлектрическую пленку окисла, (Ta2O5, TiO2), образование двойного слоя связано с адсорбцией ионов кислорода, создающих отрицательный заряд поверхности. Вторая (жидкостная) обкладка двойного слоя формируется за счет положительно заряженных ионов водорода и металлов, раствор солей которых и представляет собой электролит (например, ион Na+ при растворении NaCl), называемых противоионами. В жидкостной обкладке двойного слоя выделяют плотную и диффузную части. Плотная часть двойного слоя представляет собой слой противоионов, сильно связанных электростатическими силами с заряженной поверхностью. Диффузной называют ту часть двойного слоя, где энергия взаимодействия противоионов с поверхностью сравнима с тепловой энергией или меньше ее в результате экранирования поверхностного заряда плотной частью жидкостной обкладки. При обтекании электрода потоком электролита часть жидкостной обкладки двойного слоя увлекается потоком по условной поверхности скольжения, отстоящей на некоторое расстояние от поверхности электрода.
Рассмотрим плоский квадратный нерастворимый электрод со стороной L, поверхность которого покрыта диэлектрической окисной пленкой и совпадает с плоскостью координат XOY, а передняя граница – с осью x, встроенный заподлицо в диэлектрическую поверхность, линейные размеры которой много больше L (рис. 1). На всей поверхности электрода существует сформированный двойной электрический слой, внутренняя обкладка которого образована адсорбированными ионами кислорода. Пусть на переднюю границу электрода набегает поток водного электролита, вектор скорости ${{\vec {V}}_{0}}$ которого направлен по оси y. Также в набегающем на электрод потоке сформирована область вязкого подслоя, характеризующаяся линейным законом нарастания скорости по перпендикуляру к поверхности. На передней границе электрода (y = 0) происходит замена сформированной диффузной части жидкостной обкладки двойного слоя электронейтральным электролитом, в связи с чем поверхность имеет нескомпенсированный заряд плотной части двойного слоя. В соответствии с [6] избыточный заряд на передней кромке электрода определяется выражением
где ε – относительная диэлектрическая проницаемость жидкости, ${{\varepsilon }_{0}}$ – диэлектрическая проницаемость вакуума, $\tau $ – постоянная времени релаксации двойного слоя, $\zeta $ – электрокинетический потенциал окисной пленки [8], a – градиент скорости жидкости в направлении, перпендикулярном к поверхности электрода. Реальный электрод имеет поверхность с множеством микровыступов, высота которых существенно превышает толщину двойного электрического слоя. При этом их вершина находится в области уже сформированного вязкого подслоя, а их протяженность вдоль направления вектора скорости много больше толщины двойного слоя, поэтому процесс формирования на них избыточного заряда в основном совпадает с рассмотренным в [6]. Процессы деформации двойного слоя на краю такого электрода не оказывают существенного влияния на поляризацию всего электрода, поскольку из-за большого числа микровыступов именно на их вершинах и происходит в основном образование избыточного заряда, приводящего к изменению потенциала электрода. Это изменение потенциала определяется как отношение суммы избыточных зарядов на всех микровыступах к емкости всего электрода. Согласно данным [8, 9] микровыступы на поверхности полированных электродов, которые и применялись в наших экспериментах, имеют размер L порядка ${{10}^{{ - 7}}}$ м, что значительно превышает толщину двойного слоя (порядка ${{10}^{{ - 9}}}$ м).Пусть реальный плоский электрод имеет форму квадрата со стороной l. Число микровыступов $N$ со стороной L на площади $S$ электрода определяется концентрацией $n = {N \mathord{\left/ {\vphantom {N S}} \right. \kern-0em} S}$ микровыступов на 1 м2. На площадке шириной l и длиной dy находится $nl \cdot dy$ микровыступов, избыточный заряд которых равен
Согласно [7] градиент скорости a можно считать равным ${{2{{V}_{0}}} \mathord{\left/ {\vphantom {{2{{V}_{0}}} {{{\delta }_{0}}}}} \right. \kern-0em} {{{\delta }_{0}}}}$, где ${{\delta }_{0}}$ – толщина вязкого подслоя, которая определяется по формуле
(3)
${{\delta }_{0}} \approx 3\sqrt {{{\nu y} \mathord{\left/ {\vphantom {{\nu y} {{{V}_{0}}}}} \right. \kern-0em} {{{V}_{0}}}}} .$Теперь выражение (2) можно записать в виде
Избыточный заряд всего электрода
(6)
$Q = \int\limits_0^l {dQ \approx 1333n\varepsilon {{\varepsilon }_{0}}} \tau L\zeta V_{0}^{{1.5}}{{l}^{{1.5}}}.$За счет этого заряда электрод приобретает потенциал φ относительно электролита. Учитывая, что $S = {{l}^{2}}$, получаем
(7)
$\varphi = \frac{Q}{{{{C}_{{{\text{уд}}}}}S}} = \frac{{1333n\varepsilon {{\varepsilon }_{0}}\tau L\zeta V_{0}^{{1.5}}}}{{{{C}_{{{\text{уд}}}}}\sqrt l }}.$Определим скачок потенциала электрода $\Delta \varphi $, вызванный скачком скорости потока $\Delta {{V}_{0}} \ll {{V}_{0}}$:
(8)
$\Delta \varphi \approx \Delta {{V}_{0}}(\varphi )_{{{{V}_{0}}}}^{'} = \frac{{1333n\varepsilon {{\varepsilon }_{0}}\tau L\zeta V_{0}^{{0.5}}}}{{{{C}_{{{\text{уд}}}}}\sqrt l }}\Delta {{V}_{0}}.$Подставим в (8) значения: ε = 81, ε0 = 8.85 × 10–12 Ф/м, $l = 2.5 \times {{10}^{{ - 3}}}$ м, $L = {{10}^{{ - 7}}}$ м. Так как $L = {{10}^{{ - 7}}}$ м, то можно считать $n = {{10}^{{14}}}\,\,{{{\text{м}}}^{{ - 1}}}$. При $\tau \approx 8 \times {{10}^{{ - 10}}}\,\,{\text{с}}$, $\zeta = {{10}^{{ - 2}}}$ В, ${{C}_{{{\text{уд}}}}} = 0.02\,\,{\text{Ф/}}{{{\text{м}}}^{{\text{2}}}}$ выражение (8) имеет вид
Пульсации скорости потока жидкости вызывают пульсации потенциала электрода, которые мы называем поляризационной составляющей шума движения. Как следует из (9), чувствительность электрода к пульсациям скорости пропорциональна $V_{0}^{{0.5}}$. Из формулы (8) также следует зависимость скачка потенциала, следовательно, и шума движения от площади электрода. Так как электрод квадратный, то $l = {{S}^{{0.5}}}$. Тогда изменение потенциала пропорционально ${{S}^{{ - 0.25}}}$.
Оценим величину Δφ. Пусть средняя скорость потока жидкости ${{V}_{0}} = 0.5$ м/с, а пульсация скорости $\Delta {{V}_{0}} = 0.02$ м/с. Амплитуда пульсации электродного потенциала при этом составит 1.63 нВ. Поскольку относительные пульсации скорости жидкости в вязком подслое, прилегающем к поверхности электрода, выше, чем в толще потока [13], можно ожидать, что в действительности пульсация потенциала больше рассчитанной. С учетом возможного увеличения постоянной времени $\tau $ релаксации ДЭС значение пульсации Δφ электродного потенциала, соответствующее пульсации скорости 0.05…0.1 м/с, при средней скорости потока порядка 1 м/с может быть больше 10 нВ. Это соответствует порядку величины шума движения, измеренного в экспериментах для длительно выдержанных в электролите электродов [4].
2. ПУЛЬСАЦИЯ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА ПРИ МОДУЛЯЦИИ ТОЛЩИНЫ ДИФФУЗИОННОГО СЛОЯ (МОДУЛЯЦИОННЫЙ ШУМ)
Процесс адсорбции кислорода на поверхность металлического электрода поддерживается за счет диффузии атомов кислорода из толщи электролита к поверхности электрода. В слое электролита (в нашем случае – раствор NaCl), прилегающем к поверхности электрода, концентрация атомов кислорода изменяется от максимального значения, равного концентрации в толще электролита, до минимального на поверхности электрода, поскольку они вступают в реакцию с металлом или адсорбируются поверхностью. Этот слой называют диффузионным. Скорость диффузии кислорода, следовательно, и скорость изменения заряда поверхности электрода зависит от толщины диффузионного слоя. В [7] рассмотрен механизм возникновения пульсаций электродного потенциала в результате модуляции толщины диффузионного слоя на границе электрод-электролит набегающим пульсирующим потоком жидкости. В соответствии с [7] зависимость заряда $\Delta Q$ поверхности электрода, обусловленного скачком скорости $\Delta {{V}_{0}}$ набегающего на электрод потока от времени t, определяется выражением
(10)
$\begin{gathered} \Delta Q(t) = - \frac{{13.4FDLa{{c}_{0}}\Delta {{V}_{0}}{{\tau }_{1}}}}{{\sqrt {{{V}_{0}}L\nu } }} \times \\ \times \,\,\exp ({{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{2}}}}} \right. \kern-0em} {{{\tau }_{2}}}})(1 - \exp ({{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{1}}}}} \right. \kern-0em} {{{\tau }_{1}}}}). \\ \end{gathered} $Здесь D – коэффициент диффузии кислорода, F – число Фарадея, a – ширина электрода, c0 – концентрация кислорода в толще электролита, V0 – скорость потока вдали от поверхности, L – длина электрода, ν – кинематическая вязкость жидкости, ${{\tau }_{1}} = {{3L} \mathord{\left/ {\vphantom {{3L} {4{{V}_{0}}}}} \right. \kern-0em} {4{{V}_{0}}}}$ – постоянная времени установления новых параметров пограничного слоя, ${{\tau }_{2}}$ – постоянная времени уменьшения площади электрода, не покрытой адсорбированным кислородом или окислом. Для электрода длиной $L = 2.5\,\,{\text{мм}}$ при скорости потока ${{V}_{0}} = 0.5\,\,{\text{м/с}}$ ${{\tau }_{2}} \approx 5 \times {{10}^{3}}{\text{ с}}$. При выводе (10) предполагалось, что на участок поверхности электрода, уже покрытый адсорбированным кислородом или окисной пленкой, адсорбция не идет. На самом деле адсорбция продолжается, хотя и с гораздо меньшей скоростью. Площадь электрода, покрытая адсорбированным кислородом, вычисляется по формуле
(11)
$S(t) = La(1 - \exp ({{ - t} \mathord{\left/ {\vphantom {{ - t} {\tau {}_{2}}}} \right. \kern-0em} {\tau {}_{2}}})).$Уменьшение скорости адсорбции на нее кислорода учтем введением коэффициента ${{k}_{1}}(t)$. Тогда выражение (10) дополнится слагаемым, учитывающим адсорбцию на ту часть поверхности электрода, где уже существует адсорбированный слой кислорода или окисел:
(12)
$\begin{gathered} \Delta Q(t) = - \frac{{13.4FDLa{{c}_{0}}\Delta {{V}_{0}}{{\tau }_{1}}}}{{\sqrt {{{V}_{0}}L\nu } }} \times \\ \times \,\,(1 - \exp ({{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{1}}}}} \right. \kern-0em} {{{\tau }_{1}}}}))({{k}_{1}}(t) + \exp ({{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{2}}}}} \right. \kern-0em} {{{\tau }_{2}}}})(1 - {{k}_{1}}(t))). \\ \end{gathered} $Подставим в (12) значение постоянной времени ${{\tau }_{1}} = {{3L} \mathord{\left/ {\vphantom {{3L} {4{{V}_{0}}}}} \right. \kern-0em} {4{{V}_{0}}}}$ и определим скачок потенциала электрода при скачке скорости потока $\Delta {{V}_{0}}$
(13)
$\begin{gathered} \Delta \varphi = \frac{{\Delta Q}}{{{{C}_{D}}}} \approx - \frac{{3 \times {{{10}}^{{ - 9}}}FD{{c}_{0}}}}{{\varepsilon {{\varepsilon }_{0}}}}\sqrt {\frac{L}{{{{c}_{1}}\nu {{V}_{0}}}}} \frac{{\Delta V{}_{0}}}{{{{V}_{0}}}} \times \\ \times \,\,(1 - \exp ({{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{1}}}}} \right. \kern-0em} {{{\tau }_{1}}}}))({{k}_{1}}(t) + \exp ({{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{2}}}}} \right. \kern-0em} {{{\tau }_{2}}}})(1 - {{k}_{1}}(t))). \\ \end{gathered} $Здесь ${{C}_{D}}$ – емкость двойного электрического слоя, ${{\varepsilon }_{0}} = 8.85 \times {{10}^{{ - 12}}}\,\,{\text{Ф/м}}$ – диэлектрическая проницаемость вакуума, ${{c}_{1}}$ – концентрация NaCl (моль/л) в электролите, $\varepsilon $ – относительная диэлектрическая проницаемость между обкладками двойного слоя. В плотной части двойного слоя $\varepsilon \approx 3$, в диффузной части при небольшой концентрации электролита значение $\varepsilon $ приближается к 81 [14]. Как следует из (13), при постоянной величине относительной пульсации скорости ${{\Delta {{V}_{0}}} \mathord{\left/ {\vphantom {{\Delta {{V}_{0}}} {{{V}_{0}}}}} \right. \kern-0em} {{{V}_{0}}}}$ чувствительность электрода к пульсациям скорости уменьшается с увеличением средней скорости потока V0. Полагая электрод квадратным, площадь электрода $S = {{L}^{2}}$, тогда $\Delta \varphi $ пропорциональна ${{S}^{{0.25}}}$.
Определим значение коэффициента ${{k}_{1}}(t)$ для титановых электродов. Изменение скорости адсорбции кислорода можно определить по скорости роста окисной пленки на поверхности электрода. От толщины окисной пленки зависит емкость электрода относительно электролита. А скорость роста окисной пленки определяется скоростью диффузии кислорода. Следовательно, изменение скорости диффузии можно определить по зависимости емкости электрода от времени.
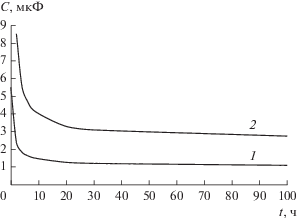
Масса окисной пленки на поверхности электрода определяется произведением плотности $\rho $ окиси титана ${\text{T}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}$ на ее объем V. Объем есть произведение толщины $h$ пленки на площадь $S$ электрода. Из формулы для емкости плоского конденсатора объем $V = {{\varepsilon {{\varepsilon }_{0}}S} \mathord{\left/ {\vphantom {{\varepsilon {{\varepsilon }_{0}}S} {{{C}_{{{\text{окс}}{\kern 1pt} {\text{1}}}}}}}} \right. \kern-0em} {{{C}_{{{\text{окс}}{\kern 1pt} {\text{1}}}}}}}$, где $\varepsilon = 100$ – относительная диэлектрическая проницаемость окиси титана, ${{C}_{{{\text{окс}}{\kern 1pt} {\text{1}}}}}$ – емкость окисной пленки на поверхности одного электрода. Емкость между двумя электродами в электролите может быть представлена как емкость двух последовательно соединенных конденсаторов, определяющих емкость каждого электрода относительно электролита. Каждый из них может быть представлен также двумя последовательно соединенными конденсаторами. Первый представляет собой двойной электрический слой на поверхности электрода, второй – конденсатор с диэлектриком в виде окисной пленки. На частоте 20 Гц измерена зависимость емкости $C$ между двумя титановыми электродами диаметром 6 мм, помещенными в раствор NaCl с концентрацией 35 г/л, от времени выдержки $t$ в электролите (рис. 2, кривая 1). Сразу после погружения электродов в электролит окисная пленка еще не успела сформироваться, поэтому полагаем, что емкость, измеренная при $t = 0$, определяется емкостью двойного слоя ${{C}_{{{\text{дэс}}}}}$ электродов. Емкость окисной пленки двух электродов определяется формулой
(14)
${{C}_{{{\text{окс}}}}} = \frac{C}{{1 - {C \mathord{\left/ {\vphantom {C {{{C}_{{{\text{дэс}}}}}}}} \right. \kern-0em} {{{C}_{{{\text{дэс}}}}}}}}},$Рис. 2.
Зависимость емкости титановых электродов от времени выдержки в электролите: 1 – измеренная емкость, 2 – емкость окисной пленки одного электрода.
число молекул окисла –
(16)
$N = \frac{{\rho \varepsilon {{\varepsilon }_{0}}{{S}^{2}}{{N}_{{\text{A}}}}}}{{M{{C}_{{{\text{окс1}}}}}}},$(17)
$\frac{{dN}}{{dt}} = - \frac{{\rho \varepsilon {{\varepsilon }_{0}}{{S}^{2}}{{N}_{{\text{A}}}}}}{{MC_{{{\text{окс1}}}}^{2}}}\frac{{d{{C}_{{{\text{окс1}}}}}}}{{dt}}.$Сравним значение скорости адсорбции кислорода, определяемое формулой (17), с предельным значением, которое определяется законом Фика при диффузии кислорода на чистый металл [11]:
где $D$ – коэффициент диффузии кислорода, $c{}_{0}$ – концентрация кислорода в толще электролита, $\delta $ – толщина диффузионного слоя. Для электрода длиной $L = 2.5\,\,{\text{мм}}$ при скорости потока V0 = $ = 0.5{\text{ м/с}}$ величина $\delta $ имеет порядок ${{10}^{{ - 5}}}\,\,{\text{м}}$. Поделив (17) на (18), получим ${{k}_{1}}(t)$.(19)
$k{}_{1}(t) = - \frac{{\rho \varepsilon {{\varepsilon }_{0}}S\delta }}{{MD{{c}_{0}}C_{{{\text{окс}}{\kern 1pt} {\text{1}}}}^{2}}}\frac{{d{{C}_{{{\text{окс1}}}}}}}{{dt}}.$Подставляя в (19) значения $\rho = 4240\,\,{{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{{\text{3}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{3}}}}}}$, M = = 0.112 кг/м3, S = 28.3 × 10–6 м2, D = 2.6 × 10–9 м2/с, $\varepsilon = 100$, ${{c}_{0}} = 0.5 \times {{10}^{{ - 3}}}\,\,{\text{моль/л}}$, получим
(20)
$k{}_{1}(t) = - \frac{{7.29 \times {{{10}}^{{ - 3}}}}}{{C_{{{\text{окс}}{\kern 1pt} {\text{1}}}}^{2}}}\frac{{d{{C}_{{{\text{окс}}{\kern 1pt} {\text{1}}}}}}}{{dt}}.$В диапазоне t = 20…100 ч зависимость ${{C}_{{{\text{окс1}}}}}(t)$ с точностью не хуже 1% аппроксимируется степенной функцией ${{C}_{{{\text{окс}}\,{\text{1}}}}} = 4.555{{t}^{{ - 0.11}}}$. Здесь ${{C}_{{{\text{окс}}\,{\text{1}}}}}$ в мкФ, t – в часах. В единицах системы СИ зависимость емкости окисной пленки одного электрода относительно электролита от времени имеет вид
В соответствии с (21) скорость изменения емкости окисной пленки выражается формулой
(22)
$\frac{{d{{C}_{{{\text{окс}}\,{\text{1}}}}}}}{{dt}} = - 1.233 \times {{10}^{{ - 6}}}{{t}^{{ - 1.1}}}.$При времени выдержки электродов в электролите 1…4 сут в соответствии с (21) и (22) получим
Зависимость чувствительности электродного датчика к пульсациям скорости жидкости от времени в соответствии с (13) определяется коэффициентом
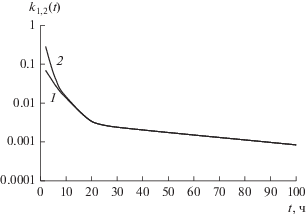
Зависимости ${{k}_{1}}(t)$ и ${{k}_{2}}(t)$, рассчитанные по (23) и (24), приведены на рис. 3. Из рисунка видно, что при $t > 20$ ч чувствительность электрода к пульсациям скорости определяется коэффициентом ${{k}_{1}}(t)$, который обратно пропорционален времени выдержки в степени меньше единицы. При $t = 100$ ч ${{k}_{1}}(t) = 0.84 \times {{10}^{{ - 3}}}$, т.е. чувствительность датчика к пульсациям скорости уменьшается более чем в 1000 раз. Но это значение на много порядков больше, чем при неучете адсорбции на окисную пленку. При ${{\varepsilon }_{0}} = 8.85 \times {{10}^{{ - 12}}}\,\,{\text{Ф/м}}$, ε = 81, c1 = 0.077 моль/л, ${{c}_{0}} = 0.5 \times {{10}^{{ - 3}}}\,\,{\text{моль/л}}$, $F = 9.64 \times {{10}^{4}}{\text{ }}$ Кл/моль, ${{\tau }_{1}} = 3.75 \times {{10}^{{ - 3}}}\,\,{\text{с}}$, ${{\tau }_{2}} = 5000$ с, $\Delta {{V}_{0}} = 5 \times {{10}^{{ - 3}}}\,\,{\text{м/с}}$, ${{V}_{0}} = 0.5\,\,{\text{м/с}}$, $L = 2.5 \times {{10}^{{ - 3}}}\,\,{\text{м}}$, $\nu = {{10}^{{ - 6}}}\,\,{{{{{\text{м}}}^{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{{\text{м}}}^{{\text{2}}}}} {\text{с}}}} \right. \kern-0em} {\text{с}}}$, по формуле (13) для $t = 100$ ч получим значение $\Delta {{\varphi }_{m}}$ порядка 1 нВ.
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По данным наших измерений [10], емкость датчиков с электродами из разных металлов не перестает изменяться в течение нескольких сотен и даже тысяч часов. Это свидетельствует о непрекращающихся электрохимических процессах на поверхности электродов, которые влияют на чувствительность датчика к пульсациям скорости жидкости.
При времени выдержки электродов в электролите до нескольких суток модуляционный шум движения при одинаковых пульсациях скорости жидкости существенно больше поляризационного. Однако поляризационный шум не имеет явной временной и частотной зависимости, поэтому при времени выдержки более нескольких суток он может превысить модуляционный шум, особенно на частотах выше 30…40 Гц. Согласно [7] спектр модуляционного шума представляет собой произведение спектра пульсаций скорости на коэффициент передачи фильтра нижних частот $K(\omega ) = {1 \mathord{\left/ {\vphantom {1 {\sqrt {1 + {{{(\omega {{\tau }_{1}})}}^{2}}} }}} \right. \kern-0em} {\sqrt {1 + {{{(\omega {{\tau }_{1}})}}^{2}}} }}$. Постоянная времени установления параметров пограничного слоя ${{\tau }_{1}}$ в зависимости от скорости жидкости и размеров электрода может составлять единицы-десятки миллисекунд. Значит, основная энергия модуляционного шума сосредоточена в диапазоне частот ниже 30 Гц.
В [4] измерена пульсация электродного потенциала электрода из нержавеющей стали, имеющей близкие с титаном импедансные характеристики. Электрод диаметром 2.5 мм находился в потоке раствора NaCl со скоростью 0.5 м/с и абсолютным значением пульсации скорости 0.02 м/с. При времени выдержки электрода в электролите 2 сут измеренное напряжение пульсации составило 11 нВ при концентрации раствора 27 г/л (0.46 моль/л). Наши экспериментальные исследования показали, что электроды из титана имели примерно в 1.5 раза более низкую чувствительность к пульсациям скорости жидкости, чем электроды из нержавеющей стали. Расчет $\Delta \varphi $ по формуле (13) для титанового электрода дает значение $\Delta \varphi = 3.5$ нВ при относительной диэлектрической проницаемости ДЭС $\varepsilon = 81$. По порядку величины измеренная пульсация электродного потенциала совпадает с расчетной. При этом остается неопределенность в величине диэлектрической проницаемости ДЭС $\varepsilon $, которая, по-видимому, имеет меньшее значение, что увеличивает расчетное значение $\Delta \varphi $.
В соответствии с (8) поляризационная составляющая шума движения уменьшается пропорционально ${{S}^{{0.25}}}$. Из (13) следует, что модуляционная составляющая шума движения растет пропорционально ${{S}^{{0.25}}}$. Однако эти зависимости справедливы только в случае, когда пульсации скорости на всей площади электрода полностью коррелированы. При большой площади электрода это условие обычно не выполняется. Если пульсации скорости жидкости не коррелированы, то пульсации заряда $\Delta Q$ на разных участках поверхности электрода усредняются и шум движения имеет тенденцию к уменьшению [15]. В нашем эксперименте [4] при увеличении площади электродов в четыре раза путем параллельного соединения четырех одинаковых секций спектральная составляющая электродного напряжения на частоте пульсации скорости жидкости уменьшилась на 2 дБ.
* * *
Таким образом, развитая теория показывает удовлетворительное совпадение с данными экспериментальных исследований. Несмотря на то, что поляризационная составляющая шума имеет небольшую величину, на частотах в несколько десятков герц она может на порядок превышать тепловой шум электродов с площадью более 50 см2, выполненных из тантала, титана и нержавеющей стали.
Список литературы
Взаимодействие электромагнитных полей контролируемых источников СНЧ диапазона с ионосферой и земной корой: матер. Всерос. (с междунар. участием) научно-практич. семинара. Апатиты, 2014. Т. 1.
Бернстайн С.Л., Барроуз М.Л., Эванс Дж.Э. и др. Дальняя связь на крайне низких частотах // ТИИЭР. 1974. Т. 62. № 3. С. 5.
Кремлевский П.П. Расходомеры и счетчики количества. Справочник. Л.: Машиностроение, 1989.
Maкcимeнкo B.Г. // PЭ. 2017. T. 62. № 11. C. 1.
Максименко В.Г. // Измерит. техника. 2017. № 9. С. 57.
Maкcимeнкo B.Г. // PЭ. 1997. T. 42. № 2. C. 210.
Maкcимeнкo B.Г // PЭ. 2018. T. 63. № 7. C. 720.
Харин С.Е. Физическая химия. Киев: Изд-во Киевск. ун-та, 1961.
Одынец Л.Л., Чекмасова С.С. // Электрохимия. 1973. Т. 9. № 8. С. 1120.
Maкcимeнкo B.Г. // PЭ. 2006. T. 51. № 7. C. 786.
Дамаскин Б.Б., Петрий О.А. Введение в электрохимическую кинетику. М.: Высш. школа, 1983.
Богородский М.М. // Сб. “Исследование космической плазмы”. М.: ИЗМИРАН СССР, 1980. С. 152.
Рейнольдс А.Дж. Турбулентные течения в инженерных приложениях. М.: Энергия, 1979.
Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов. М.: Изд-во МГУ, 1952.
Maкcимeнкo B.Г. // PЭ. 2013. T. 58. № 8. C. 768.
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника