Радиотехника и электроника, 2020, T. 65, № 10, стр. 1019-1029
Автоматизированная система измерения интегрального индекса боли у пациентов при общей анестезии
В. М. Сокольский a, *, И. Ю. Петрова b, И. З. Китиашвили c, Ю. А. Лежнина b, М. В. Сокольский a
a ООО “Медицинские роботизированные технологии”
121205 Москва, Большой бульвар, 42, корп. 1, кв. 4/1474/5, Российская Федерация
b Астраханский государственный архитектурно-строительный университет
414056 Астрахань, ул. Татищева, 18, Российская Федерация
c Астраханский государственный медицинский университет
4140246 Астрахань, ул. Бакинская, 121, Российская Федерация
* E-mail: sokolskiy_vm@mail.ru
Поступила в редакцию 17.12.2019
После доработки 17.12.2019
Принята к публикации 12.03.2020
Аннотация
Разработаны требования к автоматизированной системе измерения уровня боли, испытываемой пациентами во время анестезии, методы и алгоритмы для реализации такой системы с использованием следующего набора показателей: данные о течении дыхательного цикла пациента, спектральные характеристики электроэнцефалограммы и электрокардиограммы; показатели кожно-гальванической реакции кожи; характеристики пульсовой волны; динамика изменения среднего артериального давления, частоты сердечных сокращений. Представлена блок-схема работы модуля для расчета интегрального показателя боли, функциональная схема его реализации, приведены результаты клинических испытаний.
ВВЕДЕНИЕ
При выполнении сложных хирургических операций используется наркоз, и анестезиологу необходимо в режиме реального времени анализировать большие объемы информации о состоянии пациентов. Правильность и своевременность решений, принятых анестезиологом, могут иметь решающее значение для жизни и здоровья пациента. Поэтому важно создать комплексную автоматизированную систему измерения и анализа информации о пациенте, предназначенную для снижения информационной и интеллектуальной нагрузки на анестезиолога. Ключевым аспектом для выполнения сбалансированной анестезии является измерение текущих уровней седации (медикаментозный сон) и ноцицепции (физиологической боли). Оба эти параметра могут быть определены количественно на основе измеренных параметров состояния пациента во время операции.
Глубина анестезии – это динамический баланс между потерей сознания пациентом и интенсивностью хирургической стимуляции [1]. Уровень седации может быть определен путем анализа электроэнцефалограммы (ЭЭГ) и последующего расчета биспектрального индекса (BIS) или индекса AAI (A-line ARX Index) [2], однако детали алгоритма расчета индекса BIS компанией Aspect Medical Systems [3] не разглашаются. Индекс AAI рассчитывается путем многократного применения слухового стимула к пациенту и усреднения выделенных фрагментов ЭЭГ, которые следуют за каждым стимулом. Таким образом, та часть ЭЭГ, которая не связана с реакцией на раздражитель, исключается, а специфические вызванные потенциалы сохраняются, по результатам анализа которых можно рассчитать степень седации. Высокочастотные сигналы ЭЭГ (около 30 Гц) указывают на то, что пациент находится в сознании, а низкочастотные сигналы указывают на состояние с высоким уровнем седации. Увеличение глубины седации вызывает увеличение регулярности ЭЭГ. Его можно оценить по величине энтропии и использовать для расчета глубины анестезии.
Для оценки уровня седации анестезиолог может использовать мгновенные значения изменения частоты сигналов ЭЭГ пациента [4]. Для получения мгновенной частоты и мгновенной амплитуды отфильтрованного сигнала ЭЭГ используется преобразование Гильберта–Хуанга, которое лучше всего подходит для анализа нестационарных и нелинейных данных, таких как физиологические сигналы [5, 6]. Значения мгновенной частоты, мгновенной амплитуды и времени отфильтрованного сигнала ЭЭГ затем могут быть объединены для создания трехмерного представления сигнала ЭЭГ в реальном времени, которое может одновременно выражать амплитуду и частоту мозговых волн сигнала ЭЭГ и их изменение во времени [4]. Момент, когда пациент теряет сознание во время анестезии, определяется рядом факторов: концентрацией анестетиков; видами лекарств, применяемых для седации; полом, возрастом, общим состоянием больного, а также “чувствительностью” пациентов к лекарствам (различия в фармакодинамике) и вариабельностью метаболизма лекарств в организме (различия в фармакокинетике) [7–9]. Фармакологическая вариабельность анальгетиков значительна и может достигать 500% [10]. Это не позволяет рассчитать перед операцией индивидуальную чувствительность конкретного пациента и оптимальную дозировку препарата для него.
Во время операции анестезиолог использует многочисленные измеренные и рассчитанные параметры, описывающие состояние пациента (табл. 1).
Таблица 1.
Параметры состояния пациента, контролируемые анестезиологом
| Параметр | Примечание* | ||
|---|---|---|---|
| Наименование | Обозначение | Тип | |
| Диастолическое, систолическое | DIA,SYS | Измеряемый | – |
| Среднее артериальное давление | MAP | Измеряемый | Да |
| Частота дыхания | RR | Измеряемый | – |
| Частота пульса | PR | Измеряемый | Да |
| Частота сердцебиения | HR | Измеряемый | Да |
| Уровень нейромышечной блокады | NB | Вычисляемый | – |
| Биспектральный индекс | BIS | Вычисляемый | – |
| Слуховые вызванные потенциалы | AEP | Вычисляемый | – |
| Насыщение кислородом (сатурация кислорода) | SpO2 | Измеряемый | – |
| Температура | T | Измеряемый | – |
| Индекс периферического сосудистого сопротивления | IPVR | Вычисляемый | – |
| Сердечный индекс | CI | Вычисляемый | – |
| Концентрация лекарств в крови | Kj | Вычисляемый | Да |
| Индекс анальгезии-ноцицепции | ANI | Вычисляемый | Да |
Кроме того, анестезиолог должен учитывать тренды электрокардиограмы (ЭКГ), пульса и насыщения крови кислородом, наблюдаемые на мониторе. Все эти параметры используются анестезиологом для расчета дозировки используемого анестезиологического пособия: анальгетика, нейролептика, гипнотика и анестетика. Состояние пациента и исход операции в целом зависят от точности выбора дозировок и скорости ввода каждого из используемых препаратов.
Из имеющихся в продаже мониторов, оценивающих интенсивность боли, известен только ANI Monitor (Metrodoloris, France), основанный на анализе парасимпатического тонуса вегетативной нервной системы (ВНС). Однако только два показателя из табл. 1 (MAP и PR) косвенно указывают на боль, испытываемую пациентом.
Традиционный метод оценки уровня боли – отслеживание сердечного ритма и среднего артериального давления. Если эти показатели изменяются более чем на 20% через 5–7 мин, обычно делается вывод, что пациент ощущает боль. Однако чувствительность этого метода считается не очень высокой [11, 12]. Современные дозаторы, применяемые для ввода анальгетика, производят расчет текущей концентрации препарата в крови, используя алгоритмы, основанные на фармакокинетических и фармакодинамических моделях препаратов. Данный метод не позволяет с достаточной точностью оценить текущую концентрации препарата в крови. Вследствие чего, расчёт потребности в анальгетике нельзя считать оптимальным.
Цель данной работы – дальнейшее развитие методов объективной оценки и мониторинга глубины обезболивания, разработка системы реализации предложенного метода
1. СРАВНЕНИЕ СОВРЕМЕННЫХ МЕТОДОВ
Рассмотрим самые перспективные методы определения показателя боли (ПБ) при анестезии.
1. Анализ вариабельности сердечного ритма. Вариабельность сердечного ритма зависит от тонуса ВНС под влиянием болевых раздражителей или введения анальгетиков. На регуляцию сердечного ритма ВНС влияет дыхательный цикл. На вдохе временно подавляет парасимпатический эффект, вызывая ускорение сердечного ритма и уменьшая интервалы RR электрокардиограммы. На выдохе, напротив, стимулируется парасимпатический тонус, замедляя частоту сердечных сокращений, увеличивая интервал RR. Каждый дыхательный цикл сопровождается различиями парасимпатического тонуса – респираторной синусовой аритмией (RSA) [16–18]. При отсутствии болевого раздражителя и/или стресса только RSA влияет на серию интервалов RR. Поэтому анализируя изменчивость интервалов RR, можно определить текущий уровень ноцицепции – это основной показатель при расчете потребности в дозах анальгетика, в том числе в приведенном выше мониторе ANI. Основным недостатком этого метода является использование данных только о парасимпатическом компоненте ВНС, на который влияют другие физиологические факторы.
2. Анализ проводимости кожи (кожно-гальванической реакции, КГР). Оценка показателя боли и хирургического стресса возможна при измерении проводимости кожи (SC) в качестве меры эмоционального состояния или возбуждения. Как показано в [19], хирургическое напряжение вызывает симпатический нервный взрыв. В этом случае ладонные и подошвенные потовые железы заполняются, а SC увеличивается. Затем пот удаляется, а кожная проводимость уменьшается. Оценка спонтанных изменений SC и количества колебаний SC в секунду у пациента является достаточно эффективным методом [17, 20]. Устройство, реализующее его подробно, описано [21].
3. Метод плетизмографии. Оценка показателя боли (ПБ) с использованием плетизмографии приведена в [22]. Для пульсовой волны (PW) различают ряд характеристик (включая амплитуду и положение дикротической насечки, т.е. инцизурию). Затем они используются для расчета ПБ.
Основным недостатком методов 2 и 3 является использование данных только по симпатическому компоненту ВНС, на который также влияют другие физиологические факторы [16, 23].
4. Анализ мозговых ритмов боли. Подавление альфа и усиление гамма-ритмов ЭЭГ в значительной степени коррелируют с болевыми нагрузками [24–27]. Оценка ПБ производится на основе изменений спектральной мощности до и во время воздействия боли [28].
5. Многопараметрический подход. Существует несколько методов, в которых для оценки боли используются различные комбинации указанных выше параметров [29–31]. Например, Medasense Biometrics Ltd. (Израиль) [31] выпускает неинвазивный монитор для оценки ПБ. Устройство объединяет несколько физиологических параметров, включая частоту сердечных сокращений (ЧСС), вариабельность сердечного ритма, амплитуду волн фотоплетизмограммы, уровень проводимости кожи, их производных по времени для вычисления ПБ в реальном времени, называемого NOL (nociception level index). Четыре датчика (фотоплетизмограф, датчик кожно-гальванической реакции (КГР), датчик температуры и акселерометр) закреплены на пальце пациента. Данные с датчиков обрабатываются с использованием алгоритмов искусственного интеллекта. Болевая шкала индекса NOL варьируется от 0 (без боли) до 100 (невыносимая боль).
Эмпирический алгоритм расчета ПБ (индекса RN) был предложен в [29] для оценки ноцицепции, основанной на обработке сигнала ЭКГ, энтропии состояния (SE), энтропии ответа (RE), вариабельности сердечного ритма (HRV), фотоплетизмографии (PPG).
Авторы [30] разработали индекс хирургического стресса (SSI), который рассчитывали как сочетание нормализованного интервала сердцебиения и амплитуды пульсовой плетизмографической волны. Эти исследования показали, что комбинация нескольких параметров, связанных с ноцицепцией, позволяет более точно оценить состояние пациента во время операции. Однако каждый из рассмотренных комбинированных методов имеет свои ограничения. NOL не использует электрокардиограмму для анализа вариабельности сердечного ритма. Однако с помощью ЭКГ изменчивость интервала R–R можно отслеживать с высокой точностью, особенно когда речь идет о не очень сильном ноцицепторном эффекте или когда мы имеем дело с достаточной компенсацией с помощью анальгетиков. Кроме того, регистрация уровня проводимости и количества колебаний проводимости кожи наиболее эффективно измеряется на внутренней поверхности ладоней, а не на пальце. Индекс NOL также не учитывает артериальное давление. Тем не менее этот индекс показал хорошие экспериментальные результаты по оценке ноцицепции. Индексы RN и SSI не включают оценку уровня проводимости кожи.
Следовательно, необходимо разработать интегрированный показатель боли (ИПБ), позволяющий учитывать максимальное количество измеряемых и расчетных параметров для более точной оценки и прогнозирования уровня боли, испытываемой пациентом.
2. ТРЕБОВАНИЯ К СИСТЕМЕ ОЦЕНКИ ИНТЕГРАЛЬНОГО ИНДЕКСА БОЛИ
Основные принципы, используемые авторами для количественной оценки ИПБ: достижение максимальной точности измерений, неинвазивность, простота использования, мониторинг в режиме реального времени, возможность использования для пациентов разного возраста, инвариантность к анестезиологическому пособию. На основании анализа научных публикаций, результатов патентного поиска и обобщения опыта врачей-анестезиологов следует, что для расчета ИПБ можно использовать данные симпатической и парасимпатической составляющих ВНС, гемодинамики, спектральных характеристик пульсовой волны, ЭЭГ и ЭКГ.
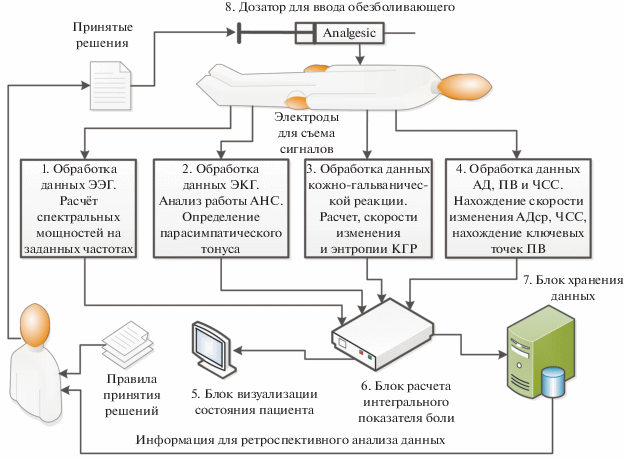
Спектральная мощность и энтропия дыхательного цикла рассчитываются по данным ЭКГ. Данные ЭЭГ используются для анализа спектральных мощностей в альфа- и гамма-диапазонах. На основании проводимости кожи (SC) рассчитывают скорость ее изменения и энтропию SC. Гемодинамические данные используются для расчета скорости изменения среднего артериального давления и частоты сердечных сокращений. Положение дикротической насечки рассчитывается по пульсовой волне (ПВ). На рис. 1 представлена функциональная блок-схема разработанной авторами автоматизированной системы измерения ИПБ.
Для реализации предлагаемого способа используются электроды для сбора данных ЭЭГ, ЭКГ, проводимости кожи (КГР) и пережимная манжета для измерения артериального давления. Данные с электродов ЭЭГ поступают в блок 1 для обработки (усиления, фильтрации, удаления артефактов) и расчета спектральных мощностей на заданных частотах.
Данные с ЭКГ электродов поступают в блок 2, где они усиливаются, фильтруются, удаляются артефакты и вычисляется парасимпатический тонус. В блоке 3 данные обрабатываются с электродов кожно-гальванической реакции (КГР), рассчитывается скорость изменения проводимости кожи и энтропия. Увеличение скорости обработки сигналов возможно благодаря использованию алгоритма параллельных вычислений [33].
В блоке 4 обрабатываются данные артериального давления, рассчитываются скорости изменения среднего артериального давления (САД), частоты сердечных сокращений (ЧСС), определяются ключевые точки пульсовой волны. В блоке 6 на основе данных, полученных из блоков 1–4 и соответствующих весовых коэффициентов для этих данных, выполняется вычисление интегрального индекса боли (ИПБ). Затем ИПБ передается в блок 5 для визуализации и в блок 7 – для записи и ретроспективного анализа. Анальгетик вводится через инфузионный дозатор. Скорость ввода используемого для обезболивания препарата рассчитывается в блоке 6 на основании полученного ИПБ, фармакокинетической и фармакодинамической моделей используемого анальгетика. Расчетная скорость ввода может быть скорректирована анестезиологом на основании текущих правил, рекомендаций, личного опыта. Наличие устройства, определяющего ИПБ, позволит оптимизировать действия анестезиолога.
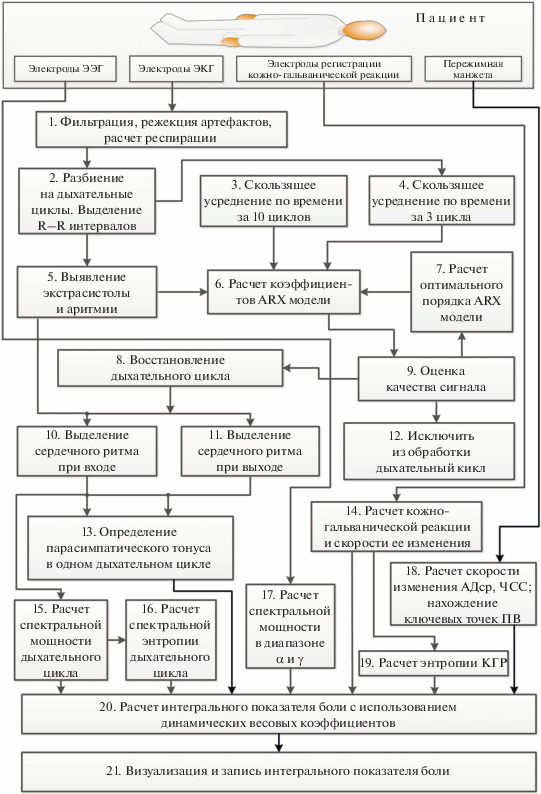
3. ПРИНЦИП РАБОТЫ БЛОКА ДЛЯ РАСЧЕТА ИНТЕГРАЛЬНОГО ПОКАЗАТЕЛЯ БОЛИ
На рис. 2 представлено обобщенное описание предлагаемой процедуры расчета ИПБ (см. рис. 1 блок 6) в виде функциональной блок-схемы. Данные с электродов электрокардиограммы поступают в узел 1 (см. рис. 2), где они фильтруются, отбраковываются артефакты и рассчитывается время респирации. В блоке 2 дыхательные циклы извлекаются из непрерывного сигнала ЭКГ с использованием данных респирации, а компонент QRS заменяется меткой, соответствующей зубцу R. В блоке 5 сигнал анализируется на наличие экстрасистол или аритмий. При их отсутствии получают данные о дыхательном цикле для выделения частоты сердечных сокращений при вдохе (блок 10) и выдохе (блок 11). Если в дыхательном цикле имеются аритмии или экстрасистолы, сигнал подвергается реконструкции. Для этого используются блоки 3, 4, 6, 7, 9. Затем сигнал в “восстановленной” форме попадает в блок 8, где ему присваивается метка – “показатель качества”. Когда сигнал восстанавливается, экстрасистолия устраняется и маркер R “устанавливается” в рассчитанном месте. При этом критерий качества сигнала уменьшается. Модель ARX используется для расчета места установки маркера R (блок 6). На его входы поступают усредненные данные из блоков 3 и 4 за последние десять и три дыхательных цикла соответственно. В блоке 7 порядок модели ARX корректируется на основе минимальной ошибки моделирования. Если “показатель качества” опускается ниже заданного, то дыхательный цикл исключается из обработки (блок 12), поскольку модель ARX не может предсказать элементы этого цикла с приемлемым качеством. Определение парасимпатического тонуса происходит в блоке 13 – на основании данных о ЧСС при вдохе и выдохе. В блоке 15 вычисляется спектральная мощность сигнала на частотах вдоха и выдоха. В блоке 16 выполняется расчет спектральной энтропии, оценивается сложность сигнала. Например, сигнал, который периодически чередуется между двумя фиксированными амплитудами, полностью предсказуем и имеет значение энтропии “0”. Вместе с тем сигнал, который генерируется некоторым случайным процессом, имеет большую сложность и большую энтропию. И тогда энтропия не зависит от абсолютной шкалы измеряемой величины (амплитуды и частоты). Кроме того, использование энтропии позволяет обнаруживать нелинейные характеристики сигнала [33, 34].
Данные с электродов ЭЭГ поступают в блок 17, где спектральная мощность рассчитывается в альфа- и гамма-диапазонах. Результаты передаются в блок 20, где для них определяются весовые коэффициенты.
Электроды для определения проводимости кожи (кожно-гальванической реакции КГР) с частотой до 200 Гц устанавливаются на ладони пациента. В блоке 14 производится расчет проводимости кожи и скорости ее изменения. В блоке 19 производится расчет энтропии КГР.
В блоке 18 выполняется вычисление скоростей изменения среднего артериального давления, частоты сердечных сокращений, характеристик пульсовой волны (определяем положение дикротической насечки). Далее эти данные поступают в блок 20, где они используются для вычисления ИПБ с учетом динамически изменяющихся весов. Их максимальные значения будут при сердечной патологии и значительной аритмии.
ИПБ рассчитывается в блоке 20. Для обработки сигнала могут использоваться методы линейной или логистической регрессии, нечеткой логики, нейронных сетей или гибридные методы (комбинации перечисленных выше). Расчет выполняется с использованием весовых коэффициентов и абсолютных значений спектральной мощности дыхательного цикла (блок 15), спектральной энтропии (блок 16), спектральных характеристик ЭЭГ (блок 17), КГР и скорости ее изменения (блок 14), энтропии КГР (блок 19), данных о скорости изменения АДср, ЧСС и характеристик ПВ. Блок 21 используется для визуализации, записи данных, построения тенденции динамики изменения во времени в ИПБ.
4. РЕАЛИЗАЦИЯ АВТОМАТИЗИРОВАННОЙ СИСТЕМЫ ИЗМЕРЕНИЯ ИНТЕГРАЛЬНОГО ПОКАЗАТЕЛЯ БОЛИ
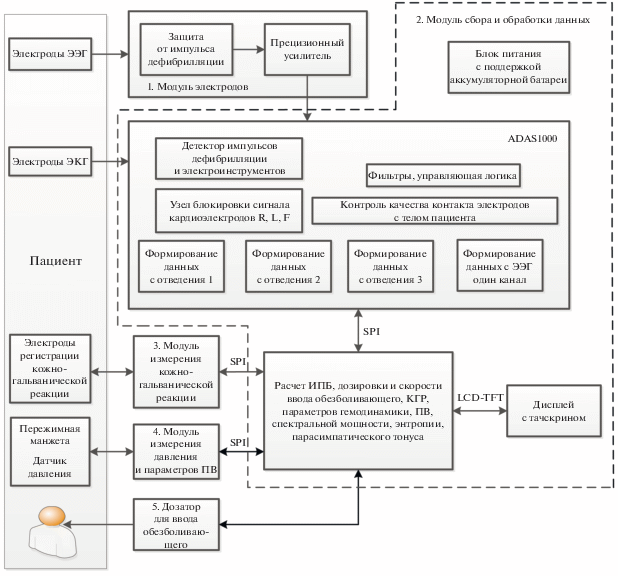
Функциональная схема реализации автоматизированной системы измерения интегрального показателя боли представлена на рис. 3. Система имеет модульную структуру и состоит из четырех модулей: модуля электродов, модуля сбора и обработки данных, модуля измерения кожно-гальванической реакции, модуля измерения давления и параметров ПВ.
Модуль электродов предназначен для решения двух задач. Первая – усиление ЭЭГ-сигнала (одно отведение) с единиц микровольт до десятка милливольт. Вторая задача модуля – увеличить длину кабеля отведения (для удобства работ) и уменьшить его емкостную составляющую. Модуль выполнен на двухканальном инструментальном прецизионном усилителе ADA4528–2. Архитектура ADA4528–2 предназначена специально для задач прецизионного усиления сигналов с высоким коэффициентом усиления, в которых требуется точность и стабильность показателей по постоянному току или на низких частотах. Также в модуле электродов предусмотрена защита от импульсов дефибрилляции.
Модуль сбора и обработки данных (см. рис. 3 блок 2 обозначен пунктирной линией), состоит из микросхемы ADAS1000, микроконтроллера STM32F429ZIT6, ЖК-дисплея с тачскрином SF-TC240T-9370A-T и блока питания. Этот модуль осуществляет расчет ИПБ, дозировки и скорости ввода обезболивающего, на основании данных о КГР, параметров гемодинамики, ПВ, спектральной мощности, энтропии, парасимпатического тонуса.
Электрокардиограф, входящий в состав модуля, построен по классическому принципу с тремя общепринятыми стандартными отведениями. Для обработки данных ЭКГ используется специализированная микросхема компании Analog Devices ADAS1000.
Микроконтроллер STM32F429ZIT6 решает следующие задачи: обработка данных ЭКГ, обработка данных, поступающих в модуль через интерфейс SPI с модулей измерения кожно-гальванической реакции (см. рис. 3 блок 3) и модуля измерения давления и параметров ПВ (см. рис. 3 блок 4), обработка данных ЭЭГ, поступающих с модуля электродов. Модулем сбора и обработки данных решается задача управления дозатором (см. рис. 3 блок 5) используемым для ввода обезболивающего, для чего реализован оптоизолированный канал последовательной передачи данных. Ввод–вывод данных осуществляется с помощью ЖК-дисплея с тачскрином SF-TC240T-9370A-T TFT 2.41дюйма с разрешением 262 тыс. цветов QVGA (240 × 320 точек). Дисплей включает в себя ЖК-контроллер ILI9341. Он напрямую управляется STM32F429ZIT6 с использованием протокола RGB.
Архитектура ADAS1000 обеспечивает высокое соотношение сигнал/шум, хорошую линейность и низкую рассеиваемую мощность, а также первичную обработку данных – усреднение выборок, фильтрацию и передачу данных по интерфейсу SPI. При проведении исследований ЭКГ очень важно вовремя обнаружить нарушение контакта электродов с телом пациента. ADAS1000 поддерживает два метода определения нарушения контакта – по переменному или постоянному току, а также позволяет использовать одновременно оба метода. ADAS1000 предоставляет возможность контролировать частоту дыхания пациента на основе анализа изменения сопротивления грудной клетки, для чего через электроды пропускают высокочастотный ток и измеряют падение напряжения. Критериями использования данной микросхемы послужило: a) упрощение схемотехники модуля, б) качественные показатели оцифровки сигналов (использование 20-битного аналого-цифрового преобразователя (АЦП)), в) встроенный алгоритм определения респирации, г) возможность определения наличия кардиостимулятора, д) встроенные фильтры, е) определение контакта электрода c телом пациента.
Модуль сбора и обработки данных содержит блок питания, осуществляющий питание всех модулей. Встроенной литий-ионной батареи достаточно для поддержания работы системы в течение 60 мин.
Модуль измерения кожно-гальванической реакции построен на базе микроконтроллера STM32F103. Он состоит из источника образцового переменного напряжения, усилителя переменного напряжения и АЦП, который встроен в микроконтроллер. Измерение производится на частоте 200 Гц. Электроды для определения кожно-гальванической реакции закрепляются на ладони пациента. Можно использовать одноразовые ЭКГ-электроды. Результаты измерения по протоколу SPI передаются в модуль сбора и обработки информации.
Модуль измерения давления и параметров пульсовой волны (см. рис. 3 блок 4) построен на базе микроконтроллера STM32F103. Модуль осуществляет усиление и фильтрацию сигналов с датчика давления (использован датчик BPM pressure sensor MPX2053GP), управление клапаном и насосом, нагнетающим давление в манжету. Этот модуль также производит оценку и при необходимости корректировку линейности при нагнетании и спуске давления в манжете. Авторами разработан модернизированный осциллометрический способ измерения артериального давления, который позволяет измерять давление как на подъеме (при нагнетании давления в манжете), так и на спуске, нагнетать в манжету давление до среднего артериального, а не до систолического (систолическое давление рассчитывается). Это дает следующие преимущества: комфорт пациента, связанный с пониженным давлением в манжете; повышение точности и возможности расчета целого спектра гемодинамических параметров, характеристик ПВ и возможность определения положения дикротической насечки; уменьшение нагрузки на сосуды, вследствие чего следующее измерение можно проводить раньше (сокращается время релаксации сосудов). Результаты измерения по протоколу SPI передаются модулю сбора и обработки информации.
5. РЕЗУЛЬТАТЫ ПРЕДВАРИТЕЛЬНЫХ КЛИНИЧЕСКИХ ИСПЫТАНИЙ
Предлагаемый метод расчета ИПБ получил положительное заключение комитета по этике Астраханского государственного медицинского университета Министерства здравоохранения Российской Федерации (выписка из протокола заседания комитета по этике № 5 ноября 6, 2018) и прошел предварительные клинические испытания в отделении анестезиологии и реаниматологии при Александро-Мариинской областной клинической больнице (Астрахань, Россия). Авторами получен патент на изобретение “Способ комплексной оценки и визуализации состояния пациента во время седации и общей анестезии” [35].
Ниже приведены результаты оценки ИПБ предложенным методом во время проведения плановой лапароскопической холецистэктомии. Было проведено 27 операций (исследований). Отобраны 27 пациентов, назначенных на плановую лапароскопическую холецистэктомию: 17 пациентов мужчин в возрасте от 20 до 52 лет и 10 женщин в возрасте от 25 до 42 лет. От пациентов было получено письменное информированное согласие на участие в клиническом исследовании.
В операционной для контроля показаний, полученных предлагаемым методом оценки уровня ноцицепции во время общей анестезии, использовались следующие приборы: монитор Mindray iMEC 12 (для мониторинга гемодинамических параметров и транспорта кислорода), монитор слуховых вызванных потенциалов AEPTM (для контроля уровня седации).
Уровень боли регистрировался тремя способами:
– по предлагаемому методу определения ИПБ;
– на клинической основе при постоянной регистрации периферической гемодинамики с помощью монитора Mindray iMEC 12;
– на лабораторном уровне при определении уровня кортизола в сыворотке крови (нмоль/л) методом иммуноферментного анализа, с использованием универсального автоматического фотометра BioTek ELx800 (BioTekInstruments Inc., США) и набора реагентов (Вектор-Бест, Россия) для иммуноферментного определения концентрации кортизола в сыворотке крови. Чувствительность: 5 нмоль/л. Диапазон измерений: 0…1200 нмоль/л.
Мониторинг проводился на шести этапах: I – до седации; II – после седации; III – во время индукции анестезии и интубации трахеи; IV – на травматическом этапе хирургической операции; V – в конце операции; VI – через 30 мин после завершения операции.
По данным Mindray iMEC 12 на травматическом этапе хирургического вмешательства повышение среднего артериального давления и частоты сердечных сокращений регистрировалось в диапазоне 10…15%. Наиболее выраженный гемодинамический ответ наступал через 5–8 мин после максимального ноцицептивного воздействия.
Авторы проанализировали уровень кортизола в сыворотке крови (нмоль/л) пациента и сравнили эти значения с полученными результатами измерения ИПБ. Результаты сравнения приведены в табл. 2. Анализируя эти данные, можно сделать вывод, что адекватная оценка болевого индекса вполне достигается предлагаемым способом. Следует отметить, что изменение IPI происходит через 30–40 с после ноцицептивного воздействия, что позволяет анестезиологу ускорить принятие решения об оптимальной дозировке анестезиологической поддержки.
ЗАКЛЮЧЕНИЕ
На основе анализа современных подходов к определению уровня ноцицепции при общей анестезии был получен оптимальный набор контролируемых и рассчитанных параметров. Было показано, что при расчете уровня ноцицепции ИПБ следует учитывать следующее: состояние вегетативной нервной системы (парасимпатические и симпатические компоненты, полученные из анализа ЭКГ); данные о спектральной мощности ЭЭГ в альфа- и гамма-диапазонах; скорость изменения КГР и ее энтропию; параметры пульсовой волны (положение дикротической насечки); скорость изменения среднего артериального давления и количество сердечных сокращений.
Предложенный авторами метод оценки уровня ноцицепции позволяет объективно оценить текущий уровень боли, испытываемый пациентом, что в свою очередь, дает возможность анестезиологу определить потребность пациента в анальгетике, выбрать его оптимальную дозировку и скорость введения, обеспечив тем самым адекватную защиту пациента от хирургической агрессии. По результатам ретроспективного анализа данных анестезиолог может оценить фармакокинетические и фармакодинамические свойства используемых препаратов.
Список литературы
Sebel P.S., Bowdle T.A., Ghoneim M.M. et al. // Anesth. Analg. 2004. V. 99. P. 833.
Jeanne M., Logier R., De Jonckheere J., Tavernier B. // Proc. Int. Annual Conf. IEEE Eng. Med. Biol. Soc. Minneapolis. 3–6 Sept. 2009. N.Y.: IEEE, 2009. P. 1840.
Kaul H.L., Bharti N. // Indian J. Anaesth. 2002. V. 46(4). P. 323.
Shih M., Doctor F., Fan S. et al. // Entropy. 2015. V. 17. P. 928.
Huang N.E., Shen Z., Long S.R. et al. // Proc. R. Soc. Lond. 1998. V. 454. P. 903.
Wu M.C., Huang N.E. // Advanced Biosignal Processing. Berlin: Springer, 2009. P. 335.
Myles P.S. // Best Pract. Res. Clin. Anaesthesiol. 2007. V. 21. P. 345.
Heyse B., Van Ooteghem B., Wyler B. et al. // Acta Anaesthesiol. Belg. 2009. V. 60. P. 19.
Palanca B.J., Mashour G.A., Avidan M.S. // Curr. Opin. Anaesthesiol. 2009. V. 22. P. 553.
Chumachenko E.D. // Clinical Anesthesiology & Intensive Care. 2014. V. 2(4). P. 91.
Zbinden A.M., Petersen-Felix S., Thomson D.A. // Anesthesiology. 1994. V. 80. P. 261.
Luginbühl M., Yppärilä-Wolters H., Rüfenacht M. et al. // Br. J. Anaesth. 2007. V. 98. P. 728.
Aloula P., Jantti V., Yli-Hankala A. // Int. J. Clin Monit. Comput. 1997. V. 14. P. 241.
De Jonckheere J., Rommel D., Nandrino J. L. et al. // Proc. Int. Annual Conf. IEEE Eng. Med. Biol. Soc. San Diego. 28 Aug.–1 Sept. 2012. N.Y.: IEEE, 2012. P. 3432.
Palanca B.J., Mashour G.A., Avidan M.S. // Curr. Opin. Anaesthesiol. 2009. V. 22. P. 553.
Jeanne M., Logier R., De Jonckheere J., Tavernier B. // Auton. Neurosci. 2009. V. 147. P. 91.
Ledowski T., Pascoe E., Ang B. et al. // Anaesthesia. 2010. V. 65. № 10. P. 1001.
Logier R., Jeanne M., De Jonckheere J. et al. // Proc. Annual Int. Conf. IEEE Eng. Med. Biol. Soc. Buenos Aires. 31 Aug–4 Sept. 2010. N.Y.: IEEE, 2010. P. 1194.
Storm H., Myre K., Rostrup M.O. et al. // Acta Anaesthesiol. Scand. 2002. V. 46. P. 887.
Storm H., Shafiei M., Myre K., Raeder J. // Acta Anaesthesiol. Scand. 2005. V. 49. P. 798.
Storm H. Apparatus and method for monitoring skin conductance and method for controlling a warning signal. US Pat. № 6571124 B1. Date of Pat.: May 27, 2003.
Huiku M.V.T., Korhonen I., van Giles M.J. et al. Method and an apparatus for pulse plethysmograph based detection of nociception during anesthesia or sedation. US Par. № 2005/0143665 A1. Pub. Date: Jun. 30, 2005.
Logier R., De Jonckheere J., Delecroix M. et al. // Conf. Proc. IEEE Eng. Med. Biol. Soc. 2011. 3776-9.
Mouraux J., Guerit M., Plaghki L. // Clin. Neurophysiol. 2003. V. 114. P. 710.
Gross J., Schnitzler A., Timmermann L., Ploner M. // PLoS biology. 2005. V. 5. e133.
Zhang Z.G., Hu L., Hung Y.S., Mouraux A. // J. Neurosci. 2012. V. 32. P. 7429.
Babiloni C., Brancucci A., Del Percio C. et al. // J. Pain. 2006. V. 7. P. 709.
Peng W., Hu L. S., Zhang Z., Hu Y. // PloS One. 2014. V. 9(3). e91052.
Rantanen M., Yli-Hankala A., Van Gils M. et al. // Br. J. Anaesth. 2006. V. 96. P. 367.
Huiku M., Uutela K., Van Gils M. et al. // Br. J. Anaesth. 2007. V. 98. P. 447.
Ben-Israel N., Kliger M., Zuckerman G. et al. // J. Clin. Monit. Comput. 2013. V. 27. P. 659.
Barabanov I., Barabanova E., Maltseva N., Kvyatkovskaya I. // CCIS. 2014. V. 466. P. 61.
Paluš M. // Contemp. Phys. 2007. V. 48. P. 307.
Paluš M., Vejmelka M. // Phys. Rev. E. 2007. V. 75. № 5. P. 056211.
Сокольский В.М., Петрова И.Ю., Китиашвили И.З. и др. Способ комплексной оценки и визуализации состояния пациента во время седации и общей анестезии // Пат. РФ RU 2718544. Опубл. офиц. бюл. “Изобретения. Полезные модели”. № 10 от 08.04.2020 г.
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника