Радиотехника и электроника, 2020, T. 65, № 7, стр. 717-724
Исследование динамических процессов в биологических системах методами акустооптической видеоспектрометрии
А. Б. Бурлаков a, Д. Д. Хохлов b, А. С. Мачихин b, *, С. А. Титов b, В. А. Ломонов c, А. В. Виноградов c
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Российская Федерация
b Научно-технологический центр уникального приборостроения РАН
117342 Москва, ул. Бутлерова, 15, Российская Федерация
c ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Ленинский просп., 59, Российская Федерация
* E-mail: machikhin@ntcup.ru
Поступила в редакцию 07.11.2019
После доработки 15.11.2019
Принята к публикации 20.11.2019
Аннотация
Представлен разработанный измерительный стенд на основе микроскопа проходящего света с возможностью двойной акустооптической монохроматизации излучения, позволяющий регистрировать спектральные изображения высокого качества размером 1920 × 1200 пикселей в видимом диапазоне длин волн со спектральным разрешением 2.5 нм (на длине волны 632 нм). Продемонстрирована эффективность данного подхода и разработанного стенда на примере исследования эмбрионов вьюна Misgurnus fossilis при переходе с 32-й на 33-ю стадию их развития. Корректность полученных выводов подтверждена сравнением с результатами сопутствующего ультразвукового исследования. Проведен анализ временных зависимостей спектров пропускания шести различных пространственных областей эмбриона, в числе которых перивителлиновое пространство, головной и хвостовой отделы. Установлено, что данные зависимости имеют существенно различающийся характер и, в частности, могут быть использованы для неинвазивного контроля и анализа изменения функционального состояния эмбрионов при переходе с одной стадии развития на другую.
ВВЕДЕНИЕ
В настоящее время исследованию фундаментальных механизмов биологии развития посвящены многочисленные работы, поскольку изменения, происходящие в процессе развития от момента оплодотворения яйцеклетки до взрослого многоклеточного организма, делают актуальными множество вопросов, связанных с формированием сложнейшей многоуровневой постоянно усложняющейся системы. Широкое использование эмбрионов костистых рыб в токсикологических исследованиях подтверждает их значительный потенциал в качестве модельных объектов биологии развития и исследований функций генов позвоночных [1–3].
Использование эмбриональной модели при разнообразных исследованиях весьма перспективно, поскольку дает возможность анализировать функциональные особенности различных стадий (особенно начальных) эмбриогенеза, когда на коротком промежутке времени сосредоточено множество процессов, определяющих дальнейшую жизнедеятельность организмов (активное деление клеток, дифференцировка, морфогенез) [4, 5]. При этом даже самое незначительное воздействие на ранних этапах развития может повлечь за собой проявление различных отсроченных эффектов. Кроме того, эмбриональные модели имеют уникальные преимущества для исследования сохранности полноты генетической информации, которая может быть обнаружена только в раннем онтогенезе, так как многие важнейшие для сохранения популяции гены экспрессируются именно в этот период, а на начальном этапе эмбриогенеза происходит закономерная смена регуляционных механизмов генной экспрессии. Для плодотворного исследования этих процессов, прежде всего, необходимы методы, позволяющие не нарушать жизнедеятельность живой постоянно усложняющейся биологической системы.
Ранее было показано, что значения окислительно-восстановительного потенциала, измеренные в воде на расстоянии 1…2 см от эмбрионов, четко коррелируют с процессами, происходящими в эмбрионе в процессе развития [6]. Это интегральный показатель, не дающий информации о пространственном распределении свойств и изменении структурно-функциональных перестроек, происходящих в эмбрионе в процессе развития. Для решения таких задач нужно использовать только прижизненные неинвазивные методы исследования. Одним из таких методов, позволяющих не нарушать жизнедеятельность живой постоянно усложняющейся биологической системы, является спектроскопия. Спектральные свойства эмбрионов существенно меняются под действием внешнего излучения, а контроль этих свойств может служить индикатором состояния и стадии развития [7, 8].
Развитием данных методов может стать видеоспектрометрия, позволяющая получать информацию о спектральных свойствах всех элементов эмбриона с высоким пространственным разрешением. Перспективным представляется использование видеоспектрометров на основе акустооптических (АО) перестраиваемых фильтров, обладающих высокой скоростью перестройки и допускающих произвольную спектральную адресацию. Ранее мы показали, что такой подход может быть использован для обнаружения гетерогенности внутри желтка у вьюна Misgurnus fossilis – рыбы, являющейся модельным объектом [9, 10]. Поскольку развитие эмбрионов вьюна происходит вне материнского организма во внешней среде, а защитные оболочки прозрачны в видимом диапазоне электромагнитных волн, наблюдение структурных преобразований может производиться с использованием оптических методов.
Цель данной работы – дальнейшее развитие описанного подхода. На примере вьюна Misgurnus fossilis показана эффективность метода при анализе процессов, проходящих в других структурах зародыша.
1. ЭКСПЕРИМЕНТАЛЬНЫЙ СТЕНД
Спектральная АО-фильтрация основана на анизотропной дифракции светового пучка на фазовой дифракционной решетке, образованной в кристалле распространяющейся в АО-ячейке акустической волной [11]. АО-фильтрация имеет две особенности, которые используются для селекции излучения. Первая – “резонансный” характер спектральной зависимости, при котором длина волны излучения λ, попадающего в резонанс (синхронизм), определяется периодом решетки Λ, т.е. частотой звука f:
(1)
$\lambda ~\sim {{(V\Delta n)} \mathord{\left/ {\vphantom {{(V\Delta n)} f}} \right. \kern-0em} f},$где V – скорость ультразвука, ∆n = ne – no, ne и no – показатели преломления кристалла для необыкновенно и обыкновенно поляризованных волн. Вторая – изменение направления поляризации и направления распространения дифрагированной световой волны $\left| {{{{\vec {k}}}_{d}}} \right| = {{2\pi {{n}_{e}}} \mathord{\left/ {\vphantom {{2\pi {{n}_{e}}} \lambda }} \right. \kern-0em} \lambda }$, что позволяет выделять ее поляризатором. Поэтому АО-фильтр, как правило, состоит из АО-ячейки и пары скрещенных поляризаторов. Излучение $\left| {{{{\vec {k}}}_{i}}} \right| = {{2\pi {{n}_{o}}} \mathord{\left/ {\vphantom {{2\pi {{n}_{o}}} \lambda }} \right. \kern-0em} \lambda }$ с длиной волны λ, выделенное входным поляризатором и удовлетворяющее условию Брэгга ${{\vec {k}}_{d}} = {{\vec {k}}_{i}} + \vec {q},$ дифрагирует на акустической волне $\left| {\vec {q}} \right| = {{2\pi } \mathord{\left/ {\vphantom {{2\pi } {\Lambda }}} \right. \kern-0em} {\Lambda }}$ в АО-ячейке с изменением плоскости линейной поляризации на ортогональную (о → е или е → о) и отклонением направления распространения согласно [11]:
(2)
${{\theta }_{d}} = \frac{{\lambda f}}{{2{{n}_{o}}V}}\left( {1 - \frac{{{{V}^{2}}\left( {{{n}^{2}}\left( {{{\theta }_{{\text{B}}}}} \right) - n_{o}^{2}} \right)}}{{{{\lambda }^{2}}{{f}^{2}}}}} \right),$где θB – угол Брэгга. Недифрагированное излучение задерживается выходным поляризатором [12].
Аберрационные пространственно-спектральные искажения изображения, присущие АО-ячейкам [13], представляющие проблему для корректного сопоставления регистрируемых спектральных изображений и получения спектров в разных точках изображения, практически полностью компенсируются за счет последовательной фильтрации двумя идентичными АО-ячейками, развернутыми примерно на 180° и фильтрующих излучение различной поляризации [14].
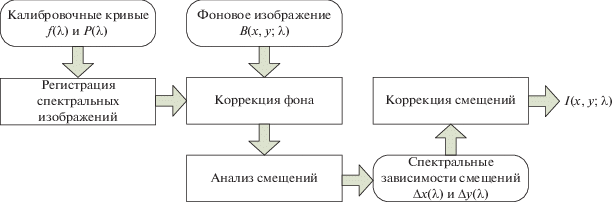
Получение спектральных изображений микрообъектов является одним из основных применений перестраиваемых АО-фильтров [15–17]. Они используются для контрастной визуализации, флуоресцентной и рамановской спектроскопии, подчеркивания границ объектов и других задач. Как правило, для реализации режима спектральной визуализации АО-фильтр устанавливается в канал фото/видеорегистрации тринокулярного светового микроскопа [15]. Это наиболее удобное место, так как при этом не требуется изменения конструкции микроскопа и сохраняется возможность привычного наблюдения через окуляры. Такая концепция не позволяет реализовать одновременно два (широкополосный и спектральный) канала с обеспечением идентичных условий наблюдения (поле зрения, фокусировка и пр.), т.е. введения дополнительной оптической системы для их сопряжения. Поэтому была предложена иная концепция съемного видеоспектрометрического АО-модуля – размещение его между станиной и окулярной насадкой микроскопа. В этом случае сохраняются и используются все составные части микроскопа, включая цветную видеокамеру, и остается достаточно места для размещения сопрягающей ОС и видеоспектрометра даже на основе двойного АО-монохроматора, имеющего большую длину [16] (рис. 1).
Рис. 1.
Схема (а) и внешний вид (б) экспериментального стенда: 1 – широкополосный источник света, 2 – линза, 3 – полевая диафрагма, 4 – зеркало, 5 – апертурная диафрагма; 6 – конденсор; 7 – столик, 8 – исследуемый объект, 9 – микрообъектив, 10 – светоделитель куб, 11 – сопрягающая система, 12, 14, 16 – скрещенные поляризаторы, 13, 15 – идентичные АО ячейки, 17, 19 – объективы, 18 – монохромная видеокамера, 20 – цветная камера, 21 – блок управления, 22 – ПК.
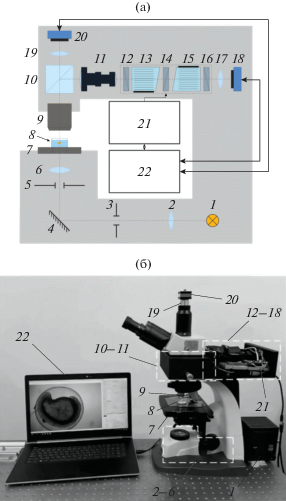
Излучение от широкополосного источника 1 с помощью системы Келера, включающей линзовые компоненты 2 и 6, зеркало 4, полевую 3 и апертурную 5 диафрагму, фокусируется на объекте 8, расположенном на предметном столе 7. После прохождения света через исследуемый объект его изображение формируется микрообъективом 9. Элементы 1–9 представляют собой тринокулярный микроскоп проходящего света.
Часть широкополосного излучения отводится светоделителем 10 в видеоспектрометрический модуль. Остальное излучение фокусируется объективом 19 на матрице цветной видеокамеры 20. Видеоспектрометрический модуль состоит из последовательно расположенных сопрягающей оптической системы 11, поляризаторов 12, 14 и 15, расположенных между ними АО-ячеек 13 и 15, объектива 17 и монохромной видеокамеры 18. Таким образом, данный стенд наряду с визуальным наблюдением образца позволяет регистрировать широкополосное (цветное) изображение и серии спектральных монохромных изображений, необходимые для получения спектров пропускания в каждом пикселе. Сопрягающая система 11 необходима для обеспечения высококачественного изображения при работе микроскопа с микрообъективами с увеличением в диапазоне 4…20 крат [18]. Чтобы обеспечить возможность работы модуля с микрообъективами различного увеличения, в качестве объектива 17 используется вариофокальный объектив. АО-фильтр содержит две идентичные широкоугольные АО-ячейки из TeO2 с углом среза γ = 6°. Диапазон перестройки по спектру составляет 500…750 нм, спектральное разрешение 2.5 нм (на длине волны 632 нм). Управление видеокамерой 18 и АО-ячейками 13 и 15 осуществляется с помощью ПК через единый интерфейс USB.
Для измерения спектральной зависимости I(λ) в каждом пикселе x,y-изображения необходимо обеспечить воспроизводимость значений длины волны λ, интенсивности I и координат x,y. Поэтому необходимо осуществлять спектральную, амплитудную и пространственную коррекцию [19] (рис. 2).
Спектральная калибровка осуществляется с помощью поверенного спектрометра. Результатом проведения спектральной калибровки является зависимость выделяемой длины волны λ от частоты ультразвука f, подаваемой на пьезопреобразователи АО ячеек, и от оптимальной акустической мощности P. Эта процедура позволяет получить перестроечную кривую f(λ) АО-монохроматора и скорректировать неравномерность его дифракционной эффективности η по спектру [11]:
(3)
$\eta \left( \lambda \right) \sim {\text{sin}}{{{\text{c}}}^{2}}\left( {\frac{{\Delta k\left( \lambda \right)l}}{{2\pi }}} \right),$где Δk(λ) – волновая расстройка, l – длина акустооптического взаимодействия.
Амплитудная калибровка необходима для коррекции неоднородности освещения и виньетирования, она заключается в съемке серии спектральных изображений фона B(x, y; λ), на которые в процессе коррекции делятся изображения исследуемого объекта.
Смещения Δx(λ) и Δy(λ) благодаря двойной АО-монохроматизации возникают лишь за счет движения эмбриона в процессе исследования и устраняются с помощью корреляционных методов. Только после применения коррекции всех трех указанных факторов могут быть получены спектральные изображения I(x, y; λ), по которым можно вычислять спектральные зависимости I(λ) в произвольных пикселях.
2. ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Эксперименты проводились на эмбрионе вьюна Misgurnus fossilis – классическом объекте биологии развития [9]. Самок, отловленных из природы, содержали в холодильнике при температуре 4…5°С. Для ускорения созревания самок применяли гормональную стимуляцию хорионическим гонадотропином при комнатной температуре, получение половых продуктов и искусственное осеменение проводили по стандартной методике. Оплодотворенные яйцеклетки тщательно промывали двумя порциями свежей воды. После этого часть зародышей (200 штук) размещали в термостате с температурой 17°С. Стадии развития определяли по таблицам нормального развития вьюна [9]. Эмбрионы 32‑й стадии развития тщательно промывали двумя порциями свежей воды, и последовательно каждый из них помещали в рабочую области АО-видеоспектрометра. Примерно в течение 1 часа с интервалом в 1 минуту проводили регистрацию изображений развивающегося эмбриона во время его перехода на 33-ю стадию развития.
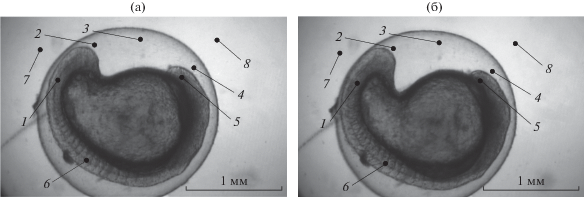
Для оценки однородности функционального состояния эмбриона вьюна были выделены шесть его локальных зон, а для коррекции неоднородности фона – две зоны вне икринки (рис. 3).
Рис. 3.
Спектральные изображения (на длине волны 532 нм) эмбриона в начале эксперимента на 32-й стадии развития (а) и в конце эксперимента на 33-й стадии развития (б): 1 – недифференцированные сомиты, 2 – перивителлиновое пространство рядом с хвостовым отделом, 3 – перивителлиновое пространство, свободно расположенное над желтком в центральной его части, 4 – перивителлиновое пространство рядом с головным отделом, 5 – головной отдел, 6 – дифференцированные сомиты, 7 и 8 – области вне икринки.
Одновременно с АО-видеспектрометрией проводилось исследование зародышей апробированным в эмбриологии ультразвуковым методом, являющимся также неинвазивным и позволяющим визуализировать пространственное распределение упруго-вязкостных свойств объекта [20]. Для ультразвуковой визуализации вьюна был использован высокочастотный ультразвуковой сканер с одиночным фокусирующим приемо-передающим преобразователем. Преобразователь излучает импульсную ультразвуковую волну, которая распространяется через иммерсионную среду с погруженным в нее объектом и фокусируется внутри него. Волна, рассеянная акустическими неоднородностями объекта, распространяется в обратном направлении и принимается тем же преобразователем. В приборе осуществляется растровое механическое сканирование преобразователя по поперечным координатам [21, 22]. В данной работе использовался фокусирующий ультразвуковой преобразователь с центральной частотой 50 МГц, относительной полосой частот 50% и полной угловой апертурой 40°. В соответствии с классическим критерием [23] поперечная разрешающая способность конфокальной системы формирования изображений с данными параметрами может быть оценена на уровне 30 мкм. Продольная разрешающая способность определяется длительностью ультразвукового импульса и составляет примерно 20 мкм.
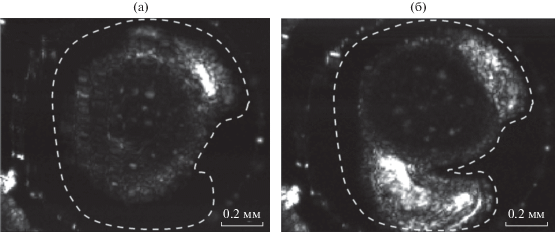
Примеры ультразвуковых изображений эмбриона вьюна представлены на рис. 4. Икринку помещали в иммерсионную ячейку ультразвукового сканера, наполненную природной водой. Для построения изображения записанный сигнал подвергали преобразованию Гильберта по временной переменной, и определяли его огибающую. Затем находили максимальное значение огибающей во временных воротах, и оно отображалось в зависимости от поперечных координат. Положение временных ворот соответствовало сигналам, приходящим из фокальной области преобразователя, а их длительность позволяла наблюдать на изображениях неоднородности, расположенные в слое толщиной 400 мкм. Ультразвуковой метод обеспечивает отчетливое наблюдение изменения структуры органов по мере развития эмбриона, в частности, рост хвостовой части и его отделение от желтка. Эти особенности характерны именно для 32–33-й стадий развития эмбриона вьюна.
Рис. 4.
Пример ультразвукового изображения эмбриона в начале эксперимента на 32-й стадии развития (а) и в конце эксперимента на 33-й стадии развития (б).
Ультразвуковой метод был использован в качестве дополнения к АО-видеоспектрометрии с целью подтверждения наличия объемных структурных преобразований, обнаруживаемых по изменению спектров пропускания и являющихся следствием биохимических процессов, происходящих на этих и более ранних стадиях развития [9].
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
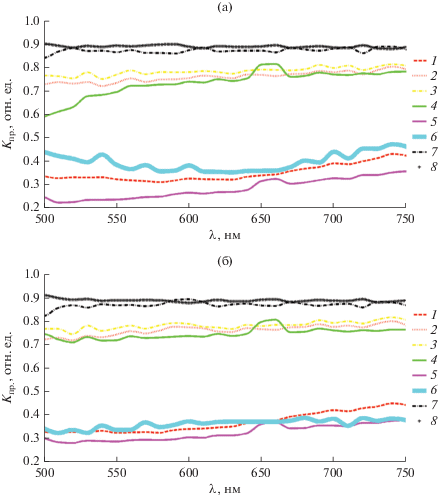
На рис. 5 приведены нормированные спектры пропускания областей эмбриона, отмеченных на рис. 3, в начале (на 32-й стадии развития) и в конце (на 33-й стадии развития) эксперимента (в течение часового мониторинга). Именно в этот период в туловищной мезодерме наблюдается увеличение с 24 до 25…26 пар туловищных сомитов. Зародыш увеличивается в длину и хвостовой отдел начинает обособляться от туловищного отдела. Желток продолжает активно менять форму и становится более грушевидным, при этом наблюдается активное перемещение желточных гранул из хвостовой области в более центральные. В головном отделе зародыша начинается инвагинация передней стенки глазного бокала и происходит образование хрусталиковых плакод. Особо необходимо отметить, что если на 32-й стадии развития зародыш был еще неподвижен, то уже на 33-й стадии наблюдается начало движений у зародыша. При переходе от 32-й к 33-й стадии развития наблюдаются определенные изменения как в структуре головного, так и хвостового отделов зародыша, что видно из ультразвуковых изображений. Ранее нами было показано, что и в желточном мешке хорошо виден маркированный переход с 32-й на 33-ю стадию развития на 30-й минуте наблюдения [10]. Естественно, что возникающая на 30-й минуте наблюдения смена характера спектров указывает на важнейшую трансформацию в биосистеме, обусловленную, по-видимому, прежде всего, регуляторными особенностями центральной нервной системы (область головного мозга). Как было продемонстрированно (желток в области головного мозга), нестационарный характер кинетики оптического поглощения при длине волны 560 нм, возникающий на стадии перехода (32-я стадия), сменяется синхронной кинетикой изменения поглощения света при выбранных длинах волн, обусловленной началом двигательной активности (33-я стадия) [10].
Рис. 5.
Нормированные спектры пропускания Kпр различных областей эмбриона в начале эксперимента на 32-й стадии развития (а) и в конце эксперимента на 33-й стадии развития (б); номера кривых соответствуют номерам областей, выделенных на рис. 3.
В области головного отдела и прилегающего к нему перивителлинового пространства вокруг него имеется характерный пик на длине волны 660 нм (рис. 6). Полученные нами данные также свидетельствуют о повышенной активности головного отдела зародыша вьюна и, соответственно, аналогичной области перивителлинового пространства и области воды вне икринки, что, по-видимому, может свидетельствовать об определенном обмене веществ между эмбрионом, перивителлиновым пространством и окружающей икринку водой. Такую связь эмбриона с окружающей средой подтверждают и полученные ранее данные измерений окислительно-восстановительного потенциала в воде, окружающей эмбрионы вьюна [6, 24], которые показали тесную корреляцию между этим показателем и изменением функционального состояния зародышей на разных стадиях развития.
Рис. 6.
Нормированные спектрально-временные зависимости пропускания области головного отдела (а) и дифференцированных сомитов (б).
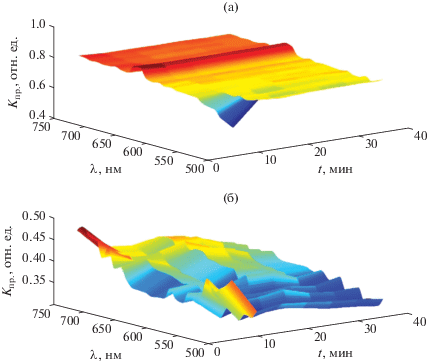
Интересно, что и область дифференцированных сомитов претерпевает значительные спектрально-временные изменения (см. рис. 6). Эти результаты могут быть сопряжены с целым комплексом процессов, происходящих в этот период на разных уровнях организации: от молекулярно-биохимических до цитологических, приводяших к целому ряду тонких дифференцировок. В сформировавшихся сомитах происходят внутриструктурные конформационные изменения, связанные, прежде всего, с дифференцировкой на дерматом, миотом и склеротом. Происходит прохождение ряда последующих дифференцировок, приводящих к образованию структурных элементов различных тканей: дерматом – соединительно тканная основа кожи, миотом – поперечно-полосатая мускулатура, склеротом – скелет. Любое клеточное перемещение сопровождается изменением поляризации клетки, перераспределением лигандов, ионных каналов, изменением уровня свободно радикальных процессов и т.п. В конечном итоге все это и приводит к наблюдаемым значительным спектрально-временным изменениям.
ЗАКЛЮЧЕНИЕ
Проведенный анализ показал, что АО-видеоспектрометрия позволяет неинвазивно получать данные, характеризующие специфику различных морфологических структур эмбриона. Проведенный мониторинг при переходе от 32-й к 33-й стадии развития эмбриона вьюна показал, что в выбранных областях происходят пространственно-временные изменения спектров пропускания, что свидетельствует о различиях в биохимических процессах. Так, например, установлены характерные особенности спектров пропускания области дифференцированных сомитов, головного отдела и перивителлинового пространства вокруг него.
Разработанный видеоспектрометрический АО-стенд не только позволяет проследить определенную специфику ряда динамически развивающихся процессов на определенном временном промежутке эмбрионального развития вьюна, но и дает возможность анализировать функциональные особенности различных стадий (особенно начальных) эмбриогенеза, когда на коротком промежутке времени сосредоточено множество процессов, определяющих дальнейшую жизнедеятельность организмов (активное деление клеток, дифференцировка, морфогенез). Показано, что видеоспектрометрия может применяться в качестве высокоточного неинвазивного способа оценки характеристик этих процессов.
Развитие описанного подхода может привести к более полному пониманию особенностей кинетики процессов, обеспечивающих развитие эмбрионов позвоночных, и позволит проследить координацию метаболических процессов при становлении самоорганизующейся биосистемы, что чрезвычайно важно для развития как фундаментальной, так и прикладной биомедицины.
Список литературы
Steenbergen P.J., Bardine N., Sharif F. // Chemosphere. 2017. № 183. P. 147.
Brox S., Ritter A.P., Küster E., Reemtsma T. // Aquatic Toxicology. 2014. № 157. P. 134.
Shirakashi R., Mischke M., Fischer P. et al. // Biochem. Biophys. Research Commun. 2012. V. 428. № 1. P. 127.
Жирмунский А.В., Кузьмин В.И. Критические уровни в развитии природных систем. Л.: Наука, 1990.
Jung G., Hug M., Halter C. et al. // BMC Biotechnology. 2013. № 13. P. 53.
Кузьмин В.И., Гадзаов А.Ф., Бурлаков А.Б. и др. // Технологии живых систем. 2018. № 2. С. 35.
Villamizar N., Vera L.M., Foulkes N.S., Sánchez-Vázquez F.J. // Zebrafish. 2014. V. 11. № 2. P. 173.
Wang R.Y., Zhang T., Bao Q., Rawson D.M. // European Biophysics J. 2006. V. 35. № 3. P. 224.
Костомарова А.А. Объекты биологии развития. М.: Наука, 1975. С. 309.
Бурлаков А.Б., Гадзаов А.Ф., Мачихин А.С., Хохлов Д.Д. // Биомед. радиоэлектроника. 2019. № 2. С. 47.
Goutzoulis A.P., Rape D.R. Design and Fabrication of Acousto-Optic Devices. Boca Raton: CRC Press, 2004.
Xu J., Stroud R. Acousto-Optic Devices: Principles, Design, and Applications. N.Y.: Wiley, 1992.
Machikhin A., Batshev V., Pozhar V. // J. Opt. Soc. Amer. A. 2017. V. 34. № 7. P. 1109.
Мачихин А.С., Пожар В.Э. // Квантовая электроника. 2015. Т. 45. № 2. С. 161.
Kutuza I., Pozhar V., Pustovoit V. // Proc. SPIE. 2003. V. 5143. P. 165.
Park B., Lee S., Yoon S.C. et al. // Proc. SPIE. 2011. V. 8027. P. 802707.
Li Q., He X., Wang Y. et al. // J. Biomed. Opt. 2013. V. 18. № 10. P. 100901.
Польщикова О.В., Мачихин А.С., Рамазанова А.Г. и др. // Оптика и спектроскопия. 2019. Т. 126. № 2. С. 237.
Мачихин А.С., Шурыгин А.В., Пожар В.Э. // ПТЭ. 2016. № 5. С. 70.
Szabo T.L. Diagnostic Ultrasonic Imaging: Inside Out. A.: Elsevier Academic Press, 2004.
Maev R.G. Advances in Acoustic Microscopy and High Resolution Imaging: From Principles to Applications. N.Y.: Wiley, 2013. P. 49.
Foster F.S., Zhang M.Y., Zhou Y.Q., et al. // Ultrasound in Medicine and Biology. 2002. V. 28. № 9. P. 1165.
Кайно Г. Акустические волны. М.: Мир, 1990.
Бурлаков А.Б., Кузьмин В.И., Гадзаов А.Ф. и др. // Онтогенез. 2017. Т. 48. № 1. С. 28.
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника