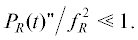Радиотехника и электроника, 2021, T. 66, № 10, стр. 989-996
Алгоритмы поддержки принятия решений при детектировании эпилептических приступов в данных длительного синхронного видео-электроэнцефалографического мониторинга
И. А. Кершнер a, *, Д. М. Мурашов b, Ю. В. Обухов a, М. В. Синкин c, d
a Институт радиотехники и электроники им. В.А. Котельникова РАН
125009 Москва, ул. Моховая, 11, корп. 7, Российская Федерация
b Федеральный исследовательский центр “Информатика и управление” РАН
119333 Москва, ул. Вавилова, 44, корп. 2, Российская Федерация
c Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского
Департамента здравоохранения города Москвы
129010 Москва, Большая Сухаревская площадь, 3, Российская Федерация
d Московский государственный медико-стоматологический университет им. А.И. Евдокимова
129010 Москва, ул. Делегатская, 20, Российская Федерация
* E-mail: ivan_kershner@mail.ru
Поступила в редакцию 17.03.2021
После доработки 29.03.2021
Принята к публикации 01.06.2021
Аннотация
Предложен новый метод сегментации данных длительного видео-электроэнцефалографического мониторинга дооперационных больных на временные интервалы, значимые при диагностике эпилепсии. Метод основан на анализе хребтов вейвлет-спектрограмм электроэнцефаллограмм и величины оптического потока видеоданных мониторинга. Показано, что предложенный метод позволяет существенно снизить трудоемкость визуального анализа данных длительного видео-электроэнцефалографического мониторинга.
ВВЕДЕНИЕ
Синхронный видео-энцефалографический мониторинг – метод длительной (сутки и более) синхронной регистрации многоканальной электроэнцефалограммы (ЭЭГ) и видеоизображения пациента. Он считается “золотым стандартом” детектирования эпилептических приступов в присутствии артефактов неэпилептической природы (см., например, работы [1, 2] и предложения по стандартизации клинических исследований пациентов с помощью видео-ЭЭГ (https:// www.ilae.org/files/dmfile/Draft-Minimum-Standards-for-LT-Video-EEG-Monitoring.pdf)). При анализе длительных записей ЭЭГ нейрофизиолог, просматривая видеозапись и сигналы многоканальной ЭЭГ по 15…30-секундным сегментам (эпохам), расставляет временные метки эпилептических приступов (ЭП), в которых наблюдаются характерные для ЭП изменения амплитуды и периодичности сигнала, и дифференцирует эти сегменты в соответствии со своими экспертными знаниями графоэлементов и с помощью просмотра видео. Такой анализ является трудоемкой работой, требующей высокой квалификации нейрофизиолога, поэтому сокращение времени анализа данных видео-ЭЭГ путем автоматизации процесса сегментации на временные интервалы, значимые при диагностике эпилепсии, с последующей дифференциацией ЭП от артефактов не эпилептической природы является в настоящее время актуальной задачей.
Существует множество методов детектирования ЭП в ЭЭГ (см., например, [3]), однако следует отметить, что они применялись для данных, не содержащих артефактов либо измеренных с помощью интракраниальных электродов на поверхности мозга, либо взятых из баз данных, предварительно очищенных от артефактов. Одна из наиболее используемых баз – Европейская база данных по эпилепсии (http://epilepsy-database.eu/), разработанная в рамках проекта EPILEPSIAE Европейского союза.
Предложенные ранее алгоритмы детектирования и классификации ЭП можно отличать по типу преобразования исходного ЭЭГ-сигнала, а именно: временное преобразование и частотно-временное преобразование (в основном вейвлет-преобразование). Чаще всего в системах поддержки принятия решений применяются методы, основанные на анализе графоэлементов ЭЭГ и реализованные в наиболее развитой системе поддержки принятия решений Persyst (https:// www.persyst.com/about/faqs/). Обзор методов детектирования ЭП в предварительно очищенных от артефактов данных ЭЭГ, основанных на применении вейвлет-преобразований разного вида, приведен в работе [4], а обзор методов детектирования и удаления артефактов – в [5].
К сожалению, данные длительного видео-ЭЭГ-мониторинга, записанные с помощью электродов, расположенных на скальпе, характеризуются большим числом неэпилептических артефактов – электромиографических, движения, приборных и др. Задача детектирования ЭП в ЭЭГ осложняется тем, что в длительных записях ЭЭГ присутствуют артефакты, связанные с приборными искажениями и жизнедеятельностью человека. Поэтому помимо необходимости в автоматизированном сегментировании ЭЭГ на временные интервалы, существует потребность в разработке методов по дифференциации ЭП от артефактов неэпилептической природы.
Анализ публикаций в исследуемой области показал, что публикаций по методам автоматической регистрации эпилептических приступов по видеопоследовательностям, полученным в ходе видео-ЭЭГ-мониторинга, крайне мало. В работах [6, 7] предложен алгоритм автоматического обнаружения приступов у пациентов на основе анализа количественных характеристик видеоизображений. На видеопоследовательности по величине оптического потока выявляется группа кадров с высокой динамикой сцены. Алгоритм предназначен для детектирования диагностических событий двух типов. Первый тип событий наблюдается у пациентов, находящихся в коме, а второй тип событий фиксируется у пациентов с активным уровнем бодрствования и проявляется в виде замирания на несколько секунд. Однако исследование только данных видеоканала не позволяет отличить активность, обусловленную движением пациента, от активности, порожденной приступом. В работе [8] предложен алгоритм выявления событий в данных видео-ЭЭГ на основе совместного анализа уровня оптического потока и хребтов вейвлет-спектрограмм сигналов [9]. Результаты анализа реальных клинических данных показали принципиальную возможность выявлять эпилептические приступы и отличать артефакты от эпилептических приступов.
Цель данной работы создать новый метод сегментации длительных (сутки и более) синхронных записей видео-ЭЭГ дооперационных больных, основанный на анализе хребтов вейвлет-спектров ЭЭГ и величины оптического потока.
1. СПОСОБ СЕГМЕНТАЦИИ СИГНАЛОВ ЭЭГ НА СИНХРОНИЗИРОВАННЫЕ ФРАГМЕНТЫ
Сигналы ЭЭГ пациентов с эпилепсией регистрировались с частотой дискретизации 256 Гц на 19 каналах, записанных в референтном монтаже по международной системе 10–20 [10]. Пациент ведет обычный образ жизни, находясь в стационаре.
Врач анализирует сигналы, пересчитанные в соответствии с продольным биполярным монтажом. Для получения такого сигнала программно вычисляется разница амплитуд с двух каналов из референтной схемы. На этих парах отведений будет осуществляться поиск синхронизированных фрагментов.
Для сигнала ЭЭГ x(t) = A(t)exp(iPx(t)) рассчитывается вейвлет-спектрограмма W(t, f) с использованием комплексной материнской функции Морле [11]:
которая задается следующим образом (коэффициенты Fb и Fc принимаются равными 1):
(2)
$\psi (\eta ) = \frac{{\exp (2\pi i{{F}_{c}}\eta )\exp ({{ - {{\eta }^{2}}} \mathord{\left/ {\vphantom {{ - {{\eta }^{2}}} {{{F}_{b}}}}} \right. \kern-0em} {{{F}_{b}}}})}}{{\sqrt {\pi {{F}_{b}}} }}.$Хребет вейвлет-спектрограммы рассчитывается в частотном диапазоне 0.5…22 Гц:
(3)
$\begin{gathered} R(t) = \mathop {\max }\limits_{f \in [0.5;22]} {{\left| {W(t,f)} \right|}^{2}}, \\ {{f}_{R}}(t) = \mathop {\arg \max }\limits_{f \in [0.5;22]} {{\left| {W(t,f)} \right|}^{2}}, \\ \end{gathered} $где R(t) – спектральная плотность мощности (СПМ) хребта вейвлет-спектрограммы, fR(t) – частота точек хребта R(t) вейвлет-спектрограммы. В приложении работы [12] было показано, что для сигнала x(t) = A(t)exp(iPx(t)) в точках хребта справедливы следующие соотношения:
(4)
$\begin{gathered} {{A}^{2}}\left( t \right) \approx {{\left| {W\left( {t,{{f}_{R}}} \right)} \right|}^{2}},\,\,\,\,{{P}_{x}}\left( t \right) \approx {{P}_{R}}\left( t \right), \\ {{P}_{R}}{{\left( t \right)}^{'}} \approx 2\pi fR. \\ \end{gathered} $При этом фаза хребта вейвлет-спектрограммы PR(t) должна удовлетворять условию
В рассматриваемых ниже точках хребта вейвлет-спектрограммы условие (5) соблюдается. Считая хребет частотно-модулированным сигналом, можно показать, что
При анализе сигнала ЭЭГ врач-нейрофизиолог ищет временные интервалы, в которых одновременно в нескольких отведениях ЭЭГ наблюдаются признаки ЭП. Предлагается найти синхронизированные фрагменты сигнала ЭЭГ, вычисляя модуль разности частот в точках хребтов вейвлет-спектрограмм для пар отведений. Если модуль разности меньше ε, то синхронизация Synci,j есть, в противном случае – нет:
(7)
${\text{Syn}}{{{\text{c}}}_{{i,j}}}(k) = \left\{ {\begin{array}{*{20}{c}} {1,\left| {{{f}_{{Ri}}}(k) - {{f}_{{Rj}}}(k)} \right| \leqslant \varepsilon ;} \\ {0,\left| {{{f}_{{Ri}}}(k) - {{f}_{{Rj}}}(k)} \right| > \varepsilon ,} \end{array}} \right.$где fRi, fRj – частоты хребтов вейвлет спектрограмм в i- и j-отведениях ЭЭГ, k – номер точки хребта.
Пороговое значение ε варьировалось от 0.1 до 1 Гц, наилучшего результата при поиске ЭП удалось достичь при ε = 0.5 Гц. Близлежащие точки, в которых выполнено условие (7), объединяются во фрагменты. В табл. 1 приведена гистограмма числа синхронизированных фрагментов в зависимости от длительности в 19 парах отведений ЭЭГ. Для каждого фрагмента вычислялись время начала и время конца синхронизации в парах отведений. Из нейрофизиологических соображений в данной работе будут рассматриваться фрагменты длительностью 10 с и более.
Таблица 1.
Гистограмма числа синхронизированных фрагментов в зависимости от длительности в 19 парах отведений ЭЭГ
| Пара отведений | Длительность фрагмента, с | |||||
|---|---|---|---|---|---|---|
| ≤1 | >1 ≤5 |
>5 ≤10 |
>10 ≤15 |
>15 ≤30 |
>30 | |
| FP1-F7 | 11 011 | 3040 | 621 | 131 | 44 | 4 |
| F7-T3 | 14 188 | 3683 | 430 | 84 | 29 | 9 |
| T3-T5 | 16 376 | 4265 | 336 | 68 | 27 | 6 |
| T5-O1 | 16 632 | 4210 | 375 | 77 | 40 | 4 |
| FP1-F3 | 14 683 | 3413 | 534 | 90 | 20 | 1 |
| F3-C3 | 20 022 | 3784 | 350 | 43 | 17 | 2 |
| C3-P3 | 18 105 | 4140 | 397 | 41 | 15 | 1 |
| P3-O1 | 17 648 | 4047 | 401 | 63 | 31 | 1 |
| FZ-CZ | 16 152 | 4250 | 362 | 35 | 18 | 1 |
| CZ-PZ | 16 123 | 4223 | 409 | 54 | 24 | 2 |
| FZ-Pz | 18 149 | 4044 | 329 | 31 | 16 | 0 |
| FP2-F4 | 13 659 | 3352 | 535 | 99 | 46 | 7 |
| F4-C4 | 20 161 | 3310 | 405 | 78 | 25 | 3 |
| C4-P4 | 18 419 | 3869 | 421 | 75 | 15 | 1 |
| P4-O2 | 16 960 | 4028 | 426 | 76 | 32 | 6 |
| FP2-F8 | 12 094 | 3024 | 678 | 130 | 48 | 3 |
| F8-T4 | 16 726 | 3385 | 518 | 88 | 46 | 5 |
| T4-T6 | 19 615 | 3946 | 454 | 67 | 28 | 3 |
| T6-O2 | 17 812 | 4190 | 470 | 76 | 28 | 3 |
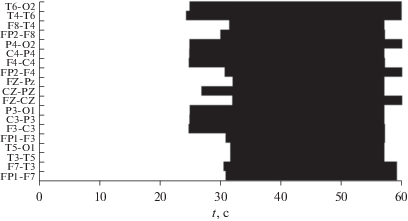
При эпилептических приступах синхронизация ЭЭГ наблюдается в нескольких парах отведений одновременно (в двух и более). На рис. 1 представлен пример минутного фрагмента из пятичасовой записи ЭЭГ, черным цветом показано наличие синхронизации в парах отведений ЭЭГ. Видно, что синхронизация ЭЭГ может наблюдаться не во всех каналах одновременно. Так с 25 секунды по 30-ю синхронизация наблюдается в девяти парах отведений, а после 31 секунды по 58-ю синхронизированы все пары отведений. При поиске ЭП важно, чтобы было синхронизировано больше двух пар отведений. Введем индикатор события Event1, который принимает значение 1, когда синхронизировано более двух пар отведений (количество синхронизированных пар отведений обозначим L), в противном случае события нет:
(8)
${\text{Even}}{{{\text{t}}}_{1}} = \left\{ {\begin{array}{*{20}{c}} {1,\,\,\,L \geqslant 2} \\ {0,\,\,\,L = 1} \end{array}} \right..$Рис. 1.
Минутный фрагмент пятичасового сигнала ЭЭГ, иллюстрирующий синхронизацию различных пар отведений ЭЭГ по частоте хребта вейвлет-спектрограммы: черным показано наличие синхронизации, белым – отсутствие. По оси ординат указаны названия пар отведений, используемых врачом при анализе в дифференциальном монтаже. Электроды, расположены по международной схеме 10 × 20.
Интервалы времени, в которых зафиксирована межканальная синхронизация по частоте хребтов, могут соответствовать как эпилептическим приступам, так и артефактам жевания, сну и случайным воздействиям на электроды, порождающим артефакты неэпилептической природы.
2. ПОРОГОВЫЙ СПОСОБ СЕГМЕНТАЦИИ СИГНАЛА ЭЭГ
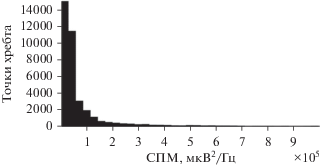
Помимо синхронизации в каждом отведении ЭЭГ осуществляется детектирование участков с большими значениями спектральной плотности мощности. Рассмотрим гистограмму точек хребта вейвлет-спектрограммы. В пике гистограммы содержится порядка 1.2 × 106 точек, а максимальное значение СПМ порядка 2.8 × 107 мкВ2/Гц. Построение такой гистограммы даст большой пик в области низких значений СПМ и не позволит оценить распределение точек хребта, поэтому на рис. 2 представлено “окно” гистограммы СПМ. Как видно из рисунка, количество точек хребта с малыми значениями СПМ велико и их можно интерпретировать как шум. Нужно отделить информативные точки хребта от шума.
Для того чтобы отделить точки хребта вейвлет-спектрограммы, относящиеся к высокоамплитудной электрической активности от шума, требуется найти пороговое значение СПМ Tr. Значения СПМ хребта R(t) вейвлет-спектрограммы и индикатор события Event2(t), определяются следующим образом:
(9)
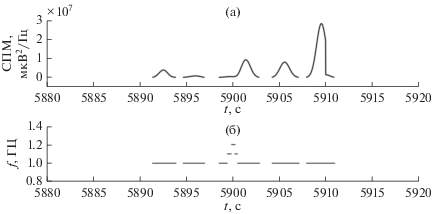
$\begin{gathered} R(t) = \left\{ \begin{gathered} R(t),R(t) \geqslant {\text{Tr}} \hfill \\ 0,R(t){\text{,}}\,\,{\text{Tr}} \hfill \\ \end{gathered} \right., \\ {\text{Even}}{{{\text{t}}}_{2}}(t) = \left\{ {\begin{array}{*{20}{c}} {1,\,\,\,R(t) \geqslant {\text{Tr}}} \\ {0,\,\,\,R(t) < {\text{Tr}}} \end{array}} \right.. \\ \end{gathered} $Точки хребта R(t), лежащие между ближайшими точками R(t) = 0, будем называть сегментами хребта. На рис. 3а представлено окно гистограммы количества сегментов хребта от значения порога СПМ Tr до значения Tr = 5 × 105 мкВ2/Гц. При больших значениях СПМ количество сегментов стремится к нулю. Пороговое значение СПМ определяется в точке максимального значения второй производной, находящейся правее первого локального минимума второй производной. На рис. 3б пороговое значение СПМ отмечено черным овалом (Tr = 1.2 × 105 мкВ2/Гц). Такой порог был выбран в связи с тем, что вторая производная слабо меняется после достижения локального максимума, что может означать устойчивый и близкий к квадратичному спад гистограммы сегментов. Для полученного порогового значения СПМ приведем пример сегментированного хребта вейвлет-спектрограммы в проекциях СПМ–время и частота–время (рис. 4а, 4б). В выбранном сегменте выполнено условие синхронизации (7).
Рис. 3.
Зависимость количества сегментов хребта от порогового значения СПМ Tr (a) и вторая производная (б) графика (а). Овалом на рисунке (б) выделено выбранное пороговое значение Tr = 1.2 × 105 мкВ2/Гц.
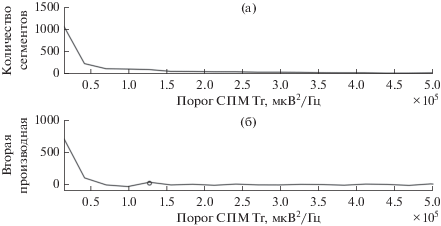
Рис. 4.
Сегментированный хребет вейвлет-спектрограммы участка сигнала ЭЭГ, характерного для ЭП: а – в проекции СПМ–время; б – в проекции частота–время.
В медицинской практике существует проблема дифференцирования ЭП от артефактов жевания. Ранее для решения данной задачи был предложен метод, основанный на анализе спектров Фурье временных срезов вейвлет-спектрограмм на частотах выше частоты хребта вейвлет-спектрограммы [13]. Было показано, что частота пика спектра Фурье среза вейвлет-спектрограммы сигнала, содержащего ЭП, имеет большее значение, чем у содержащего артефакт жевания. Также было показано, что полуширина спектра для артефакта жевания больше, чем у ЭП. Это позволяет дифференцировать ЭП и артефакты жевания.
Совместное использование двух методов, описанных выше, позволяет выделить сегменты, характерные для ЭП, и удалить из рассмотрения сегменты, характерные для артефактов жевания.
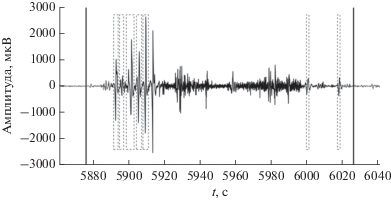
На рис. 5 представлен сегмент пятичасового сигнала ЭЭГ, в котором наблюдается ЭП. На рисунке показана разметка начала и конца ЭП, сделанная экспертом-нейрофизиологом; обозначен фрагмент, в котором была зафиксирована синхронизация в нескольких парах отведений ЭЭГ и отмечены области, найденные пороговым методом по СПМ.
Рис. 5.
Фрагмент сигнала ЭЭГ, в котором наблюдается ЭП: вертикальные линии – метки начала и конца ЭП, сделанные экспертом; серым выделен исходный сигнал; черная линия, повторяющая форму сигнала, – метка, полученая методом поиска синхронизированных пар отведений; пунктирные прямоугольники – метки, полученные пороговым способом детектирования ЭП.
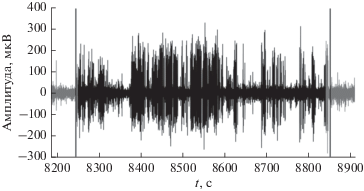
На рис. 6 приведен сегмент сигнала ЭЭГ, относящийся к артефакту жевания: обозначены начало и конец жевания, найденные при помощи визуального анализа видеофрагментов на данном промежутке времени; выделен фрагмент, в котором была зафиксирована синхронизация в нескольких парах отведений ЭЭГ. На данном участке сигнала ЭЭГ пороговым методом не было зафиксировано сегментов схожих с ЭП.
Рис. 6.
Фрагмент сигнала ЭЭГ, относящийся к артефакту жевания: вертикальные линии – метки, обозначающие начало и конец жевания и поставленные по зрительному анализу видеофайла, серым тоном выделен исходный сигнал; черная линия, повторяющая форму сигнала, – метка, полученная методом поиска синхронизированных пар отведений.
Данные рисунки иллюстрируют, что метод детектирования эпилептической активности при помощи анализа синхронизации пар отведений сигнала ЭЭГ позволяет найти продолжительные участки сигнала, характерные как для ЭП, так и для жевания. Пороговый метод детектирования ЭП позволяет выделить среди найденных участков такие, которые содержат характерные для ЭП значения СПМ и позволяет убрать из рассмотрения фрагменты, соответствующие артефактам жевания, создающие трудности эксперту при визуальном анализе ЭЭГ.
3. АНАЛИЗ ВИДЕОДАННЫХ
Эпилептический приступ проявляется в виде характерных движений пациента. Рассмотрим приступы двух типов у пациентов с активным уровнем бодрствования. Первый тип проявляется в виде конвульсивных движений с достаточно большой амплитудой, а второй тип приступов (бессудорожный) проявляется в виде замирания пациента на несколько секунд. В работах [6–8] предложено детектировать диагностические события в видеоканале по величине показателя, характеризующего степень подвижности области интереса. Областью интереса является часть кадра, в которой виден пациент. В качестве показателя подвижности области интереса используется суммарная величина оптического потока, вычисляемого по каждому кадру видеопоследовательности:
(10)
$\begin{gathered} J(n) = \sum\limits_{x = 0}^{W - 1} {\sum\limits_{y = 0}^{H - 1} {\sqrt {V_{x}^{2}(x,y,n) + V_{y}^{2}(x,y,n)} } } + \delta (n), \\ n = 1,...,N, \\ \end{gathered} $где J(n) – величина показателя, вычисленная по кадру с номером n; W, H – ширина и высота кадра, Vx(x, y, n) и Vy(x, y, n) – величины оптического потока по направлениям осей x и y для кадра с номером n в пикселе с координатами (x, y); δ(n) – шум.
Для вычисления показателя подвижности J(n) используется алгоритм Лукаса–Канаде [14]. Этот алгоритм вычисления оптического потока выбран из условия наибольшего быстродействия по сравнению с другими методами.
В модели (10) присутствует шумовая составляющая, поэтому при детектировании событий нужно использовать сглаженную величину показателя подвижности $\hat {J}(n)$, которая вычисляется с помощью дискретного варианта алгоритма фильтрации Калмана–Бьюси [15]. Решение о фиксации диагностического события будет приниматься по пороговому правилу. Для исключения ложных срабатываний детектора из-за кратковременных скачков решение о появлении события будет приниматься в том случае, если величина $\hat {J}(n)$ будет превышать заданный порог на последовательности кадров длиной не меньше, чем M.
При анализе видеопоследовательностей возможна фиксация следующих событий: эпилептический приступ; движение пациента (например, изменение позы, перемещение по палате).
Каждое из диагностических событий и артефактов характеризуется определенным диапазоном уровней сглаженной величины показателя подвижности $\hat {J}(n)$. Тогда решающее правило будет иметь следующий вид:
(11)
${\text{Even}}{{{\text{t}}}_{3}} = \left\{ {\begin{array}{*{20}{l}} {1,\,\,{\text{если}}\,\,\hat {J}(n) \geqslant {{T}_{1}}\,\,{\text{и}}\,\,n - {{n}_{0}} \geqslant M} \\ {0,\,\,{\text{если}}\,\,\hat {J}(n) < {{T}_{1}}\,\,{\text{или}}\,\,n - {{n}_{0}} < M} \end{array}} \right.,$где Event3 – индикатор события; T1 – порог; n0 – номер кадра, начиная с которого выполняется неравенство $\hat {J}(n)$ ≥ T1; M – длина последовательности кадров, необходимая для принятия решения о наличии диагностического события. Величина порога определяется по формуле
где Ĵ0 вычисляется как среднее значение $\hat {J}(n)$ на фрагменте видеопоследовательности с низкой динамикой сцены, σ1 – среднеквадратическое отклонение величины $\hat {J}(n)$, k1 – коэффициент.
У активных пациентов детектируемые события другого типа проявляются в виде замирания на несколько секунд. В этом случае предлагается фиксировать события также ${\text{по}}$ значению показателя подвижности. В отличие от рассмотренного выше случая появление события соответствует минимуму показателя подвижности. Решающее правило имеет следующий вид:
(13)
${\text{Even}}{{{\text{t}}}_{4}} = \left\{ {\begin{array}{*{20}{l}} {1,\,\,{\text{если}}\,\,\hat {J}(n) \leqslant {{T}_{2}}\,\,{\text{и}}\,\,n - {{n}_{0}} \geqslant M} \\ {0,\,\,{\text{если}}\,\,\hat {J}(n) > {{T}_{2}}\,\,{\text{или}}\,\,n - {{n}_{0}} < M} \end{array}} \right.,$а величина порога вычисляется по формуле
где k2 – коэффициент.
Таким образом, алгоритм фиксации событий в видеоканале данных видео-ЭЭГ мониторинга состоит из следующих операций.
1. Чтение кадра с номером n видеопоследовательнсти.
2. Вычисление величины показателя подвижности J(n).
3. Вычисление сглаженной величины показателя подвижности $\hat {J}(n)$.
4. Проверка условий (11)–(14). Если условие $\hat {J}(n)$ ≥ T1 или $\hat {J}(n)$ ≤ T2 выполняется, то запоминается номер текущего кадра n0 = n. Если условия не выполняются, то переход к шагу 1.
5. Повторение шагов 1–3. Если выполняются условия $\hat {J}(n)$ ≥ T1 или $\hat {J}(n)$ ≤ T2 и n – n0 ≥ M, то принимается решение об обнаружении события. В противном случае переход к шагу 1.
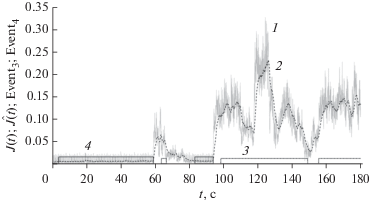
Работа алгоритма фиксации событий в видеоканале данных видео-ЭЭГ-мониторинга представлена на рис. 7: показаны графики нормированного J(t) критерия (здесь t = nFrate, где t – время, а Frate – частота кадров видеозаписи), нормированного сглаженного критерия Ĵ(t) и индикаторов событий Event3, Event4 для фрагмента видеозаписи, на которой зафиксирован эпилептический приступ.
Рис. 7.
Иллюстрация локализации приступа по видеопоследовательности видео-ЭЭГ-мониторинга: 1 – график нормированного критерия J(t), 2 – график сглаженного нормированного критерия Ĵ(t) (здесь t = nFrate, где t – время, а Frate – частота кадров видеозаписи); 3 и 4 – графики индикаторов событий Event3 и Event4.
Следует отметить, что артефакт движения с достаточно высоким уровнем $\hat {J}(n)$ и состояние покоя (сна) с очень низким уровнем $\hat {J}(n)$ будут фиксироваться как приступ. Поэтому для дифференциации диагностических событий и артефактов необходим анализ как видеопоследовательности, так и сигналов ЭЭГ.
Каждое из диагностических событий и артефактов характеризуется определенным диапазоном уровней сглаженной величины показателя подвижности Ĵ(t) видеоканала и диапазоном уровней величины спектральной плотности мощности СПМRidge(S, t) хребтов вейвлет-спектрограммы каналов ЭЭГ и наличием или отсутствием синхронизации по частоте хребтов вейвлет-спектрограмм сигналов ЭЭГ. В этом случае решающие правила можно сформировать в виде таблицы, построенной по значениям переменных Eventj, j = 1, 2, 3, 4, полученных по формулам (8), (9), (11), (13) в результате синхронного анализа данных видео-ЭЭГ-мониторинга (табл. 2).
5. ОБРАБОТКА ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Рассмотрим данные пятичасовой записи ЭЭГ и синхронной видеозаписи, полученные в клинических условиях. Из данных с использованием условия (9) выделено 22 фрагмента с высокими значениями СПМ хребтов вейвлет-спектрограммы сигналов ЭЭГ (Event2). Для 16 из 22 выделенных фрагментов выполнено условие синхронизации по частоте хребтов (Event1) (8). Совместное появление событий Event2 и Event3 (большие значения спектральной плотности мощности хребтов и высокая динамика сцены, см. условия (9) и (11)) выявлено в девяти фрагментах, а Event2 и Event4 (высокие значения СПМ хребтов и низкая динамика сцены, см. условия (9) и (13)) – в четырех фрагментах. Одновременно большое значение СПМ хребтов (Event2), синхронизация по частоте хребтов сигналов ЭЭГ (Event1) и высокая динамика сцены (Event3) зафиксированы в шести фрагментах, а события Event1, Event2 и Event4 одновременно детектированы в четырех фрагментах. Из 10 фрагментов, выявленных согласно решающим правилам (см. табл. 2) как эпилептические приступы, только три соответствуют реальным эпилептическим приступам, остальные семь выделены из-за артефактов в сигналах ЭЭГ, обусловленных случайным воздействием на электроды. Суммарная длительность фрагментов, которые, возможно, содержат ЭП и должны быть верифицированы экспертами, составила 207 с.
Таким образом, результаты эксперимента показали, что разработанный метод сегментации и дифференциации событий позволил существенно (с 5 ч до 4 мин) сократить количество участков данных длительного видео-ЭЭГ-мониторинга для проведения визуального анализа экспертами, что существенно уменьшает время поиска ЭП.
Алгоритм детектирования событий, основанный на совместном анализе условий (9), (11) и (9), (13) был предложен ранее в работе [8]. Алгоритм, комбинирующий условия (8), (9), (11) и (8), (9), (13), и решающие правила, предложенные в данной работе, позволили сократить количество выявленных событий, которые должны верифицироваться экспертами для принятия диагностического решения.
ЗАКЛЮЧЕНИЕ
Предложен метод сегментации данных длительного видео-ЭЭГ-мониторинга пациентов с эпилепсией. Метод реализован в виде комбинации следующих алгоритмов: (а) алгоритма нахождения синхронизированных по частоте хребта временных интервалов; (б) алгоритма анализа спектральной плотности мощности хребтов вейвлет-спектрограмм ЭЭГ на основе порогового метода; (в) алгоритма детектирования событий в видеоданных.
Тестирование метода на клинических данных показало, что продолжительность фрагментов данных видео-ЭЭГ мониторинга для проведения визуального анализа экспертами сократилась почти в 100 раз, что существенно снижает трудоемкость поиска эпилептических событий.
Учет эффекта синхронизации сигналов ЭЭГ по частоте хребта и изменение выбора порогового значения по СПМ в предложенном методе обусловил улучшение решающих правил, что позволило сократить количество фрагментов и, соответственно, время просмотра данных длительного видео-ЭЭГ-мониторинга врачами-экспертами по сравнению с ранее предложенным алгоритмом [8].
Список литературы
Eddy C.M., Cavanna A.E. // Epilepsy & Behavior. 2014. V. 30. P. 24.
Крылов В.В., Гехт А.Б., Трифонов И.С. и др. // Журн. неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2016. Т. 116. № 9. С. 13.
Alotaiby T.N., Alshebeili S.A., Alshawi T. et al. // EURASIP J. Advances in Signal Processing. 2014. V. 2014. № 1. P. 1.
Faust O., Acharya R.U., Adeli H., Adeli A. // Seizure. 2015. V. 26. P. 56.
Islam M.K., Rastegarnia A., Yang Z. // Clinical Neurophysiology. 2016. V. 46. № 4–5. P. 287.
Murashov D., Obukhov Yu., Kershner I., Sinkin M. // CEUR Workshop Proc. 2019. V. 2391. P. 285.
Murashov D., Obukhov Y., Kershner I., Sinkin M. // Int. Arch. Photogramm. Remote Sens. Spatial Inf. Sci. 2019. V. XLII-2/W12. P. 155.
Мурашов Д.М. // Сборник трудов VI Междунар. конф. и молодежной школы. Самара 26–29 мая 2020. Самара, 2020. Т. 2. С. 554.
Guillemain P., Kronland-Martinet R. // Proc. IEEE. 1996. V. 84. № 4. P. 561.
Homan R.W., Herman J., Purdy P. // Electroencephalography and Clinical Neurophysiology. 1987. V. 66. № 4. P. 376.
Mallat S. A Wavelet Tour of Signal Processing. L.: Acad. Press, 1999.
Толмачева Р.А., Обухов Ю.В., Полупанов А.Ф., Жаворонкова Л.А. // Физика и радиоэлектроника в медицине и экологии. 2018. С. 225.
Kershner I.A., Sinkin M.V., Obukhov Y.V. // RENSIT. 2019. V. 11. P. 237.
Lucas B.D., Kanade T. // Proc. of Imaging Understanding Workshop. Washington. Apr. 23, 1981. Washington: DTIC, 1981 P. 121.
Kalman R.E., Falb P.L., Arbib M.A. Topics in Mathematical System Theory. N.Y.: McGraw-Hill, 1969.
Дополнительные материалы отсутствуют.
Инструменты
Радиотехника и электроника