Расплавы, 2020, № 1, стр. 98-108
Электрохимический синтез гексаборидов стронция и бария
Я. Б. Чернов a, Д. О. Чухванцев a, Д. А. Роженцев a, Н. И. Шуров a, Е. С. Филатов a, b, *, Н. К. Ткачёв a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет
Екатеринбург, Россия
* E-mail: e.filatov@ihte.uran.ru
Поступила в редакцию 27.11.2018
После доработки 06.04.2019
Принята к публикации 25.06.2019
Аннотация
Получены порошкообразные гексабориды стронция и бария методом электрохимического синтеза из их расплавленных хлоридов с добавками оксидов при непрерывном введении оксида бора. Определен их химический и фазовый состав, содержание примесей (не более 2%) и выход по току. Объяснено нетипичное образование гексаборидов не на поверхности катода, а в прилегающем к нему слое электролита, которое наблюдается в расплавах, содержащих хлорид натрия.
ВВЕДЕНИЕ
Гексабориды щелочноземельных металлов (ЩЗМ) в течение четырех десятилетий находятся в центре многочисленных экспериментальных и теоретических исследований. Этот интерес обусловлен уникальным сочетанием их свойств. Гексабориды кальция, стронция и бария демонстрируют низкую плотность (около 2.5 г/см3), высокую твердость (25–30 ГПа), высокую температуру плавления (более 2200°C), хорошую электропроводность при высоких температурах, а также химическую устойчивость [1].
Кроме этого, гексабориды ЩЗМ обладают такими полезными свойствами, как низкая работа выхода электрона, устойчивое удельное сопротивление и низкий коэффициент линейного расширения в довольно широких температурных диапазонах. Известно применение гексаборида кальция в качестве наиболее эффективного раскислителя при получении чистых меди и серебра. Он также является ценным компонентом – модификатором при производстве абразивных инструментов и конструкционной жаростойкой керамики.
Открытие необычного типа ферромагнетизма у гексаборидов CaB6 и SrB6 около двадцати лет назад вызвало новый всплеск интереса к ним. Довольно высокая температура Кюри (600 К) стала неожиданностью, поскольку эти соединения не имеют частично занятых 3d или 4f-орбиталей [2–4]. Теперь эти соединения рассматриваются как перспективные материалы для спинтроники – электроники нового поколения.
Из справочных данных [5] следует, что все щелочноземельные металлы образуют единственные бориды состава МеВ6 кубической структуры.
Известные методы получения гексаборидов ЩЗМ включают прямой синтез из элементов в виде спрессованных таблеток при температурах до 2000°С (СаВ6) и термохимический синтез из смеси карбонатов стронция [6] или бария [7] с карбидом бора и углеродом при 1300–1400°С. Чистота гексаборидов ЩЗМ при этом не выше 97%. В работе [8] методом термолиза диборанов В2Н6 на подложке SrO при 700°С получено пористое покрытие из нанонитей SrB6.
Известна единственная работа по электрохимическому синтезу BaB6 [9] из расплава BaCO3 + LiF + B2O3 при 875°С. Получен кристаллический порошок кубической структуры с размерами частиц 60–150 мкм. Недостатком этой работы по нашему мнению является неудачный выбор электролита, т.к. вследствие обменной реакции
(1)
${\text{BaC}}{{{\text{O}}}_{3}} + {\text{LiF}} \to {\text{Ba}}{{{\text{F}}}_{2}} + {\text{L}}{{{\text{i}}}_{2}}{\text{O}} + {\text{CO}}_{{{\text{2}}\,{\text{г}}}}^{{ \uparrow ~~~}}.$Цель настоящей работы – разработка непрерывного способа получения гексаборидов стронция и бария методом первичного электровосстановления компонентов из оксидного сырья на инертной подложке.
ВЫБОР ЭЛЕКТРОЛИТОВ И ПОДГОТОВКА ЭКСПЕРИМЕНТОВ
Ранее нами получен патент на способ получения гексаборида кальция электролизом расплава CaCl2–CaO–B2O3 [10]. Учитывая сходство химических свойств Ca, Sr,Ba и их соединений, мы выбрали подобные расплавы для электросинтеза гексаборидов SrB6 и BaB6. Для этого мы провели две группы опытов с разными по составу электролитами.
В первой серии опытов в качестве электролитов с целью снижения температуры синтеза были выбраны эвтектические смеси: хлорида стронция с 47 мол. % NaCl (пл. 544°С) [11] и хлорида бария с 55 мол. % NaCl (пл. 654°С) [12]. Для их приготовления использовали химически чистые хлориды стронция SrCl2⋅ 6H2O, бария BaCl2 ⋅ 2H2O, натрия NaCl, и оксид BaO (ГОСТ 10 203-78). Оксиды стронция и бария для очистки от карбонатов прокаливанием с углеродом при 850°С в течение 10 ч в шахтной печи. Оксиды ЩЗМ хранили в сухом боксе из-за их гигроскопичности и способности поглощать углекислый газ с обратным образованием карбонатов. Перед проведением эксперимента соли просушивались в камерной печи при 400°С в течение 4 ч.
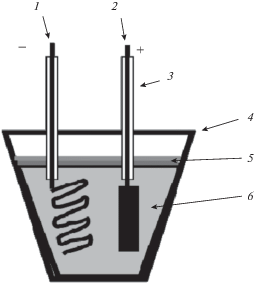
Для опытов была изготовлена электрохимическая ячейка (рис. 1), которая состояла из корундового тигля емкостью 200 см3 с расплавленной солью, графитового анода площадью 40 см2 и катода из молибденовой проволоки. Для защиты токоподводов катода и анода от окисления использовали корундовые трубки. Во время опыта их фиксировали специальными держателями.
ПРОВЕДЕНИЕ ЭКСПЕРИМЕНТОВ
На столе в корундовый тигель загружали раздробленную эвтектику MeCl2 + NaCl с добавкой 5 мас. % порошка оксида MeO (с использованием респиратора и очков), помещали тигель в печь и разогревали ее до 850°С. После полного расплавления электролита на его поверхность загружали оксид бора В2О3 особой чистоты (ТУ 6-09-35 558-78), который и после расплавления из-за малой плотности находился на поверхности расплава (см. рис. 1).
В разогретый расплав опускали электроды, как показано на рис. 1, и проводили сначала очистной электролиз постоянным током плотностью 0.20 А/см2 в течение 15 мин, а затем вели электроосаждение боридов катодной плотностью тока 0.15 А/см2 в течение 2–3 ч. После окончания электролиза катоды извлекали из электролита, катодный осадок отмывали от соли в кипящей дистиллированной воде, фильтровали, высушивали и взвешивали порошок борида.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полной неожиданностью для нас оказалось отсутствие осадков на катодах (см. рис. 2).
После окончания опыта расплавленный электролит выливали в графитовый стакан для охлаждения, застывший расплав раскалывали, в его объеме обнаружили много темных вкраплений (см. рис. 3), поэтому было сделано предположение, что практически весь катодный продукт в виде порошка находится в застывшем электролите.
Для извлечения порошка электролит растворяли в кипящей дистиллированной воде, подкисленной соляной кислотой, при этом порошок боридов оседал на дно стакана. Осадок переводили на бумажный фильтр, дополнительно промывали его дистиллированной водой и спиртом. Фильтр с порошком выдерживали в сушильном шкафу при температуре 80°С. Полученный порошок был почти черного цвета, под микроскопом – серого (рис. 4, 5).
Результаты химического анализа синтезированных порошков представлены в табл. 1, 2.
Таблица 1.
Элементный анализ порошка борида стронция
| Элемент | Содержание | |
|---|---|---|
| мас. % | ат. % | |
| Al | 1.75 | 1.43 |
| В | 41.39 | 84.54 |
| Na | 0.13 | 0.13 |
| Fe | 0.084 | 0.03 |
| Sr | 54.27 | 13.67 |
Таблица 2.
Элементный анализ порошка борида бария
| Элемент | Содержание | |
|---|---|---|
| мас. % | ат. % | |
| Al | 1.269 | 1.33 |
| В | 32.27 | 84.2 |
| Ba | 64.59 | 13.25 |
| Fe | 0.462 | 0.23 |
Из результатов химического анализа следует, что по атомному соотношению бора к стронцию (6.184) порошок соответствует соединению SrB6 с небольшим избытком элементарного бора. Наличие примесей алюминия и железа обусловлено контактом электролита с корундовым тиглем в течение всего эксперимента, их количество можно кратно уменьшить заменой корундового тигля например на высокочистый графит или стеклоуглерод.
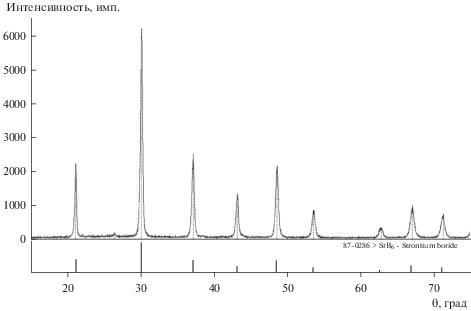
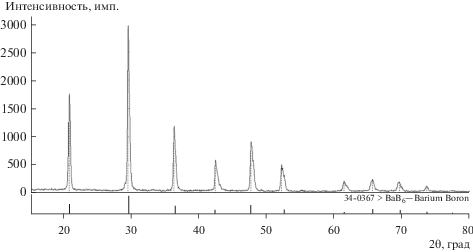
Полученные порошки были также подвергнуты рентгенофазовому анализу на дифрактометре Rigaku D/Max-2200. Результаты анализа представлены ниже на рис. 6 и 7.
МЕХАНИЗМ ФОРМИРОВАНИЯ ГЕКСАБОРИДОВ В ОБЪЕМЕ ЭЛЕКТРОЛИТА
По нашему мнению, расплавленный оксид бора на поверхности расплава медленно взаимодействует с оксидом MeO, растворенным в расплаве NaCl + MeCl2 с образованием диссоциированного метабората
(2)
${\text{MeO}} + {{{\text{B}}}_{2}}{{{\text{O}}}_{3}} = {\text{Me}}{{{\text{B}}}_{2}}{{{\text{O}}}_{4}} = {\text{M}}{{{\text{e}}}^{{2 + }}} + {{\left[ {{{{\text{B}}}_{2}}{{{\text{O}}}_{4}}} \right]}^{{2 - }}}~.$Далее на катоде в соответствии с законами электрохимической термодинамики в первую очередь должны разряжаться ионы бора из анионного комплекса [B2O4]2– по реакции:
(3)
${{[{{{\text{B}}}_{2}}{{{\text{O}}}_{4}}]}^{{2 - ~}}} + 6{{{\text{e}}}^{ - }}~ \to {{{\text{B}}}_{2}} + 4{{{\text{O}}}^{{2 - }}}.$При достижении предельной диффузионной плотности тока разряда ионов бора на катоде совместно с В3+ в кинетическом режиме должны разряжаться ионы ЩЗМ с деполяризацией за счет образования гексаборидов по брутто-реакции:
Основной вопрос по результатам первой серии опытов – почему отсутствует осадок гексаборидов на катоде? Причина такого явления заключается, вероятно, в механизме формирования катодного осадка, а именно в том, что восстановление ионов Me2+ и B3+ происходило не на катоде, а в прикатодном слое электролита.
Известно, что из чистых эвтектических расплавов CaCl2–NaCl и BaCl2–NaCl первым на катоде выделяется натрий [13] и он способен растворяться в электролите [14] с образованием делокализованных электронов. Этот растворенный натрий способен восстанавливать ионы В3+ из боратного комплекса и ионы Ме2+ в прикатодном слое по брутто-реакции
(5)
$20{\text{N}}{{{\text{a}}}_{{{\text{solv}}}}} + 3{\kern 1pt} {{[{{{\text{B}}}_{2}}{{{\text{O}}}_{4}}]}^{{2 - }}}~ + {\text{ М}}{{{\text{е}}}^{{2 + }}} \to {\text{Ме}}{{{\text{B}}}_{6}} + 20{\text{N}}{{{\text{a}}}^{ + }} + 12{{{\text{O}}}^{{2 - }}}.$Такой механизм “вторичного восстановления ионов на катоде” в общем виде описан и объяснен в монографии Барабошкина [16].
В качестве заключения по этой серии опытов необходимо указать, что хотя возможность электросинтеза гексаборидов ЩЗМ в данных расплавах доказана, сам процесс синтеза в этом электролите носит разовый характер с предельным накоплением целевого продукта, после чего необходимо прекращать электролиз (во избежание короткого замыкания электродов), выливать электролит и растворять его в воде полностью, чтобы извлечь порошковый гексаборид.
Такой процесс не соответствует современным требованиям к непрерывности технологического процесса и сильно удорожает целевой продукт. В связи с этим с целью улучшения технологических перспектив электросинтеза гексаборидов ЩЗМ мы провели серию опытов с электролитами без NaCl.
Во второй серии опытов в качестве электролитов были выбраны расплавы эвтектическиx составов: SrCl2–SrO (5 мол. %), пл. 825°С и BaCl2–BaO (12.5 мол. %), пл. 899°С [17] без NaCl для исключения влияния растворенного натрия на качество сцепления осадка с катодом. Методика проведения опытов и режимы электролиза были такими же, что и в предыдущей серии. Отличие только в температурах опытов: 875°С для синтеза SrB6 и 950°С для BaB6. Результаты второй серии опытов представлены ниже.
Прежде всего следует отметить, что во второй серии опытов катодные осадки были лучше сцеплены с катодной спиралью, (см. рис. 8).
Образование порошкового осадка гексаборидов можно представить первичной реакцией совместного восстановления ионов бора из боратных комплексов и ионов ЩЗМ в кинетическом режиме по реакции (4).
При электроосаждении сплавов, интерметаллидов и неорганических соединений в кинетическом режиме катодные осадки получаются как правило в виде порошков. Сплошные покрытия получаются крайне редко и в специальных условиях.
Полученные в этой серии опытов порошки были также подвергнуты рентгенофазовому анализу. Результаты анализа представлены ниже на рис. 10 и 11.
Рис. 10.
Дифрактограмма порошкового осадка борида стронция из второй серии опытов, идентичная эталону гексаборида SrB6.
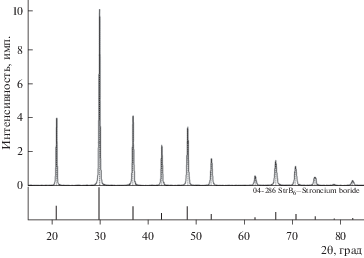
Рис. 11.
Дифрактограмма порошкового осадка борида бария из второй серии опытов, идентичная эталону гексаборида BaB6.
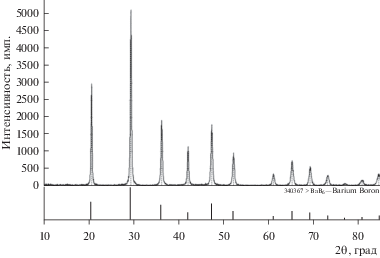
Сравнивая дифрактограммы порошков гексаборидов стронция (рис. 6 и 10) и гексаборидов бария (рис. 7 и 11) из первой и второй серий опытов, можно констатировать их полное сходство.
Результаты химического анализа синтезированных порошков без учета малых примесей (≤0.01%) представлены в табл. 3 и 4.
Таблица 3.
Элементный анализ порошка SrB6 из второй серии опытов
| Элемент | Содержание | |
|---|---|---|
| мас. % | ат. % | |
| Al | 1.53 | 1.55 |
| В | 40.54 | 83.64 |
| Sr | 57.24 | 14.57 |
| Si | 0.55 | 0.44 |
| Fe | 0.07 | 0.03 |
Таблица 4.
Элементный анализ порошка BaB6 из второй серии опытов
| Элемент | Содержание | |
|---|---|---|
| мас. % | ат. % | |
| B | 31.26 | 85.21 |
| Вa | 68.64 | 14.73 |
| Fe | 0.10 | 0.06 |
Чистота целевых продуктов по данным химического анализа не хуже 98%. Значимыми примесями являются алюминий, кремний и железо. Выход целевых продуктов по току составляет 84 ± 2%.
ЗАКЛЮЧЕНИЕ
В разных по составу хлоридно-оксидных расплавленных электролитах методом высокотемпературного электрохимического синтеза получены порошки гексаборидов стронция и бария из оксидных соединений бора и ЩЗМ.
Их состав идентифицирован методами химического элементного и рентгенофазового анализов, которые подтвердили достаточно высокую чистоту продуктов.
С привлечением литературных данных о природе растворов щелочных металлов в их расплавленных солях объяснен экспериментальный факт формирования осадков гексаборидов стронция и бария не на катоде, а в прикатодном слое электролита, содержащего хлорид натрия.
Авторы выражают глубокую благодарность за деятельное участие в проведении экспериментов сотрудникам ЦКП “Состав вещества” С.В. Плаксину, Н.И. Москаленко и Б.Д. Антонову за проведение химических и рентгенофазовых анализов катодных продуктов.
Список литературы
Matkovich V.I. Boron and refractory borides. Springer-Verlag, Berlin, 1977.
Tromp H.J., Van Gelderen P., Kelly P.J., Brocks G., Bobbert P.A. CaB6: a new semiconducting material for spin electronics // Physical Review Letters. 2001. 87. P. 016401.
Souma S., Komatsu H., Takahashi T., Kaji R., Sasaki T., Yokoo Y., Akimitsu J. // Physical Review Letters. 2003. 90. P. 027202. https://doi.org/10.1103/PhysRevLett.90.027202
Rhyee J.S., Cho B.K. The effect of boron purity on electric and magnetic properties of CaB6 // J. Applied Physics. 20004. 95. P. 6675–6677.
Лякишев Н.П. Диаграммы состояния двойных металлических систем: Справочник: в 3 т. Машиностроение,1996.
Shu-Qi Z. Synthesis of strontium hexaboride powder by the reaction of strontium carbonate with boron carbide and carbon // J. materials science letteres. 2003. 21. P. 313 – 315.
Guanghui M. Reaction synthesis and formation mechanism of barium hexaboride // Materials Letters. 2003. 57. P. 1330–1333.
Panchatapa J. Synthesis and characterization of single-crystal strontium hexaboride nanowires // Nano Letters. 2008. 8. P. 3794–3798.
Jose T.P. Electrochemical synthesis and characterization of BaB6 from molten melt // J. of Mining and Metallurgy. 2009. 45. P. 101–109.
Каримов К.Р., Шуров Н.И., Чернов Я.Б., Филатов Е.С. Электрохимический способ получения порошка гексаборида кальция. Пат. РФ № 2539593. 05.12.2014.
Бухалова Г.А., Бурлакова В.М. // Изв. Вузов. Химия и хим. технология. 1968. 11. С. 955.
Максина Н.В., Сосновская Л.К., Финкельштейн Н.А., Рютина Н.М. // Журн. неорг. химии. 1973. 18. С. 1098.
Морачевский А.Г., Шестёркин И.А., Буссе-Мачукас В.Б. Натрий. Свойства, производство, применение. СПб: Химия. 1992.
Bredig M.A. Mixtures of metals with molten salts // Molten salts chemistry. Interscience Publishers, 1964.
Richter D., Emons H.H. // Z. Chem. 1966. 6. № 11. P. 407–416.
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука. 1976.
Neumann B., Kroeger C., Juettner H. // Z. Elektrochem. Angew. Phys. Chem. 1935. 41. № 10. P. 725–736.
Дополнительные материалы отсутствуют.