Расплавы, 2020, № 2, стр. 193-197
Коэффициент активности цезия в расплавах Cs–CsCl
В. В. Чебыкин a, В. М. Ивенко a, *, Л. А. Циовкина a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: Ivenko@ihte.uran.ru
Поступила в редакцию 13.03.2019
После доработки 11.04.2019
Принята к публикации 26.04.2019
Аннотация
Из тензиметрических данных (38 составов от 0.09 до 99.0 мол. % Cs) исследования расплавов Cs–CsCl получены аппроксимирующие уравнения для коэффициентов активности цезия в конкретных опытах, а также общее уравнение, описывающее все экспериментальные точки. Обсуждены условия проведения эксперимента и их влияние на погрешность полученных экспериментальных данных.
Из галогенидных цезиевых расплавов, содержащих металлический цезий, термодинамика хлоридных расплавов наиболее востребована. Электрохимические методы исследования возможны лишь в очень узком концентрационном интервале, да и то наталкиваются на проблемы конструкционных материалов и способы задания необходимой концентрации цезия.
Экспериментальные данные, представленные в данной работе, получены статическим тензиметрическим методом на установке, описанной в работе [1]. Материал установки, контактирующий с цезием и хлоридом цезия, – сталь 12Х18Н9Т. Коррозионных процессов при контакте хлорида цезия с данной сталью данным методом не обнаружено, хотя известно, что данная сталь незначительно взаимодействует со фторидами цезия [2] и калия [3].
Хлорид цезия марки х.ч. сушился под вакуумом ~1–10 Па при нагревании до 500°С с ловушкой, охлаждаемой жидким азотом. Затем хлорид цезия нагревали на воздухе для выжигания оставшихся органических соединений в соли с последующей переплавкой. Цезий особой чистоты (основная примесь калий, менее 0.01 мас. %) запаянный в ампулы, вскрывался и перегонялся в прибор в вакууме при давлении остаточных газов около 1 Па. Конструкция прибора позволяла после эксперимента изменять концентрацию цезия отгонкой его части в вакууме, не вскрывая прибор. Все это позволяет снизить неконтролируемые контакты цезия и его соли с окружающей средой.
Тензиметрический метод измерения позволяет определять общее давление в приборе для определенной температуры расплава. Чтобы определить термодинамические характеристики цезия необходимо знание парциального давления цезия и его концентрацию в расплаве. Схема расчета [5] позволяет рассчитать концентрацию цезия в расплаве при каждой измеряемой температуре. Общее давление складывалось из парциальных давлений цезия и мономера и димера хлорида цезия. При расчете предполагалось отсутствие соединений в паре на основе цезия и его солевого компонента. Особенностью данных расплавов является большое различие в давлении паров индивидуальных компонентов, отличающиеся в зависимости от температуры на 2–3 порядка. Вклад парциального давления солевого компонента в общее давление заметен лишь для разбавленных растворов щелочного металла.
При увеличении концентрации цезия общее давление паров возрастает на столько, что вклад давления солевого компонента приближается к погрешности определения общего давления. Также необходимо отметить, что в области разбавленных растворов цезия солевой компонент проявляет себя как близкий к идеальному, т.к. коэффициент активности его при приближении концентрации к 100% стремится к 1. Однако программа расчета после решения уравнения Гиббса–Дюгема учитывала неидеальность солевого компонента и в последующем определении парциального давления цезия вновь рассчитывала коэффициент активности щелочного металла. После сравнения рассчитанных коэффициентов активности цезия в приближении идеальности солевого компонента и после учета его неидеальности делался вывод о целесообразности повторной итерационной процедуры определения неидеальности солевого компонента. Все необходимые данные по давлению цезия и его хлорида рассчитывались с использованием справочника [6]. Из парциального давления пара цезия, через вириальное уравнение для пара цезия и мольный объем щелочного металла, по этому же справочнику [6] рассчитывалась фугитивность цезия и фугитивность цезия над индивидуальным цезием при данной температуре.
Коэффициент активности цезия в расплаве находили из выражения:
где yCs – коэффициент активности цезия, f – фугитивность цезия при его парциальном давлении, fо – фугитивность цезия над индивидуальным цезием при данной температуре, NCs – мольная доля цезия.
Вид аппроксимирующего уравнения для yCs в опытах:
(1)
$\ln {{\gamma }_{{{\text{Cs}}}}} = A + \frac{B}{T} + C \cdot \left( {1 - \frac{{1050}}{T} + \ln \frac{{1050}}{T}} \right) \pm \Delta .$Коэффициенты уравнения, общая погрешность на доверительном уровне 0.95, с использованием при расчете коэффициента Стьюдента, число экспериментальных точек (n) и интервал температуры исследования в однофазной области для конкретных опытов приведены в табл. 1.
Таблица 1
| № | NCs ∙ 100 | А | В | С | Δ | n | ΔТ, К | |
|---|---|---|---|---|---|---|---|---|
| 1 | 0.09 | –3.097 | 5406 | –8.327 | 5.99 | 34 | 911 | 1310 |
| 2 | 0.15 | –1.591 | 4160 | – | 8.03 | 13 | 984 | 1198 |
| 3 | 0.17 | –2.652 | 5093 | –13.035 | 1.98 | 22 | 925 | 1302 |
| 4 | 0.18 | –2.958 | 5204 | –2.294 | 2.66 | 15 | 935 | 1255 |
| 5 | 0.22 | –2.680 | 5282 | –6.860 | 4.14 | 19 | 916 | 1257 |
| 6 | 0.3 | –2.976 | 5093 | –13.804 | 3.59 | 7 | 935 | 1166 |
| 7 | 1.37 | –2.613 | 4748 | –2.657 | 0.23 | 12 | 917 | 1193 |
| 8 | 1.77 | –2.515 | 4611 | –4.101 | 1.43 | 8 | 945 | 1196 |
| 9 | 1.94 | –2.352 | 4357 | –1.687 | 1.50 | 7 | 947 | 1298 |
| 10 | 2.24 | –2.476 | 4496 | –5.088 | 1.49 | 12 | 912 | 1218 |
| 11 | 4.08 | –2.201 | 4043 | –2.104 | 0.50 | 16 | 918 | 1209 |
| 12 | 5.59 | –1.395 | 3181 | – | 1.62 | 12 | 948 | 1246 |
| 13 | 6.88 | –1.610 | 3243 | –1.070 | 1.00 | 17 | 914 | 1268 |
| 14 | 8.68 | –1.687 | 3212 | –1.334 | 0.44 | 12 | 916 | 1269 |
| 15 | 10.9 | –1.293 | 2683 | –0.844 | 0.76 | 11 | 947 | 1264 |
| 16 | 13.8 | –1.207 | 2461 | –0.528 | 0.52 | 20 | 899 | 1258 |
| 17 | 24.1 | –0.871 | 1743 | – | 1.29 | 17 | 905 | 1237 |
| 18 | 31.4 | –0.721 | 1435 | 0.761 | 0.36 | 23 | 903 | 1254 |
| 19 | 37.5 | –0.519 | 1087 | 0.719 | 0.77 | 17 | 903 | 1242 |
| 20 | 49.1 | –0.307 | 676 | 1.690 | 0.67 | 21 | 892 | 1249 |
| 21 | 50.4 | –0.457 | 810 | –2.636 | 2.03 | 18 | 843 | 1188 |
| 22 | 58.9 | –0.320 | 569 | 1.167 | 0.6 | 10 | 895 | 1202 |
| 23 | 71.1 | –0.197 | 314 | –1.274 | 1.26 | 14 | 840 | 1188 |
| 24 | 77.1 | –0.112 | 175 | – | 1.18 | 27 | 883 | 1191 |
| 25 | 78.2 | –0.138 | 189 | – | 0.80 | 14 | 892 | 1212 |
| 26 | 80.9 | –0.206 | 259 | – | 1.07 | 19 | 862 | 1174 |
| 27 | 85.6 | –0.114 | 151 | 0.47 | 0.54 | 9 | 868 | 1197 |
| 28 | 85.7 | –0.087 | 105 | 0.615 | 0.31 | 37 | 830 | 1209 |
| 29 | 88.3 | –0.078 | 62 | – | 1.40 | 8 | 867 | 1162 |
| 30 | 88.7 | –0.084 | 109 | – | 1.10 | 13 | 869 | 1193 |
| 31 | 89.8 | –0.037 | 43 | 0.391 | 0.47 | 14 | 844 | 1212 |
| 32 | 90.7 | –0.064 | 74 | 0.714 | 0.21 | 9 | 816 | 1114 |
| 33 | 91.9 | –0.02 | –3 | 0.544 | 0.74 | 10 | 842 | 1215 |
| 34 | 92.7 | –0.037 | 43 | – | 0.56 | 17 | 782 | 1188 |
| 35 | 96.1 | 0.049 | –95 | –1.003 | 1.21 | 16 | 808 | 1197 |
| 36 | 97.1 | 0.082 | –82 | – | 0.61 | 12 | 754 | 1148 |
| 37 | 98.0 | 0.045 | –93 | – | 0.85 | 10 | 855 | 1180 |
| 38 | 99.0 | 0.071 | –110 | – | 1.88 | 16 | 719 | 1162 |
Все экспериментальные данные можно достаточно точно описать общим уравнением с 13 параметрами.
(2)
$\ln {{\gamma }_{{{\text{Cs}}}}} = {{\left( {1 - {{N}_{{{\text{Cs}}}}}} \right)}^{2}} \cdot \left[ {\sum\limits_{i = 0}^{{{n}_{1}}} {{{a}_{i}} \cdot N_{{{\text{Cs}}}}^{i}} + \sum\limits_{i = 0}^{{{n}_{2}}} {{{b}_{i}} \cdot \frac{{N_{{{\text{Cs}}}}^{i}}}{T}} + \sum\limits_{i = 0}^{{{n}_{3}}} {{{с}_{i}} \cdot N_{{{\text{Cs}}}}^{i} \cdot \left( {1 - \frac{{{{T}_{^\circ }}}}{T} + \ln \frac{{{{T}_{^\circ }}}}{T}} \right)} } \right] \pm \Delta {\kern 1pt} .$Коэффициенты общего уравнения, погрешность на доверительном уровне 0.95 с использованием при расчете коэффициента Стьюдента, и число экспериментальных точек, вошедших в обработку, приведено в табл. 2.
Таблица 2
| Параметры уравнения | ||||||||
|---|---|---|---|---|---|---|---|---|
| 1 | a0 | –2.93290 | 6 | b0 | 5187.817 | 11 | c0 | –5.421 |
| 2 | a1 | 15.50184 | 7 | b1 | –21 955.62 | 12 | c1 | 37.05028 |
| 3 | a2 | –54.01748 | 8 | b2 | 73 543.42 | 13 | c2 | –32.7018 |
| 4 | a3 | 78.88302 | 9 | b3 | –103 251.5 | Δ = | 0.0211 | |
| 5 | a4 | –44.15770 | 10 | b4 | 53 956.81 | = число точек | 498 | |
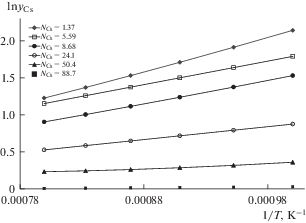
На рис. 1 показана температурная зависимость для экспериментальных данных ln yCs от 1/Т. Видно, что логарифм коэффициента активности цезия в этих координатах линейно убывает с ростом температуры. Коэффициент активности цезия с увеличением концентрации щелочного металла резко уменьшается.
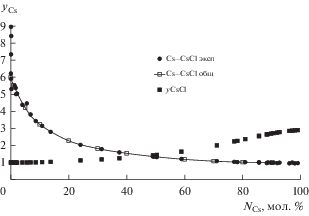
На рис. 2 показана концентрационная зависимость коэффициента активности цезия и его хлорида для конкретных опытов при температуре 1050 К. Здесь же, для сравнения, показана концентрационная зависимость коэффициента активности цезия, рассчитанная по общему уравнению. Видно, что коэффициент активности цезия максимален при небольших концентрациях щелочного металла и резко убывает с ростом его концентрации, асимптотически приближаясь к 1. Видно также, что коэффициент активности хлорида цезия при небольших концентрациях цезия мало отличается от 1. Концентрационная зависимость коэффициента активности цезия, рассчитанная по общему уравнению, хорошо описывает экспериментальные данные.
Рис. 2.
Зависимость коэффициента активности цезия и его хлорида от концентрации цезия в расплавах Cs‒CsCl. Температура 1050 К.
Величины коэффициента активности цезия в этих расплавах меньше чем у расплавов калия и натрия [7, 8] в собственных галогенидах, однако вид зависимости от концентрации и температуры схож. Известно также, что цезиевые металло-солевые смеси не имеют выраженного купола расслоения [9], однако т.к. коэффициенты активности цезия больше 1, то это может указывать на тенденцию к расслоению.
Список литературы
Смирнов М.В., Чебыкин В.В., Циовкина Л.А., Краснов Ю.Н. Прибор для измерения давления агрессивных высокотемпературных сред статическим методом // Журн. физ. химии. 1977. 51. № 7. С. 1848–1850.
Чебыкин В.В., Ивенко В.М., Циовкина Л.А., Смирнов М.В.. Экспериментальное исследование давления насыщенных паров растворов цезия в его расплавленных галогенидах. I. Система Cs–CsF. Свердловск. 1987. Деп. в ВИНИТИ 12.01.1987. № 799 – В87.
Ивенко В.М., Циовкина Л.А. Давление насыщенных паров и термодинамические свойства калия, растворенного в расплавленном фториде калия // Расплавы. 1998. № 5. С. 41–47.
Шишкин В.Ю., Митяев В.С. Очистка галогенидов щелочных металлов методом зонной плавки // Изв. АНСССР. Неорган. материалы. 1982. 18. № 11. С. 1917–1918.
Ивенко В.М. Давление насыщенных паров и термодинамические свойства растворов калия в расплавленных бинарных смесях его галогенидов. Дисс. канд. хим. наук. Свердловск: Ин-т электрохимии УНЦ АН СССР, 1988.
Глушко В.П. Термодинамические свойства индивидуальных веществ: Справ, изд-е. М.: Наука, 1978, 1982.
Smirnov M.V., Chebykin V.V., Tsiovkina L.A. The thermodynamic properties of sodium and potassium dissolved in their molten chlorides, bromides, and iodides // Electrochimica Acta. 1981. 26. № 9. P. 1275–1288.
Smirnov M.V, Ivenko V.M. Saturation vapor pressure and thermodynamic properties of potassium solutions in molten binary mixtures of its halides // Electrochimica Acta. 1990. 35. № 2. P. 529–538.
Bredig M.A. Mixtures of metals with molten salts. In Molten salts chemistry. N.Y. ets.: Interscience Publ. 1964. P. 367–425.
Дополнительные материалы отсутствуют.