Расплавы, 2020, № 2, стр. 155-165
Новый способ синтеза лигатур Al–Sc в оксидно-фторидных и фторидных расплавах
А. Ю. Николаев a, b, *, А. В. Суздальцев a, Ю. П. Зайков a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет
Екатеринбург, Россия
* E-mail: suzdaltsev_av@mail.ru
Поступила в редакцию 12.05.2019
После доработки 21.05.2019
Принята к публикации 19.06.2019
Аннотация
Методом вольтамперометрии изучена кинетика электровыделения алюминия и скандия из фторидных и оксидно-фторидных расплавов. Определены параметры (область потенциалов, токи) электровыделения алюминия и скандия из фторидных расплавов с добавками Al2O3, Sc2O3, AlF3 и ScF3 в диапазоне температур 750–800°С. Предложен новый подход для производства богатых по скандию лигатур Al–Sc, включающий электроосаждение алюминия и скандия на твердом катоде при электролизе фторидных и оксидно-фторидных расплавов и последующее растворение полученного катодного осадка в жидком алюминии. На основании электрохимических измерений выбраны параметры электролиза и проведены электролизные испытания по получению лигатур Al–Sc. Определены катодные выхода по току при совместном электроосаждении алюминия и скандия и изучена микроструктура получаемых лигатур Al–Sc.
ВВЕДЕНИЕ
В настоящее время значительное внимание уделяется производству лигатур для получения сплавов и композиционных материалов на основе алюминия [1–3]. Благодаря уникальному сочетанию физико-механических свойств, одним из перспективных продуктов с точки зрения производства сплавов являются лигатуры Al–Sc [4–7], для производства которых разработаны способы прямого сплавления металлов, алюминотермического или электролитического восстановления солей или оксида скандия в расплавах [7–12]. Несмотря на относительно высокое извлечение скандия в алюминий указанными способами, поиск альтернативных подходов при получении лигатур Al–Sc остается актуальным.
Для улучшения технологичности процесса и повышения извлечения скандия из его солей или оксида при производстве лигатур Al–Sc предлагается новый подход, включающий совместное электроосаждение алюминия и скандия на твердом катоде из галогенидных и оксидно-галогенидных расплавов с последующим растворением катодного осадка в жидком алюминии. Такой подход может обеспечить получение более богатых по скандию лигатур c возможностью применения ранее разработанных эффективных конструкций электролизеров. Для осуществления предлагаемого подхода необходимы данные по кинетике совместного электровыделения указанных металлов из расплавов. В литературе преимущественно представлены результаты изучения электровыделения либо скандия, либо алюминия из галогенидных расплавов на различных катодных материалах [13–19].
В данной работе методом вольтамперометрии изучена кинетика электровыделения алюминия и скандия из фторидных и оксидно-фторидных расплавов в области температур 750–800°С. Для исследований выбраны расплавы KF–AlF3, LiF–NaF и LiF–CaF2 с добавками ScF3 и Sc2O3. Полученные результаты использованы в электролизных испытаниях с целью получения скандий-содержащих лигатур и сплавов на основе алюминия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление расплавов. Расплавы для проведения измерений готовили путем сплавления индивидуальных фторидов LiF, NaF, CaF2, AlF3 и KF (ОАО “Вектон”, Россия). Безводный фторид калия получали путем термического разложения KF ∙ HF при поэтапном нагревании соли до 900°С. Приготовленные расплавы подвергали очистному электролизу в течение 2 ч при потенциале графитового катода 0.2 В относительно потенциала алюминиевого электрода [20]. По данным анализатора кислорода (LECO Corp, США) концентрация кислорода в приготовленных расплавах не превышала 0.1 мас. % (в пересчете на Al2O3). В полученный расплав добавляли необходимое количество ScF3 или Sc2O3 (ООО “Интермикс-Мет”, Россия). Масса расплава в ячейке составляла 200 г.
Электрохимические измерения. Электрохимические измерения проводили в трех-электродной ячейке в атмосфере воздуха в интервале температур 750–800°С. Контейнер для расплава, изготовленный из графита марки МПГ-8, одновременно служил вспомогательным электродом. В качестве рабочих электродов использовали стержни из стеклоуглерода СУ-2000 и вольфрама диаметром 2 мм. Потенциал рабочего электрода измеряли относительно потенциала алюминиевого электрода [20]. Вольтамперограммы получали при помощи PGSTAT AutoLab 320N и ПО NOVA 1.11 (The MetrOhm, Нидерланды). Для определения и компенсации омической составляющей измерительной цепи использовали процедуру “I-Interrupt”. Температуру расплава измеряли термопарой Pt/PtRh и поддерживали постоянной (±2°С) с помощью термопарного модуля USB-ТС01 (National Instruments, США).
Электролизные испытания. Электролизные испытания проводили в лабораторном электролизере на силу тока до 20 А с расплавом массой 500–520 г. Электролизер представлял собой корундовый контейнер с вертикально расположенными пластинами из вольфрама (катод) и плотного графита (анод). Межэлектродное расстояние составляло 4 см. После погружения электродов в расплав и достижения рабочей температуры вели электролиз исследуемого расплава при помощи PGSTAT AutoLab 320N, BOOSTER 20A и ПО NOVA 1.11 (The MetrOhm, Netherlands). В ходе электролиза фиксировали ток и потенциал катода. По окончании электролиза осадок счищали с электродов и растворяли в жидком алюминии под слоем расплава, используемого при электролизе.
Анализ расплавов и продуктов. Элементный и фазовый состав расплавов и полученных продуктов определяли с использованием спектрометра iCAP 6300 Duo (Thermo scientific, США) и дифрактометра Rigaku D/MAX-2200VL/PC (Rigaku, Япония). Структуру лигатур Al-Sc анализировали на сканирующем электронном микроскопе JMS-5900LV с микроанализатором INCA Energy 200 и энерго-дисперсионным микроанализатором INCA Wave 250 (JEOL, UK). Для этого из отливок лигатур изготавливали шлифы при помощи режущего и шлифовального оборудования (Struers, Denmark).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вольтамперные измерения. В качестве оксидно-фторидных расплавов выбраны системы на основе KF–AlF3, обладающие относительно высокой растворимостью Al2O3 и Sc2O3 [21, 22]. На рис. 1 приведены вольтамперограммы, полученные на вольфраме в расплаве KF–AlF3 ([KF]/[AlF3] = 1.5) с добавками Sc2O3 при температуре 800°С [23]. Электровыделение алюминия начинается при потенциалах отрицательнее –0.2 В с формированием пика (Al) при –0.45 В и сохранением тока электровыделения алюминия при дальнейшем смещении потенциала в отрицательную сторону. Добавление Sc2O3 в расплав приводит к появлению дополнительного пика электровыделения скандия (Sc + Al) на фоне волны электровыделения алюминия в области потенциалов от –0.55 до –0.75 В и появлению волны (K) электровыделения калия при потенциале около –1.1 В. Электровыделение калия при более положительных потенциалах может быть связано с образованием соединений KSc, K2Sc и K3Sc [24] и восстановлением KF скандием [25, 26]. Стоит отметить также появление гистерезиса на катодной ветви вольтамперограмм, связанного с ростом катодного осадка [27].
Рис. 1.
Вольтамперограммы на вольфраме в расплаве KF–AlF3 ([KF]/[AlF3] = 1.5) с добавками Sc2O3 при 800°С и скорости развертки потенциала 0.1 В/с.
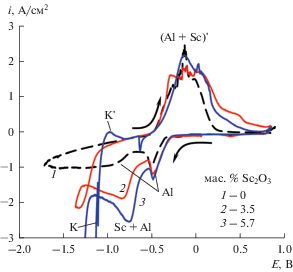
При развертке потенциала в анодную сторону наблюдается пик растворения скандия и алюминия сложной формы.
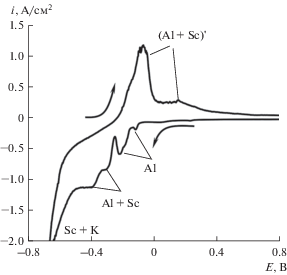
На рис. 2 приведены вольтамперограммы, полученные на стеклоуглероде в расплаве KF–AlF3 ([KF]/[AlF3] = 1.3) с 10 мас. % ScF3 при 750°С и скоростью развертки потенциала 0.1 В/с. Фторид скандия в расплав задавали в виде предварительно приготовленной смеси KF–ScF3. В области потенциалов от –0.05 до –0.40 В наблюдается ряд пиков, характеризующих электровыделение алюминия и совместное электровыделение алюминия и скандия. Большее число пиков в богатом по скандию расплаве может быть связано с образованием интерметаллидных соединений Al–Sc разного состава. При потенциале отрицательнее –0.65 В наблюдается волна электровыделения калия, которая в расплаве KF–AlF3–Sc2O3 наблюдалась при потенциале около –1.1 В. Как было отмечено выше, деполяризация может быть связана с образованием соединений K–Sc и восстановлением KF алюминием и скандием. С точки зрения термодинамики металлические скандий и алюминий не должны вытеснять калий из фторида, однако реакции могут достаточно быстро протекать в прямом направлении за счет отвода калия от зоны реакции при температуре, близкой к температуре кипения калия (759°С). Подобные явления были экспериментально отмечены ранее [25].
Рис. 2.
Вольтамперограммы на стеклоуглероде в расплаве KF–AlF3 ([KF]/[AlF3] = 1.3) с 10 мас. % ScF3 при 750°С и скорости развертки потенциала 0.1 В/с.
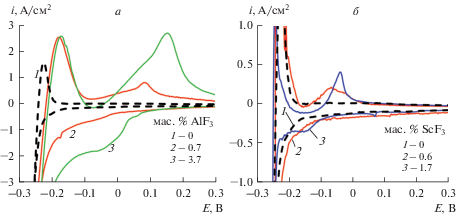
Для расширения представлений о кинетике электровыделения скандия были получены вольтамперограммы в расплавах, в которых содержание алюминия существенно меньше, чем в электролите KF–AlF3. На рис. 3 приведены вольтамперограммы на вольфраме в эвтектическом расплаве LiF–NaF без добавок и с добавками AlF3 и ScF3. Электровыделение алюминия и натрия из фторидного расплава наблюдаются при потенциалах отрицательнее 0 и –0.15 В относительно потенциала алюминиевого электрода, соответственно. При этом повышение содержания AlF3 в расплаве сопровождается увеличением катодного тока восстановления ионов Al3+ и анодного тока окисления алюминия. Добавление и повышение содержания ScF3 в расплаве LiF–NaF практически не повышает катодные токи, но приводит к появлению анодного пика окисления скандия. Предполагаем, что в данном расплаве электровыделение натрия протекает при более положительном потенциале, чем выделение скандия, и появление анодных пиков растворения скандия может указывать на металлотермическое восстановление ионов Sc3+. Это подтверждают термодинамические оценки, согласно которым потенциал электровыделения скандия отрицательнее потенциала алюминиевого электрода на 0.44 В [28], в то время как начало выделения натрия из расплава LiF–NaF наблюдается уже при потенциале –0.15 В (рис. 3).
Рис. 3.
Вольтамперограммы на вольфраме в расплаве LiF–NaF с добавками AlF3 (а) и ScF3 (б) при 750°С и скорости развертки потенциала 0.1 В/с.
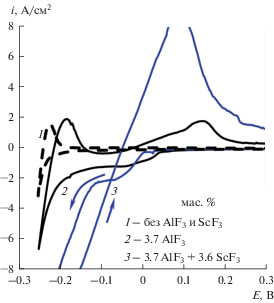
При совместном электровыделении алюминия и скандия из расплава LiF–NaF–AlF3–ScF3 на вольтамперной зависимости (рис. 4) наблюдается увеличение катодного тока и появление гистерезиса.
Рис. 4.
Вольтамперограммы на вольфраме в расплаве LiF–NaF с добавками AlF3 и ScF3 при 750°С и скорости развертки потенциала 0.1 В/с.
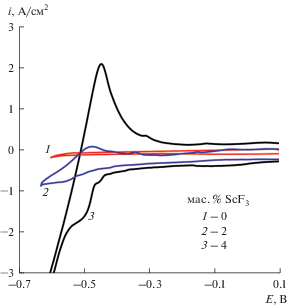
Для установления области потенциалов электровыделения скандия получены вольтамперные зависимости в эвтектическом расплаве LiF–CaF2 (рис. 5). Из них прослеживается зависимость плотности тока электровыделения скандия от заданного содержания ScF3 в расплаве. Потенциал начала электровыделения скандия относительно потенциала алюминиевого электрода находится в диапазоне от –0.44 до –0.45 В. Эта величина близка к термодинамическому значению разности потенциалов между скандием и алюминием [28].
Рис. 5.
Вольтамперограммы на вольфраме в расплаве LiF–CaF2 с добавками ScF3 при 800°С и скорости развертки потенциала 0.1 В/с.
Полученные результаты вольтамперных измерений были использованы при выборе области потенциалов и токов электровыделения алюминия и скандия при электролизных испытаниях.
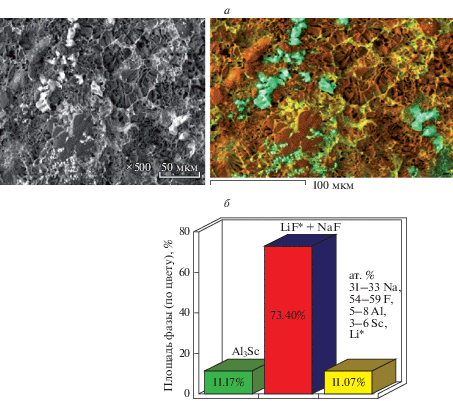
Электролизные испытания. Проверку предложенного подхода получения лигатур Al–Sc осуществляли в расплавах LiF–NaF–AlF3–ScF3 и KF–AlF3–Sc2O3 при разных параметрах (табл. 1). Электролизные испытания проводили как в потенциостатическом, так и в гальваностатическом режимах. В ходе потенциостатического электролиза наблюдали рост катодного тока по причине увеличения катодной поверхности. По окончании электролиза в обоих режимах был получен рыхлый катодный осадок (рис. 6). Согласно результатам химического, рентгенофазового и микрорентгеноструктурного анализов осадок представляет собой смесь фаз интерметаллидного соединения (Al3Sc) с компонентами электролита (LiF, NaF).
Таблица 1.
Параметры и результаты электролизных испытаний
| № опыта | Расплав | T, °C | i, А см–2 | Время, мин |
U, В | Выход по току, % | РФА осадка |
|---|---|---|---|---|---|---|---|
| 1 | LiF–NaF–AlF3–ScF3 | 750 | 0.8–0.9 | 120 | –0.1 | Не оценивали | NaF, Al, Al3Sc, примеси: ScF3, Sc2O3 |
| 2 | 750 | 0.8 | 120 | –0.1…–0.2 | |||
| 3 | KF–AlF3–Sc2O3 | 800 | 0.7 | 260 | –0.1…–0.4 | 65.2 Al, 14.5 Sc |
Al3Sc, KAlF4, K3AlF6, K2AlF5, KAl4F13 |
| 4 | 800 | 0.55 | 320 | –0.1…–0.3 | 62.3 Al, 10.8 Sc |
||
| 5 | 750 | 0.4 | 480 | –0.1…–0.2 | 60.3 Al, 13.5 Sc |
||
| 6 | KF–AlF3–Al2O3 | 750 | 0.4 | 480 | –0.1…–0.2 | 77.1 Al |
Рис. 6.
Микрофотография катодного осадка и распределение фаз в нем после электролиза расплава NaF‒LiF–AlF3–ScF3.
В ходе электролизных испытаний в расплав KF–AlF3–Sc2O3 периодически подгружали оксид Sc2O3 в соответствии с токовой нагрузкой. В результате серии электролизных испытаний на предварительно смоченном алюминием катоде образовывались твердые рыхлые осадки с частично металлическим блеском, содержащие фазы Al3Sc, KAlF4, K3AlF6, K2AlF5 и KAl4F13 по данным рентгенофазового анализа. В расплаве при этом наряду с фазами KAlF4, K3AlF6, K2AlF5 и KAl4F13 были обнаружены достаточно четкие линии ScOF. Аналогичные результаты были достигнуты при снижении катодной плотности тока и при снижении температуры электролиза с 800 до 750°С.
Стоит отметить, что во всех случаях на катоде образовывался твердый осадок, что указывает на преимущественное электровыделение алюминия и скандия в виде интерметаллидного соединения Al3Sc. Для сравнения был проведен электролиз расплава KF–AlF3–Al2O3 при 750°С с использованием алюминиевого катода (опыт № 6 в табл. 1).
Для определения катодного выхода по току этого осадок счищали с вольфрамовой пластины и растворяли в жидком алюминии под слоем солевого флюса при 900°С в условиях периодического механического перемешивания. При этом достигалось полное отделение из катодного осадка целевого продукта (Al3Sc). Зная увеличение массы полученного слитка и содержание элементов в нем оценивали катодные выхода по току. При оценке теоретической массы катодного осадка принимали, что скандий и алюминий выделяются в виде интерметаллидного соединения Al3Sc. Из табл. 1 видно, что в условиях электролиза с использованием вертикальных электродов выхода по току для алюминия и скандия при их совместном электровыделении достигают 65.2 и 14.5% соответственно. Суммарный катодный выход по току достигает 75–80%. Для сравнения, катодный выход по току при индивидуальном электровыделении алюминия составил 77.1%.
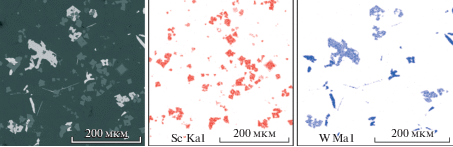
На рис. 7 приведена микрофотография лигатуры Al–Sc с содержанием 2 мас. % скандия, полученной путем растворения катодного осадка с вольфрамового вертикального катода после электролиза расплава KF–AlF3–Sc2O3 при 750°С. В случае использования вольфрамового катода в лигатуре присутствуют соединения Al–W, которые могут быть исключены при использовании катода из другого материала (например, TiB2).
Рис. 7.
Микрофотография лигатуры Al–Sc, полученной при электролизе расплава KF–AlF3–Sc2O3 при 750°С с использованием вертикального вольфрамового катода.
Полученные результаты указывают на принципиальную возможность получения лигатур Al–Sc при электролизе фторидных и оксидно-фторидных расплавов с использованием вертикального расположения электродов.
ВЫВОДЫ
При помощи вольтамперных измерений оценены диапазоны потенциалов и токи электровыделения алюминия и скандия из фторидных и оксидно-фторидных расплавов. Показано, что электровыделение алюминия и скандия из расплавов KF–AlF3–Al2O3–Sc2O3 на вольфраме без прямого электровыделения калия протекает в области потенциалов от –0.1 до –1.1 В относительно потенциала алюминиевого электрода. При этом замена Al2O3 на Sc2O3 приводит к появлению дополнительного пика электровыделения скандия на фоне волны выделения алюминия.
Характер электровыделения скандия из фторидных расплавов определяется присутствием в расплаве компонентов (AlF3, NaF), разложение которых протекает при более положительных потенциалах. Следовательно, электровыделение скандия из таких расплавов протекает на фоне выделения алюминия и натрия с вероятным металлотермическим восстановлением ионов Sc3+.
Проведены испытания по электроосаждению твердых осадков Al–Sc из расплавов LiF–NaF–AlF3–ScF3 и KF–AlF3–Sc2O3 в электролизере с вертикальными электродами и показано, что преимущественным катодным продуктом является соединение Al3Sc. Предложен новый подход для производства лигатур Al–Sc, включающий электровыделение алюминия и скандия из фторидов или оксидов при электролизе фторидных или оксидно-фторидных расплавов и последующее растворение полученного катодного осадка в жидком алюминии. Определен катодный выход по току при совместном электровыделении алюминия и скандия из расплава KF–AlF3–Sc2O3, которые достигают 65.2 и 14.5% соответственно.
В работе использовано оборудование и методики ЦКП “Состав вещества” Института высокотемпературной электрохимии УрО РАН.
Список литературы
Inoue A. Amorphous, nanoquasicrystalline and nanocrystalline alloys in Al-based systems // Progress in Materials Science. 1998. 43. P. 365–520.
Filatov A.A., Pershin P.S., Suzdaltsev A.V., Nikolaev A.Yu., Zaikov Yu.P. Synthesis of Al–Zr master alloys via the electrolysis of KF–NaF–AlF3–ZrO2 melts // J. Electroch. Soc. 2018. 165. № 2. E28–E34.
Меньшикова С.Г., Ширинкина И.Г., Бродова И.Г., Бражкин В.В. Структура сплава Al90Y10 при кристаллизации под давлением // Расплавы. 2019. № 1. С. 18–23.
Royset J., Ryum N. Scandium in aluminium alloys overview: physical metallurgy, properties and applications // International Materials Reviews. 2005. 50. P. 19–46.
Ткачева О.Ю., Бродова И.Г., Архипов П.А., Зайков Ю.П. Влияние условий кристаллизации на структуру и модифицирующую способность Al–Sc-сплавов // Известия вузов. Цвет. металлургия. 2016. № 6. С. 55–64.
Яценко С.П., Овсянников Б.В., Ардашев М.А., Сабирзянов А.Н. Цементационное получение “мастер-сплава” из фторидно-хлоридных расплавов // Расплавы. 2006. № 5. С. 29–36.
Напалков В.И., Махов С.В. Легирование и модифицирование алюминия и магния. МИСиС: М. 2002.
Castrillejo Y., Vega A., Vega M., Hernandez P., Rodriguez J.A., Barrado E. Electrochemical formation of Sc-Al intermetallic compounds in the eutectic LiCl-KCl. Determination of thermodynamic properties // Electrochimica Acta. 2014. 118. P. 58–66.
Суздальцев А.В., Филатов А.А., Николаев А.Ю., Панкратов А.А., Молчанова Н.Г., Зайков Ю.П. Извлечение скандия и циркония из их оксидов при электролизе оксидно-фторидных расплавов // Расплавы. 2018. № 1. С. 5–13.
Махов С.В., Москвитин В.И. Основы кинетики алюминотермического восстановления скандия из хлоридно-фторскандиатных расплавов // Известия вузов. Цвет. металлургия. 1998. № 2. С. 13–16.
Москвитин В.И., Махов С.В. О возможности получения алюминиево-скандиевой лигатуры в алюминиевом электролизере // Цветные металлы. 1998. № 7. С. 43–46.
Суздальцев А.В., Николаев А.Ю., Зайков Ю.П. Обзор современных способов получения лигатур Al–Sc // Цветные металлы. 2018. № 1. С. 69–73.
Kononov A., Kuznetsov S., Polyakov E. Electrorefining in molten salts – an effective method of high purity tantalum, hafnium and scandium metal production // J. Alloys and Compounds. 1995. 218. P. 173–176.
Kononov A., Polyakov E. Cathodic process in halide melts containing scandium // Electrochimica Acta. 1998. 43. P. 2537–2542.
Sun B., Zhai Yu., Tian Ya., Zhao Ya. Reduction mechanism of Sc3+ ion on Ag electrode in fluoride salt melt // The Chinese J. Nonferrous Metals. 1997. № 7. P. 35–37.
Tian Y., Sun B., Zhai Yu. Preparation of Al–Sc alloy in chloride system with molten salt electrolysis // Transactions of Nonferrous Metals Society of China. 1998. 8. № 4. P. 626–631.
Guo R., Zhai X., Zhang T. Preparation of Al-Sc alloy by LiF–ScF3–ScCl3 molten salt electrolysis // Materials Science Forum. 2011. 675–677. P. 1125–1128.
Odegard R., Bjorgum A., Sterten A., Thonstad J., Tunold R. Kinetics of aluminium deposition from aluminium chloride-alkali chloride melts // Electrochimica Acta. 1982. 27. P. 1595–1598.
Николаев А.Ю., Ясинский А.С., Суздальцев А.В., Поляков П.В., Зайков Ю.П. Вольтамперометрия в расплаве и суспензиях KF–AlF3–Al2O3 // Расплавы. 2017. № 3. С. 214–225.
Суздальцев А.В., Храмов А.П., Зайков Ю.П. Алюминиевый электрод для электрохимических исследований в криолит-глиноземных расплавах при 700–960°С // Электрохимия. 2012. 48. С. 1264–1271.
Руденко А.В., Ткачева О.Ю., Катаев А.А., Редькин А.А., Зайков Ю.П. Влияние Sc2O3 на физико-химические свойства легкоплавких криолитовых расплавов КF–AlF3 и КF–NaF–AlF3 // Электрохимия. 2018. 54. С. 786–793.
Дедюхин А.Е., Аписаров А.П., Ткачева О.Ю., Редькин A.A., Зайков Ю.П., Фролов А.В., Гусев А.О. Растворимость Al2О3 в расплавленной системе KF–NaF–AlF3 // Расплавы. 2009. № 2. С. 23–28.
Nikolaev A.Yu., Suzdaltsev A.V., Zaikov Yu.P. Electrowinning of aluminium and scandium from KF–AlF3–Sc2O3 melts for the synthesis of Al–Sc master alloys // J. Electrochemical Society. 2019. 166. № 8. D252–D257.
Лякишев Н. П. Диаграммы состояния двойных металлических систем: Справочник в 3 т. М.: Машиностроение, 1996.
Шишкин В.Ю. Давление паров цезия над расплавленными смесями фторидов цезия и циркония // Расплавы. 1994. № 5. С. 56–62.
Шуров Н.И., Храмов А.П., Зайков Ю.П., Ковров В.А., Суздальцев А.В. О механизме восстановления оксидов в расплавах хлорида кальция // Известия вузов. Цвет. металлургия. 2015. № 2. С. 14–19.
Исаев В.А., Гришенкова О.В., Лаптев М.В., Исаков А.В., Зайков Ю.П. Формирование электродного осадка в гальваностатических условиях // Расплавы. 2018. № 4. С. 428–434.
Turkdogan E.T. Physical chemistry of high-temperature technology. Academic Press, N.Y., 1980.
Дополнительные материалы отсутствуют.


