Расплавы, 2020, № 2, стр. 166-175
О тепловой калибровке эстанса в расплавленных электролитах и оценка коэффициентов Пельтье и Зеебека
Ю. Г. Пастухов *
Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: yuripast@bk.ru
Поступила в редакцию 02.06.2018
После доработки 15.06.2018
Принята к публикации 13.07.2018
Аннотация
Предлагается для тепловой калибровки эстанса исследуемого металлического электрода использовать электрохимическую теплоту Пельтье реакции анодного растворения. Изменение потенциала электрода приводит к постепенному переходу от двойнослойного процесса заряжения и адсорбции к области обратимого электрода. Использование данных теплового эстанса для золота в расплаве CsCl позволило оценить величину коэффициентов Пельтье и Зеебека для этой полуреакции.
ВВЕДЕНИЕ
Если изучение явлений, протекающих на идеально поляризуемом электроде, имеет, в основном, фундаментальный характер [1, 2], то оптимизация процессов электролиза приносит осязаемую выгоду.
Теплота, выделяющаяся на отдельном электроде электрохимической ячейки, кажется доступной прямому калориметрическому измерению, тогда как его потенциал Е может быть измерен только относительно второго электрода, обычно это неполяризуемый электрод сравнения. Термогальванические цепи изучаются методами термодинамики необратимых процессов [3, с. 415]. Термопотенциал ε или коэффициент Зеебека, (измеренный для двух одинаковых обратимых электродов с градиентом температуры) определяет знак и величину локальной теплоты Пельтье W при прохождении заряда (тока) согласно первому уравнению Томсона (T и S – температура и энтропия, n и F – заряд иона и постоянная Фарадея):
С теорией термоэлектрических процессов (начальная ε0 и стационарная термо-ЭДС ε∞, энтропия движущихся ионов) можно ознакомиться в работе [4]. Начальная термо-ЭДС отличается от стационарной из-за действия термодиффузии. Хотя энтропия отдельного иона Si и его энтропия переноса $S_{{\text{i}}}^{*}$ не измеряются, их сумма, названная энтропией движущего иона $S_{{\text{i}}}^{ = }$ = Si+ $S_{{\text{i}}}^{*}$, может быть экспериментально определена [4, 5]. Экспериментально определяемая электрохимическая теплота Пельтье:(2)
$W = T(\Delta {{S}_{{{\text{гет}}}}}--{{\Sigma {{t}_{{\text{i}}}}{{S}_{{\text{i}}}}} \mathord{\left/ {\vphantom {{\Sigma {{t}_{{\text{i}}}}{{S}_{{\text{i}}}}} {{{n}_{{\text{i}}}}~}}} \right. \kern-0em} {{{n}_{{\text{i}}}}~}}--nS_{{\text{e}}}^{*})~$Для идеально поляризуемого электрода получены уравнения, описывающие частотную зависимость теплоты Пельтье [6]. Они проверены экспериментально при измерении гармонических колебаний потенциала при таком же изменении температуры (термоимпеданс) Pt электрода в растворе ${\text{Fe}}({\text{CN}})_{6}^{{{{3--} \mathord{\left/ {\vphantom {{3--} {4--}}} \right. \kern-0em} {4--}}}}$ при освещении светом лазера, модулированным от 1.3 до 6300 Гц [7]. При низкой частоте (<300 Гц и концентрации раствора 0.002 М) получается классическая теплота Пельтье электродной реакции:
Уменьшение W с ростом частоты связано с выключением вклада электродной реакции. Остается вклад, связанный с заряжением двойного слоя и адсорбцией компонентов раствора. Увеличение концентрации до 0.2 М сдвигает такой переход до 30 кГц. Для сравнения, прямое измерение методом термо-ЭДС дает при концентрации 0.2 М близкую величину W = 0.425 В, а методом эстанса 0.41 B [1, с. 48].
Использование эффекта Пельтье позволило прокалибровать (определить масштаб) величину q-эстанса в водных электролитах [1]. В статье, описывающей успехи электрохимии за 200 лет, предложено использовать дистанционный нагрев электрода лучом лазера сразу после получения экспериментальной зависимости эстанса для его калибровки при высокой температуре [2]. Реализация этой методики, к сожалению, имеет свои ограничения. Влияние нагрева электрода лазером можно прокалибровать по известному W для Au в растворе ферро-феррицианида, после чего использовать лазерный нагрев электрода в расплаве. Чтобы использовать эту методику, нужно быть уверенным, что замена раствора ${\text{Fe}}({\text{CN}})_{6}^{{{{3--} \mathord{\left/ {\vphantom {{3--} {4--}}} \right. \kern-0em} {4--}}}}$ на расплавленный электролит не изменит коэффициент передачи Епьезо/ΔF при прочих равных условиях. Здесь Епьезо – переменное напряжение пьезодатчика, ΔF – сила, действующая на изучаемую поверхность.
В расплавленных электролитах исследования термогальванических явлений начаты 180 лет назад [3] и продолжены авторами [8–19]. Тепловые эффекты при катодном выделении Ag из хлоридных расплавов NaCl + KCl + xAgCl изучались при 973 K [11]. Знак теплового эффекта зависел от плотности тока, времени и концентрации х. В разбавленных смесях при j < jпредельн температура уменьшалась, при j > jпредельн наблюдали переход от отрицательных ее значений к положительным, а при х = 50% – положительный температурный эффект. Отмечена вероятность дендритообразования и сложный характер процесса. В ходе катодного процесса приповерхностный слой обедняется ионами серебра, что особенно заметно при его малой исходной концентрации. Возможно, гомогенная составляющая (энтропия переноса иона в объеме) в некоторых условиях может превышать гетерогенную, что приводит к смене знака теплового эффекта. Аналогичные зависимости наблюдали в нитратных расплавах, причем выделение натрия сопровождается нагревом электрода [12]. Катодное электроосаждение серебра из нитратного расплава, содержащего 10, 100% AgNO3 повышает температуру электрода, а анодное растворение в расплаве, содержащем 1, 5, 10, 50 и 100% AgNO3 приводит к охлаждению электрода [13]. Аналогичное охлаждение золотого электрода при анодной поляризации наблюдали в расплаве CsCl [20].
Теория тепловых эффектов серебряного электрода в расплавленном нитрате, содержащем 0.5 мол. % AgNO3, приведена в [14], расчет дает ε0 = –0.649 мкВ/К. При плотности тока j = 0.2 А/см2 [AgNO3] = 5% у поверхности электрода и ε∞ = –0.149 мкВ/К. Соответственно, начальная теплота Пельтье W0 = –36.5 кДж/моль, W∞ = –24.2, стационарный гетерогенный Wмг = –8.4, распределенная теплота Пельтье Wрд = –15.8, теплота перенапряжения 12.3 кДж/моль. Знак “–” означает поглощение тепла при растворении серебра.
Кроме анодного растворения металлического электрода (Au, Ag, Cu) в расплавленных галогенидах, в области анодных потенциалов, возможно выделение галогена (Cl2, Br2, I2) [20–26]. При исследовании тепловых эффектов выделения хлора из хлоридного расплава, наблюдали охлаждение электрода [15, 16]. Мощность отрицательной теплоты Пельтье W = –0.108 Вт/см2 при j = 0.5 A/см2 дает оценку коэффициента Пельтье W = –0.216 В. Материал обобщен в [17].
Теория и результаты для системы Al/расплав NaF–AlF3–Al2O3 приведены в [18], анодный ток до 20 А/см2 за 3–5 мин. охлаждал электрод на 20 К, катодный ток – нагревал до 30 К. В работе [19] продолжены эти работы на Al, а также изучены процессы на Pt–O2 электроде в криолит-глиноземном расплаве. Поглощение тепла на аноде частично компенсируется его выделением при перенапряжении процесса и на омическом сопротивлении в электролите. По оценке [17] при получении алюминия при ε0 = = 1 мВ/К, Т = 1200 К, I = 150 кА, тепловая мощность Пельтье 180 кВт. Изучение этих эффектов необходимо для оптимизации работы промышленных электролизеров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика измерений эстанса описана ранее [1, 20]. Отметим, что воспроизводимые в независимых опытах плавные кривые получались после нескольких циклов потенциала с анодным растворением для удаления поверхностных примесей, иногда к этому приводило повышение температуры с дальнейшим ее понижением. Для золотого электрода такие кривые получались лучше, чем для платины, серебра и стеклоуглерода, что связано, возможно, с влиянием остаточного кислорода на поверхности или в объеме электродов.
Ранее изучалось поведение поверхности Au, Ag, Cu, Pt электродов в расплавленных галогенидах щелочных металлов методом E-эстанса [20–26]. Характерная экспериментальная зависимость приведена на рис. 1 для Au в расплаве CsCl. Амплитуда регистрируемого сигнала пьезодатчика пропорциональна ${{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial E}}} \right. \kern-0em} {\partial E}}$, размерность Кл/м2. Калибровка эстанса позволит связать измеряемую величину пьезосигнала с плотностью заряда изучаемой границы раздела и измерить наклон ${{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial q}}} \right. \kern-0em} {\partial q}}$ – Е зависимости вблизи ПНЗ, связанный с особенностями двойного слоя.
Рис. 1.
Экспериментальные зависимости эстанса и плотности тока j от потенциала для Au в расплаве CsCl при Т = 931 К, f = 4.8 кГц.
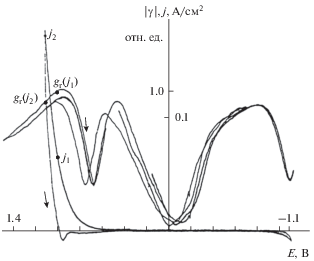
Медленная поляризация изучаемой границы позволяет перейти из двойнослойной области (эстанс натяжения) к области обратимого электрода (тепловой эстанс), т.к. в ходе анодного процесса вблизи поверхности концентрация ионов металла электрода достигает нескольких процентов [14, 27]. “Выделение тепла на поверхности электрода при его обратимом электрорастворении может быть использовано для теплового моделирования поверхностного натяжения” [1, стр. 376]. Уменьшение величины теплового эстанса при увеличении анодного тока позволяет определить его знак [1, стр. 56].
Области электрорастворения золота и выделения хлора в расплавах хлоридов щелочных металлов близки [27], но в расплавах бромидов и иодидов они отличаются. В последнем случае тепловой эстанс связан с анодным выделением галогена. Выделения пузырьков газа при этом не было. Оно хорошо регистрируется пьезодатчиком, например, при выделении водорода в водных электролитах.
При значительной анодной поляризации возможно протекание анодных процессов электрорастворения металла и выделение галогена (Х = Cl, Br, I):
(4)
${\text{AuCl}} = {\text{Au}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{C}}{{{\text{l}}}_{2}},$(7)
${{{\text{X}}}^{ - }} - {{{\text{e}}}^{ - }} = {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{X}}}_{2}}.$Осадок порошка золота (см. ур. (4)) после охлаждения ячейки находился на дне тигля.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Пределы областей поляризации выбирали такими, чтобы заряд, прошедший через границу при анодной развертке потенциала, превосходил заряд при катодной. Таким образом, поверхность металла обновлялась, и получались воспроизводимые кривые. При линейной развертке потенциала (от стационарного) и его малом гармоническом изменении (E = Ест + vt + ΔЕ sin ωt) регистрировались зависимости: плотности тока поляризации (j), модуля и фазы адмитанса (Y = dj/dE), модуля $\left| {\gamma {\kern 1pt} '} \right|$), фазы (arg γ') эстанса, иногда модуля 2-й (γ''), 3-й гармоник эстанса. При этом изменяли частоту (f от 0.5 до 50 кГц), температуру, состав электролита, природу металла (Au, Ag, Cu, Pt) [20–26]. Скорость развертки v = 50 мВ/c. Использовали свинцовый электрод сравнения.
Метод эстанса регистрирует механическое колебание электрода. Вызвать это колебание может заряжение двойного слоя и адсорбция на поляризуемом электроде (т.е. без переноса заряда). При этом регистрируется производная поверхностного натяжения. Для этих условий можно использовать уравнения Гохштейна для равновесного эстанса (низкая частота):
(8)
${{({{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial q}}} \right. \kern-0em} {\partial q}})}_{\vartheta }} = {{({{\partial E} \mathord{\left/ {\vphantom {{\partial E} {\partial \vartheta }}} \right. \kern-0em} {\partial \vartheta }})}_{Q}},$(9)
${{({{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial E}}} \right. \kern-0em} {\partial E}})}_{\vartheta }}~~ = - q - {{({{\partial q} \mathord{\left/ {\vphantom {{\partial q} {\partial \vartheta }}} \right. \kern-0em} {\partial \vartheta }})}_{E}},$Другая причина механического колебания электрода (в областях фарадеевских процессов) связана с проходящим через границу переменным током, который из-за локального электрохимического эффекта Пельтье приводит к изменению температуры поверхности и ее тепловому расширению-сжатию. При этом регистрируется тепловой эстанс. Возможен случай совместного действия этих причин, например, выделение тепла адсорбции при изменении потенциала. Вклад теплового эстанса, монотонно изменяющегося со сдвигом потенциала, можно оценить в окрестности точки, где эстанс натяжения изменяет знак и проходит через ноль. При этом регистрируется приподнятый нуль эстанса. Разделение этих двух ортогональных величин проведено в [23].
Остается вопрос о применимости теории термогальванических процессов к этим системам в области значительной анодной поляризации. “Реакции на электродах идут при условиях, близким к равновесным по отношению к приэлектродным слоям солевых расплавов” [28]. Для Au в CsCl при E > 1.0 В (рис. 1) концентрация монохлорида золота в приэлектролном слое >2% [27], что достаточно для работы уравнения Нернста.
Тепловой эффект анодной полуреакции складывается из теплот Пельтье и Джоуля: jW + j2R [1, 56 ] , где R = Rэл + Rп, соответственно сопротивление электролита и переходное сопротивление границы. Предполагается, что регистрируемый пьезосигнал пропорционален мощности g (обозначения аналогичны [1]).
Если постоянный ток j0 и переменный ток Δ j cos(ωt) проходят через параллельно включенные R и C, то при измерении теплового q-эстанса (${{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial q}}} \right. \kern-0em} {\partial q}}$)тепл регистрируется сумма составляющих этих эффектов на частоте ω = 2π f [1, с. 56]:
(10)
${{g}_{{\text{r}}}}(\omega ,{{j}_{0}}) = \left( {W + 2R{\kern 1pt} {{j}_{0}}} \right)\Delta {\kern 1pt} j{\text{cos}}{{(\omega t--{\text{arctg}}\omega RC)} \mathord{\left/ {\vphantom {{(\omega t--{\text{arctg}}\omega RC)} {\sqrt {1 + {{{(\omega RC)}}^{2}}} }}} \right. \kern-0em} {\sqrt {1 + {{{(\omega RC)}}^{2}}} }}.$Для двух значений постоянного тока j2 > j1 амплитуды теплового q-эстанса (этот анализ проведен по совету А.Я. Гохштейна):
относительное уменьшение теплового q-эстанса:(13)
$A = ({{g}_{{\text{r}}}}(\omega ,{{j}_{2}})--{{{{g}_{{\text{r}}}}(\omega ,{{j}_{1}}))} \mathord{\left/ {\vphantom {{{{g}_{{\text{r}}}}(\omega ,{{j}_{1}}))} {{{g}_{{\text{r}}}}(\omega ,{{j}_{1}})}}} \right. \kern-0em} {{{g}_{{\text{r}}}}(\omega ,{{j}_{1}})}} = {{2R({{j}_{2}}--{{j}_{1}})} \mathord{\left/ {\vphantom {{2R({{j}_{2}}--{{j}_{1}})} {(W + 2R{\kern 1pt} {{j}_{1}})}}} \right. \kern-0em} {(W + 2R{\kern 1pt} {{j}_{1}})}}$Мы регистрировали Е-эстанс, он связан с q-эстансом уравнением:
(14)
${{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial E}}} \right. \kern-0em} {\partial E}} = {{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial q}}} \right. \kern-0em} {\partial q}} \cdot {{\partial q} \mathord{\left/ {\vphantom {{\partial q} {\partial E.}}} \right. \kern-0em} {\partial E.}}$(15)
$\left| {{{\partial q} \mathord{\left/ {\vphantom {{\partial q} {\partial E}}} \right. \kern-0em} {\partial E}}} \right| = {1 \mathord{\left/ {\vphantom {1 {R\omega }}} \right. \kern-0em} {R\omega }} = {Y \mathord{\left/ {\vphantom {Y \omega }} \right. \kern-0em} \omega }.$(16)
$W = {{2R({{j}_{2}}--{{j}_{1}})} \mathord{\left/ {\vphantom {{2R({{j}_{2}}--{{j}_{1}})} A}} \right. \kern-0em} A}--2R{\kern 1pt} {{j}_{1}} = --0.38{\text{ В}}.$(17)
${{\varepsilon }_{0}} = {W \mathord{\left/ {\vphantom {W T}} \right. \kern-0em} T} = --0.38\,\,{{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {\text{К}}}} \right. \kern-0em} {\text{К}}}.$Таблица 1
| Система | Температура, К | Термопотенциал ε0, мВ/К | Ссылка |
|---|---|---|---|
| С, Cl2/LiCl/Cl2,С | 973–1373 | –0.54 | [8] |
| С, Cl2/NaCl/Cl2,С | 1173–1573 | –0.48…–0.415 | [8] |
| С, Cl2/CsCl/Cl2,С | 973 | –0.533 | [8] |
| Cu/CuCl/Cu | 735–861 | –0.436 | [8] |
| Ag/AgCl/Ag | 728–1173 | –0.375…–0.44 | [8] |
| С/0.5% AgCl + NaCl + KCl/С | 973 | –0.272 | [9] |
| Ag/5% AgCl + CsCl/Ag | 1073 | –0.355 | [10] |
| Ag/5% AgBr + CsBr/Ag | 1073 | –0.444 | [33] |
Значение полученной величины сравнимо с литературными данными. В работе [8] о локальном эффекте Пельтье указано, что поглощение тепла при анодном растворении металла и выделении тепла при катодном осаждении приводит к переходу от изотермических условий к неизотермическим. Электрокристаллизация в поле градиента температуры позволяет получать плотные или рыхлые осадки [29, c. 143], т.е. оптимизировать процессы. Оценить знаки и величину теплового эффекта анодного электрорастворения можно: приближенно по величине термопотенциалов или расчетом по разности энтропии металла и парциальной энтропии иона. Если энтропия металла меньше, тепловой эффект положительный (поглощение тепла) (табл. 2, 1–3 строки), энтропия металла больше – 5–7 строки, близки – строка 4.
Таблица 2.
(1В = 23.06 ккал/эквивалент)
| № | Система | Т, К | ΔS, э.е. | TΔS, В |
|---|---|---|---|---|
| 1 | ${{{\text{Fe}}\left( {{\text{CN}}} \right)_{6}^{{4 - }}} \mathord{\left/ {\vphantom {{{\text{Fe}}\left( {{\text{CN}}} \right)_{6}^{{4 - }}} {{\text{Fe}}\left( {{\text{CN}}} \right)_{{\text{6}}}^{{{\text{3}} - }}}}} \right. \kern-0em} {{\text{Fe}}\left( {{\text{CN}}} \right)_{{\text{6}}}^{{{\text{3}} - }}}}$ 0.2Мвод | 293 | +0.41 [1] | |
| 2 | Cuт/CuClрасп | 703 | +6.1 | +0.186 [8] |
| 3 | Agт/AgClрасп | 728 | +5.7 | +0.18 [8] |
| 4 | Liж/LiClрасп | 880 | –1.4 | –0.052 [8] |
| 5 | Naж/NaClрасп | 1073 | –3.2 | –0.152 [8] |
| 6 | Csж/CsClрасп | 918 | –5.9 | –0.234 [8] |
| 7 | Kг/KClрасп | 1030 | –23.8 | –1.075 [8] |
Необходимые данные термо-ЭДС изучаемых систем доступны прямому измерению. Для этого ячейку с двумя обратимыми полуэлементами (Au, Ag, Cu и др. в расплаве, содержащем их ионы) нужно поместить в печь с двумя температурными зонами и измерить ЭДС, аналогично [10, 30]. Для золотых электродов придется обеспечить равновесное парциальное давление хлора. Мы проводили прямое измерение температуры Au и Ag электродов, изготовленных в виде пробирок, внутри которых помещали ХА термопару. При пропускании тока 0.1–0.2 А/см2 электрод охлаждался на 1–2 К. Данные электрохимической калориметрии могут дать новую полезную информацию.
При линейном сдвиге потенциала изменяется концентрация активного вещества в приэлектродном слое по уравнению Нернста. При этом могут изменяться коэффициенты Зеебека и Пельтье аналогично [1, с. 48, 10, 13].
Мощность теплоты Пельтье, рассчитанная по данным, приведенным на рис. 1: Wj2 = 60 мВт/см2, что заметно больше тепла Джоуля $R{\kern 1pt} j_{2}^{2}$ = 3.8 мВт/см2.
Оценим порядок величины Е-эстанса в области электрорастворения. В этой области полагаем переменный ток активным фарадеевским, величина адмитанса приведена в [20, 21]
В регистрируемой величине эстанса предполагаем преобладающим вклад теплового эстанса, поверхностное натяжение не меняется [23], с учетом уравнений (14), (15):
(19)
${{({{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial q}}} \right. \kern-0em} {\partial q}})}_{{{\text{тепл}}}}} = {{({{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial E}}} \right. \kern-0em} {\partial E}})}_{{{\text{тепл}}}}} \cdot {\omega \mathord{\left/ {\vphantom {\omega Y}} \right. \kern-0em} Y} = W,$(20)
${{({{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial E}}} \right. \kern-0em} {\partial E}})}_{{{\text{тепл}}}}} = {{WY} \mathord{\left/ {\vphantom {{WY} \omega }} \right. \kern-0em} \omega } = {{(0.38\,\,{\text{В}} \cdot 6{\text{ }}{{{\text{См}}} \mathord{\left/ {\vphantom {{{\text{См}}} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}})} \mathord{\left/ {\vphantom {{(0.38\,\,{\text{В}} \cdot 6{\text{ }}{{{\text{См}}} \mathord{\left/ {\vphantom {{{\text{См}}} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}})} 2}} \right. \kern-0em} 2} \cdot 3.14 \cdot 4.8 \cdot {{10}^{{3~}}}\,{\text{Гц}} = 75{\text{ }}{{{\text{мкКл}}} \mathord{\left/ {\vphantom {{{\text{мкКл}}} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}}.$При этом постоянный ток j2 = 0.17 А/см2 за 1 с переносит через границу 0.17 Кл/см2, что в 2300 раз больше, чем тепловой Е-эстанс. Отметим, что тепловой Е-эстанс уменьшается с ростом частоты, такое объяснение частотной зависимости эстанса приведено в [20].
В области поляризуемости переменный ток расходуется на заряжение емкости и адсорбцию, регистрируется изменение поверхностного натяжения. Оценим порядок Е-эстанса в точке, где ${{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial q}}} \right. \kern-0em} {\partial q}}$ = 0.38 В:
(21)
${{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial E}}} \right. \kern-0em} {\partial E}} = ({{\partial \gamma } \mathord{\left/ {\vphantom {{\partial \gamma } {\partial q}}} \right. \kern-0em} {\partial q}}) \cdot С = 0.38{\text{ В}} \cdot {{10}^{{ - 4}}}\,\,{{\text{Ф}} \mathord{\left/ {\vphantom {{\text{Ф}} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}{\text{\;}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}{\text{\;}}}} = 38\,\,{{{\text{мкКл}}} \mathord{\left/ {\vphantom {{{\text{мкКл}}} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{{\text{2}}}}}}.$Вариант q-эстанса имеет ряд преимуществ по сравнению с Е-эстансом, вероятно, поэтому выбран в качестве основного автором метода [1] и развит в [32].
Отметим, что экспериментальная величина А в (13) уменьшается с ростом частоты. Расчет W по (16) приводит при этом к его увеличению, что не согласуется с подходом [7]. Решение проблемы калибровки эстанса требует продолжения. Надеемся, что высказанные предположения дадут стимул для новых идей и исследований в этой области электрохимии расплавленных электролитов.
Список литературы
Гохштейн А.Я. Поверхностное натяжение твердых тел и адсорбция. М.: Наука, 1976.
Гохштейн А.Я. Электролиз и поверхностные явления. К 200-летию публикации Вольта о первом источнике постоянного тока // Успехи физических наук. 2000. 170. № 7. С. 779–804.
Хаазе Р. Термодинамика необратимых процессов. М.: Мир, 1967.
Темкин М.И., Хорошин А.В. К теории термоэлектрических явлений в растворах электролитов // Ж.Ф.Х. 1952. 26. № 4. С. 500–508.
Гохштейн А.Я. О расчете энтропии движущейся частицы // Электрохимия. 1995. 31. № 6. С. 667–668.
Графов Б.М. Частотная зависимость теплоты Пельтье идеально поляризуемого электрода // Электрохимия. 1992. 28. № 2. С. 147–151.
Ротенберг З.А. Частотная зависимость теплоты Пельтье // Электрохимия. 1997. 33. № 2. С. 155–158.
Марков Б.Ф., Кузякин Е.Б. Термогальванические элементы с индивидуальными расплавленными солями // Успехи химии. 1972. XLI. № 3. С. 459–473.
Городский А.В., Кузякин Е.Б., Кузьминский Е.В. Определение электрохимического эффекта Пельтье в расплавленных и водных электролитах // Украинский химический журнал. 1978. 44. № 2. С. 115–121.
Sinistry C., Pezzati E. Thermoelectric properties in silver chloride-alkali chloride fused mixtures // Z.Naturforsch. 1970. 25a. P. 893–897.
Поляков П.В., Бурнакин В.В. Температурные эффекты при выделении металлов из разбавленных хлоридов I. Электролиз хлористого серебра // Электрохимия. 1972. 8. № 1. С. 26–29.
Бурнакин В.В., Поляков П.В. Исследование кинетики выделения серебра из разбавленных нитратов // Изв. ВУЗ. Цветная металлургия. 1971. № 4. С. 51–54.
Поляков П.В., Гронь Н.Л., Тимофеева М.Е. О связи тепловых эффектов на электродах с термопотенциалами // Изв. ВУЗ. Цветная металлургия. 1973. № 2. С. 36–39.
Гронь Н.Л., Поляков П.В. Тепловые эффекты на отдельном электроде в расплавленных электролитах в условиях лимитирующей стадии массопереноса // Электрохимия. 1981. 17. № 11. С. 1607–1612.
Поляков П.В., Бурнакин В.В. Температурные эффекты при выделении хлора из расплавов // Электрохимия. 1972. 8. № 5. С. 658–661.
Fischer W. Die Thermocraft einiger Zellen des Typs Cl2/T geschmolzenes Clorid /T + ΔT Cl2 // Z. Naturforsch. 1966. 21a. P.281–286.
Поляков П.В. Массо- и теплоперенос при электролизе расплавленных солей. Диссертация д. х. н., Красноярск. 1980.
Kjelstrup S., Qien J., Haarberg G.M. The Peltier heating of the aluminium cathode in contact with criolyte-alumina melts // El. Acta. 2000. 45. P. 2707–2717.
Flem B.E., Xu Q., Kjelstrup S., Sterten A. Thermoelectric powers of cells with NaF–AlF3–Al2O3 melts // J. Non-Equilib. Thermodyn., 2001. 26. P. 125–151.
Пастухов Ю.Г. Дифференциальное поверхностное натяжение твердых металлов подгруппы меди в расплавах галогенидов щелочных металлов. Дис. ... канд. хим. наук, Екатеринбург, 1994.
Пастухов Ю.Г. Эстанс золота в расплавах галогенидов цезия // Электрохимия. 1994. 30. № 8. С. 997–1007.
Пастухов Ю.Г. Эстанс золота в расплавах галогенидов натрия и влияние на него выделения щелочного металла // Расплавы. 2015. № 2. С. 88–100.
Пастухов Ю.Г. Расчет вклада теплового эстанса в экспериментальную величину эстанса золотого электрода в расплавленном CsCl // Расплавы. 2015. № 3. С. 71–82.
Пастухов Ю.Г. Эстанс золота в расплавленном LiCl и влияние природы катиона на потенциалы нулей эстанса Au в расплавленных хлоридах щелочных металлов // Расплавы. 2017. № 4. С. 320–334.
Пастухов Ю.Г. Исследование поверхности Au, Ag, Cu и Pt электродов в расплавленных солях методом эстанса // Труды Всесоюзной школы по электрохимии. Свердловск: УрО АН СССР. 1991. 2. С. 86–100.
Pastukhov Yu. Differential surface tension of solid metals/ molten alkali halides interfaces // Electrohimica Acta. 1995. 40. № 9. P. 1191–1197.
Салтыкова Н.А., Семерикова О.Л., Барабошкин А.Н. Равновесные потенциалы золота в расплавах эвтектики NaCl–KCl–CsCl // Электрохимия. 1995. 31. № 12. С. 1325–1328.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973.
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. Москва: Наука, 1976.
Sinistry C. The thermoelectric power of the molten systems (Ag + Li)NO3, (Ag + Na)NO3, (Ag + K)NO3 // Z. Naturforsch. 1965. 21a. P.753–755.
Кириллова Е.В., Докашенко С.И., Степанов В.П. Емкость и импеданс границы раздела поликристаллического золота с расплавами хлоридов щелочных металлов // Расплавы. 2008. № 4. С. 74–79.
Степанов В.П., Ситников Л.В. Поверхностные свойства упругодеформируемого медного электрода в расплавах хлоридов щелочных металлов // Расплавы. 2013. № 6. С. 51–64.
Pezzati E. Thermoelectric properties in silver bromide-alkali bromide fused mixtures // Z. Naturforsch. 1970. 25a. P. 898–900.
Дополнительные материалы отсутствуют.


