Расплавы, 2020, № 2, стр. 208-220
Электрохимическое поведение редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF–K2TiF6 в присутствии катионов щелочноземельных металлов
Д. А. Ветрова a, *, С. А. Кузнецов a
a Институт химии и технологии редких элементов и минерального сырья
им. И.В. Тананаева Кольского научного центра РАН
Апатиты, Россия
* E-mail: d.vetrova@ksc.ru
Поступила в редакцию 29.11.2019
После доработки 08.12.2019
Принята к публикации 16.12.2019
Аннотация
Методом циклической вольтамперометрии определены стандартные константы скорости переноса заряда для редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF(10 мас. %)– K2TiF6. Рассчитана энергия активации процесса переноса заряда. Изучено влияние сильнополяризующих катионов Mg2+, Ca2+, Sr2+ и Ba2+ на кинетику переноса заряда в редокс паре Ti(IV)/Ti(III) при введении их в исходный расплав. Установлена прямолинейная зависимость констант скорости переноса заряда от ионного потенциала катионов щелочноземельных металлов.
ВВЕДЕНИЕ
Изучению электрохимического поведения титана в хлоридных и хлоридно-фторидных расплавах посвящены работы [1–9]. В исследованиях [1, 2] было показано, что процесс электровосстановления комплексов Ti(IV) до металла является двухстадийным:
В работах [1, 2] были определены коэффициенты диффузии комплексов Ti(IV) в расплаве эквимолярной смеси NaCl–KCl при различных температурах. Механизм и кинетика процессов электровосстановления и электроокисления ионов титана при введении K2TiF6 в расплав NaCl–KCl–NaF изучены в исследованиях [4–9]. В работах [8, 9] рассчитаны константы скорости переноса заряда редокс пары Ti(IV)/Ti(III) в расплаве (NaCl–KCl)экв–NaF(10 мас. %)–K2TiF6 и определена энергия активации процесса переноса заряда.
Электрохимические исследования титана в расплаве KCl–KF крайне немногочисленны. Лишь в работах [3, 6, 7] было рассмотрено электрохимическое поведение титана в эвтектической смеси KCl–KF. Однако данные по коэффициентам диффузии комплексов титана и константам скорости переноса заряда редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF отсутствуют.
Целью данной работы являлось изучение кинетики переноса заряда редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF(10 мас. %)–K2TiF6, определение области квазиобратимости процесса (1) и расчет стандартных констант скорости переноса заряда (ks), а также установление влияния добавок катионов щелочноземельных металлов (Mg2+, Ca2+, Sr2+ и Ва2+) на константы скорости переноса заряда редокс пары Ti(IV)/Ti(III) в указанном расплаве.
МЕТОДИКА
Исследования проводились в диапазоне температур 1073–1173 K методом циклической вольтамперометрии с помощью динамической электрохимической лаборатории “VoltaLab 40” (программное обеспечение “VoltaMaster 4” (версия 6)). Скорость развертки потенциала изменялась в пределах от 0.1 до 2.0 В ⋅ с–1. В качестве контейнера для расплава использовался тигель из стеклоуглерода марки СУ-2000, который одновременно являлся вспомогательным электродом. Вольтамперные кривые регистрировались на электроде из стеклоуглерода марки СУ-2000 диаметром 2.0 мм относительно стеклоуглеродного квази-электрода сравнения.
Хлорид калия квалификации “ч. д. а.” перекристаллизовывали, прокаливали в муфельной печи, затем помещали в кварцевую реторту. Реторту вакуумировали при комнатной температуре и ступенчатом нагревании до 873 K. Величина остаточного давления составляла 0.66 Па. Затем реторту заполняли аргоном и расплавляли электролит. Фторид калия (марки “ч”) очищали двойной перекристаллизацией из расплава. Соль сушили при температуре 673–773 K в вакууме, затем нагревали до температуры на 50 K выше температуры плавления, выдерживали в течение нескольких часов и затем медленно охлаждали со скоростью 3–4 град/ч до температуры на 50 K ниже точки плавления. После затвердевания соли переносили в перчаточный бокс с контролируемой атмосферой (содержание О2 и H2O ≤ 2 ppm) и в боксе механически удаляли загрязнения. Гексафторотитанат калия получали путем перекристаллизации из растворов плавиковой кислоты исходного продукта марки “ч”.
Хлорид бария марки “х. ч.” сушили в вакуумном шкафу при температуре 433 К в течение 24 ч. Фториды магния (“о. с. ч.”), бария (“ч. д. а.”) и кальция (“ч.”) использовались без дополнительной обработки.
Хлорид стронция марки “ч. д. а.” сушили в вакуумном шкафу при температуре 523 К в течение 12 ч. После этого соль перекладывали в стеклянные ампулы и помещали в герметичную реторту, которую вакуумировали при одновременном нагреве со скоростью 100 K/час до температуры 823 K.
Фоновый солевой электролит KCl–KF (10 мас. %) помещали в тигель из стеклоуглерода, загружали его в реторту, повторяли вышеописанные операции вакуумирования – плавления и вводили в расплав K2TiF6.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
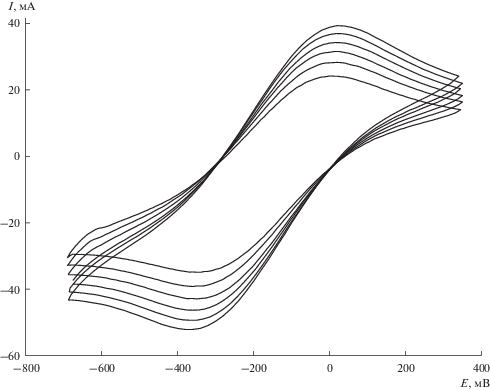
Типичные циклические вольтамперограммы для редокс пары Ti(IV)/Ti(III), полученные на стеклоуглеродном электроде при различных скоростях поляризации, представлены на рис. 1.
Рис. 1.
Циклические вольтамперограммы расплава KCl–KF(10 мас. %)–K2TiF6 (С(K2TiF6) = 1.22 ⋅ · 10‒4 моль ⋅ см–3), Т = 1023 K. Скорости поляризации (В ⋅ с–1): 0.75 (внутренняя кривая); 1.0, 1.25, 1.5, 1.75, 2.0 (наружная).
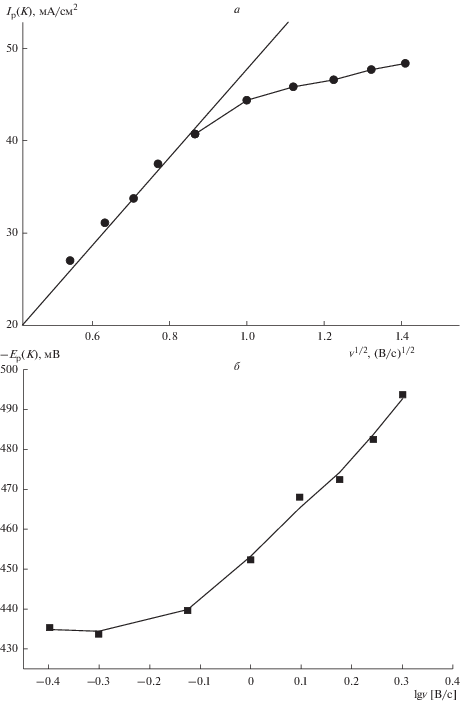
На рис. 2а представлена зависимость тока пика от корня квадратного из скорости поляризации. Отклонение экспериментальных точек от прямой, проходящей через начало координат, при скоростях поляризации больше 1.0 В ⋅ с–1 указывает на то, что процесс электровосстановления титана в расплаве KCl–KF(10 мас. %)–K2TiF6 при более высоких скоростях поляризации, вероятно, является квазиобратимым [10]. Это предположение подтверждается криволинейной зависимостью потенциала пика от логарифма скорости (рис. 2б), тогда как для необратимого процесса характерна линейная зависимость в данных координатах.
Рис. 2.
Зависимость тока пика (а) и потенциала пика (б) электровосстановления Ti(IV) до Ti(III) от скорости поляризации в системе KCl–KF(10 мас. %)–K2TiF6 (С(K2TiF6) = 1.22 ⋅ 10–4 моль ⋅ см–3), Т = 1073 K.
Коэффициенты диффузии комплексов Ti(IV) в расплаве KCl–KF (10 мас. %) были определены при v = 0.1 В ⋅ с–1 по уравнению Рэндлса–Шевчика [11]:
(3)
${{I}_{п}} = 0.4463{{F}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}{{R}^{{--{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{T}^{{--{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{n}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}AC{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{{v}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Величины коэффициентов диффузии Ti(IV), полученные по уравнению (3), составили для температуры 1073 K (1.34 ± 0.5) ⋅ 10–5 см2 ⋅ с–1, для температуры 1123 K – (1.72 ± ± 0.5) ⋅ 10–5 см2 ⋅ с–1 и для температуры 1173 K (2.5 ± 0.5) ⋅ 10–5 см2 ⋅ с–1.
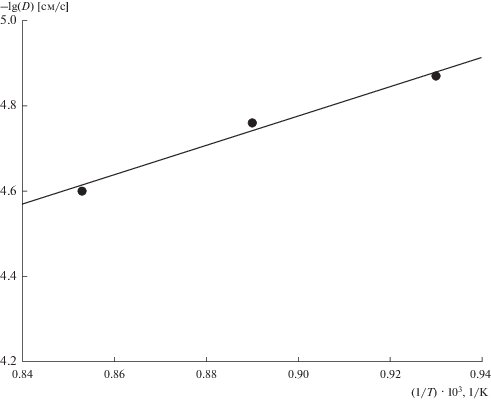
Температурная зависимость коэффициентов диффузии, представленная на рис. 3, описывается следующим уравнением:
(4)
${\text{lg}}D\left( T \right) = --1.62 - {{3496} \mathord{\left/ {\vphantom {{3496} T}} \right. \kern-0em} T} \pm 0.03.$Рис. 3.
Зависимость коэффициентов диффузии D от температуры в расплаве KCl–KF(10 мас. %)–K2TiF6 (С(K2TiF6) = 1.22 ⋅ 10–4 моль ⋅ см–3) в логарифмических координатах. Скорость поляризации 0.1 В ⋅ с–1.
Используя данную зависимость, была рассчитана энергия активации процесса диффузии по уравнению:
(5)
${{--\Delta U} \mathord{\left/ {\vphantom {{--\Delta U} {2.303R}}} \right. \kern-0em} {2.303R}} = {{\partial {\text{lg}}D} \mathord{\left/ {\vphantom {{\partial {\text{lg}}D} {\partial \left( {{1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T}} \right).}}} \right. \kern-0em} {\partial \left( {{1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T}} \right).}}$Величина энергии активации диффузии в расплаве KCl–KF(10 мас. %)–K2TiF6 составила 70 ± 11 кДж ⋅ моль–1.
В работе [12] Николсоном была разработана теория определения стандартных констант скорости переноса заряда для квазиобратимых редокс процессов по данным циклической вольтамперометрии. Принимая, что формы Ох и Red растворимы или в растворе, или в материале электрода и переносятся только путем диффузии, Николсон получил решение, которое не может быть представлено в аналитической форме. В работе [12] установлена корреляция между функцией ψ, связанной с разностью потенциалов катодного и анодного пиков (ΔEp) и стандартной константой скорости переноса заряда:
(6)
${{\psi }_{T}} = \frac{{{{k}_{{\text{s}}}}{{{\left( {{{{{D}_{{{\text{ox}}}}}} \mathord{\left/ {\vphantom {{{{D}_{{{\text{ox}}}}}} {{{D}_{{{\text{red}}}}}}}} \right. \kern-0em} {{{D}_{{{\text{red}}}}}}}} \right)}}^{{{\alpha \mathord{\left/ {\vphantom {\alpha 2}} \right. \kern-0em} 2}}}}}}{{\sqrt {{{(\pi {{D}_{{{\text{ox}}}}}nFv)} \mathord{\left/ {\vphantom {{(\pi {{D}_{{{\text{ox}}}}}nFv)} {RT}}} \right. \kern-0em} {RT}}} }},$Уравнение (6) может быть упрощено, так как обычно Dox/Dred ≈ 1, тогда выражение принимает вид:
(7)
${{\psi }_{T}} = \frac{{{{k}_{{\text{s}}}}}}{{\sqrt {{{(\pi {{D}_{{{\text{ox}}}}}nFv)} \mathord{\left/ {\vphantom {{(\pi {{D}_{{{\text{ox}}}}}nFv)} {RT}}} \right. \kern-0em} {RT}}} }}.$Для расчета стандартных констант скорости переноса заряда необходимо данные ΔEp и ψ, приведенные в работе [12] для температуры 298 K, пересчитать на рабочую температуру. Пересчет производился по уравнениям [13]:
(8)
${{(\Delta {{E}_{{\text{p}}}})}_{{298}}} = \frac{{{{{(\Delta {{Е}_{{\text{p}}}})}}_{T}}298}}{T},$Расчет величин (ΔEp)298 и ψT по уравнениям (8, 9) позволял с использованием зависимости (7) и величин коэффициента диффузии Ti(IV) рассчитать стандартные константы скорости переноса заряда.
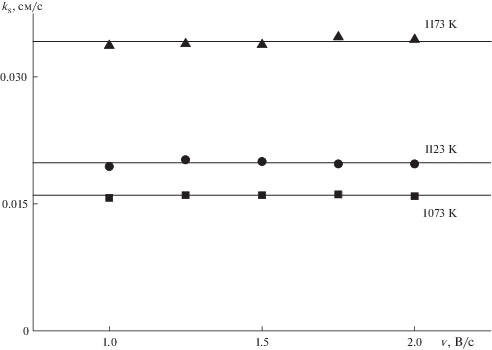
Стандартные константы скорости переноса заряда (ks) редокс пары Ti(IV)/Ti(III) при различных температурах и скоростях поляризации представлены на рис. 4. Как видно из рисунка, ks не зависят от скорости поляризации и возрастают с увеличением температуры. Увеличение значений констант с ростом температуры обусловлено возрастанием числа частиц с энергией, достаточной для преодоления потенциального барьера [14].
Рис. 4.
Зависимость ks от скорости поляризации при различных температурах в системе KCl–KF(10 мас. %)–K2TiF6 (С(K2TiF6) = 1.22 ⋅ 10–4 моль ⋅ см–3).
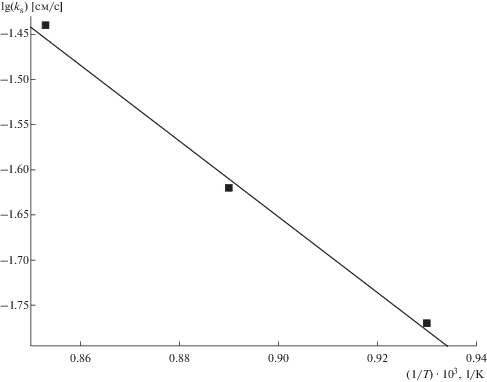
Температурная зависимость стандартных констант скорости переноса заряда в логарифмических координатах (рис. 5) описывается следующим эмпирическим уравнением:
(10)
${\text{lg}}{{k}_{{\text{s}}}} = \left( {2.01 \pm 0.40} \right)--{{\left( {4178 \pm 810} \right)} \mathord{\left/ {\vphantom {{\left( {4178 \pm 810} \right)} Т}} \right. \kern-0em} Т}$Рис. 5.
Зависимость ks от температуры в расплаве KCl–KF(10 мас. %)–K2TiF6 (С(K2TiF6) = 1.22 ⋅ 10–4 моль ⋅ см–3) в логарифмических координатах. Скорость поляризации 1.5 В ⋅ с–1.
Из этого уравнения была рассчитана энергия активации переноса заряда, равная 80 ± 15 кДж ⋅ моль–1. Полученное значение существенно выше энергии активации, рассчитанной для расплава (NaCl–KCl)экв–NaF(10 мас. %)–K2TiF6. [8]
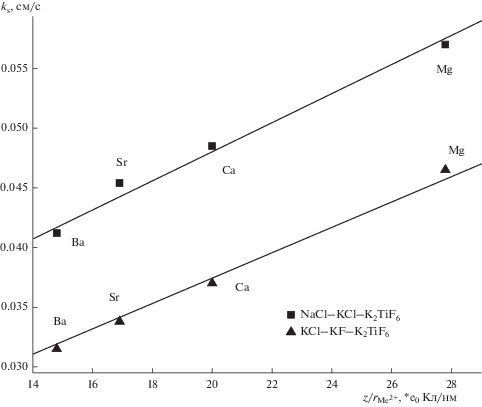
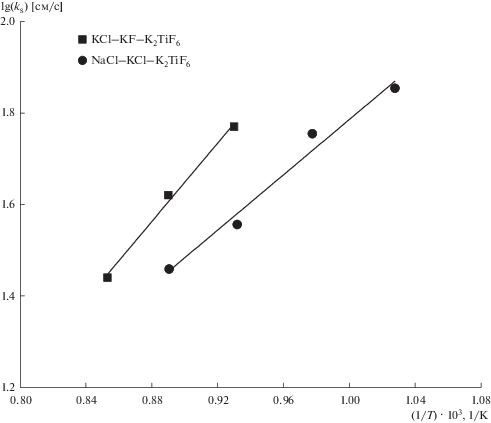
На рис. 6 представлены температурные зависимости стандартных констант скорости переноса заряда редокс пары Ti(IV)/Ti(III), полученные для расплавов (NaCl–KCl)экв–NaF(10 мас. %)–K2TiF6 [8] и KCl–KF(10 мас. %)–K2TiF6. Как видно из рисунка, значения ks уменьшаются при переходе от расплава (NaCl–KCl)экв–NaF(10 мас. %) к расплаву KCl–KF (10 мас. %) в виду увеличения прочности комплексов титана из-за присутствия во второй координационной сфере катионов калия.
Рис. 6.
Зависимость ks от температуры в расплавах KCl–KF(10 мас. %)–K2TiF6 (С(K2TiF6) = 1.22 ⋅ 10–4 моль ⋅ см–3) и (NaCl–KCl)экв–NaF(10 мас. %)–K2TiF6 (С(K2TiF6) = 2.872 ⋅ 10–4 моль ⋅ см–3 в логарифмических координатах. Скорость поляризации 1.5 В ⋅ с–1.
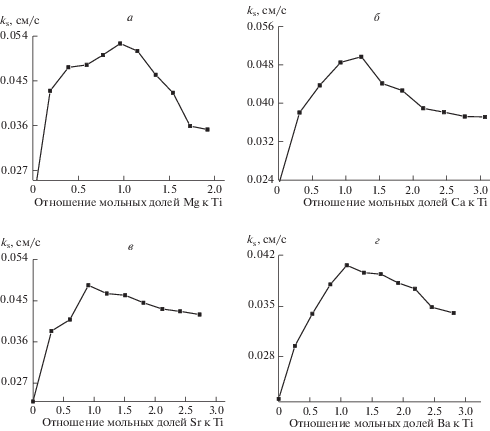
Исследование влияния сильнополяризующих катионов Mg2+, Ca2+, Sr2+ и Ва2+ на кинетику переноса заряда редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF (10 мас. %) показало, что при введении добавок солей щелочноземельных металлов в исходный расплав наблюдается увеличение ks, достигающее максимального значения при определенном отношении Me2+/Ti(IV) (рис. 7). Возрастание значений ks связано с вытеснением катионами щелочноземельных металлов катионов натрия и калия из второй координационной сферы комплексов титана и уменьшению прочности фторидных комплексов титана. Дальнейшее уменьшение ks происходит, по-видимому, из-за увеличения вязкости солевого расплава (так как расплавы галогенидов щелочноземельных металлов имеют большую вязкость по сравнению с расплавами щелочных металлов) и, как следствие, уменьшения коэффициентов диффузии.
Рис. 7.
Зависимость ks от отношения мольных долей катионов щелочноземельных металлов к Ti(IV) в расплаве KCl–KF(10 мас. %)–K2TiF6: Mg2+ (а), Ca2+ (б), Sr2+ (в) и Ва2+ (г). Скорость поляризации 1.5 В ⋅ с–1, Т = 1073 К.
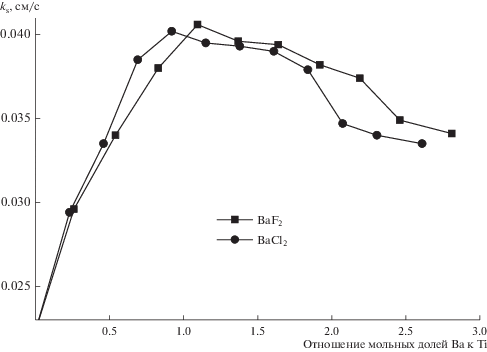
Такие же результаты (в пределах погрешности эксперимента) были получены при использовании в качестве добавок как хлоридов, так и фторидов щелочноземельных металлов (рис. 8).
Рис. 8.
Зависимость ks от отношения мольных долей катионов Ва2+ к Ti(IV) в сиcтемах KCl–KF(10 мас. %)–K2TiF6–BaF2 (С(K2TiF6) = 1.21 ⋅ 10-4 моль ⋅ см–3) и KCl–KF(10 мас. %)–K2TiF6–BaCl2 (С(K2TiF6) = = 1.19 ⋅ 10–4 моль ⋅ см–3). Т = 1073 K.
Температурные зависимости максимальных значений стандартных констант скорости переноса заряда с добавками катионов щелочноземельных металлов описываются эмпирическими уравнениями:
(11)
${\text{lg}}{{k}_{{{\text{s}}({\text{M}}{{{\text{g}}}^{{2 + }}})}}} = --(0.19 \pm 0.09)--{{(1150 \pm 240)} \mathord{\left/ {\vphantom {{(1150 \pm 240)} {T,}}} \right. \kern-0em} {T,}}$(12)
${\text{lg}}{{k}_{{{\text{s}}({\text{C}}{{{\text{a}}}^{{2 + }}})}}} = --(0.15 \pm 0.01)--{{(1367 \pm 280)} \mathord{\left/ {\vphantom {{(1367 \pm 280)} {T,}}} \right. \kern-0em} {T,}}$(13)
${\text{lg}}{{k}_{{{\text{s}}({\text{S}}{{{\text{r}}}^{{2 + }}})}}} = (0.23 \pm 0.04)--{{(1483 \pm 300)} \mathord{\left/ {\vphantom {{(1483 \pm 300)} {T,}}} \right. \kern-0em} {T,}}$(14)
${\text{lg}}{{k}_{{{\text{s(В}}{{{\text{а}}}^{{2 + }}})}}} = (0.19 \pm 0.02)--{{(1710 \pm 350)} \mathord{\left/ {\vphantom {{(1710 \pm 350)} {T.}}} \right. \kern-0em} {T.}}$Расчет энергий активации процесса переноса заряда в расплавах с щелочноземельными металлами показал, что их значения (табл. 1) существенно меньше энергии активации исходной системы. Величины энергий активации для расплавов с добавками щелочноземельных металлов имеют тенденцию к уменьшению при переходе от катионов с меньшим ионным потенциалом к катионам с большим ионным потенциалом.
Таблица 1.
Энергия активации переноса заряда в расплаве KCl–KF(10 мас. %)–K2TiF6 при введении в расплав сильнополяризующих катионов
| Катион | Еа, кДж/моль |
|---|---|
| Mg2+ | 22 ± 4 |
| Ca2+ | 26 ± 5 |
| Sr2+ | 28 ± 5 |
| Ba2+ | 33 ± 7 |
На рис. 9 показана зависимость максимального значения ks от ионного потенциала катионов щелочноземельных металлов для расплавов (NaCl–KCl)экв–NaF(10 мас. %)– K2TiF6 и KCl–KF(10 мас. %)–K2TiF6. Как видно из рисунка, константы скорости переноса заряда возрастают с увеличением ионного потенциала, для обоих расплавов зависимость носит прямолинейный характер и значения ks редокс пары Ti(IV)/Ti(III) в системах с добавками сильнополяризующих катионов имеют большие значения для расплава на основе эквимолярной смеси NaCl–KCl.
ЗАКЛЮЧЕНИЕ
В работе была изучена кинетика переноса заряда редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF(10 мас. %)–K2TiF6. Установлена область квазиобратимости процесса переноса заряда в данной редокс паре. По методу Николсона были рассчитаны стандартные константы скорости переноса заряда (ks). Показано, что стандартные константы скорости переноса заряда не зависят от скорости поляризации и возрастают с увеличением температуры, что обусловлено повышением тепловой энергии системы и увеличением числа частиц, обладающих энергией, необходимой для преодоления активационного барьера.
Было изучено влияние сильнополяризующих катионов Mg2+, Ca2+, Sr2+ и Ва2+ на кинетику переноса заряда редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF(10 мас. %)–K2TiF6. Установлено, что величины констант скорости переноса заряда возрастают с увеличением ионного потенциала, достигая максимального значения для комплексов с внешнесферными катионами магния.
Определены энергии активации процесса переноса заряда для фторидных комплексов редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF(10 мас. %)–K2TiF6 и в системах с щелочноземельными металлами. Величины энергий активации в расплавах с добавками сильнополяризующих катионов существенно ниже энергии активации исходной системы и имеют тенденцию к уменьшению при переходе от катионов с меньшим ионным потенциалом к катионам с большим ионным потенциалом.
Работа выполнена при финансовой поддержке РФФИ (грант № 15-03-02290_а).
Список литературы
Polyakova L.P., Stangrit P.T., Polyakov E.G. Electrochemical study of titanium in chloride-fluoride melts // Electrochim. Acta. 1986. 31. P. 159–161.
Sequeira C.A. Chronopotentiometric study of titanium in molten NaCl + KCl + K2TiF6 // J. Electroanal. Chem. 1988. 239. № 1–2. P. 203–208.
Полякова Л.П., Стогова Т.В. Исследование механизма взаимодействия титана с хлоридно-фторидными расплавами // ЖПХ. 1985. № 7. С. 1470–1473.
Polyakova L.P., Taxil P., Polyakov E.G. Electrochemical behaviour and codeposition of titanium and niobium in chloride–fluoride melts // Alloys and Compd. 2003. 359. P. 244–255.
Malyshev V., Gab A., Bruskova D.-M., Astrelin I., Popescu A.-M., Constantin V. Electroreduction processes involving titanium and boron species in halide melts. // Revue Roumaine de Chimie. 2009. 54. № 1. P. 5–25.
Norikawa Y., Yasuda K., Nohira T. Electrochemical behavior of Ti(III) ions in KCl–KF eutectic melt // The Electrochem. Soc. of Japan. 2018. 86. № 2. P. 99–103.
Norikawa Y., Yasuda K., Nohira T. Electrodeposition of titanium in a water-soluble KCl–KF molten salt // Materials Transactions. 2017. 58. № 3. P. 390–394.
Ветрова Д.А., Казакова О.С., Кузнецов С.А. Изучение электрохимического поведения редокс-пары Ti(IV)/Ti(III) в расплаве NaCl–KCl–K2TiF6 для оптимизации электрорафинирования титана и синтеза сплавов на его основе // ЖПХ. 2014. 87. № 4. С. 446–450.
Ветрова Д.А., Кузнецов С.А. Влияние сильнополяризующих катионов на кинетику переноса заряда редокс-пары Ti(IV)/Ti(III) в хлоридно-фторидном расплаве // Труды Кольского Научного Центра РАН. Апатиты. 2015. С. 214–217.
Nicholson R.S., Shain J. Theory of stationary electrode polarography // Anal. Chem. 1964. 36. № 4. P. 706–723.
Делахей П. Новые приборы и методы в электрохимии. М.: ИИЛ, 1957.
Nicholson R.S. Theory and application of cyclic voltammetry for measurement of electrode reaction kinetics // Anal. Chem. 1965. 37. № 11. P. 1351–1355.
Кузнецов С.А., Кузнецова С.В., Стангрит П.Т. Катодное восстановление тетрахлорида гафния в расплаве эквимольной смеси хлоридов натрия и калия // Электрохимия. 1990. 26. С. 63–68.
Дамаскин, Б.Б., Петрий, О.А. Введение в электрохимическую кинетику. М.: Высшая школа, 1975.
Matsuda H., Ayabe Y. Zur Theorie der Randles-Sevcikschen kathodenstrahl-polarographie // Z. Elektrochem. 1955. 59. P. 494–503.
Дополнительные материалы отсутствуют.