Расплавы, 2020, № 3, стр. 302-312
Коррозионно-электрохимическое поведение молибдена в расплаве LiCl–KCl, содержащем добавки трихлоридов церия и неодима
Н. А. Казаковцева a, М. В. Мазанников a, Е. В. Никитина a, b, *, Э. А. Карфидов a, b, А. М. Потапов a, c
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет им. первого Президента Б.Н. Ельцина
Екатеринбург, Россия
c Уральский государственный горный университет
Екатеринбург, Россия
* E-mail: neekeetina@mail.ru
Поступила в редакцию 23.01.2020
После доработки 05.02.2020
Принята к публикации 19.02.2020
Аннотация
Изучено коррозионно-электрохимическое поведение молибдена в зависимости от состава расплава (имитаторы компонентов отработавшего ядерного топлива (ОЯТ)) в окислительной атмосфере. Выполнен термодинамический анализ возможных коррозионных процессов в программе HSC Chemistry 9.0 в модуле Equilibrium calculations. Методом гравиметрии оценена скорость коррозии металла. При помощи микрорентгеноспектрального и рентгенофазового анализа сопоставлены продукты коррозионного процесса реальные и ожидаемые на основании термодинамических расчетов. Атомно-абсорбционным методом исследована концентрация молибдена в замороженных пробах расплава. Скорость коррозии молибдена зависит от продолжительности испытаний. Уменьшение скорости коррозии во времени можно объяснить накоплением в приэлектродном слое ионов Nd3+ и Ce3+, коррозия протекает в диффузионном режиме. Коррозионная активность солевого расплава возрастает с увеличением температуры и увеличением ионной силы расплава.
ВВЕДЕНИЕ
Использование солевых сред для переработки нитридного отработавшего ядерного топлива осложняется коррозией материала контейнера, в котором непосредственно проводится процесс переработки, и других конструкционных элементов. Высокая температура, высокая коррозионная активность среды, движение среды, ее неоднородный состав, высокая вероятность гидролиза при контакте с воздухом препятствуют подбору устойчивых материалов для создания оборудования для переработки отработанного ядерного топлива и разделения его компонентов.
Химическое сопротивление легированных многокомпонентных материалов в расплавленных средах отличается от такового в низкотемпературных средах, и влияние их компонентов, при низких температурах способствующее большей коррозионной стойкости, при высоких температурах в расплавленных солях вносят значительный вклад в коррозию материала. Молибден как компонент стали ЭП-823 (16Cr12MoWСVNbB) и как востребованный материал для конструкционного оформления различных узлов высокотемпературных электрохимических устройств (токоподводы, экраны и др.) демонстрирует аномальный выход в расплав, и представляется целесообразным изучить его электрохимическое поведение в зависимости от состава расплава (имитаторы компонентов ОЯТ) и атмосферы над ним.
К коррозионным испытаниям целесообразно добавить одновременно как электрохимические методы анализа, которые позволят оценить ток коррозии, число электронов при окислении молибдена, так и физико-химические методы анализа для сопоставления с результатами электрохимического анализа и гравиметрии. Термодинамическое моделирование несомненно будет способствовать всесторонней оценке коррозионного процесса, появится возможность рекомендовать условия использования молибдена и молибденсодержащих материалов, более глубокому пониманию протекания коррозионного процесса в расплавленных солях.
Коррозия молибдена в расплавленных солях определяется степенью разрушения металла в данной среде при заданных условиях. При этом определяют количество металла, прокорродировавшего с единицы поверхности за определенное время [1–3]. Впервые проанализирована качественная характеристика процесса: характер разрушения металлической фазы, природа образовавшихся продуктов, их распределение в поверхностном слое. Механизм процесса коррозии индивидуальных металлов и сплавов в расплавленных солевых электролитах до настоящего времени не установлен окончательно, хотя исследования в этой области ведутся регулярно [4, 5].
Задачей исследования является изучение коррозии молибдена в расплаве эвтектики LiCl–KCl, которая содержит добавки CeCl3 и NdCl3. Атмосфера над расплавом – воздух. Выбор именно таких электрохимических систем связан с тем, что состав расплавов близок к составу реальных электролитов, которые используются в пирохимической технологии при обработке нитридного отработавшего ядерного топлива (ОЯТ). Ионы церия и неодима в этом случае являются имитаторами ионов плутония и урана, соответственно. Молибден, является основным легирующим компонентом коррозионностойких и жаропрочных сталей [6].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты по исследованию скорости коррозии методом гравиметрии проводили в ячейке, в которую помещали алундовый тигель со смесью солей. В тигель опускали образец исследуемого металла и выдерживали в течение заданного времени.
Электрохимические коррозионные исследования проводили в трехэлектродной ячейке. Рабочим электродом служила пластинка исследуемого материала (1 × 1 × 0.1 см), которая предварительно была обработана наждачной бумагой, отшлифована, отмыта в ацетоне и просушена в сушильном шкафу. Образцы выдерживали от 4 до 50 ч в опытах с церий-содержащими и неодим-содержащими композициями для оценки структурных и химических изменений на поверхности молибдена в процессе коррозии. В ряде опытов во время выдержки образцов в расплаве измеряли их потенциалы коррозии относительно хлорсеребряного электрода сравнения при помощи потенциостата BioLogik SP-50 (Франция). Хлорсеребряный электрод сравнения состоял из кварцевой пробирки с конструкционным отверстием в нижней части, плотно забитым асбестом, содержащей хлорид серебра и серебряную проволоку толщиной 1 мм. В расплав вводили электрод сравнения, противоэлектрод, термопару “хромель–алюмель” в алундовом чехле и рабочий электрод из холодной зоны ячейки.
Смеси солей готовили сплавлением расчетных количеств солей марки ”х. ч.”, предварительно переплавленных на воздухе, а затем подвергнутых трехкратной зонной плавке в токе сухого очищенного аргона. Затем проводили сушку солей при температуре 200°С в атмосфере аргона (чистотой 99.9%), на протяжении 4-х часов, для удаления адсорбированной влаги при размоле и смешивании солей. Хранили соли в герметичном вакуумном эксикаторе во избежание поглощения влаги ввиду сильной гигроскопичности солей лития.
После каждого измерения осуществляли выдержку для стабилизации потенциала. Для оценки структурных и химических изменений на поверхности молибдена в процессе коррозии в расплаве осуществляли выдержку рабочего электрода в расплаве в течение 8 ч.
Для определения значений потенциалов коррозии проведено измерение потенциалов молибденовых образцов (табл. 1) относительно хлор-серебряного электрода сравнения в течение 8 ч выдержки в LiС1–КС1, содержащем ионы редкоземельных металлов при 500°С. После испытаний образец извлекали из расплава, отмывали в различных режимах (вода, 0.1 М соляная кислота).
Таблица 1.
Скорость коррозии и потенциалы коррозии молибдена в зависимости от концентрации трихлорида церия и неодима
| CeCl3 | NdCl3 | ||||
|---|---|---|---|---|---|
| C, мол. % | t, ч | скорость коррозии, г ∙ м2/ч | φk, В | скорость коррозии, г ∙ м2/ч | φk, В |
| 0.2 | 4 | 3.27 | –0.95 | 3.52 | –0.97 |
| 0.5 | 4 | 2.17 | –0.78 | 1.92 | –0.85 |
| 1.0 | 4 | 0.79 | –0.5 | 0.36 | –0.77 |
| 2.0 | 4 | 0.66 | –0.5 | 0.31 | –0.70 |
| 5.0 | 4 | 0.51 | –0.5 | 0.25 | –0.70 |
Поверхность образцов исследовали при помощи сканирующего электронного микроскопа “GEOL SM-5900 LV” с возможностью энергодисперсионного рентгеновского анализа поверхности изучаемого образца.
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
Использование термодинамического моделирования (ТДМ) позволяет количественно моделировать и прогнозировать состав и свойства продуктов коррозии в широком диапазоне температур и давлений с учетом химических и фазовых превращений. Это дает возможность прогнозировать результаты высокотемпературных взаимодействий металла с расплавленным солевым электролитом и газовой атмосферой, резко сокращать коррозионные потери металлического материала.
Термодинамические расчеты были выполнены в программе HSC Chemistry 9.0 в модуле Equilibrium calculations. Программа позволяет рассчитать равновесный состав системы при заданных параметрах. Для определения равновесного состава системы программа использует метод минимизации свободной энергии Гиббса:
где f – общее число фаз системы; bi – общее число молей независимого компонента i в системе; n – число независимых компонентов системы; cj – эмпирическая термодинамическая функция; Xa – общее число молей фазы a в системе; xj/Xa – мольная доля зависимого компонента в фазе a; γj – коэффициент активности j – компонента. Экстремум находится с учетом некоторых ограничений, таких как уравнения баланса масс вещества:
и условий нормировки:Параметры равновесия системы определяются решением математической задачи о нахождении экстремума с учетом ограничений, приведенных выше. Для вычислений используется метод последовательных приближений Ньютона.
При создании алгоритма расчета в данном программном комплексе приняты следующие допущения математической модели:
– рассматриваются закрытые и изолированные термодинамические системы, в которых границы непроницаемы для обмена с окружающей средой;
– считается, что исследуемая система является гетерогенной, состоящей из нескольких однородных частей (фаз), отделенных видимыми границами;
– присутствие газовой фазы в система обязательно;
– газовая фаза описывается уравнением состояния идеального газа; – поверхностные эффекты на границе раздела фаз не учитываются, растворимость газов в конденсированных фазах отсутствует;
– в расчете учитывается несколько конденсированных фаз, которые принимаются взаимонерастворимыми;
– индивидуальные вещества, имеющие одинаковую химическую формулу, но входящие в различные фазы, считаются разными компонентами;
– вещества с одинаковой химической формулой, находящиеся в различных полиморфных модификациях, кристаллическом или жидком состоянии, рассматриваются как один компонент, у которого изменение свойств происходит скачкообразно при температурах превращений;
– объем конденсированных компонентов пренебрежимо мал;
– значения коэффициентов активности не зависят от состава фаз. Результатом расчета с использованием программного комплекса HSC Chemistry 9.0 является равновесный состав продуктов коррозии молибдена в расплаве в зависимости от температуры и концентрации вводимой добавки – имитатора продуктов ОЯТ.
С целью более точного установления механизма коррозии и состава образующихся продуктов коррозии было проведено термодинамическое моделирование процесса коррозии молибдена в чистом расплаве LiCl–KCl и в расплаве с добавками трихлоридов церия и неодима.
С использованием программного комплекса HSC-9 Chemistry был рассчитан равновесный состав системы следующего состава: Mo – 1, LiCl – 6; KCl – 4; Al2O3 – 2 кмоль; CeCl3 или NdCl3 по 0.2 кмоль (то есть их концентрация примерно 2 мол. %). При расчете принимали коэффициенты активности (500°С): γ(CeCl3) = 3.03 ∙ 10–3; γ(NdCl3) = 3.55 ∙ 10–4 [7]; молибдаты – 0.1 (оценочное значение). Для всех остальных соединений коэффициенты активности по умолчанию принимались равными единице.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Микрофотографии поверхности образцов молибдена и распределение элементов на локальных участках поверхности образцов после выдержки в расплаве в течение 4 ч приведены на рис. 1–3. Поверхность образцов ровная, без видимых коррозионных поражений, покрыта плотным слоем из продуктов коррозии, который легко отмывается в дистиллированной воде. Рентгеноспектральный анализ показывает, что количество церия и неодима на поверхности крайне мало.
Рис. 2.
Микрофотография и распределение элементов на локальных участках поверхности молибдена, выдержанного 4 ч в контакте со смесью LiCl–KCl содержащий 1 мол. % трихлорида церия.

Рис. 3.
Микрофотография поверхности и распределение элементов на локальных участках поверхности молибдена, выдержанного 4 ч в контакте со смесью LiCl–KCl содержащий 1 мол. % трихлорида неодима.

Потенциалы коррозии практически не зависят от концентрации вводимой добавки. По потенциалам рассчитан ток коррозии и сопоставлен с результатами из парциальных кривых и с химическим анализом замороженных проб расплава, контактировавшего с молибденом. Удовлетворительное совпадение величин токов коррозии, полученных тремя независимыми методами, позволяет говорить об электрохимическом механизме коррозии, поверхность молибдена покрыта смесью оксидов молибдена MoO и Mo2O3 со следами оксихлоридов. Методом ТДМ определены возможные соединения, которые могут быть образованы на поверхности. В основном коррозия молибдена определяется наличием кислорода в расплаве, а значит, напрямую его скорость коррозии зависит от степени очистки аргона и качество используемых солей и методики их подготовки.
Молибден весьма коррозионностоек в исследуемых средах.
Результаты гравиметрических измерений скорости коррозии молибдена и его потенциала коррозии в зависимости от концентрации CeCl3 или NdCl3, а также от времени выдержки, приведены в табл. 1 и 2.
Таблица 2.
Скорость коррозии молибдена в расплаве LiCl–KCl, с добавлением 1 мол. % CeCl3 и NdCl3 в зависимости от времени выдержки
| CeCl3 | NdCl3 | |||
|---|---|---|---|---|
| t, ч | скорость коррозии, г ∙ м2/ч | φk, В | скорость коррозии, г ∙ м2/ч | φk, В |
| 2 | 0.92 | 0.65 | ||
| 4 | 0.79 | –0.5 | 0.36 | –0.77 |
| 8 | – | – | ||
| 12 | 0.50 | 0.34 | ||
| 24 | 0.43 | 0.31 | ||
| 50 | 0.32 | 0.28 | ||
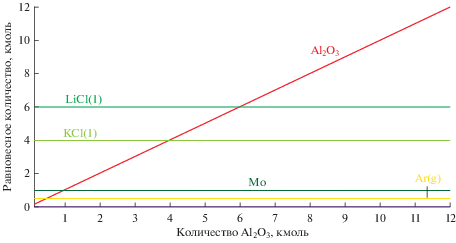
На рис. 4 показаны результаты моделирования системы, состоящей из расплава LiCl–KCl, находящемся в алундовом тигле и содержащей металлический молибден. Инертная атмосфера. В такой системе нет химического взаимодействия.
Рис. 4.
Моделирование молибдена в тигле Al2O3 в расплаве LiCl–KCl при температурах 500–650°С в атмосфере аргона.
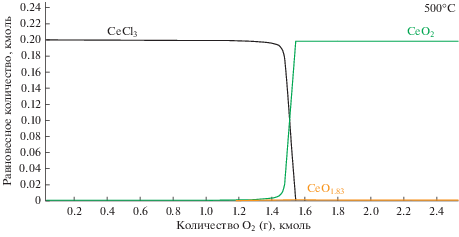
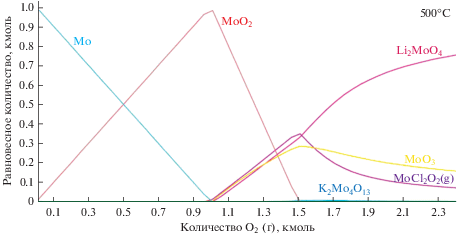
На рис. 5 приведен равновесный состав системы, состоящей из эвтектики LiCl–KCl, находящейся в алундовом тигле (Al2O3), содержащей металлический молибден и в которую постепенно подается смесь кислорода и азота, 0.22O2 + 0.78N2.
Рис. 5.
Поведение молибдена в тигле Al2O3 в расплаве LiCl–KCl при температуре 500°С в атмосфере аргона и кислорода (1 : 1).
Данные, приведенные на рис. 4, подтверждают давно известный факт, что, молибден, в отсутствии иных окислителей, не взаимодействует с алундом (Al2O3) и расплавленными хлоридами щелочных металлов [9]. Этот вывод, разумеется, относится только к замкнутым равновесным системам.
Как следует из рис. 5 и 6 первоначально окисление молибдена газовой смесью 0.22O2 + 0.78N2 идет по двум параллельным реакциям (здесь и далее все ΔG приведены для 500°C):
Принимая во внимание небольшую величину энергии Гиббса образования Mo2N, можно предположить, что он образует тонкий поверхностный слой, который также, как и металлический молибден взаимодействует с кислородом (3):
Если газовой смеси 0.22O2 + 0.78N2 достаточно, что, в какой-то мере, эквивалентно продолжающемуся во времени контакту расплава с этой смесью, то происходит дальнейшее окисление молибдена. Вероятными реакциями являются следующие:
Далее могут протекать реакции уже с участием компонентов соли-растворителя:
Изменение энергии Гиббса при протекании реакции близко к нулю. Однако в этой записи не учтено, что имеется большой избыток одного из исходных веществ – LiCl, а один из продуктов реакции (MoO2Cl2) газообразный и немедленно удаляется из зоны реакции. Согласно [10], давление пара MoO2Cl2 достигает 1 атм. уже при 157–161°C. Таким образом, равновесие данной реакции существенно смещено вправо.
При наличии в расплаве LiCl–KCl хлоридов церия или неодима первым начинает окисляться молибден. CeCl3 начинает взаимодействовать с кислородом когда уже заканчивается окисление Mo(IV) до Mo(VI). Тогда параллельно с доокислением молибдена протекает реакция:
ЗАКЛЮЧЕНИЕ
Коррозия молибдена в смеси LiCl–KCl, содержащей добавки трихлорида неодима и трихлорида церия, при 500°С равномерная, сопровождающаяся образованием плотного слоя из продуктов коррозии.
Эволюция образующихся продуктов коррозии на молибдене в хлоридном расплаве изучена методом ТДМ и сопоставлена с результатами, полученными методом растровой электронной микроскопии, и спектроскопией комбинационного рассеяния. Результаты моделирования и анализов поверхности достаточно хорошо сходятся, к тому же модомот ТДМ можно наиболее точно определить сложные образующиеся соединения нестихиометриеского состава.
Предложены механизмы влияния галогенидов лантаноидов на коррозию молибдена в инертной и в окислительной атмосфере. Ключевым моментом является то, что в инертной атмосфере такие добавки в расплав действуют как экранирующие ингибиторы анодного типа, т.к. скорость коррозии молибдена в чистом расплаве выше, чем в расплаве с добавками.
В окислительной атмосфере молибден с расплавом образует летучее соединение MoO2Cl2, а следовательно, скорость коррозии значительно увеличится.
Поскольку коррозия молибдена равномерная по все поверхности, то отсутствует вероятность развития питтинговой коррозии, которая в дальнейшем приведет к сквозным коррозионным поражениям.
Работа выполнена по проекту РФФИ № 18-33-00582 мол_а.
Список литературы
Смирнов М.В. Озеряная И.Н. Коррозия металлов в расплавленных солевых средах и защита от коррозии // Итоги науки и техники. Коррозия и защита от коррозии. М.: ВИНИТИ. 1987. 1. С. 142–143.
Улиг Г.Г. Коррозия и борьба с ней. Введение в коррозионную науку и технику. Под ред. Сухотина А.М. Л.: Химия. 1989.
Кочергин В.П. Защита металлов от коррозии в ионных расплавах и растворах электролитов: монография. Екатеринбург: УрГУ. 1991.
Gabriel J.C., Vincent D., Bouteillon J., Poignet J.C., Volkovich V.A., Griths T.R. Molybdenum chemistry in molten LiCl–KCl eutectic: an electrochemical and absorption spectroscopy study of the concentration dependent stability of solutions of K3MoCl6 // Electrochimica Acta. 1999. № 44. P. 4619–4629.
Le Wang, Bing Li, M. Shen, Shi-yan Li, Jian-guo Yu. Corrosion resistance of steel materials in LiCl-KCl melts // International Journal of Minerals, Metallurgy, and Materials, 2012. 19. № 10. P. 930–933.
Génération IV nuclear energy systems: Road тap and concepts // Transactions of the American Nuclear Society. 2001. 84. P. 115–118.
Sridharan K. Thermal properties of LiCl–KCl molten salt for nuclear waste separation. NEUP Final Report. 2012.
Yamamura T., Mehmood M., Maekawa H., Sato Y. Electrochemical processing of rare-earth and rare metals by using molten salts // Chemistry for Sustainable Development. 2004. № 12. P. 105–111.
Залазинский Г.Г. Взаимодействие металлического молибдена с расплавами хлоридов щелочных металлов. Дис.… к. х. н. Ин-т электрохимии УНЦ АН CCCP. Свердловск, 1974.
Елисеев C.C., Малышева Л.E., Вождаева E.E., Гайдаенко H.B. Хлориды и хлорокиси молибдена и вольфрама. Душанбе: Изд-во “Дониш”, 1989.
Васин Б.Д., Иванов В.А., Распопин С.П., Савченко С.В. Условные стандартные потенциалы церия в эвтектической смеси хлоридов натрия и цезия // Расплавы. 1989. № 3. С. 100–101.
Новоселова А.В., Смоленский В.В. Электрохимические и термодинамические свойства лантанидов (Nd, Sm, Eu, Tm, Yb) в расплавленных хлоридах щелочных металлов // Радиохимия. 2013. 55. № 3. С. 193–204.
Новоселова А.В., Смоленский В.В. Электрохимическое исследование свойств ионов Nd(III) и Nd(II) в расплавленных эвтектике LiCl–KCl–CsCl и индивидуальном CsCl // Электрохимия. 2013. 49. № 10. С. 1041–1047.
Shirai O., Iwai T., Suzuki Y., Sakamura Y., Tanaka H. Electrochemical behavior of actinide ions in LiCl–KCl eutectic melts // J. Alloys Comp. 1998. 273–273. P. 685–688.
Дополнительные материалы отсутствуют.