Расплавы, 2020, № 3, стр. 267-274
Исследование реакции катодного восстановления ионов Ce(III) в эвтектическом расплаве 3LiCl–2KCl
А. В. Новоселова a, b, *, В. В. Смоленский a, b, А. Л. Бове a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: alena_novoselova@list.ru
Поступила в редакцию 27.01.2020
После доработки 05.02.2020
Принята к публикации 15.02.2020
Аннотация
Исследована реакция катодного восстановления ионов Ce(III) до металла на инертном Мо электроде в расплавленной эвтектике 3LiCl–2KCl в интервале температур 723–823 K стационарными и нестационарными электрохимическими методами. Установлено, что на вольтамперограммах фиксируется только один катодный пик тока при потенциале –3.19 ± 0.10 В и соответствующий ему анодный пик тока при потенциале –3.10 ± 0.08 В относительно хлорного электрода сравнения. Следовательно, процесс восстановления протекает по реакции Ce3+ + 3ē → Ce. Анализ циклических вольтамперограмм показал, что потенциал пика тока восстановления ионов Ce(III) смещается в отрицательную сторону с увеличением скорости сканирования. В тоже время ток катодного пика прямо пропорционален корню квадратному от скорости поляризации во всем исследуемом диапазоне потенциалов. Показано, что увеличение скорости сканирования приводит к уменьшению коэффициента переноса (α), то есть к увеличению необратимости катодного процесса. Согласно теории циклической вольтамперометрии катодный процесс восстановления ионов церия необратим, протекает в одну стадию и контролируется скоростью переноса заряда. Определена зависимость условного стандартного потенциала пары Ce(III)/Ce от температуры методом хронопотенциометрии при нулевом токе. Экспериментальные значения описываются линейным уравнением: $E_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}}}^{{\text{*}}} = - \left( {{\text{3}}{\text{.455}} \pm {\text{0}}{\text{.010}}} \right)$ + $\left( {{\text{6}}{\text{.1}} \pm {\text{0}}{\text{.1}}} \right) \cdot {\text{1}}{{{\text{0}}}^{{ - 4}}} \cdot T \pm {\text{0}}{\text{.009}}\,\,{\text{В}}{\text{.}}$ Рассчитаны изменение условной стандартной энергии Гиббса, энтальпии, энтропии реакции образования трихлорида церия из элементов в расплавленной эвтектике 3LiCl–2KCl и коэффициент активности CeCl3.
ВВЕДЕНИЕ
Расплавленные соли являются перспективной средой для использования в качестве растворителя для экстракционной металлургии. В частности, расплавленные хлориды являются хорошим реакционным электролитом для селективного растворения или осаждения чистых реагентов, а их использование обеспечивает перспективное направление обработки сырья [1].
За последние годы открыта новая область применения расплавленных солей, их возможное использование для процессов пирохимической очистки основных компонентов ядерного топлива от продуктов деления. Причина такого интереса связана с прогрессом в оценке новых концепций трансмутации продуктов деления в инновационных топливных циклах. Для оценки возможности пирохимического разделения разработан ряд процессов извлечения минорных актинидов из отработавшего ядерного топлива и высокоактивных жидких отходов [2–6].
В настоящее время в литературе имеется противоречивая информация об электрохимическом поведении соединений церия в расплавленных солях. В работе [7] изучено электроосаждение металлического церия в расплавленных фторидах. Установлен механизм процесса, определены некоторые кинетические характеристики катодного восстановления ионов Ce3+. Результаты исследования электрохимических свойств ионов Ce3+ в расплавленных системах LiCl–KCl–CeCl3 и CaC12–NaCl–CeCl3 на различных электродах в интервале температур 450–550°C представлены в [8]. Рассчитаны значения стандартной константы скорости k0 и коэффициент переноса α электрохимической реакции Ce3+ + 3ē = Ce. Вольтамперометрическим методом изучена электродная реакция Ce3+ → Ce в расплаве LiCl–KCl при 773 K на вольфрамовом и жидком кадмиевом электродах [9]. Потенциалы восстановления ионов Ce3+ на вольфрамовом и жидком кадмиевом электродах составили –2.04 В и –1.47 В соответственно, относительно AgCl/Ag электрода сравнения. Такая большая разность потенциалов объяснялась авторами образованием интерметаллических соединений Ce с Cd. В статье приведены данные по изменению свободной энергии Гиббса интерметаллических соединений CeCd, CeCd2, CeCd3, CeCd4 и CeCd6. В публикации [10] авторы исследовали катодное восстановление ионов церия методами циклической и квадратно-волновой вольтамперометрии. Установлено, что катодный процесс восстановления ионов Ce3+ в расплавах на основе CsCl протекает в две стадии: Ce3+ + ē = Ce2+ и Ce2+ + 2ē = Ce. В [11] рассчитаны и построены диаграммы Пурбэ. Установлено, что стабильными степенями окисления для церия являются Ce(III) и Ce(0), а Ce(IV) устойчив только в виде твердого CeO2. Определен механизм восстановления ионов Ce3+ в расплавленной эвтектике 3LiCl–2KCl. Рассчитаны кинетические параметры процесса и коэффициент диффузии ионов Ce3+. В работе [12] изучена система NaCl–KCl–CeCl3 (5–30 мол. %) с точки зрения кислотно-основных свойств. Определена растворимость оксида церия(III) и СеOCl.
Целью данной работы является изучение механизма электрохимического восстановления ионов церия(III) в расплавленной эвтектике 3LiCl–2KCl и расчет кинетических характеристик процесса и термодинамических свойств соединений церия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали LiCl (Aldrich >99.99%), KCl (99.9% квалификация “х. ч.”), CeCl3 (Aldrich 99.99%). Эксперименты проводили в стандартной трехэлектродной кварцевой ячейке с тиглем из стеклоуглерода в атмосфере инертного газа. В качестве рабочего электрода применяли молибденовую проволоку диаметром 1 мм, которую погружали в расплав на глубину 3–10 мм. Площадь поверхности катода определяли экспериментально после каждого опыта. Противоэлектродом служил стержень из стеклоуглерода диаметром 3 мм, а электродом сравнения – стандартный хлорный электрод [13]. Для анализа электрохимических процессов были использованы следующие методы: циклическая вольтамперометрия и потенциометрия при нулевом токе. Измерения выполняли на потенциостате-гальваностате AUTOLAB PGSTAT 302N (Eco Chemie) с программным обеспечением (NOVA 1.11).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
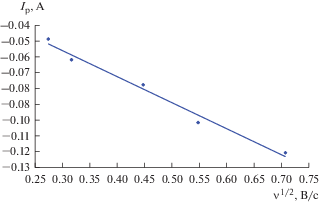
Циклические вольтамперограммы расплава 3LiCl–2KCl–CeCl3 при 773 K, снятые на молибденовом инертном электроде при разных скоростях сканирования, приведены на рис. 1 (кривые 1–4). На вольтамперограмме фиксируется катодный пик тока при потенциале –3.18 В и соответствующий ему анодный пик тока при потенциале –3.11 В относительно хлорного электрода сравнения. Анализ циклических вольтамперограмм показал, что потенциал пика тока восстановления ионов Ce3+ до Ce смещается в отрицательную сторону с увеличением скорости сканирования, рис. 2. В тоже время ток катодного пика прямо пропорционален корню квадратному от скорости поляризации во всем исследуемом диапазоне потенциалов, рис. 3.
Рис. 1.
Циклические вольтамперограммы расплава LiCl–KCl–CeCl3 (2.88 мас. %), зарегистрированные на Мо электроде (S = 0.36 см2) при разных скоростях сканирования, В/с: 1 – 0.075; 2 – 0.1; 3 – 0.3; 4 – 0.5. T = = 773 K.
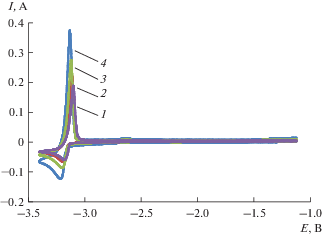
Рис. 2.
Зависимость катодного потенциала пика от скорости сканирования в расплаве LiCl–KCl–CeCl3 (2.88 мас. %). Рабочий электрод: Мо (S = 0.36 см2). T = 773 K.
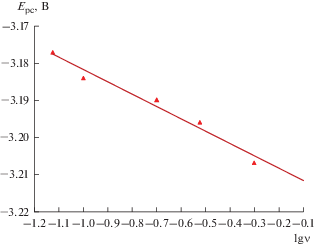
Рис. 3.
Зависимость катодного тока пика от скорости сканирования в расплаве LiCl–KCl–CeCl3 (2.88 мас. %). Рабочий электрод: Мо (S = 0.36 см2). T = 773 K.
Согласно теории циклической вольтамперометрии [14, 15] катодный процесс восстановления ионов церия(III) до металла протекает в одну стадию, которая необратима и контролируется скоростью переноса заряда:
Величину коэффициента переноса (α) для электрохимической реакции (1) рассчитывали по уравнению (2) [14, 15]:
(2)
${{E}_{{\text{p}}}} - {{E}_{{{{\text{p}} \mathord{\left/ {\vphantom {{\text{p}} 2}} \right. \kern-0em} 2}}}} = - 1.857\left( {{{RT} \mathord{\left/ {\vphantom {{RT} {\alpha nF}}} \right. \kern-0em} {\alpha nF}}} \right).$Результаты расчета представлены в табл. 1. Видно, что увеличение скорости сканирования приводит к закономерному уменьшению коэффициента переноса, т.е. к увеличению необратимости катодного процесса.
Таблица 1.
Рассчитанные значения αn и α по уравнению (2) для реакции катодного восстановления ионов Ce(III) при температуре 773 K
| ν, В/с | Ep, В | Ep/2, В | $\alpha $ | $\alpha n$ |
|---|---|---|---|---|
| 0.075 | –3.177 | –3.134 | 0.96 | 2.87 |
| 0.1 | –3.184 | –3.14 | 0.94 | 2.81 |
| 0.2 | –3.19 | –3.143 | 0.88 | 2.63 |
| 0.3 | –3.196 | –3.145 | 0.81 | 2.42 |
| 0.5 | –3.207 | –3.152 | 0.75 | 2.25 |
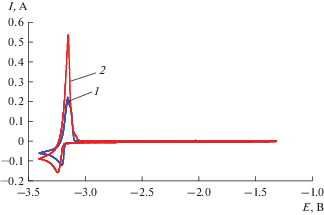
Изменение температуры не приводит к смене механизма катодного восстановления ионов церия(III). Наблюдается лишь закономерное смещение потенциала пика и пика тока, рис. 4.
Рис. 4.
Циклические вольтамперограммы расплава LiCl–KCl–CeCl3 (2.74 мас. %), снятые на Мо электроде (S = 0.32 см2) при разных температурах, K: 1 – 723; 2 – 823. ν = 0.1 В/с.
Определение условного стандартного потенциала пары Ce(III)/Ce при разных температурах проводили методом хронопотенциометрии при нулевом токе, рис. 5. Для этого молибденовый катод поляризовали током 200 мА в течение 20 с, а затем снимали зависимость потенциал–время. Горизонтальный участок зависимости представлял собой равновесный потенциал пары Ce(III)/Ce. Расчет условного стандартного потенциала проводили с использованием уравнения Нернста:
(3)
${{E}_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}{\text{\;}}}}} = E_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}}}^{*} + \frac{{RT}}{{nF}}{\text{ln}}{{X}_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}},$(4)
$E_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}}}^{*} = E_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}}}^{^\circ } + \frac{{RT}}{{nF}}{\text{ln}}{{\gamma }_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}}.$Рис. 5.
Зависимости потенциал–время, полученные после катодной поляризации Мо рабочего электрода в расплаве LiCl–KCl–CeCl3 (0.67 мол. %) при разных температурах, K: 1 – 723; 2 – 773; 3 – 823. Ток поляризации – 200 мА. Время поляризации – 20 с.
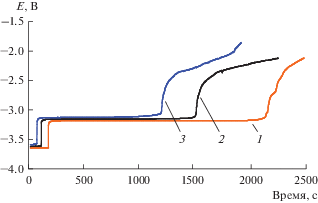
Экспериментальные значения удовлетворительно описываются линейным уравнением (5), полученным с использованием метода наименьших квадратов с доверительным интервалом 0.95:
(5)
$E_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}}}^{*} = - \left( {{\text{3}}{\text{.455}} \pm {\text{0}}{\text{.010}}} \right) + \left( {{\text{6}}{\text{.1}} \pm {\text{0}}{\text{.1}}} \right) \cdot {\text{1}}{{{\text{0}}}^{{ - 4}}} \cdot T \pm {\text{0}}{\text{.009}}\,\,{\text{В}}.$Изменение условной стандартной энергии Гиббса $\left( {\Delta G_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{{\text{*}}}} \right)$ определяли по выражению (6):
(6)
$\Delta G_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*} = nFE_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}}}^{*}.$Поскольку известна зависимость условного стандартного потенциала $\left( {E_{{{{{\text{Ce}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Ce}}\left( {{\text{III}}} \right)} {{\text{Ce}}}}} \right. \kern-0em} {{\text{Ce}}}}}}^{*}} \right)$ от температуры, представляется возможным определить энтальпию $\left( {\Delta H_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*}} \right)$ и энтропию $\left( {T\Delta S_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*}} \right)$ исследуемой реакции (7), которая описывается уравнением (9):
(7)
${\text{C}}{{{\text{e}}}_{{\left( {{\text{тв}}} \right)}}} + {3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}{\text{C}}{{{\text{l}}}_{{{\text{2}}\left( {\text{г}} \right)}}} = {\text{CeC}}{{{\text{l}}}_{{{\text{3}}\left( {{\text{тв}}} \right)}}},$(8)
$\Delta G_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*} = \Delta H_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*} - T\Delta S_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*},$(9)
$\Delta G_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*} = - 1000.2 + 0.166 \cdot T \pm 1.1\,\,{\text{кДж}}\,\,{\text{мол}}{{{\text{ь}}}^{{ - {\text{1}}}}}.$Значение величины $\Delta G_{{{\text{CeC}}{{{\text{l}}}_{3}}}}^{{\text{*}}}$ позволяет рассчитать коэффициент активности ${\text{CeC}}{{{\text{l}}}_{{\text{3}}}}\left( {{{\gamma }_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}}} \right)$ в расплаве по уравнению (10):
(10)
${\text{lg}}{{\gamma }_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}} = \frac{{\Delta G_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{*} - \Delta G_{{{\text{CeC}}{{{\text{l}}}_{{\text{3}}}}}}^{^\circ }}}{{2.3RT}},$ВЫВОДЫ
Исследована реакция катодного восстановления ионов Ce(III) до металла в расплавленной эвтектике 3LiCl–2KCl в интервале температур 723–823 K на инертном молибденовом электроде стационарными и нестационарными электрохимическими методами. Установлен механизм осаждения металлического церия. Показано, что катодный процесс восстановления необратим, протекает в одну стадию по реакции Ce3+ + 3ē → Ce и контролируется скоростью переноса заряда. Рассчитаны коэффициенты активности ${\text{CeC}}{{{\text{l}}}_{3}}~$ в расплаве и определены основные термодинамические характеристики трихлорида церия.
Список литературы
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука, 1976.
Osipenko A., Mayershin A., Smolenski V., Novoselova A., Kormilitsyn M. Electrochemistry of Curium in Molten Chlorides. In book: “Recent Trend in Electrochemical Science and Technology”. Edited by Ujjal Kumar Sur. InTech, 2012. Chapter 1. P. 11–30.
The chemistry of the actinide elements, Editors J.J. Katz, G.T. Seaborg, L.R. Morss. London, N.-Y.: Chapman and Hall, 1986. 2.
Fukaya Y. Safety and economics of uranium utilization for nuclear power generation. In book: “Uranium – Safety, Resources and Thermodynamic Calculation”, Edited by Nasser S. Awwad. IntechOpen, 2018. Chapter 2. P. 21–48.
Laidler J.J., Battles J.E., Miller W.E., Ackerman J.P., Carls E.L. Development of pyroprocessing technology // Prog. Nucl. Energ. 1997. 31. P. 131–140.
Lewin R.G., Harrison M.T. International developments in electrorefining technologies for pyrochemical processing of spent nuclear fuels. In: Reprocessing and Recycling of Spent Nuclear Fuel. Cambridg: Woodhead Publishing, 2015. P. 373–414.
Constantin V., Popescu A.-M., Olteanu M. Electrochemical studies on cerium(III) in molten fluoride mixtures // J. Rar. Earths. 2010. 28. P. 428–434.
Castrillejo Y., Bermejo M.R., Arocas D., Martinez A.M., Barrado E. Chemical and electrochemical behavior of cerium(III) in molten LiCl–KCl and CaCl2–NaCl. In: Progress in Molten Salt Chemistry. 2000. 1. P. 143–149.
Castrillejo Y., Bermejo M.R., Pardo R., Martinez A.M. Use of electrochemical techniques for the study of solubilization processes of cerium-oxide compounds and recovery of the metal from molten chlorides // J. Electroanal. Chem. 2002. 522. P. 124–140.
Kim S.-H., Paek S., Kim T.-J., Park D.Y., Ahn D.-H. Electrode reactions of Ce3+/Ce couple in LiCl–KCl solutions containing CeCl3 at solid W and liquid Cd electrodes // Electrochim. Acta. 2012. 85. P. 332–335.
Shuqiang J., Hongmin Z. An investigation into the electrochemical recovery of rare earth ions in a CsCl-based molten salt // J. Hazard. Mater. 2011. 189. P. 821–826.
Combest R., Levelut M.N., Tremillon B. Oxoacidity and its influence on the electrochemical properties in molten mixtures of CeCl3 and equimolar NaCl–KCl at 1000 K // Electrochim. Acta. 1978. 231. P. 291–1295.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973.
Галюс З. Теоретические основы электрохимического анализа. М.: Мир, 1974.
Bard A.J., Faulkner L.R. Electrochemical Methods: Fundamentals and Applications. N.-Y.: John Wiley & Sons, 1980.
Дополнительные материалы отсутствуют.


