Расплавы, 2020, № 4, стр. 434-440
Активность кислорода в расплавах никеля, содержащих бор и гафний, при РAr = 0.1 МПа
В. Т. Бурцев *
Институт металлургии и материаловедения им. А.А. Байкова РАН
Москва, Россия
* E-mail: burtsev@imet.ac.ru
Поступила в редакцию 28.06.2019
После доработки 17.02.2020
Принята к публикации 01.03.2020
Аннотация
Раскисление жаропрочных сплавов на основе никеля при плавке в вакууме проводят в присутствии алюминия сильными раскислителями – бором и гафнием, что требует дополнительных знаний об активности растворенного кислорода (а[O]). Предварительно собран и проанализирован обзор научной литературы о влиянии бора и гафния на а[O] и показано отсутствие надежных результатов. Для восполнения этого изучили а[O] в модельных расплавах Ni–O–B/Hf (0.001–0.1 мас. %*1 каждого) и Ni–O–Al (5%) – B/Hf (0.001–0.1%) при 1560°С и РAr = 0.1 МПа методом мгновенного фиксирования ЭДС (МФЭ). Опыты провели на специальной установке, состоявшей из вакуумной печи сопротивления с графитовым нагревателем и системами контроля газовой фазы и температуры металла; а[O] определяли с помощью МФЭ погружными одноразовыми сертифицированными датчиками фирмы “Heraeus Electro-Nite” с твердым электролитом ZrO2 (0.06% MgO), с электродом сравнения (Cr/Cr2O3) “Celox II Standart”, выводом из молибдена. Показано, что для расплавов Ni–O–(B/Hf) зависимость а[O] = f[B/Hf] описывается логарифмическими функциями, и при 0.05% раскислителя а[O] снижается на 9% (отн.) при введении бора по сравнению с гафнием. Для расплавов Ni–O–Al (5%)–B/Hf (0.05% каждого) а[O] при введении бора уменьшается на 36% (отн.) по сравнению с гафнием; а[O] при введении (B/Hf) по сравнению с Al при концентрации 0.05% уменьшилась для B в 11.5 раза, для Hf – в 10.5 раза. Для практики раскисления следует учитывать порядок введения раскислителей и его количество, отдавая предпочтение бору, как конечному раскислителю.
ВВЕДЕНИЕ
Для получения качественных изделий из новейших литейных жаропрочных сплавов на основе никеля специальную шихту плавят в вакуумных индукционных печах, а далее металлический расплав рафинируют, раскисляют и микролегируют редкоземельными металлами (РЗМ). Главной задачей этих процессов перед финальной присадкой РЗМ – снижение концентрации вредных примесей, в основном кислорода, до содержания менее 0.001%, чтобы обеспечить полное усвоение РЗМ без образования неметаллических включений (НВ) и создание необходимых условий для наноструктурирования [1].
C учетом введения в расплав реакционноактивных легирующих компонентов и сильных раскислителей, что приводит к образованию НВ, очевидна необходимость постоянного совершенствования процесса раскисления различными раскислителями и контроля поведения кислорода в жидком металле, вплоть до кристаллизации последнего. Применение на практике элементов-раскислителей основано на теоретическом фундаменте термодинамики раскисления никелевых расплавов [2], а также на эмпирическом опыте.
Термодинамика расплавов Ni–O при введении сильных раскислителей, таких как B, Al, Mg, Y, La, Ce, Hf изучена недостаточно полно, и по Вагнеру параметры взаимодействия кислорода от указанных элементов (${\text{е}}_{{\text{О}}}^{{\text{j}}}$) имеют оценочный характер и при 1600°C они равны: $ - {\text{е}}_{{\text{О}}}^{{\text{j}}}$ = 0; 1.98; 70; 1.5; 0; 0; 0.58 соответственно [3, 4], что приближенно указывает на преимущественное использование Mg в качестве эффективного раскислителя. Ранее [5] при раскислении никеля алюминием, магнием, иттрием (0.1%, каждого) экспериментально определили значения а[O] и показали рост раскислительной способности (РС) магния в 5.4 раза, иттрия – в 3 раза по сравнению с РС алюминия. При введении в металл La, Ce, Pr, Dy (0.1%, каждого) также определили величины а[O] и показали изменение (увеличение) РС лантана в 0.95 раза, церия – в 8.4 раза, празеодима – в 4.2 раза, диспрозия – в 6.1 раза по сравнению с РС алюминия. Отметим, что под РС принято изменение значения а[O] при введении в металл одного раскислителя, по сравнению с другим, т.к. определить РС сильного элемента-раскислителя в расплаве никеля при равновесии с реально используемой керамикой тигля и газовой фазой с окислительным потенциалом ниже 10–16 МПа в настоящее время затруднительно.
Выбор бора и гафния обусловлен отсутствием сведений о РС, что задерживает их применение на практике. Взаимодействие B/Hf с кислородом в жидком никеле представили схематически:
Традиционно для определения суммарного содержания кислорода в сложнолегированном металле в виде раствора в матрице и НВ, содержащих кислород, используется отбор проб металла с последующим анализом кислорода методом восстановительного плавления, используя фракционный газовый анализ. Это связано со сложными технологическими процедурами подготовки образцов и недостаточной корректностью анализа из-за возможного неполного восстановления тугоплавких кислородсодержащих соединений углеродом тигля. Поэтому в восстановительный период плавки при введении в сложнолегированный расплав никеля реакционноактивных компонентов, таких как Al с концентрацией до 5% и сильных раскислителей с концентрацией до 0.1%, активность кислорода (а[O]) определяют методом ЭДС. Это дает возможность управлять процессами легирования и раскисления, а также определять влияние других раскислителей на а[O], что в настоящее время почти не изучено [9]. В этой связи целью работы явилось исследование а[O] в модельных расплавах Ni–O–B/Hf (0.001–0.1%), Ni–O–Al (5%)–B/Hf (0.001–0.1%) при 1560°С с определением а[O] методом мгновенного фиксирования ЭДС (МФЭ) [10] и сравнение значений а[O] с данными системы Ni–O–Al (0.001–0.1%) в аналогичных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали электрохимическую ячейку следующей конструкции:
Особенности метода МФЭ представлены в работе [5], и этим методом экспериментально фиксировали горизонтальное плато зависимости ЭДС от времени E = f (τ), где τ равно 1–10 с, т.к. в ячейку помещены два металлических токоподвода из молибдена, и “значение Δμi равно разности электростатических потенциалов токоподводов” [10]. Обработка результатов состояла из расчетов значений а[O] по уравнению Нернста:
Шихтой для плавки служили Ni марки ДНК (дробь никелевая карбонильная) и раскислители в виде лигатур Ni–B (15.6%), Ni–Hf (90%). Содержание раскислителей в металле определяли по расчету. Для измерения a[O] использовали установку, состоящую из вертикальной вакуумной печи сопротивления с графитовым нагревателем, электрохимической ячейки (см. выше), устройства для введения ячейки ЭДС в металл, аналого-цифрового преобразователя, ПК, снабженного ПО “Экохром“, модернизированного для измерения ЭДС с периодом фиксации 0.02 с, монитором. В ячейке ЭДС использовали погружные одноразовые сертифицированные датчики фирмы “Heraeus Electro-Nite” с твердым электролитом ZrO2 (0.06% MgO) с электродом сравнения (Cr/Cr2O3) “Celox II Standart”, выводом из молибдена. Температуру металла фиксировали термопарой ВР5/20 и вольтметром В7-78/1 с тестированием по точкам плавления чистых металлов.
Эксперименты проводили по следующей программе: нагрев и плавление шихты в вакууме 5 ⋅ 10–6 MПа, рафинирование металла – 20 мин, заполнение аргоном марки в.ч. на проток при РAr = 0.1 МПа, фиксация температуры металла, введение датчика в металл и измерение Е (ЭДС) для тестирования a[O] в расплаве Ni–O в течение 6–9 с, откачка системы и напуск аргона, введение в металл раскислителей и измерение Е, а далее следующий цикл. Подробно установка и методика опытов описаны ранее [5].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Было проведено свыше 30 измерений Е в сплавах Ni–O–B/Hf (0.001–0.1%); Ni–O–Al (5%)–B/Hf (0.001–0.1%) при температуре 1560°С. Обработка результатов состояла из расчетов значений а[O] по уравнению Нернста.
Система Ni–O–Al (0.001–5%). Эта система была изучена ранее [5]. В качестве примера воспроизводимости и достоверности результатов были представлены экспериментальные и расчетные значения. Среднее квадратичное отклонение данных Е для ограниченного количества измерений составило 4–8 отн. %. Табличные значения представили в виде Е и [Al, %], а далее после расчета a[O] изобразили их графически, обработали методом наименьших квадратов и описали уравнением lg а[O] = –5.27–0.231 ln[Al, %] с коэффициентом множественной корреляции K = 0.98, что свидетельствует о достоверной аппроксимации экспериментальных данных. Это уравнение позволило определить зависимость а[O] = f[Al, %] в интервале концентраций алюминия 0.001–0.2%, что дало основание сравнивать эту зависимость с данными при раскислении металла бором и гафинем.
Системы Ni–O–B/Hf (0.001–0.1%), Ni–O–Al (5%)–B/Hf (0.001–0.1%). Экспериментальные данные Е и расчетные значения а[O] представлены в табл. 1 и на рис. 1 и 2, которые обработаны методом наименьших квадратов и имеют вид для систем: Ni–O–Al (см. выше); Ni–O–B: lg а[O] = –6.06–0.139 ln[B, %] с K = 0.97; Ni–O–Al (5%)–B: lg а[O] = = –6.35–0.151 ln[B, %] с K = 0.85; Ni–O–Hf: lg а[O] = –6.40–0.266 ln[Hf, %] с K = 0.97; Ni–O–Al (5%) – Hf: lg а[O] = –6.29–0.195 ln[Hf, %] с K = 0.83.
Таблица 1.
Экспериментальные и расчетные значения Е и а[O] для расплавов Ni–O–B/Hf, Ni–O–Al (5%)–B/Hf при 1560°С
| № серии и опыта | Состав, % | Е, В | а[O] · 10–6 |
|---|---|---|---|
| 32-1 | Ni–O (O = 0.0036) | 0.087 | 5.69 |
| 32-2 | Ni–O–B (0.009*) | 0.107 | 4.15 |
| 32-3 | Ni–O–B (0.019) | 0.130 | 2.83 |
| 32-4 | Ni–O–B (0.049) | 0.140 | 2.39 |
| 32-5 | Ni–O–B (0.098) | 0.156 | 1.8 |
| 35-1 | Ni–O (O = 0.0035) | 0.094 | 5.10 |
| 35-2 | Ni–O–Al (Al = 5*) | 0.186 | 1.03 |
| 35-3 | Ni–O–Al–B (0.009) | 0.155 | 1.84 |
| 35-3 | » | 0.135 | 2.60 |
| 35-4 | Ni–O–Al–B (0.019) | 0.166 | 1.51 |
| 35-4 | » | 0.141 | 2.23 |
| 35-5 | Ni–O–Al–B (0.049) | 0.158 | 1.75 |
| 35-6 | Ni–O–Al–B (0.097) | 0.197 | 0.83 |
| 35-6 | » | 0.127 | 2.99 |
| 33-1 | Ni–O (O = 0.0020) | 0.130 | 2.83 |
| 33-2 | Ni–O–Hf (0.01) | 0.070 | 7.37 |
| 33-3 | Ni–O–Hf (0.02) | 0.117 | 3.52 |
| 33-4 | Ni–O–Hf (0.049) | 0.130 | 2.83 |
| 33-5 | Ni–O–Hf (0.099) | 0.163 | 1.59 |
| 34-1 | Ni–O (O = 0.0037) | 0.07 | 7.37 |
| 34-2 | Ni–O–Al (Al = 5) | 0.110 | 3.93 |
| 34-2 | » | 0.078 | 6.51 |
| 34-3 | Ni–O–Al–Hf (0.01) | 0.101 | 4.56 |
| 34-3 | » | 0.073 | 7.05 |
| 34-4 | Ni–O–Al–Hf (0.02) | 0.182 | 1.12 |
| 34-5 | Ni–O–Al–Hf (0.056) | 0.150 | 2.01 |
| 34-6 | Ni–O–Al–Hf (0.1) | 0.170 | 1.4 |
| 34-6 | » | 0.154 | 1.87 |
Рис. 1.
Зависимости активности кислорода от содержания бора в расплавах никеля при 1833 К и РAr = = 0.1 МПа: 1 – Ni–O–Al; 2 – Ni–O–B, 3 – Ni–O–Al (5%)–B.
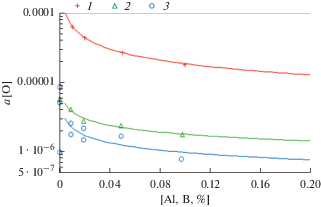
Рис. 2.
Зависимости активности кислорода от содержания гафния в расплавах никеля при 1833 К и РAr = = 0.1 МПа: 1 – Ni–O–Al; 2 – Ni–O–Hf; 3 – Ni–O–Al (5%) – Hf.
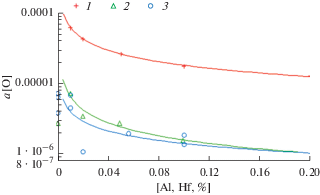
Анализ представленных графических результатов показывает:
1) изменения а[O] в системах Ni–O–B/Hf в интервале концентраций 0.001–0.1% подчиняются логарифмической зависимости;
2) значения а[O] при (B/Hf) = 0.05% равны lg а[O] = –5.64/–5.60 (а[O] = 2.27 ⋅ 10–6/ 2.49 ⋅ 10–6) соответственно, что указывает на снижение активности кислорода при введении бора по сравнению с гафнием на 9 отн. %;
3) изменения a[O] в системах Ni–O–Al (5%)–B/Hf в интервале концентраций 0.001–0.1% описываются принятой логарифмической зависимостью, и значения а[O] при (B/Hf) = 0.05% равны lg а[O] = –5.89/–5.70 (а[O] = 1.26 ⋅ 10–6/1.97 ⋅ 10–6) соответственно, что указывает на уменьшение активности кислорода при введении бора по сравнению с гафнием на 36 отн. %. В обоих случаях очевидно возрастание раскислительной способности бора по сравнению с гафнием. Отметим, что описание последней зависимости логарифмическим уравнением весьма приближенно, т.к. экспериментальные значения при минимальных концентрациях B/Hf повторяют ранее обнаруженную закономерность [5] при раскислении La/Ce расплавов Ni–O–Al (5%): сперва рост, а потом уменьшение значений а[O] с возрастанием содержания сильного раскислителя [12];
4) а[O] при введении B/Hf по сравнению с Al при концентрации 0.05% уменьшилась с 2.64 ⋅ 10–5 до 2.27 ⋅ 10–6 для бора, т.е. в 11.5 раз, для гафния – с 2.62 ⋅ 10–5 до 2.49 ⋅ 10–6, т.е. в 10.5 раз;
5) для практики раскисления следует учитывать порядок ведения раскислителей и его количество, отдавая предпочтение бору как конечному раскислителю.
ЗАКЛЮЧЕНИЕ
Для изучения раскисления расплавов никеля бором и гафнием исследовали активности кислорода в модельных системах Ni–O–B/Hf (0.001–0.1%) и Ni–O–Al (5%)–B/Hf (0.001–0.1%) при 1560°С и РAr = 0.1 МПа методом мгновенного фиксирования ЭДС. Для первых расплавов функции а[O] = f [B/Hf] описали логарифмическими уравнениями и показали уменьшение активности кислорода при введении бора по сравнению с гафнием. Для вторых расплавов изменения a[O] интервале концентраций 0.001–0.1% (B/Hf) подчиняются выбранной логарифмической зависимости, и значения а[O] при (B/Hf) = 0.05% равны 1.26 ⋅ 10–6/1.97 ⋅ 10–6 соответственно, т.е. также подтвердили более высокую раскислительную способность бора по сравнению с гафнием. В процессе раскисления следует реализовывать порядок введения раскислителя, учитывая преимущественное влияние бора.
Автор благодарит к. т. н. С.Н. Анучкина за помощь в работе.
Работа поддержана Грантом РФФИ № 19-08-00461/19.
Список литературы
Сидоров В.В., Каблов Д.Е., Ригин В.Е. Металлургия литейных жаропрочных сплавов: технология и оборудование. М.: ВИАМ. 2016.
Аверин В.В. Растворимость кислорода, азота и активность элементов-раскислителей в расплавах на основе железа, кобальта, никеля и хрома. Автореферат на соиск. уч. степени д. т. н. М.: ИМЕТ АН СССР. 1968.
Куликов И.С. Раскисление металлов. М. Металлургия. 1975.
Buzek Z. Hutnicke. Actuality Fundamental Thermodynamic Data on Metallurgical Reactions and Interactions of Elements in System Significant for Metallurgical Theory and Practice. Ostrava: Vyzkumny ustav hutnictvi zeleza, 1979.
Бурцев В.Т. Активность кислорода в расплавах никеля, содержащих алюминий, лантан и церий, при РAr = 0.1 МПа // Расплавы. 2018. № 6. С. 634–641.
Глушко В.П. Термические константы веществ. М.: ВИНИТИ. 1971. V.
Глушко В.П. Термические константы веществ. 1974. YII.
Казенас Е.К., Цветков Ю.В. Термодинамика испарения оксидов. М.: Изд. ЛКИ. 2007.
Падерин С.Н., Серов Г.В., Комиссаров А.А., Тихонов С.М., Кузнецов Д.В. Термодинамические расчеты и анализ процессов раскисления трубной стали // Сталь. 2017. № 1. С. 26–29.
Морачевский А.Г., Воронин Г.В., Гейдерих В.А., Куценок И.Б. Электрохимические методы исследования в термодинамике металлических систем. М.: ИКЦ “Академкнига“. 2003.
Kemori N., Katayama K., Kozuka Z. Solubility limit and thermodynamic properties of oxygen in liquid nickel // J. Chem. Thermodynamics. 1981. 13. P. 313–325.
Жучков В.И., Ватолин Н.А., Бородулин Е.К., Криночкин Э.В., Сафронов В.П. Модифицирование стали сплавами со щелочноземельными элементами // Труды 10-ой конференции по физико-химическим основам металлургических процессов. Ч. 1. М.: Черметинформация. 1991. С. 173–175.
Дополнительные материалы отсутствуют.


