Расплавы, 2020, № 4, стр. 399-405
Импеданс серебряного электрода, обратимого по неосновным носителям, в сульфатном твердом электролите или в ионном расплаве в гальванодинамическом режиме
Р. М. Гусейнов a, *, Р. А. Раджабов a, **, У. М. Магомедова a
a Дагестанский государственный педагогический университет
Махачкала, Россия
* E-mail: rizvanguseynov@mail.ru
** E-mail: radjab67@mail.ru
Поступила в редакцию 15.10.2019
После доработки 19.11.2019
Принята к публикации 15.01.2020
Аннотация
Целью настоящего исследования является изучение поведения серебряного электрода, обратимого по неосновным носителям, в сульфатном твердом электролите или в соответствующем ионном расплаве в гальванодинамическом режиме. В настоящей работе применяется метод преобразования Лапласа закона Ома о взаимодействии между током, потенциалом и комплексным сопротивлением (импедансом), получившем в электрохимии и электротехнике название метода операционного импеданса. Кроме метода операторного импеданса в настоящей работе нами применяется эквивалентная электрическая схема серебряного электрода, обратимого по кислороду и по неосновным носителям заряда (в качестве которых рассматриваются ионы кислорода). Возможность применения при исследовании релаксационных процессов в твердых электролитах эквивалентных электрических схем была показано еще в 1973 году американским электрохимиком Армстронгом [9, 10]. Получено аналитическое выражение зависимости потенциала межфазной границы электрод–твердый электролит или соответствующий ионный расплав от времени в гальванодинамическом режиме функционирования электрохимической ячейки. Графоаналитическим путем установлено, что гальванодинамическая кривая зависимости межфазного потенциала от времени подчиняется экспоненциальной функции. В настоящей работе показано также, что отличие серебряного электрода в сульфатных электролитах от классической эквивалентной электрической схемы Эршлера–Рэндлса заключается в том, что при очень малых концентрациях ионов серебра серебряный электрод выполняет еще одну функцию, а именно, кислородную функцию.
ВВЕДЕНИЕ
Изучение физико-химических свойств твердых электролитов и соответствующих ионных расплавов имеет двоякое назначение. С одной стороны, интерес к твердым электролитам и ионным расплавам объясняется возможностью их практического применения в электрохимических преобразователях энергии и информации: химических источниках энергии (ХИТ), электролитических конденсаторах и в других хемотронных устройствах. С другой стороны, изучение явлений ионного переноса в рассматриваемых объектах способствует развитию теории строения жидкого состояния, для которого пока не существует общепринятой теории, несмотря на существующие многочисленные модельные приближения.
Анализ механизма и кинетики электрохимических реакций на границе электрод-электролит также способствует раскрытию теории строения двойного электрического слоя в ионных расплавах и твердых электролитах. Анализ физико-химических явлений на границе раздела твердая фаза–жидкая фаза способствует раскрытию специфических особенностей строения как той, так и другой фазы.
Что же касается сульфатных твердых электролитов и их ионных расплавов, то они также не являются исключением из вышеизложенного и могут найти применение во всех перечисленных выше направлениях.
В отличие от ионных расплавов в твердых электролитах различают два сорта ионов – основные и неосновные. В качестве основных ионов в твердых электролитах рассматривают наиболее подвижные ионы (ионы проводимости), концентрация которых достаточно велика по сравнению с неосновными ионами. В качестве же неосновных ионов в твердых электролитах рассматривают дефекты кристаллической решетки, менее подвижные и концентрация которых сравнительно мала по сравнению с основными ионами.
Что же касается серебряного электрода, то в отличие от золотого электрода, он может быть обратим как по отношению к основным ионам сульфатного твердого электролита (т.е. ионам лития и натрия, а также ионам самого серебра), так и по отношению к дефектам кристаллической решетки, т.е. ионам кислорода и к самому кислороду. Другими словами, мы имеем дело с кислородной функцией серебряного электрода.
Известно [1–3], что поведение импеданса обратимого по основным ионам серебряного электрода в сульфатных твердых электролитах, а также в соответствующих им ионных расплавах с добавками сульфата серебра подчиняется классической эквивалентной электрической схеме Эршлера–Рэндлса [4, 5]. Однако при очень низких концентрациях ионов серебра наблюдаются существенные отклонения от эквивалентной электрической схемы Эршлера–Рэндлса. Более того, не выполняется также уравнение Нернста для потенциала металлического (серебряного) электрода. Причиной подобного поведения является обратимость серебряного электрода по отношению к двум сортам электрохимически активных частиц: ионам серебра и ионам кислорода. Для изучения природы этих эффектов в работах [1–3] авторы попытались исследовать поведение серебряного электрода в сульфатных твердых электролитах ${\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\kern 1pt} - {\kern 1pt} {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}$ и в соответствующих им ионных расплавах, не содержащих ионов Ag+. Оказалось, что частотную зависимость импеданса в этих случаях удовлетворяет схема цепи переменного тока, изображенная на рис. 1. Такая схема может соответствовать реакции разряда-ионизации кислорода
Структурные элементы на рис. 1: RЭ – сопротивление твердого электролита или ионного расплава; С1 – емкость двойного электрического слоя, связанная с разрядом-ионизацией кислорода; C2 – емкость двойного электрического слоя, связанная с адсорбцией кислорода; W2 – диффузионная постоянная Варбурга, связанная с диффузией ионов O2–; W3 – диффузионная постоянная Варбурга, связанная с диффузией нейтрального кислорода.Рис. 1.
Эквивалентная электрическая схема ячейки, содержащей серебряный электрод, обратимый по кислороду, в сульфатных твердых электролитах и в соответствующих им ионных расплавах.
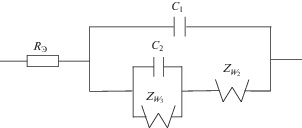
Вклад анионов кислорода в заряжение двойного электрического слоя C1 может быть связан с их движением по границам зерен и дислокациям [1–3]. Величина емкости С1 (мкФ/см2) возрастает с ростом температуры и в твердом сульфатном электролите. Что же касается эквивалентной электрической схемы, изображенной на рис. 1, то она одинаково применима как в случае твердых электролитов, так и в случае соответствующих ионных расплавов. В случае расплава изменяются только численные значения этих параметров. В частности, возрастает значение емкости С1, что связано, по-видимому, с формированием поверхностного заряда в двух монослоях в случае ионного расплава. Идея формирования двойного электрического слоя в двух монослоях принадлежит Чеботину и Соловьевой [6], которые внесли существенный вклад в теорию электродных процессов, как в ионных расплавах, так и в твердых электролитах [11–15].
Основным источником образования ионов кислорода в сульфатных электролитах авторы работы [1] связывают с термическим разложением сульфатов при их очистке, обезвоживании и плавлении, а также с термическим разложением примесей оксидов тяжелых металлов. Для проверки гипотезы справедливости кислородной функции серебряного электрода авторы [2, 3] проводили измерения импеданса границы Ag|Li2SO4–Na2SO4 при добавлении к электролиту ионов Ca2+ в виде CaO. Добавление CaO оказывает на емкость С1 сравнительно небольшое влияние, но уменьшает как W2, так и W3. В присутствии оксида кальция, по-видимому, повышается растворимость кислорода в твердом электролите [1]. Более того, оба диффузионных импеданса W2 и W3 сохраняются и после расплавления солей.
В настоящей же работе мы попытаемся проанализировать поведение серебряного электрода, обратимого по неосновным носителям, в сульфатном твердом электролите и в соответствующем ионном расплаве в гальванодинамическом режиме.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Гальванодинамический режим
Для относительно больших времен, т.е. для времен больших, чем постоянная ячейки, которая равна
(2)
$Z\left( p \right) = \frac{{p{{C}_{2}}}}{{1 + \sqrt p {{C}_{2}}{{W}_{3}}}} + \frac{{{{W}_{2}}}}{{\sqrt p }} = \frac{{p\sqrt p {{C}_{2}} + {{W}_{2}}\left( {1 + \sqrt p {{C}_{2}}{{W}_{3}}} \right)}}{{\sqrt p \left( {1 + \sqrt p {{C}_{2}}{{W}_{3}}} \right)}}.$(3)
$Z\left( p \right) = \frac{{p\sqrt p a + b + c\sqrt p }}{{\sqrt p \left( {k + \sqrt p } \right)}},$В гальванодинамическом режиме (в методе линейной развертки тока) $I\left( t \right) = {{I}_{0}} + \vartheta t$ (где ${{I}_{0}}$ – первоначальное значение тока, а $\vartheta $ – скорость линейной развертки тока) при условии ${{I}_{0}} = 0$ оператор Лапласа от функции $I\left( t \right)$ равен $I\left( p \right) = {\vartheta \mathord{\left/ {\vphantom {\vartheta {{{p}^{2}}}}} \right. \kern-0em} {{{p}^{2}}}}$. Поскольку $E\left( p \right) = I\left( p \right) \cdot Z\left( p \right)$, то для операторного потенциала получим соотношение
(4)
$E\left( p \right) = \frac{\vartheta }{{{{p}^{2}}}}\left[ {\frac{{ap\sqrt p + b + c\sqrt p }}{{\sqrt p \left( {k + \sqrt p } \right)}}} \right].$(5)
$E\left( p \right) = \frac{\vartheta }{{{{p}^{2}}}}\left[ {\frac{{ap\sqrt p + b + c\sqrt p }}{{\sqrt p \left( {k + \sqrt p } \right)}}} \right] = \frac{{{{d}_{1}}}}{{{{p}^{2}}}} + \frac{{{{d}_{2}}}}{p} + \frac{{{{d}_{3}}}}{{\sqrt p }} + \frac{{{{d}_{4}}}}{{k + \sqrt p }}.$(6)
$E\left( p \right) = \frac{{{{d}_{1}}\left( {k + \sqrt p } \right) + {{d}_{2}}p\left( {k + \sqrt p } \right) + {{d}_{3}}p\sqrt p \left( {k + \sqrt p } \right) + {{d}_{4}}{{p}^{2}}}}{{{{p}^{2}}\left( {k + \sqrt p } \right)}}.$(7)
$\left. {\begin{array}{*{20}{c}} {{{d}_{1}}k = \vartheta b} \\ {{{d}_{2}} + {{d}_{3}}k = a\vartheta } \\ {{{d}_{4}} + {{d}_{3}} = 0} \end{array}} \right\}.$(8)
${{d}_{1}} = {{\vartheta b} \mathord{\left/ {\vphantom {{\vartheta b} {k,}}} \right. \kern-0em} {k,}}\,\,\,\,{{d}_{2}} = a\vartheta - {{d}_{3}}k,\,\,\,\,{{d}_{3}} = - {{d}_{4}}.$(9)
$E\left( t \right) = {{d}_{1}}t + {{d}_{2}} + \frac{{{{d}_{3}}}}{{\sqrt {\pi t} }} + {{d}_{4}}\left[ {\frac{1}{{\sqrt {\pi t} }} - k\exp ({{k}^{2}}t){\kern 1pt} {\text{erfc(}}k{{t}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{\text{)}}~~} \right].$(10)
$E\left( t \right) = {{d}_{1}}t + {{d}_{2}} + {{d}_{4}}k\exp ({{k}^{2}}t){\kern 1pt} {\text{erfc}}(k{{t}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}).$(11)
$E\left( t \right) = 0.165 \cdot {{10}^{{ - 3}}} \cdot t + 10.25 \cdot {{10}^{{ - 4}}} + 0.165 \cdot {{10}^{{ - 3}}} \cdot 6.21\exp \left( {38.57 \cdot t} \right)~{\kern 1pt} {\text{erfc}}(6.21 \cdot {{t}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}})~.$На рис. 2 построен график зависимости межфазного потенциала от времени функционирования ячейки в соответствии с соотношением (11).
Рис. 2.
График зависимости межфазного потенциала от времени функционирования ячейки в соответствии с соотношением (11).
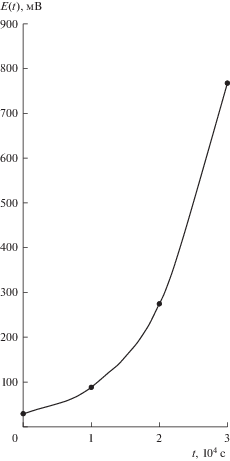
Основной вклад в величину межфазного потенциала E(t) вносит третий член в соотношении (11), содержащий сочетание экспоненты и функции, дополнительной к функции ошибок (или дополнительным интегралом вероятностей), т.е. ${\text{erfc(}}6.21 \cdot {{t}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{\text{)}}$.
В целом, как следует из рис. 2, зависимость межфазного потенциала от времени носит экспоненциальный характер.
ЗАКЛЮЧЕНИЕ
Графоаналитическим путем установлено, что временная зависимость потенциала межфазной границы серебряного электрода, обратимого относительно неосновных носителей тока в сульфатных твердых электролитах и в соответствующих им ионных расплавах, в гальванодинамическом режиме имеет характер экспоненты.
Список литературы
Укше Е.А., Букун Н.Г. Твердые электролиты. М.: Наука, 1977.
Леонова Л.С., Гусейнов Р.М., Укше Е.А. Электродные процессы в сульфатных твердых электролитах // Электрохимия. 1975. 11. С. 340–344.
Гусейнов Р.М., Леонова Л.С., Укше Е.А. Электрохимическое поведение системы Ag/Ag2SO4 в твердом электролите 0.8Li2SO4 ⋅ 0.2Na2SO4 // Электрохимия. 1975. 11. С. 1594–1597.
Гусейнов Р.М., Раджабов Р.А. Электрохимия твердых электролитов. Монография. Palmarium Academic Publishing. Германия, 2018.
Гусейнов Р.М., Раджабов Р.А., Бахмудкадиева З.Н. Граница блокированный электрод–твердый электролит в различных режимах. Palmarium Academic Publishing. Германия. 2016.
Чеботин В.Н., Соловьева Л.М. Электродные реакции в твердых электролитах // Электрохимия. 1968. 4. № 7. С. 858–862.
Деч Г. Руководство к практическому применению преобразования Лапласа. М.: Наука. 1965.
М. Абрамовиц, И. Стиган. Справочник по специальным функциям. М.: Наука. 1979.
Armstrong R.D., Mason R. // J. Electroanalitical Chem. 1973. 41. P. 231–241.
Armstrong R.D. // Ibid. 1974. 52. № 3. P. 413–419.
Чеботин В.Н., Соловьева Л.М. // Труды Института электрохимии УНЦ АН СССР. 1969. № 13. С. 90–102.
Чеботин В.Н., Соловьева Л.М., Ремез И.Д. // Труды Института электрохимии УНЦ АН СССР. 1969. № 13. С.1189-1197.
Чеботин В.Н., Соловьева Л.М., Ремез И.Д. // Труды Института электрохимии УНЦ АН СССР. 1969. № 13. С.1198–1204.
Чеботин В.Н. // Труды Института электрохимии УНЦ АН СССР. 1977. 13. № 12. С. 1829–1832.
Соловьева Л.М., Чеботин В.Н. // Электродные реакции в твердых электролитах. Свердлолвск: УрО АН СССР. 1990. С. 19–24.
Чеботин В.Н., Перфильев М.В. Электрохимия твердых электролитов. М.: Химия, 1978.
Чеботин В.Н., Мурыгин И.В. // Высокотемпературная электрохимия: электролиты, кинетика. Свердловск: УЕЦ АН СССР. 1986. С. 104–122.
Чеботин В.Н. Химическая диффузия в твердых телах. М.: Химия, 1989.
Chebotin V.N., Remez I.D., Solovieva L.M., Karpachev S.V. // Electrochim. Acta. 1984. 29. № 10. P. 1381–1388.
Remez I.D., Chebotin V.N. // Ibid. P. 1389–1397.
Дополнительные материалы отсутствуют.


