Расплавы, 2020, № 4, стр. 406-423
Электрохимические процессы в расплавах карбонатов щелочных металлов под избыточным давлением диоксида углерода
Х. Б. Кушхов a, *, М. Н. Лигидова a, Ж. З. Али a, А. А. Хотов a, М. Р. Тленкопачев a, Р. Х. Карацукова a
a ФГБОУ ВО Кабардино-Балкарский государственный университет им. Х.М. Бербекова
Нальчик, Россия
* E-mail: hasbikushchov@yahoo.com
Поступила в редакцию 19.02.2020
После доработки 15.03.2020
Принята к публикации 20.03.2020
Аннотация
Установлены закономерности электрохимического поведения расплавов смеси карбонатов щелочных металлов K2CO3–Na2CO3 и K2CO3–Na2CO3–Li2CO3 на платиновом и золотом электродах в атмосфере воздуха и диоксида углерода под избыточным давлением до 10 ⋅ 105 Па. Особенности вольтамперных зависимостей расплавов карбонатов щелочных металлов объяснены с учетом кислотно-основных равновесий с участием карбонат-иона ${\text{CO}}_{3}^{{2 - }}$ $ \leftrightarrow $ CO2 + O2–. Показано, что в эвтектическом расплаве K2CO3–Na2CO3 карбонат-ион устойчив, т.е. катионы Na+ и K+ обладают слабо выраженными оксокислотными свойствами, и не проявляет электрохимическую активность до потенциалов разряда катионов щелочных металлов. В этих условиях электровосстановление ${\text{CO}}_{3}^{{2 - }}$ происходит совместно с катионами K+ и Na+, или имеет место вторичное восстановление карбонат-иона выделяющимся щелочным металлом. Добавление карбоната лития, содержащего катион с большей поляризующей силой (большей оксокислотностью), в расплав K2CO3–Na2CO3 смещает кислотно-основное равновесие в сторону образования CO2 и влияет на электрохимическое поведение карбонатных расплавов, приводя к появлению катодной волны восстановления CO2 до элементарного углерода. Создание избыточного давления диоксида углерода над расплавом смеси K2CO3–Na2CO3, K2CO3–Na2CO3–Li2CO3 до 10 · 105 Па приводит к насыщению расплавов диоксидом углерода, а поляризация платинового и золотого электродов в этих системах – к восстановлению CO2 до элементарного углерода. Показано, что продукт гальваностатического электролиза в широком интервале плотностей тока 0.25–2.0 А/см2 эквимольной смеси Na2CO3–Li2CO3 и эвтектической смеси K2CO3–Na2CO3–Li2CO3 при температуре 873 К состоит из фаз графита, фуллеренов С60 и С70, углеродных нанотрубок.
ВВЕДЕНИЕ
Расплавы карбонатов щелочных металлов обладают целым рядом привлекательных свойств, таких как высокая электропроводность, химическая и термическая устойчивость, низкое давление паров, минимальные риски для человека и окружающей среды [1]. Этим обусловлен интерес к данным расплавленным средам при разработке новых экологически дружественных технологий в различных отраслях современной науки и техники, в частности, в электрогенерирующих устройствах, сенсорах, генераторах синтез газа и т.д. Применительно к высокотемпературной электрохимии, электрохимической энергетике, расплавленные карбонатные электролиты представляют особый интерес. Расплавы карбонатов также могут быть использованы для улавливания CO2 благодаря высокой скорости растворения. В расплавах карбонатов может быть утилизирован СО2 с помощью процесса электролиза.
Так авторы [2] впервые подтвердили возможность выделения углерода из смесей расплавленных карбонатов и галогенидов щелочных металлов при 1123 К. В последующих работах других авторов [3–5] был подтвержден факт электровыделения углерода из расплавов карбонатов при температуре ниже 873 К.
Систематические исследования электролиза и электродных процессов с участием карбонатов были проведены Ю.К. Делимарским с сотр. [6–10]. В работах [7, 8] было установлено, что при электролизе эквимольной смеси карбонатов лития и калия при температуре 853–873 К единственным катодным продуктом является порошкообразный графит с высоким выходом по току около 100%. Электродные процессы, протекающие при электролизе расплавленных карбонатов были исследованы в работах [7, 9] снятием вольтамперных характеристик и анализом продуктов электролиза. Катодный процесс, по мнению авторов, можно выразить следующими реакциями:
(1)
${\text{CO}}_{3}^{{2 - }} \leftrightarrow {\text{C}}{{{\text{O}}}_{2}} + {{{\text{O}}}^{{2 - }}},~$(2)
${\text{C}}{{{\text{O}}}_{2}} + 4{{{\text{e}}}^{--}} \to {\text{C}} + 2{{{\text{O}}}^{{2 - }}},~$(3)
${\text{CO}}_{3}^{{2 - }} \to {\text{C}}{{{\text{O}}}_{2}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} + 2{{{\text{e}}}^{ - }},~$(4)
${{{\text{O}}}^{{2 - }}}~ \to {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} + 2{{{\text{e}}}^{ - }}.~$Соотношение параллельных процессов (3) и (4) определяется плотностью анодного тока. Суммарная реакция имеет вид:
(5)
$3{\kern 1pt} {\text{CO}}_{3}^{{2 - }} \to 2{\text{C}}{{{\text{O}}}_{2}} + {\text{C}} + 3{{{\text{O}}}^{{2 - }}} + {{{\text{O}}}_{2}}.$Возможность протекания реакций (1) и (5), по мнению авторов, подтверждается тем, что при электролизе чистого расплава K2CO3 углерод не выделяется. Наоборот, если расплав K2CO3 насытить диоксидом углерода, то наблюдается катодное выделение углерода [8–10]. Этими же авторами исследован электролиз расплавленных хлоридов и карбонатов щелочных металлов под давлением углекислого газа, и при прохождении тока через такие расплавы протекают электродные реакции (2) и (4). Суммарная реакция заключается в электролитическом разложении углекислого газа на углерод и кислород.
В работах [11–19] было установлено, что электровосстановление карбонатов и выход углерода по току зависит от кислотно-основных свойств расплавленных электролитов, соответствующих равновесию (1). Относительно механизма выделения углерода из карбонат-иона существуют различные точки зрения. По мнению авторов работы [20] в эвтектике FLiNaK при 1023 К карбонат-ион разлагается по реакции (1).
Эта точка зрения согласуется с результатами изучения расплавов FLiNaK–М2CO3 методом КР-спектроскопии [21, 22], согласно которым при температурах выше 823 K карбонат-ион становится неустойчивым. В работе [23] на основе квантово-химических расчетов предложена общая схема образования электрохимически активных частиц при электровосстановлении ${\text{CO}}_{3}^{{2 - }}$, которую можно представить следующим образом:
(6)
$x{\text{M}}{{{\text{e}}}^{{m + }}} + {\text{CO}}_{3}^{{2 - }}\begin{array}{*{20}{c}} {{{{[{\text{M}}{{{\text{e}}}_{x}}{\text{C}}{{{\text{O}}}_{3}}]}}^{{mx - 2}}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,}&{} \\ { \Downarrow \, \Uparrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,}&{} \\ {{\text{C}}{{{\text{O}}}_{2}} + {\text{M}}{{{\text{e}}}_{{{2 \mathord{\left/ {\vphantom {2 m}} \right. \kern-0em} m}}}}{\text{O}} + {\text{(}}x - {{\text{2}} \mathord{\left/ {\vphantom {{\text{2}} m}} \right. \kern-0em} m}{\text{)M}}{{{\text{e}}}^{{m + }}}.\,\,\,\,\,\,}&{} \end{array}$Направление реакции, по которой будет смещаться равновесие (6), определяется концентрацией и поляризующей силой катиона металла Меm+.
В работе [24] обнаружен двухстадийный механизм восстановления при электровыделении углерода из карбонат-иона в галогенидно-оксидных расплавах:
(7)
${\text{CO}}_{3}^{{2 - }} + 2{{{\text{e}}}^{ - }} \to {\text{CO}}_{2}^{{2 - }} + {\text{ }}{{{\text{O}}}^{{2 - }}},~$(8)
${\text{CO}}_{2}^{{2 - }} + {\text{ }}2{{{\text{e}}}^{ - }} \to {\text{C }} + {\text{ }}2{{{\text{O}}}^{{2 - }}}.~$Ревен и др. [34] изучали восстановление CO2 в Li2CO3–K2CO3 (62 : 38 мол. %) в температурном диапазоне 884–1073 К с помощью линейной развертки потенциала и хроноамперометрии. Анализ и вычисления из уравнения Коттрелла предполагали одноэлетронный перенос с диффузионно-контролируемым механизмом:
Суммарная реакция:(11)
$2{\text{C}}{{{\text{O}}}_{2}} + {\text{ }}2{{{\text{е}}}^{ - }} \to {\text{CO}} + {\text{CO}}_{3}^{{2 - }}.$По результатам исследования методом циклической вольтамперометрии, проведенного авторами [35] было выявлено два феномена происходящих на вольтамперных кривых при потенциалах –1.2 и –0.88 В относительно Ag/Ag+. Авторами [35] были предложены следующие два механизма восстановления CO2:
Первый механизм:
(14)
${\text{CO}}_{2}^{{2 - }} + {\text{C}}{{{\text{O}}}_{2}}~ \to {\text{CO}} + {\text{CO}}_{3}^{{2 - }}.$Второй механизм описывается уравнениями (9) и (10).
Таким образом, к настоящему времени проведен определенный объем исследований по электрохимическому поведению карбонатных расплавов. Предложен ряд реакционных схем по электровосстановлению диоксида углерода. Остается неясным вопрос об электровосстановлении CO2 растворенного при избыточным давлением в карбонатном расплаве. Нет определенности по вопросу возможности протекания многоэлектронных реакций в одну многоэлектронную стадию переноса заряда. Практически не изучены характеристики получающихся продуктов электролиза: состав, морфология, микроструктура, размеры, удельная поверхность порошков углерода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование электрохимического поведения карбонатных расплавов под избыточным давлением CO2 осуществляли в трехэлектродной ячейке из специальной нержавеющей стали, которая позволяла проводить измерения при температуре 1173 К и избыточном давлении газа до 20 ⋅ 10–5 Па [25]. Наиболее приемлемым электродом сравнения для расплавленной карбонатной системы является платиновый или золотой электрод, погруженный в исследуемый расплав, находящийся в воздушной атмосфере. На этом электроде устанавливается равновесие:
(15)
${1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} + 2{{{\text{e}}}^{ - }} \leftrightarrow {{{\text{O}}}^{{2 - }}}.$При создании атмосферы диоксида углерода над карбонатным расплавом функция такого электрода может изменяться и перейти в кислородно-карбонатный электрод, на котором устанавливается равновесие.
(16)
${\text{C}}{{{\text{O}}}_{2}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} + 2{{{\text{e}}}^{ - }} \leftrightarrow {\text{CO}}_{3}^{{2 - }}.$Обратимость такого электрода обоснована в работах [34, 36]. Однако, “электродом сравнения” он может быть назван условно, так как его потенциал зависит от избыточного давления углекислоты над расплавом. Изменение функции электрода сравнения при постоянном повышении давления CO2 в системе оценивали по потенциалу выделения щелочного металла (разряд фонового электролита), считая его потенциал независимым от состава газовой атмосферы. В качестве рабочих электродов применяли платину, золото в виде проволоки диаметром 0.5 мм, глубина погружения в расплав – 10–15 мм. Анодом и одновременно контейнером для расплава служил стеклоуглеродный тигель объемом 30 см3. В качестве электролитов, с целью снижения температуры, были выбраны эвтектические смеси: K2CO3–Na2CO3; K2CO3–Na2CO3–Li2CO3. Для их приготовления использовали химически чистые карбонаты калия, натрия и лития. Соли перед проведением эксперимента сушили в вакуумном сушильном шкафу при температуре 200°С в течение 5 ч, а затем прокаливали в муфельной печи в течение 4 ч при температуре 400°С. Все реактивы хранили в сухом перчаточном боксе LabStar (Германия). Для создания рабочей температуры 873–1173 К применяли печь сопротивления шахтного типа, нагревательным элементом в которой использовали силитовые стержни. Автоматическое регулирование температуры осуществлялось с помощью электронного терморегулятора ОВЕН-ТРМ-1, используя хромель-алюмелевую термопару (точность поддержания температуры ±1°С). Для получения вольтамперных зависимостей использовали электрохимический комплекс Autolab Nova 2013 (Голландия) согласованного с компьютерной системой управления. В качестве источника питания для электролиза применяли источник тока БП-5А.
Для определения фазового, элементного, гранулометрического состава, микроструктуры катодных осадков использовали рентгеновский дифрактометр D2 Phazer (Брюкер, Германия), рентгенофлюоресцентный спектрометр Спектроскан MAKS GV (Cпектрон, Санкт-Петербург), лазерный анализатор размера частиц Fritseh Analisette – 22 Nano Tecplus (Германия), сканирующий электронный микроскоп Vega 3 LMN (TESCAN, Чехия) с системой для рентгеновского микроанализа X-Max (Oxford, Великобритания). Удельную поверхность порошков определяли с помощью многоточечного метода БЭТ на оборудовании Soft Sorbi-2 ver 1.0 при низкотемпературной адсорбции азота.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1а представлены циклические вольтамперограммы расплава эвтектической смеси карбонатов калия и натрия на платиновом электроде относительно платино-кислородного электрода сравнения при температуре 1023 К. На рис. 1а (кривая 1) при потенциалах отрицательнее –1.9 В наблюдается подъем тока на вольтамперной зависимости, вызванный разложением расплава смеси карбонатов натрия и калия (происходит электровосстановление катионов натрия и калия до металла). При смещении потенциала еще в более отрицательную область ток резко возрастает, но предельного тока не достигается. Перед этим подъемом тока в области потенциалов –1.8…–1.85 В наблюдается предволна A. Появление волны А мы связываем с деполяризацией разряда ионов щелочных металлов на платиновом электроде с образованием интерметаллида. Предельный ток этой волны сплавообразования не столь высок по сравнению с другими волнами на рис. 1а и так не заметен. Если повысить чувствительность шкалы тока при съемке вольтамперограмм, волна А ярко проявляется (рис. 1б).
Рис. 1.
Циклические вольт-амперные зависимости эквимольного расплава K2CO3–Na2CO3: (а) при различных значениях избыточного давления диоксида углерода над расплавом. ${{P}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ · 10–5 Па: 1 – 0; 2 – 3.0; 3 – 5.0; 4 – 7.0; 5 – 10.0. Скорость поляризации, В/c: 1, 4, 5 – 0.2; 2, 3 – 0.05. (б) в атмосфере воздуха. Скорость поляризации, В/c: 0.2. T = 1023 K, рабочий электрод – Pt.
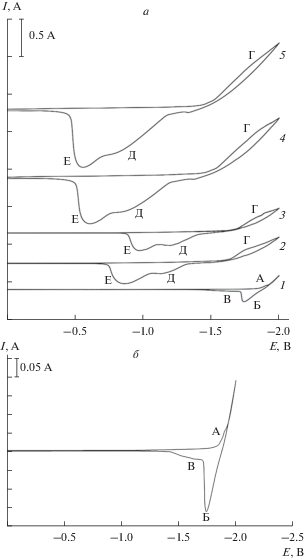
На анодной ветви наблюдаются волны растворения продукта катодного цикла (волна Б и В). Появление волны Б вызвано анодным растворением выделившихся при катодной поляризации щелочных металлов, а волна В – растворением щелочного металла из интерметаллида. При многократном циклировании потенциала рабочего платинового электрода форма катодной части циклической вольтамперограммы существенно не меняется, а анодные волны (Б и В) претерпевают изменения как по высоте, так и по потенциалам. Высота волны Б мало зависит от количества циклов измерения потенциала, но существенно зависит от потенциала возврата. Чем более отрицателен потенциал возврата, тем значительнее ток пика волны Б. Волна В также растет по высоте и одновременно смещается в положительную область с увеличением числа циклов и смещением потенциала возврата в более отрицательную область.
Создание избыточного давления диоксида углерода над расплавом смеси карбонатов калия и натрия приводит к появлению в области более положительных потенциалов –1.65…–1.75 В волны восстановления Г (рис. 1а, кривая 2) до потенциалов разложения расплавленной смеси карбонатов калия и натрия. На анодной ветви наблюдаются две волны Д и Е. С увеличением избыточного давления диоксида углерода высота катодной волны восстановления Г растет, а общая картина циклической вольтамперограммы сохраняется. Если поляризацию платинового электрода проводить до –2.0 В, то на анодной ветви появляется волна окисления щелочного металла Б. При избыточном давлении диоксида углерода (выше 7.0 ⋅ 10–5 Па) потенциалы волн анодного растворения продукта катодной волны существенно смещаются в положительную область и уменьшается разность потенциалов пиков волн Д и Е.
На циклических вольтамперограммах, снятых на золотом электроде относительно кислородного электрода сравнения, наблюдаются две волны восстановления (волна А) при потенциалах –1.1…–1.4 В и (подъем тока волны В) при потенциалах отрицательнее –1.7 В (рис. 2 , кривая 1). На анодной ветви при поляризации до –2.0 В также наблюдаются две волны электроокисления В и Д продуктов катодного цикла. При создании избыточного давления диоксида углерода над расплавом смеси карбонатов калия и натрия форма циклической вольтамперограммы на золотом электроде не изменяется. Однако имеет место смещение как катодных, так и анодных волн в положительную область на 50–70 мВ. Если катодную поляризацию золотого электрода проводить только до потенциалов завершения первой волны Б, то на анодной ветви наблюдается только одна волна окисления Д (рис. 3). При увеличении избыточного давления диоксида углерода, как и на платиновом электроде, наблюдается рост высоты волны А.
Рис. 2.
Циклические вольтамперные зависимости эквимольного расплава K2CO3–Na2CO3 при различных значениях избыточного давления диоксида углерода над расплавом. ${{P}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ · 10–5 Па: 1 – 0; 2 – 1.0; 3 – 3.0; 4 – 7.0. Скорость поляризации – 0.2 В/c. T = 1023 K, рабочий электрод – Au.
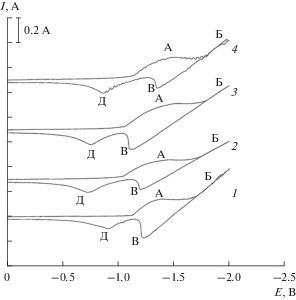
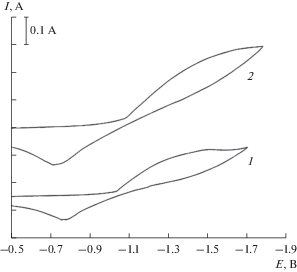
Рис. 3.
Циклические вольт-амперные зависимости эквимольного расплава K2CO3–Na2CO3 при различных значениях избыточного давления диоксида углерода над расплавом. ${{P}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$· 10–5 Па: 1 – 1.0; 2 – 3.0. Скорость поляризации, В/c: 1 – 0.2; 2 – 3.0. T = 1023 K, рабочий электрод – Au. Потенциал возврата (–1.7 В).
На рис. 4 представлены циклические вольтамперограммы снятые на платиновом электроде в эвтектическом расплаве K2CO3–Na2CO3 содержащем 10.0 мол. % Li2CO3. Введение карбоната лития в эвтектический расплав карбонатов калия и натрия приводит к появлению волны восстановления при потенциалах –1.1…–1.2 В относительно платино-кислородного электрода сравнения и волны окисления продукта катодной волны при потенциалах –0.8…–1.0 В. Подача диоксида углерода под избыточным давлением над расплавом K2CO3–Na2CO3–Li2CO3 (10.0 мол. %) не приводит к появлению других волн, а наблюдается только рост волны катодного восстановления и волны электроокисления продукта катодного процесса. Наблюдаемый скачок потенциала при подаче CO2 под избыточным давлением (рис. 4, кривые 1 и 2) вызван изменением функции электрода сравнения от кислородного к карбонатному.
Рис. 4.
Циклические вольтамперные зависимости эквимольного расплава K2CO3–Na2CO3 содержащего 10.0 мол. % Li2CO3 при различных значениях избыточного давления диоксида углерода над расплавом. ${{P}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ · 10–5 Па: 1 – 0; 2 – 1.0; 3 – 3.0; 4 – 5.0; 5 – 7.0. Скорость поляризации – 0.2 В/c, T = 1023 K, рабочий электрод – Pt.

На рис. 5 представлены циклические вольтамперограммы эвтектического расплава K2CO3–Na2CO3 с содержанием 30.0 мол. % карбоната лития на золотом поляризуемом электроде в атмосфере воздуха. На вольтамперограммах до потенциалов разложения эвтектического расплава K2CO3–Na2CO3 наблюдается только одна катодная волна восстановления –1.25…–1.30 В и одна анодная волна окисления –1.2…–1.05 В продукта катодного цикла. При подаче диоксида углерода под избыточным давлением (3.0 ⋅ ⋅ 105 Па) над расплавом K2CO3–Na2CO3–Li2CO3 (30.0 мол. %) форма циклической вольтамперной кривой не меняется, однако волны восстановления смещаются в область потенциалов –0.9…–0.95 В. На анодной ветви циклической вольтамперограммы также наблюдается одна волна окисления продукта катодного цикла. Повышение избыточного давления диоксида углерода над расплавленной смесью K2CO3–Na2CO3–Li2CO3 (30.0 мол. %) до 10 ⋅ 105 Па не приводит к изменению общей картины вольтамперных зависимостей, кроме роста высот волн восстановления и окисления. Если поляризацию электрода в расплаве K2CO3–Na2CO3–Li2CO3 (30.0 мол. %) проводить до потенциалов –1.7…–2.0 В, как в атмосфере воздуха, так и атмосфере диоксида углерода под избыточным давлением, то на анодной ветви в области более положительных потенциалов –0.1…–0.35 В наблюдается волна окисления (рис. 6). Причем потенциал этой волны зависит от значений потенциалов возврата циклической вольтамперной зависимости. Чем отрицательнее значение потенциала возврата, тем волна окисления находится в более положительной области потенциалов.
Рис. 5.
Циклические вольтамперные зависимости эквимольного расплава K2CO3–Na2CO3 содержащего 30.0 мол. % Li2CO3 при различных значениях избыточного давления диоксида углерода над расплавом. ${{P}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ · 10–5 Па: 1 – 0; 2 – 3.0; 3 – 5.0; 4 – 7.0; 5 – 10.0. Скорость поляризации – 0.1 В/c, T = 1023 K, рабочий электрод – Au.
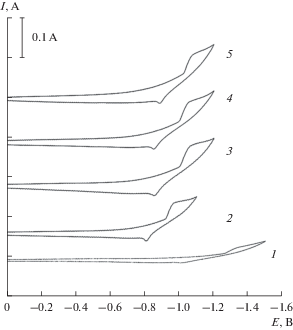
Рис. 6.
Циклические вольтамперные зависимости эквимольного расплава K2CO3–Na2CO3 содержащего 30.0 мол. % Li2CO3 при различных значениях избыточного давления диоксида углерода над расплавом. ${{P}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ · 10–5 Па: 1 – 0; 2 – 5.0; 3 – 7.0; 4 – 7.0; 5 – 7.0; 6 – 10.0. Скорость поляризации – 0.2 В/c, T = 1023 K, рабочий электрод – Au. Потенциал возврата, В: 1, 2, 3 – –1.75; 4, 5 – –1.3; 6 – –1.4.
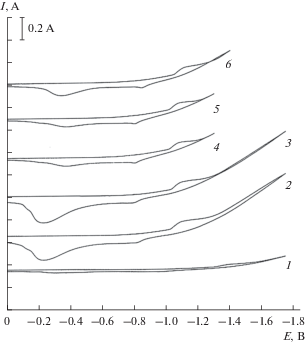
Наблюдаемые особенности вольтамперных зависимостей расплавов карбонатов щелочных металлов под избыточным давлением диоксида углерода мы объясняем на основе кислотно-основных равновесий, которые имеют место в исследуемых карбонатных расплавленных системах. В расплавленных смесях карбонатов калия и натрия, содержащих слабо поляризующие катионы (K+, Na+), карбонат-ион устойчив и кислотно-основное равновесие (1) смещено в сторону ${\text{CO}}_{3}^{{2 - }}$. В этой расплавленной системе карбонат-ион не проявляет электрохимическую активность на платиновом электроде до потенциалов –1.75 В. Выделение углерода при потенциалах отрицательнее ‒1.75 В может происходить совместно с выделением щелочного металла или вторичным восстановлением карбонат-иона щелочным металлом. Наблюдаемые волны анодного растворения продукта катодного цикла связаны с растворением щелочного металла (волна Б) и интерметаллида платины с щелочным металлом (волна В). Волна С, появляющаяся при более положительных потенциалах при подаче CO2 над расплавом под избыточным давлением, связана с восстановлением растворенного в расплаве CO2 до элементарного углерода. Волнам Д и Е отвечают процессы анодного растворения углерода до CO и CO2 соответственно. Соотношение высот волн окисления углерода до CO и CO2 зависит от величины избыточного давления CO2 над расплавом и значения потенциала возврата в катодной ветви.
Электрохимическое поведение расплава смеси карбонатов калия и натрия на золотом электроде отличается от их поведения на платиновом электроде. На золотом электроде расплавленная смесь K2CO3–Na2CO3 проявляет электрохимическую активность при значительно положительных потенциалах –1.1 В (рис. 2, волна А). На катодной ветви при потенциалах отрицательнее –1.75 В, также как и на платиновом электроде, начинается разложение карбонатного расплава с выделением щелочного металла, и подъем тока (волна Б). На анодной ветви наблюдается волна растворения щелочного металла (волна В) и волна Д растворения продукта волны восстановления А. Создание избыточного давления диоксида углерода не приводит к изменению характера циклических вольтамперных зависимостей. Повышение избыточного давления CO2, приводит к увеличению высоты волны А, на которой происходит восстановление диоксида углерода до элементарного углерода. Если проводить поляризацию катода до потенциалов завершения волны А, то на анодной ветви наблюдается только одна волна окисления продукта катодного восстановления (углерода до CO2). Соотношение токов пика волн катодного и анодного процессов (${{i_{{\text{p}}}^{{\text{k}}}} \mathord{\left/ {\vphantom {{i_{{\text{p}}}^{{\text{k}}}} {i_{{\text{p}}}^{{{\text{a}}1}}}}} \right. \kern-0em} {i_{{\text{p}}}^{{{\text{a}}1}}}}$) и существенное различие потенциалов пиков ($\varphi _{{\text{p}}}^{{\text{k}}} - \varphi _{{\text{p}}}^{{\text{a}}}$ > 0.5 В) свидетельствует о необратимом характере процесса электровосстановления диоксида углерода.
Добавление в карбонатный расплав более поляризующего катиона лития смещает кислотно-основное равновесие в сторону образования CO2 и влияет на электрохимическое поведение карбонатных расплавов. Как видно на рис. 5, добавление 30.0 мол. % Li2CO3 приводит к появлению волны восстановления CO2 до элементарного углерода при потенциалах –1.1…–1.2 В. Следует отметить, что циклические вольтамперограммы на платиновом электроде расплава K2CO3–Na2CO3 под избыточным давлением схожи с таковыми в расплаве K2CO3–Na2CO3–Li2CO3 в атмосфере воздуха. Создание избыточного давления CO2 над расплавом K2CO3–Na2CO3–Li2CO3 не приводит к появлению других волн на вольтамперных зависимостях, наблюдается только рост единственной волны восстановления диоксида углерода. На золотом электроде наблюдается аналогичная картина изменений вольтамперных зависимостей расплава K2CO3–Na2CO3–Li2CO3.
Таким образом, в карбонатном расплаве, содержащем слабополяризующие катионы (K+, Na+) карбонат-ион на платиновом электроде не проявляет электрохимическую активность до потенциалов выделения щелочных металлов. В этих условиях, имеет место вторичное восстановление карбонат-иона выделившимся щелочным металлом. Создание избыточного давления диоксида углерода приводит к восстановлению растворенного в расплаве CO2 до элементарного углерода. На золотом электроде происходит каталитическое разложение карбонат-иона с образованием CO2 и его последующее восстановление до углерода при значительно положительных областях потенциалов. Введение в карбонатный расплав сильнополяризующего катиона лития смещает кислотно-основное равновесие в сторону образования CO2 и последующее восстановление до элементарного углерода.
Принимая во внимание результаты вольтамперных измерений, нами было проведено электроосаждение углерода из карбонатных расплавов при температуре 873°С в гальваностатическом режиме в широком интервале плотностей тока 0.25–2.0 А/см2. В качестве катода использовали никелевый пруток диаметром 3.0 мм, площадью 2.0–2.5 см2, а в качестве анода – стеклоуглеродный тигель. Электролиз осуществляли в эквимольной смеси Na2CO3–Li2CO3. Продолжительность электролиза 60 мин. В процессе электролиза катодный продукт осаждался на никелевом катоде в виде “груши”. После окончания электролиза катодный осадок отмывали от электролита в кипящей дистиллированной воде, центрифугировали, высушивали в сушильном шкафу при температуре 423 К и взвешивали. На рис. 7 и в табл. 1 представлены результаты рентгенофазового анализа катодного осадка, полученного электролизом расплава Na2CO3– Li2CO3 в интервале плотностей тока 0.25–2.0 А/см2. На рентгенограммах катодных осадков присутствуют характеристические линии фаз графита, фуллеренов С60; С70, углеродных нанотрубок.
Рис. 7.
Рентгенофазовый анализ образца катодного осадка, полученного электролизом эквимольного расплава Na2CO3–Li2CO3 при плотности тока 1.0 А/см2. Т = 873 К. Продолжительность электролиза 60 мин.
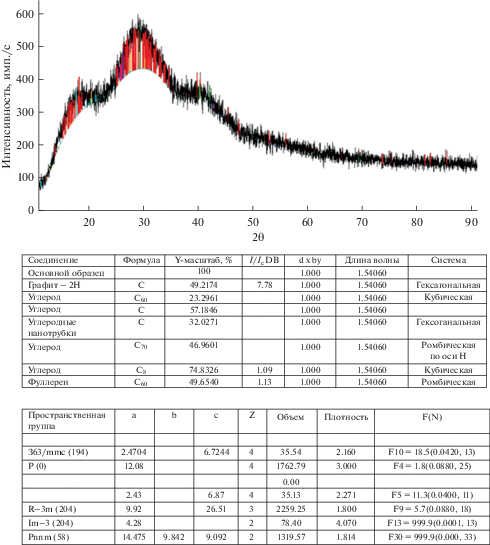
Таблица 1.
Качественный фазовый состав порошков углерода, полученных электролизом эквимольного расплава Na2CO3–Li2CO3. T = 873 К. Продолжительность электролиза 1 час
| Плотность катодного тока, А/см2 | 0.25 | 0.5 | 1.0 | 2.0 |
| Качественный фазовый состав порошков углерода | графит, фуллерены С60, С70; углеродные нанотрубки | графит, фуллерены С60, С70; углеродные нанотрубки |
графит, фуллерены С60, С70; углеродные нанотрубки | графит, фуллерены С60, С70; углеродные нанотрубки |
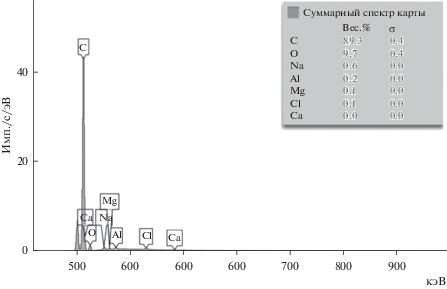
Проведенный элементный анализ синтезированных образцов (рис. 8) показал наличие углерода, кислорода и следы Al, Na, Cl. При этом содержание углерода выше 85 мас. %. Содержание кислорода достаточно высокое (более 10 мас. %). Кислород в порошках содержится, по-видимому, в сорбированном состоянии из-за развитой поверхности образцов углерода. На рис. 9 также представлена цветная карта распределение элементов в синтезированных порошках углерода. Проведенные измерения удельной поверхности порошков низкотемпературной адсорбции азота показали, что удельная поверхность синтезированных порошков изменяется от 80.0 до 130 м2/г, в зависимости от плотности катодного тока. На микрофотографиях синтезированных углеродных порошков, полученных с помощью сканирующей электронной микроскопии (рис. 10) видно, что образцы содержат искривленные нанотрубки углерода диаметром до 20 нм и длиной до нескольких мкм.
Рис. 8.
Результаты элементного анализа образцов катодного осадка, полученного электролизом эквимольного расплава Na2CO3–Li2CO3 при плотности тока 1.5 А/см2. Т = 873 К. Продолжительность электролиза 60 мин.
ВЫВОДЫ
1. Установлены закономерности электрохимического поведения расплавов смесей карбонатов щелочных металлов K2CO3–Na2CO3, K2CO3–Na2CO3–Li2CO3 в атмосфере воздуха и диоксида углерода под избыточным давлением СО2 до 10 ⋅ 105 Па. Показано, что в эвтектическом расплаве K2CO3–Na2CO3 карбонат-ион устойчив и не проявляет электрохимическую активность до потенциала разрядов щелочных металлов, а электровосстановление карбонат-иона происходит совместно с катионами K+ и Na+ или имеет место вторичное восстановление карбонат-иона щелочным металлом. Добавление в эвтектический расплав K2CO3–Na2CO3 карбоната лития, содержащего катион с большей поляризующей силой (большей оксокислотностью) смещает кислотно-основное равновесие ${\text{CO}}_{3}^{{2 - }}$ ↔ CO2 + O2– в сторону образования более электронофильной частицы CO2 и ее восстановления до элементарного углерода.
2. Создание над карбонатными расплавами K2CO3–Na2CO3 и K2CO3–Na2CO3–Li2CO3 атмосферы газообразного CO2 под избыточным давлением до 10 ⋅ 105 Па приводит к насыщению расплава диоксидом углерода, а поляризация платинового и золотого электродов в расплаве – к восстановлению CO2 до элементарного углерода.
3. Проведена диагностика и характеризация полученных наноструктурированных порошков углерода (фазовый и элементный состав, размеры частиц, удельная поверхность, морфология, микроструктура).
Работа выполнена при финансовой поддержке РФФИ проект 19-03-00606.
Список литературы
Fragini S., Masi A. Molten carbonates for advanced and sustainable energy applications: Part 1. Revisiting molten carbonate properties from a sustainable viewpoint // Int. I. Hydrogen Energy. 2016. 41. P. 18 739–18 740.
Andrieux I.-L., Weiss G. Carbon electrodeposition from molten chlorides // Comptes rendus Acad. Sci Pares. 1944. 219. P. 551–555.
Dubois I., Buvet R. Carbon electrodeposition from molten carbonates // Bull. Soc. Chim. France. 1963. № 11. P. 2522–2527.
Janz G.J., Conte A., Neclenscwandez E. Corrosion of platinum, gold, silver and refractories in molten carbonates // Corrosion. 1963. 19. P. 292–294.
Ingrem M.D., Janz G. Electrochemical studies in fused carbonates // Electrochim. Acta. 1965. 10. P. 783–786.
Делимарский Ю.К., Городыский А.В., Гриценко В. Ф. Катодное выделение углерода из расплавленных карбонатов // Докл. АН СССР. 1964. 166. № 1. С. 650–653.
Делимарский Ю.К., Городыский А.В., Гриценко В.Ф. Изучение реакций происходящих при электролизе расплавленных карбонатов // Укр. хим. журн. 1965. 31. № 2. С. 32–37.
Делимарский Ю.К., Шаповал В.И., Гриценко В.Ф. Катодное выделение углерода из расплавов // Докл. АН СССР. 1968. 183. № 6. С. 1332–1336.
Делимарский Ю.К., Гриценко В.Ф., Василенко В.А. Электролиз расплавленных карбонатов щелочных металлов // Журн. прикл. химии. 1969. 42. № 1. С. 224–226.
Делимарский Ю.К., Шаповал В.И., Василенко В.А. Электролиз хлоридных расплавов под избыточным давлением углекислоты // Журн. прикл. химии. 1970. 43. № 12. С. 2634–2637.
Смирнов М.В., Циовкина Л.А., Олейникова В.A. Процессы на платиновом и никелевом катоде при электролизе карбонатных расплавов // Труды института электрохимии УФ АН СССР. 1965. № 6. С. 69–73.
Janz G.J., Conte A. Potentiostatic polarization studies in fused carbonates – II. Stainless steel // Electrochim. Acta. 1964. 9. № 10. P. 1279–1287.
Ingram M.D., Boron B., Janz G.J. The electrolytic Deposition of carbon from fused carbonates // Electrochim. Acta. 1996. V. P. 1629–1639.
Bartleet H.E., Jonson K.E. Electrolysis of Li2CO3–Na2CO3 system // Con. J. Chem. 1966. 44. № 18. P. 2119–2121.
Bartleet H.E., Jonson K.E. Electrochemical studies in molten Li2CO3–Na2CO3 // J. Electrochem. Soc. 1967. 114. № 6. P. 457–461.
Dubois I. Carbonate electroreduction in molten electrolysis // Annal. Chem. 1963. 10. P. 120–126.
Ingrem M.D., Janz G.J. The thermodynamics of corrosion in molten carbonates: application of E/p CO2 diagrams // Electrochim. Acta. 1965. 10. P. 783–792.
Делимарский Ю.К., Шаповал В.И., Василенко В.А. Значение кинетического процесса при электровосстановлении ${\text{CO}}_{3}^{{2 - }}$ в расплаве NaCl–KCl // Электрохимия. 1971. 7. № 9. С. 1301–1304.
Делимарский Ю.К., Шаповал В.И., Василенко В.А. Хронопотенциометрическое изучение стадии разряда при электровосстановлении ${\text{CO}}_{3}^{{2 - }}$ // Укр. хим. журн. 1973. 39. № 6. С. 616–619.
Deanhardt M.L., Stern K.H., Kende A. Thermal decomposition and reduction of carbonate ion in fluoride melts // J. Electrochem. Soc. 1986. 135. P. 48–52.
Witing F.L., Mamahtov G., Begun G.M., Young I.P. Raman spectra of solute species in molten fluorides ${\text{O}}_{2}^{ - }$, ${\text{CrO}}_{4}^{{2 - }}$ and ${\text{CO}}_{3}^{{2 - }}$ // Inorg. Chim. Acta. 1971. 5. P. 260–262.
Stern K.H., Weise E.L., Physico-chemical study of FLiNaK–K2CO3 melt // Nat. standart reference Data Servise; National bureau of standarts. 1969. № 30.
Соловьев В.В., Шаповал В.И. Квантово-химический расчет влияния трех основных факторов на процесс электровосстановления аниона // Укр. хим. журн. 1995. 61. № 8. С. 100–106.
Ito I. Carbon film electrodeposition from melts // The 1st West Pac. Electrochem. Symp. (WPES), Tokyo 1992. Abstr. P. 37–38.
Кушхов Х.Б., Шаповал В.И., Новоселова И.А. Электрохимическое поведение углекислого газа под избыточным давлением в эквимольном расплаве хлоридов калия и натрия // Электрохимия. 1987. 23. № 7. С. 952–956.
Ijije H.V., Sun C., Chen G.Z. Indirect electrochemical reduction of carbon dioxide to carbon nanopowders in molten alkali carbonates: Process variables and product properties // Carbon. 2014. 73. P. 163.
Wu H., Li Z., Ji D., Liu Y., Li L., Yuan D., Zhang Z., Ren J., Lefler M., Wang B., Licht S. One-pot synthesis of nanostructured carbon materials from carbondioxide via electrolysis in molten carbonate salts // Carbon. 2016. 106. P. 208.
Deng B., Chen Z., Gao M., Song Y., Zheng K., Tang Xiao I., Mao X., Wang D. Molten salt CO2 capture and electro-transformation (MSCC-ET) into capacitive carbon at medium temperature: effect of the electrolyte composition // Faraday Discuss. 2016. 190. P. 241.
Ijije H.V., Lawrence R.C., Chen G.Z. Carbon electrodeposition in molten salts: electrode reactions and applications // RSC Adv. 2014. 4. P. 35808.
Kaplan V., Wachtel E., Cartsman K., Feldman Y., Lubomirsky I. Conversion of CO2 to CO by Electrolysis of Molten Lithium Carbonate // J. Electrochem. Soc. 2010. 157. P 552.
Yin H., Mao X., Tang D., Xiao W., Xing L., Zhu H., Wang D., D.R. Capture and electrochemical conversion of CO2 to value-added carbon and oxygen by molten salt electrolysis Sadoway // Energy Environ. Sci. 2013. 6. P. 1538.
Helmann M.M., Stainberg M., Green house gas carbon dioxide mitigation: science and technology. Lewis Boca Raton (Florida), 1999.
Peelen W.H.A., Hammes K., Wd I.H. Wit. CO2 reduction in molten 62/38 mol. % Li/K carbonate mixture // I. Electrochimical Acta. 1997. 43. № 7. P. 763–769.
Chery D., Albin V., Melendez-Ceballos A., Loiz V., Cossira M. Mechanistic approach of the electrochemical reduction of CO2 into CO at a gold electrode in molten carbonates by cyclic voltammetry // Int. I. Hydrog. Energy. 2016.
Selman J.R., Maru H.C. Advances in Molten Salt Chemistry, Plenum press, New York, 1981. 4.
Lachance G.R., Traill R.J. A practical solution to the matrix problem in X-ray analysis // Appl. Spectrosc. 1966. 11. P. 43–48.
Дополнительные материалы отсутствуют.




