Расплавы, 2020, № 4, стр. 363-374
Селективное испарение компонентов расплавленных смесей (LiCl–KCl)эвт–BaCl2–SrCl2–NdCl3 при пониженных давлениях
А. Б. Салюлев a, *, Н. И. Москаленко a, В. Ю. Шишкин a, Ю. П. Зайков a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: salyulev@ihte.uran.ru
Поступила в редакцию 05.12.2019
После доработки 13.01.2020
Принята к публикации 25.01.2020
Аннотация
Проведены экспериментальные исследования отгонки хлоридов из их расплавленных смесей при различных условиях. Во всех случаях испарению при пониженном (до ~1 Па) давлении и температурах 753–1033°С подвергали разбавленные растворы BaCl2, SrCl2, NdCl3 (по 1–2 мол. %), как представителей хлоридов щелочных, щелочноземельных и редкоземельных металлов, в расплавленной эвтектической смеси LiCl–KCl. Проанализированы составы возгонов и солевых расплавов (плавов) до и после отгонки, и сделаны выводы о степени отгонки, селективности испарения компонентов расплавленных смесей и относительной летучести различных хлоридов.
ВВЕДЕНИЕ
В настоящее время в ряде стран разрабатываются различные варианты пирохимических (с использованием расплавленных солей) технологий, которые бы обеспечивали эффективную утилизацию отработавшего ядерного топлива (ОЯТ), снижение объемов радиоактивных отходов, извлечение урана, плутония и очистку электролита для повторного их использования в реакторе [1–5]. Для выработки перспективных схем переработки ОЯТ представляет интерес оценка возможности очистки катодных осадков и металлизированных продуктов пирохимических операций от электролита (LiCl, эвтектика LiCl–KCl), а последнего – от содержащихся в нем примесей хлоридов и оксидов щелочных, щелочноземельных и редкоземельных элементов методом отгонки, приемлемым вариантом которой могла бы быть отгонка в вакууме при повышенной температуре [3–8].
С целью оценки возможности селективной отгонки различных компонентов солевых электролитов в настоящей работе проведены экспериментальные исследования улетучивания хлоридов из расплавленной эвтектической смеси LiCl–KCl, содержащей соединения имитаторов некоторых продуктов деления – щелочноземельных и редкоземельных металлов (разбавленные растворы), при различных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали LiCl безводный квалификации “ч. д. а.”, KCl “х. ч.”, BaCl2 ⋅ ⋅ 2H2O “х. ч.”, SrCl2 ⋅ 6H2O “ос. ч.”. Их подготавливали по стандартным методикам [9]. Соли осушали в кварцевых пробирках при постепенном, в течение нескольких часов, медленном повышении температуры от комнатной до 500–550°С при непрерывном вакуумировании через ловушку, охлаждаемую жидким азотом. Хлориды щелочных металлов затем подвергали двойной зонной перекристаллизации [10], а хлориды бария и стронция при повышенных температурах в твердом и расплавленном состояниях обрабатывали сухим хлороводородом.
Оксид Nd2O3 марки “НО–Е” переводили в хлорид по реакции с тетрахлоридом углерода квалификации “ос. ч.” по известной методике [11, 12]. Дополнительно безводный NdCl3 очищали методом вакуумной перегонки в кварцевых ячейках при температурах 980–1030°C.
Все операции с солями (хранение, взвешивание, загрузку в ячейки) проводили в сухом боксе c P2O5 в атмосфере азота. Использовали весы ювелирные SF-700 (точность взвешивания – 10 мг), торсионные WT-500 и весы портативные MH-03B (точность – 1 мг).
Применявшиеся в опытах ячейки, изготовленные из кварцевого стекла, показаны на рис. 1.
Рис. 1.
Сбор возгонов солей в кварцевых ячейках: 1 – хлоридный расплав; 2 – возгоны солей; 3 – край печи; 4 – запаянная кварцевая ампула; 5 – двухкамерная кварцевая ячейка; 6 – к вакуумному насосу.
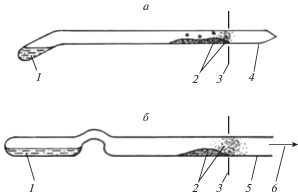
В перчаточном боксе в небольшие кварцевые пробирки (диаметром 6–8 мм) загружали по 150–250 мг плавов № 1 или № 2, приготовленных заранее, в атмосфере гелия, на основе эвтектики KCl–LiCl, содержащей, соответственно, мол. %: 1.40 BaCl2, 1.59 SrCl2 или 0.95 BaCl2, 1.43 SrCl2, 1.07 NdCl3. Пробирки после вакуумирования заваривали с помощью дугового разряда, возникающего между угольными электродами. Полученные в результате этого запаянные ампулы (рис. 1а) длиной около 175 мм, содержащие солевые плавы фиксированных составов, нагревали в электрической печи сопротивления. Температуру нагрева солей с точностью ±1°С фиксировали с помощью Pt/Pt-Rh термопары, время выдержки расплава при заданной температуре (782–1033°С) – 1–6 часов. Затем ампулу, вынутую из печи, быстро охлаждали и разламывали на две части недалеко от ее изгиба. Застывшие хлоридный расплав и солевые возгоны, находящиеся в разных частях вскрытой ампулы, растворяли в дистиллированной воде.
В более крупные ячейки (диаметром 16 мм), показанные на рис. 1б, загружали заданные количества хлоридов бария, стронция, неодима (как представителей хлоридов щелочноземельных и редкоземельных металлов) и плава эвтектической смеси хлоридов лития и калия. Общая масса солей в каждой ячейке была 800–1000 мг. Хлориды перемешивали и сплавляли в атмосфере чистого гелия. Во всех случаях отгонке подвергали разбавленные (по 1–2 мол. %) растворы SrCl2, NdCl3 и, в некоторых опытах, BaCl2 в расплавленной эвтектической смеси LiCl–KCl.
Ячейки с загруженными в них солями помещали в электропечь. Их при непрерывной откачке с помощью вакуумного насоса 2НВР-5ДМ (остаточное давление P ~ 1 Па) постепенно в течение 1 ч нагревали до 650–700°C, затем быстро (за 2–5 мин) – до заданной максимальной температуры нагрева (753–838°C), при которой выдерживали в печи еще в течение 2–30 мин. Затем ячейки вынимали из печи и быстро охлаждали.
В ходе отгонки на более холодных частях кварцевых стенок ячейки вблизи края печи постепенно накапливались возгоны солей в виде белоснежного налета и прозрачного расплава (рис. 1). Застывший в левом отделении ячейки после ее охлаждения хлоридный расплав и солевые возгоны вымывали раздельно дистиллированной водой.
Полученные после проведения опытов в ячейках разного типа прозрачные растворы анализировали на содержание хлоридов щелочных, щелочноземельных и редкоземельных металлов с помощью оптического атомно-эмиссионного спектрометра с индуктивно-связанной плазмой OPTIMA 4300 DV (Perkin Elmer, США). Результаты представлены в табл. 1–5.
Таблица 1.
Концентрации хлоридов в паре (возгонах) и в конечном расплаве (плаве) после отгонки солей из расплавленных смесей (LiCl–KCl)эвт–BaCl2–SrCl2 (состав № 1) в вакуумированных кварцевых ампулах
| t , °C | Время, ч | Отогнано*, мол. % |
Фаза | Концентрация, мол. % | |||
|---|---|---|---|---|---|---|---|
| KCl | LiCl | BaCl2 | SrCl2 | ||||
| 856 | 2 | 5.0 | Пар | 34.8 | 64.8 | 0.174 | 0.210 |
| Расплав | 40.5 | 56.0 | 1.67 | 1.91 | |||
| 903 | 2 | 9.9 | Пар | 35.2 | 64.6 | 0.109 | 0.137 |
| Расплав | 42.0 | 54.5 | 1.62 | 1.89 | |||
| 953 | 1 | 13.2 | Пар | 35.3 | 64.5 | 0.106 | 0.128 |
| Расплав | 42.1 | 53.9 | 1.83 | 2.08 | |||
| 955 | 2 | 14.6 | Пар | 35.1 | 64.8 | 0.061 | 0.073 |
| Расплав | 41.6 | 54.6 | 1.77 | 2.00 | |||
| 988 | 1.5 | 18.9 | Пар | 36.3 | 63.7 | 0.016 | 0.022 |
| Расплав | 41.4 | 54.7 | 1.83 | 2.10 | |||
Таблица 2.
Концентрации хлоридов в паре (возгонах) и в конечном расплаве (плаве) после отгонки солей из расплавленных смесей (LiCl–KCl)эвт–BaCl2–SrCl2–NdCl3 (состав № 2) в вакуумированных кварцевых ампулах
| t , °C | Время, ч | Отогнано*, мол. % |
Фаза | Концентрация, мол. % | ||||
|---|---|---|---|---|---|---|---|---|
| KCl | LiCl | BaCl2 | SrCl2 | NdCl3 | ||||
| 782 | 6 | 8.3 | Пар | 29.1 | 70.7 | 0.055 | 0.077 | 0.045 |
| Расплав | 42.9 | 53.5 | 0.99 | 1.50 | 1.08 | |||
| 830 | 5 | 6.3 | Пар | 31.6 | 68.3 | 0.021 | 0.020 | 0.038 |
| Расплав | 40.9 | 55.5 | 1.00 | 1.50 | 1.13 | |||
| 876 | 3.5 | 9.6 | Пар | 32.6 | 67.2 | 0.051 | 0.070 | 0.064 |
| Расплав | 40.9 | 55.3 | 1.04 | 1.57 | 1.17 | |||
| 923 | 2 | 10.4 | Пар | 32.0 | 67.9 | 0.034 | 0.055 | 0.062 |
| Расплав | 41.1 | 55.1 | 1.04 | 1.60 | 1.16 | |||
| 923 | 3.5 | 20.7 | Пар | 33.8 | 66.2 | 0.008 | 0.013 | 0.031 |
| Расплав | 41.9 | 53.8 | 1.20 | 1.80 | 1.32 | |||
| 977 | 2 | 27.5 | Пар | 34.9 | 65.0 | 0.035 | 0.068 | 0.067 |
| Расплав | 42.0 | 54.1 | 1.08 | 1.67 | 1.22 | |||
| 1003 | 2 | 28.9 | Пар | 36.7 | 63.1 | 0.046 | 0.079 | 0.088 |
| Расплав | 41.3 | 55.6 | 0.85 | 1.32 | 0.95 | |||
| 1033 | 2 | 35.7 | Пар | 36.4 | 63.5 | 0.022 | 0.022 | 0.057 |
| Расплав | 43.8 | 51.0 | 1.41 | 2.17 | 1.57 | |||
Таблица 3.
Соотношение концентраций хлоридов в паре (возгонах) и в конечном расплаве (плаве) после отгонки солей из расплавленных смесей (LiCl–KCl)эвт–BaCl2–SrCl2–NdCl3 (составы № 1 и № 2) в вакуумированных кварцевых ампулах
| t, °C | Время, ч | Отогнано от исходного плава, мол. % | Соотношение концентраций (мол. %) пар/расплав | ||||
|---|---|---|---|---|---|---|---|
| KCl | LiCl | BaCl2 | SrCl2 | NdCl3 | |||
| 856 | 2 | 5.0 | 0.86 | 1.16 | 0.104 | 0.110 | – |
| 903 | 2 | 9.9 | 0.84 | 1.19 | 0.067 | 0.073 | – |
| 953 | 1 | 13.2 | 0.84 | 1.20 | 0.058 | 0.062 | – |
| 955 | 2 | 14.6 | 0.84 | 1.19 | 0.035 | 0.037 | – |
| 988 | 1.5 | 18.9 | 0.88 | 1.16 | 0.009 | 0.010 | – |
| 782 | 6 | 8.3 | 0.68 | 1.32 | 0.056 | 0.052 | 0.041 |
| 782 | 6 | 8.3 | 0.70 | 1.31 | 0.029 | 0.043 | 0.044 |
| 830 | 5 | 6.3 | 0.77 | 1.23 | 0.021 | 0.013 | 0.034 |
| 830 | 5 | 6.3 | 0.78 | 1.23 | 0.006 | 0.010 | 0.036 |
| 876 | 3.5 | 9.6 | 0.80 | 1.22 | 0.049 | 0.044 | 0.055 |
| 876 | 3.5 | 6.9 | 0.76 | 1.25 | 0.044 | 0.038 | 0.050 |
| 923 | 2 | 10.4 | 0.78 | 1.23 | 0.032 | 0.034 | 0.054 |
| 923 | 2 | 10.4 | 0.79 | 1.22 | 0.020 | 0.031 | 0.051 |
| 923 | 3.5 | 20.7 | 0.81 | 1.23 | 0.007 | 0.007 | 0.024 |
| 923 | 3.5 | 17.6 | 0.80 | 1.23 | 0.008 | 0.009 | 0.030 |
| 977 | 2 | 27.5 | 0.83 | 1.20 | 0.033 | 0.041 | 0.055 |
| 977 | 2 | 27.5 | 0.80 | 1.22 | 0.019 | 0.030 | 0.056 |
| 1003 | 2 | 28.9 | 0.84 | 1.19 | 0.037 | 0.034 | 0.053 |
| 1033 | 2 | 35.7 | 0.83 | 1.25 | 0.016 | 0.010 | 0.036 |
| 1033 | 2 | 35.7 | 0.81 | 1.26 | 0.007 | 0.012 | 0.042 |
Таблица 4.
Концентрации хлоридов в паре (возгонах) и в конечном расплаве (плаве) после отгонки солей из расплавленных смесей (LiCl–KCl)эвт–SrCl2–BaCl2–NdCl3 при непрерывной откачке вакуумным насосом
| t, °C | Время, мин |
Отогнано*, мол. % |
Фаза | Концентрация, мол. % | ||||
|---|---|---|---|---|---|---|---|---|
| KCl | LiCl | BaCl2 | SrCl2 | NdCl3 | ||||
| 782 | 31 | 79.0 | Пар | 35.2 | 64.8 | − | 0.0002 | 0.000 |
| Расплав | 56.7 | 36.6 | − | 0.6 | 6.0 | |||
| 827 | 8 | 87.9 | Пар | 38.4 | 61.5 | − | 0.0004 | 0.083 |
| Расплав | 61.5 | 24.8 | − | 1.1 | 12.7 | |||
| 830 | 7 | 94.8 | Пар | 38.9 | 61.0 | − | 0.0004 | 0.088 |
| Расплав | 63.8 | 5.4 | − | 2.8 | 28.1 | |||
| 835 | 6 | 94.1 | Пар | 40.0 | 59.7 | − | 0.0068 | 0.277 |
| Расплав | 43.6 | 2.8 | − | 28.8 | 24.8 | |||
| 829 | 10 | 93.7 | Пар | 39.8 | 60.1 | − | 0.0048 | 0.175 |
| Расплав | 48.5 | 5.4 | − | 22.1 | 24.0 | |||
| 830 | 7 | 93.8 | Пар | 39.1 | 60.8 | − | 0.0039 | 0.097 |
| Расплав | 48.0 | 3.7 | − | 24.9 | 23.4 | |||
| 838 | 7 | 95.1 | Пар | 41.5 | 57.9 | 0.0014 | 0.0062 | 0.530 |
| Расплав | 15.9 | 0.6 | 24.0 | 31.3 | 28.1 | |||
| 835 | 8 | 94.8 | Пар | 41.7 | 57.8 | 0.0027 | 0.0082 | 0.446 |
| Расплав | 14.7 | 0.3 | 29.3 | 30.8 | 24.9 | |||
| 827 | 8 | 86.1 | Пар | 39.2 | 60.7 | − | 0.0041 | 0.093 |
| Расплав | 54.9 | 22.0 | − | 10.5 | 12.5 | |||
| 782 | 31 | 76.0 | Пар | 36.7 | 63.3 | − | 0.0002 | 0.000 |
| Расплав | 54.6 | 33.4 | − | 6.0 | 6.0 | |||
| 780 | 4 | 35.1 | Пар | 33.5 | 66.5 | 0.0002 | 0.0011 | 0.006 |
| Расплав | 44.4 | 48.5 | 1.9 | 2.5 | 2.6 | |||
| 760 | 3 | 24.9 | Пар | 31.0 | 69.0 | 0.0003 | 0.0002 | 0.001 |
| Расплав | 43.1 | 50.6 | 1.7 | 2.2 | 2.4 | |||
| 753 | 2.5 | 14.7 | Пар | 30.0 | 70.0 | 0.0006 | 0.0084 | 0.001 |
| Расплав | 43.1 | 51.7 | 1.4 | 1.8 | 2.0 | |||
| 803 | 5 | 61.6 | Пар | 36.9 | 63.0 | 0.0004 | 0.0017 | 0.020 |
| Расплав | 47.6 | 41.0 | 3.5 | 4.6 | 3.3 | |||
Таблица 5.
Соотношение концентраций хлоридов в паре (возгонах) и в конечном расплаве (плаве) после отгонки солей из расплавленных смесей на основе (LiCl–KCl)эвт–SrCl2–BaCl2–NdCl3 при непрерывной откачке вакуумным насосом
| t, °C | Время, мин |
Отогнано от исходного плава, мол. % | Соотношение концентраций (мол. %) пар/расплав | ||||
|---|---|---|---|---|---|---|---|
| KCl | LiCl | BaCl2 | SrCl2 | NdCl3 | |||
| 782 | 31 | 79.0 | 0.62 | 1.77 | – | 0.00026 | 0.0001 |
| 827 | 8 | 87.9 | 0.63 | 2.48 | – | 0.00038 | 0.0066 |
| 830 | 7 | 94.8 | 0.61 | 11.37 | – | 0.00014 | 0.0031 |
| 835 | 6 | 94.1 | 0.92 | 21.66 | – | 0.00024 | 0.0112 |
| 829 | 10 | 93.7 | 0.82 | 11.13 | – | 0.00022 | 0.0073 |
| 830 | 7 | 93.8 | 0.81 | 16.48 | – | 0.00016 | 0.0041 |
| 838 | 7 | 95.1 | 2.61 | 95.58 | 0.00006 | 0.00020 | 0.0188 |
| 835 | 8 | 94.8 | 2.83 | 217.73 | 0.00009 | 0.00027 | 0.0179 |
| 827 | 8 | 86.1 | 0.71 | 2.76 | – | 0.00039 | 0.0074 |
| 782 | 31 | 76.0 | 0.67 | 1.90 | – | 0.00003 | 0.0001 |
| 780 | 4 | 35.1 | 0.76 | 1.37 | 0.00012 | 0.00044 | 0.0024 |
| 760 | 3 | 24.9 | 0.72 | 1.36 | 0.00021 | 0.00007 | 0.0003 |
| 753 | 2.5 | 14.7 | 0.70 | 1.35 | 0.00043 | 0.00467 | 0.0006 |
| 803 | 5 | 61.6 | 0.78 | 1.54 | 0.00012 | 0.00038 | 0.0060 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Из данных, представленных в табл. 1–5, следует, что содержание BaCl2, SrCl2 и NdCl3 в парах (возгонах) значительно снижается по сравнению с их содержанием в расплавленных смесях, для хлоридов же щелочных металлов такое изменение концентраций – менее существенное. Более отчетливо количественное различие в испарении (летучестях) разных солей можно проследить по рассчитанным нами величинам соотношений концентраций хлоридов в паре (возгонах) и в конечном расплаве (плаве) после отгонки солей из расплавленных смесей (табл. 3 и 5).
Из экспериментальных данных, приведенных в табл. 3, следует, что возгоны почти на 2 порядка обедняются по BaCl2, SrCl2 и NdCl3 по сравнению с расплавом, в котором их концентрация после отгонки, наоборот, незначительно повышается (табл. 1 и 2) по сравнению с содержанием в исходных плавах № 1 и № 2. Для хлоридов лития и калия, которые составляют основу расплава и возгонов над ним, соотношение концентраций в паре и расплаве, в пределах погрешностей аналитических определений, незначительно отклоняются от единицы: пар немного обогащен по LiCl, являющимся более легколетучим компонентом (рис. 2), и обеднен по KCl (табл. 1–3).
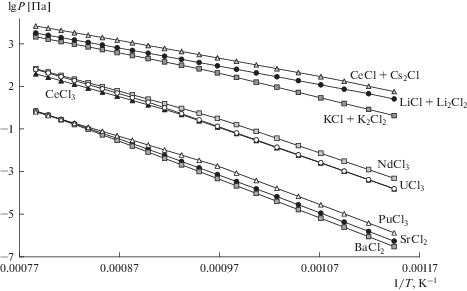
На основании литературных данных [13–21] по давлениям насыщенных паров над расплавами различных индивидуальных хлоридов можно было бы ожидать при совместном испарении чистых солей примерно тех же величин разделения для перехода расплав–пар у хлоридов калия и лития, но еще значительно больших по сравнению с приведенными в табл. 3 – у трихлорида неодима (примерно на порядок) и у хлоридов бария и стронция (на 2–4 порядка).
Действительно, давления насыщенных паров над расплавами чистых хлоридов различных щелочных, щелочноземельных и редкоземельных металлов, урана и плутония существенно различаются. Это хорошо иллюстрируют политермы давлений паров, построенные нами по справочным данным [13] для интервала температур 600–1000°C (рис. 2). Наиболее летучими являются хлориды щелочных металлов (давление насыщенных паров над эвтектическим расплавом LiCl–KCl близко к давлениям паров над чистыми KCl и LiCl [14]). Летучесть же рассматриваемых ди- и трихлоридов – на 3–6 порядков ниже.
Однако процессы взаимодействия (комплексообразования) хлоридов разных металлов в многокомпонентных расплавленных смесях и в парах над ними могут существенно изменить соотношение летучестей хлоридов этих металлов по сравнению с летучестями над чистыми солями и повлиять, таким образом, на результаты отгонки.
Рассмотрим в самом общем случае равновесие между бинарным солевым расплавом A–B и его паровой фазой, содержащей молекулы мономеров A и B, димеры молекул исходных компонентов A2 и B2, а также их смешанное соединение AB [14–19, 22, 23]:
(1)
$\begin{gathered} P({{{\text{A}}}_{2}})\,\,\,\,P({\text{A}})\,\,\,\,P({\text{AB}})\,\,\,\,P({\text{B}})\,\,\,\,P({{{\text{B}}}_{2}}) \\ {\mathbf{РАСПЛАВ}}\,\,({\text{A}} + {\text{B}}) \leftrightarrow \\ \leftrightarrow \,\,{\mathbf{ПАР}}\,\,({{{\text{A}}}_{{2~}}}\,\, \leftrightarrow \,\,2{\text{A}}\,\,~ \leftrightarrow ~\,\,2{\text{AB}}\,\, \leftrightarrow \,\,2{\text{B}}\,\,~ \leftrightarrow \,\,{{{\text{B}}}_{2}}). \\ \end{gathered} $Примеры “A, B”: KCl, LiCl, BaCl2, NdCl3, UCl3, …; примеры “A2, B2”: K2Cl2, Ba2Cl4, Nd2Cl6, U2Cl6, …; примеры “AB”: KLiCl2, KBaCl3, LiNdCl4, ….
Общее давление пара над такими расплавленными смесями складывается из парциальных давлений компонентов пара:
(2)
${{P}_{{{\text{общ}}}}} = P({\text{A}}) + P({{{\text{A}}}_{2}}) + P({\text{B}}) + P({{{\text{B}}}_{2}}) + P({\text{AB}}).$Естественно, что они должны удовлетворять условиям межфазного равновесия:
(3)
$P({\text{A}}) = \gamma ({\text{A}}) \cdot N({\text{A}}) \cdot P^\circ ({\text{A}}),\,\,\,\,P({\text{B}}) = \gamma ({\text{B}}) \cdot N({\text{B}}) \cdot P^\circ ({\text{B}}),$где γ и N – коэффициент активности и мольная доля соответствующего компонента в расплаве, P ° – парциальные давления мономеров в парах над расплавами соответствующих индивидуальных солей.
Равновесия между мономерами, димерами и смешанными соединениями в паровой фазе, в свою очередь, связаны константами равновесия:
(4)
${{{\text{A}}}_{2}} \leftrightarrow 2{\text{A}},\,\,\,\,K({{{\text{A}}}_{2}}) = {{{{P}^{2}}({\text{A}})} \mathord{\left/ {\vphantom {{{{P}^{2}}({\text{A}})} {P({{{\text{A}}}_{2}}),}}} \right. \kern-0em} {P({{{\text{A}}}_{2}}),}}$(5)
${{{\text{B}}}_{2}} \leftrightarrow 2{\text{B}},\,\,\,\,K({{{\text{B}}}_{2}}) = {{{{P}^{2}}({\text{B}})} \mathord{\left/ {\vphantom {{{{P}^{2}}({\text{B}})} {P({{{\text{B}}}_{2}}),}}} \right. \kern-0em} {P({{{\text{B}}}_{2}}),}}$(6)
${\text{AB}} \leftrightarrow {\text{A}} + {\text{B}},\,\,\,\,K({\text{AB}}) = {{P({\text{A}}) \cdot P({\text{B}})} \mathord{\left/ {\vphantom {{P({\text{A}}) \cdot P({\text{B}})} {P({\text{AB}}).}}} \right. \kern-0em} {P({\text{AB}}).}}$Отметим, что в парах реальных солевых систем могут присутствовать, кроме мономеров и димеров, также тримеры (A3, B3), а также смешанные соединения и других (отличных от AB, например A2B, AB2) составов [14–18]. В случае же многокомпонентных расплавленных смесей A–B–C– … количество различных молекулярных форм в насыщенных парах, по сравнению с рассмотренными выше бинарными системами, возрастает еще более, иногда – многократно. В результате, содержание хлоридов разных металлов в парах многокомпонентных расплавленных смесей может существенно отличаться от оцененного только на основе соотношений давлений паров чистых индивидуальных соединений – P °(A), P °(B), P °(С), ….
Применительно к исследуемым в настоящей работе расплавленным смесям отметим, что, согласно литературным данным [22, 23], в насыщенных парах расплава эвтектики LiCl–KCl хлориды щелочных металлов присутствуют преимущественно в виде мономерных (MCl) и димерных (M2Cl2) молекул, причем доля димерных молекул у хлорида лития составляет 40–60%, а у хлорида калия – 20–30%. Доля молекул смешанного соединения KLiCl2 в насыщенных парах расплавленных смесей доходит до 7–9%. Количество димеров в насыщенных парах над NdCl3, BaCl2, SrCl2, в отличие от хлоридов лития и калия, очень малое (менее 1–2%) [14–18, 23].
Известно [24–29], что коэффициенты активности (γ) хлоридов двух и трехвалентных металлов, являющихся комплексообразователями в их разбавленных растворах в расплавленных хлоридах щелочных металлов, существенно ниже единицы. В частности, у трихлорида неодима в его разбавленных растворах в расплаве эвтектики LiCl–KCl величины коэффициента активности находятся вблизи 0.001 [27], а у хлоридов бария и стронция они приблизительно равны 0.5–0.7 [28, 29]. Согласно уравнениям (3) это должно было бы приводить к дополнительному, еще большему снижению парциальных давлений рассматриваемых хлоридов. Напротив, в результате комплексообразования в паровой фазе летучесть труднолетучего хлорида (в частности, BaCl2, SrCl2, NdCl3) многократно (иногда в десятки и сотни раз) может повыситься за счет его совместного соиспарения с более летучим хлоридом (LiCl, KCl) в составе смешанного соединения типа KSrCl3, LiBaCl2, KNdCl4 и т.д. [14–19, 23].
В запаянных ампулах в наших опытах (табл. 1–3), отгонка происходит очень медленно. За несколько часов, даже при высоких температурах порядка 1000°C, отгоняется лишь 5–35% исходного расплава (несколько десятков мг солей), в результате чего обеспечиваются практически равновесные условия для взаимодействия компонентов в жидкости и газе, а также между расплавом и паром как в зоне испарения так и в зоне конденсации.
Известно, что кинетика испарения жидкости зависит от большого количества различных факторов [30]. В частности, существенно повышает скорость испарения жидкости непрерывная откачка ее паров, которая, в свою очередь, зависит от внешнего давления в системе [6, 30]. Скорость испарения может на несколько порядков величины увеличиваться как при повышении температуры (в зависимости от которой экспоненциально возрастает давление насыщенных паров испаряющегося расплава [17]), так и при понижении остаточного давления, при котором производят отгонку [30]. Это, в частности, подтверждают исследования скорости испарения расплава эвтектики LiCl–KCl при температурах 770–1130°C и внешнем давлении 70–7000 Па [6]. Поскольку скорость протекания нежелательных побочных реакций с участием реакционноспособных веществ, упоминавшихся во введении, также, в свою очередь, существенно возрастает при повышении температуры, для снижения последней мы перешли к отгонке расплавов при непрерывно работающем вакуумном насосе. Результаты опытов приведены в табл. 4 и 5.
Анализируя результаты, можно сделать следующие выводы.
− Отгонка солей при непрерывной откачке паров протекает с многократно большей скоростью, чем при испарении в запаянных ампулах (табл. 1–3), поскольку позволяет за многократно меньшие промежутки времени и при более низких температурах отогнать значительно большую долю (и массу) исходного расплава (плава).
− Возгоны солей в небольшой степени обогащаются по LiCl и немного обедняются по KCl (по сравнению с их концентрацией в исходном эвтектическом расплаве). Однако после испарения большей части загруженной массы наиболее летучего компонента многокомпонентных расплавленных смесей − хлорида лития, начинается преимущественное испарение следующего по летучести компонента − хлорида калия.
При этом соотношение концентраций в паре и расплаве у рассматриваемых солей значительно возрастает, а для KCl начинает превышать единицу (см., например, результаты отгонок при 838 и 835°C в табл. 4 и 5).
− Содержание хлоридов щелочно- и редкоземельных элементов в парах (возгонах) на 3–4 порядка ниже их содержания в расплаве. Другими словами, указанные хлориды практически не отгоняются. При этом их концентрацию в конечном расплаве можно повысить до 2−3 десятков мол. % (табл. 4) по сравнению с 1−2 мол. % в исходном.
− При переходе от испарения в ампулах к отгонке при непрерывно работающем насосе разделение (соотношение концентраций пар/конечный расплав) для хлоридов щелочных металлов изменяется несущественно (при невысоких долях отогнанного расплава), в то время как для NdCl3 оно возрастает приблизительно на порядок, а для BaCl2 и SrCl2 – примерно на 2 порядка.
Последнее можно объяснить тем, что при отгонке с непрерывной откачкой, проводимой при низких остаточных давлениях (~1 Па), пар становится ненасыщенным, что способствует распаду по уравнениям типа (6) смешанных соединений, ответственных за повышенное испарение труднолетучих хлоридов (BaCl2, SrCl2, NdCl3) в составе их совместных комплексных соединений с более легколетучими хлоридами (LiCl, KCl) [15–19, 23].
ЗАКЛЮЧЕНИЕ
Проведены экспериментальные исследования отгонки хлоридов из их расплавленных смесей при различных условиях. Результаты обсуждены и сделаны выводы о степени отгонки, селективности испарения компонентов расплавленных смесей и относительной летучести различных хлоридов.
Найденные зависимости могут оказаться полезными для разработки перспективных схем переработки ОЯТ с использованием отгонки солей.
Работа (частично) выполнена с использованием оборудования центра коллективного пользования “Состав вещества” ИВТЭ УрО РАН.
Список литературы
Аврорин Е.Н., Адамов Е.О., Алексахин Р.М., Джалавян А.В., Драгунов Ю.Г. и др. Концептуальные положения стратегии развития ядерной энергетики России в XXI веке. М.: ОАО “НИКИЭТ”. 2012.
Koyama T., Sakamura Y., Iizuka M., Kato T., Murakami T., Glatz J.-P. Development of pyro-processing fuel cycle technology for closing actinide cycle // Procedia Chemistry. 2012. 7. P. 772–778.
Westphal B.R., Marsden K.C., Price J.C., Laug D.V. On the development of a distillation process for electrometallurgical treatment of irradiated spent nuclear fuel // Nucl. Eng. and Technol. 2008. 40. № 3. P. 163–174.
Choi E.-Y., Jeong S.M. Electrochemical processing of spent nuclear fuels: An overview of oxide reduction in pyroprocessing technology // Progress in Natur. Science: Materials International. 2015. 25. P. 572–582.
Choi E.-Y., Won C.Y., Kang D.-S., Kim S.-W., Cha J.-S., Lee S.-J., Park W., Im H. S., Hur J.-M. Production of uranium metal via electrolytic reduction of uranium oxide in molten LiCl and salt distillation // J. Radioanal. Nucl. Chem. 2015. 304. P. 535–546.
Yang H.-C., Eun H.-C., Kim I.-T. Study on the distillation rates of LiCl–KCl eutectic salt under different vacuum conditions // Vacuum. 2010. 84. P. 751–755.
Cho Y.-Z., Lee T.-K., Eun H.-C., Choi J.-H., Kim I.-T., Park G.-I. Purification of used eutectic (LiCl–KCl) salt electrolyte from pyroprocessing // J. Nucl. Mater. 2013. 437. P. 47–54.
Salyulev A.B., Shishkin A.V., Shishkin V.Yu., Zaikov Yu.P. Distillation of lithium chloride from the products of uranium dioxide metalization // Atomic Energy. 2019. 126. № 4. P. 226–229.
Фурман А.А. Неорганические хлориды (химия и технология). М.: Химия. 1980.
Шишкин В.Ю., Митяев B.C. Очистка галогенидов щелочных металлов методом зонной плавки // Изв. АН СССР. Неорганические материалы. 1982. 18. № 11. С. 1917–1918.
Лаптев Д.M. Физико-химические свойства хлоридов лантаноидов и их взаимодействие в системах LnCl3–LnCl2 // Дис. д-ра хим. наук. Новокузнецк, 1996.
Kochedykov V.A., Khokhlov V.A. Refractive indices and molar refractivities of molten rare-earth trichlorides and their mixtures with alkali chlorides // J. Chem. Eng. Data. 2017. 62. № 1. P. 44–51.
Roine A. HSC Chemistry 7.0 Thermochemical Database. Finland: Outokumpu Research Oy. 2009.
Миронов В.Л., Бурылев Б.П. Давление насыщенного пара индивидуальных хлоридов и их бинарных смесей // “Успехи термодинамики расплавов”: материалы Всесоюзного семинара. Краснодар: Краснодар. политехн. ин-т, 1976. С. 25–84.
Новиков Г.И., Гаврюченков Ф.Г. Комплексные галогениды в парах при высоких температурах // Успехи химии. 1967. 36. № 3. С. 399–413.
Новиков Г.И., Баев А.К. К вопросу о летучести ацидокомплексных соединений в системах LnCl3–KCl // Ж. неорг. химии. 1964. 9. № 7. С. 1669–1675.
Суворов А.В. Термодинамическая химия парообразного состояния. Л.: Химия. 1970. 208 с.
Schäfer H. Gaseous chloride complexes with halogen bridges – homo-complexes and hetero-complexes // Angewandte Chemie, Intern. Edition. 1976. 15. № 12. P. 713–727.
Халтурина Л.К. Давление насыщенных паров расплавленных бинарных смесей хлоридов лития, цезия, бария и лантана // Дис. … канд. хим. наук. Свердловск, 1978.
Морачевский А.Г. Сладков И.Б. Физико-химические свойства молекулярных неорганических соединений (экспериментальные данные и методы расчета): Справочник. СПб.: Химия. 1996.
Yaws C.L. Thermophysical properties of chemicals and hydrocarbons. Norwich, New York: William Andrew. 2008.
Стрелец Х.Л., Стуковенков Л.М. Давление насыщенного пара над расплавом системы MgCl2–KCl–LiCl // Труды ВАМИ, Ленинград. 1971. № 71. С. 43–54.
Ярым-Агаев Н.Л. Термодинамические свойства и строение пара над расплавленными солями и их смесями // Ионные расплавы. Киев: Наукова думка. 1974. № 1. С. 42–61.
Марков Б.Ф. Термодинамика расплавленных солевых смесей. Киев: Наукова думка. 1974.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука. 1973.
Марков Б.Ф., Волков С.В., Присяжный В.Д., Козин Л.Ф. и др. Термодинамические свойства расплавов солевых систем. Справочное пособие. Киев: Наукова думка. 1985.
Fukasawa K., Uehara A., Nagai T., Sato N., Fujii T., Yamana H. Thermodynamic properties of trivalent lanthanide and actinide ions in molten mixtures of LiCl and KCl // J. Nucl. Mater. 2012. 424. P. 17–22.
Emons H.-H., Bräutigam G., Thomas R. Einige thermodynamische Eigenschaften binärer geschmolzener Mischungen aus Erdalkalimetall- und Alkalimetallchloriden // Chem. Zvesti. 1978. 32. № 6. P. 721–733.
Волкович А.В., Журавлев В.И., Ретюнский А.Г., Распопин С.П. Термодинамические свойства BaCl2 в расплавах смесей хлоридов лития, натрия, калия и цезия // Известия ВУЗ. Цвет. металлургия. 1986. № 2. С. 70–74.
Пазухин В.А., Фишер А.Я. Разделение и рафинирование металлов в вакууме. М.: Металлургия. 1969.
Дополнительные материалы отсутствуют.